缓激肽后处理缺血再灌注损伤大鼠心肌磷酸化STAT3、梗死面积及细胞凋亡指数观察
2015-04-05夏大川田轶魁魏民新天津市第一中心医院天津3009天津医科大学总医院
夏大川,田轶魁,魏民新(天津市第一中心医院,天津3009;天津医科大学总医院)
缓激肽后处理缺血再灌注损伤大鼠心肌磷酸化STAT3、梗死面积及细胞凋亡指数观察
夏大川1,田轶魁2,魏民新2(1天津市第一中心医院,天津300192;2天津医科大学总医院)
摘要:目的观察缓激肽后处理缺血再灌注损伤大鼠心肌磷酸化STAT3、梗死面积、细胞凋亡指数变化。方法将72只健康雄性Wistar大鼠随机分为4组各18只,假手术组只穿线,不结扎;缺血再灌注(I-R)组缺血30 min,再灌注120 min。缓激肽后处理(BK)组缺血30 min,再灌注120 min,并于再灌注前予缓激肽(200 μg/kg)。BK +AG490组缺血30 min,再灌注120 min,再灌注前予缓激肽(200 μg/kg),并于再灌注前5 min静注AG490(3 mg/kg)。再灌注10 min时各组取6只大鼠处死,制作心肌标本,Western blotting法检测心肌磷酸化STAT3(p-STAT3)。再灌注120 min时将剩余大鼠处死,制作心肌标本,TTC染色法检测心肌梗死面积,TUNEL法计算心肌细胞凋亡指数。结果I-R组、BK组、BK+AG490组心肌p-STAT3相对表达量分别为0.28±0.04、0.56±0.08、0.27±0.05,心肌梗死面积分别为38.0%±3.0%、17.3%±2.8%、37.7%±3.8%,心肌细胞凋亡指数分别为72.0%±3.7%、40.7%±3.7%、71.7%±5.9%,BK组与I-R组、BK+AG490组比较,P均<0.01。结论 缓激肽后处理的缺血再灌注损伤大鼠心肌磷酸化STAT3水平升高,心肌细胞凋亡指数降低,心肌梗死面积减少。
关键词:缺血再灌注损伤;缓激肽;磷酸化细胞信号传导与转录活化因子3
研究[1,2]表明,缓激肽后处理可模拟缺血后处理发挥心肌保护作用,且可减少对主动脉的操作,减少并发症。JAK-STAT通路的主要作用是将细胞外信号传递到细胞核,进而调节细胞核内转录引发生物学效应[3],在心肌缺血再灌注损伤及内源性心肌保护机制中发挥重要作用[4,5]。而缓激肽后处理是否可以通过激活JAK2-STAT3通路发挥心肌保护作用目前并不清楚。2013年10月,我们通过构建心肌缺血再灌注损伤模型,观察了缓激肽后处理缺血再灌注损伤大鼠心肌磷酸化STAT3、梗死面积、细胞凋亡指数变化。现将结果报告如下。
1材料与方法
1.1实验动物及试剂健康雄性Wistar大鼠72只(体质量230~280 g),购自解放军军事医学科学院实验动物中心。缓激肽、JAK2的特异性拮抗剂AG490购自Sigma公司。TTC试剂及Western blotting检测用β-actin、p-STAT3及t-STAT3一抗购自Cell Signaling Technology公司,二抗购自北京中杉金桥公司。TUNEL试剂盒购自罗氏公司。
1.2实验方法
1.2.1心肌缺血再灌注损伤模型构建、分组及处理大鼠腹腔注射10%水合氯醛(3 mg/g)麻醉,气管插管连接小动物呼吸机,气源为室内空气,呼吸频率60次/min,潮气量13~15 mL。大鼠四肢接心电图监护电极。左侧第四肋间开胸,以6/0无损伤线在左冠状动脉前降支分支下约3 mm处穿一结扎线,已备结扎。结扎时采用直径0.2 cm的细塑料管穿过结扎线用止血钳夹紧。心电图Ⅱ导联出现ST段抬高及心肌颜色变为苍白为结扎成功。模型建立成功后将大鼠随机分为4组各18只,假手术组只穿线,不结扎;缺血再灌注(I-R)组缺血30 min,再灌注120 min。缓激肽后处理(BK)组缺血30 min,再灌注120 min,并于再灌注前给予缓激肽(200 μg/kg)。缓激肽后处理+AG490 (BK+AG490) 组缺血30 min,再灌注120 min,再灌注前给予缓激肽(200 μg/kg),并于再灌注前5 min静脉注射AG490(3 mg/kg)。再灌注10 min时各组取6只大鼠处死,制作心肌标本,用以检测心肌磷酸化细胞信号传导与转录活化因子3(p-STAT3);于再灌注120 min时将剩余大鼠处死,制作心肌标本,用以检测心肌细胞凋亡指数及心肌梗死面积。
1.2.2心肌p-STAT3检测大鼠处死后迅速取出心脏,冰生理盐水冲净余血,置-80 ℃冰箱快速冷冻。将速冻后的心脏自心尖向心底切成厚2 mm的切片,Western blotting法检测p-STAT3,以β-actin作为内参。
1.2.3心肌细胞凋亡指数测算心肌标本固定后常规石蜡包埋和切片,用末端脱氧核苷酸转移酶(TdT酶)介导的带荧光的dUTP缺口末端标记法(TUNEL)测算心肌细胞凋亡指数。每张切片随机取4个高倍镜视野,计数每个高倍镜视野下调亡细胞核数和总细胞核数。凋亡指数为100个细胞核中凋亡细胞核的个数。
1.2.4心肌梗死面积测定制作好的心肌切片置于2%TTC溶液37 ℃避光孵育30 min后,生理盐水冲去游离染料,10%甲醛固定。蓝染区为非缺血区,砖红色区为危险区,灰白色区为梗死区。用计算机图像分析系统计算左室总面积(LV)、危险区面积(AAR)及梗死面积(Infarct Size)。以AAR/LV表示心肌缺血程度,Infarct size/AAR表示心肌梗死程度。
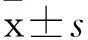
2结果
I-R组、BK组、BK+AG490组心肌p-STAT3相对表达量分别为0.28±0.04、0.56±0.08、0.27±0.05,心肌细胞凋亡指数分别为72.0%±3.7%、40.7%±3.7%、71.7%±5.9%,心肌梗死面积分别为38.0%±3.0%、17.3%±2.8%、37.7%±3.8%, BK组与I-R组、BK+AG490组比较,P均<0.01。
3讨论
细胞凋亡是一种多基因控制的自身程序性细胞死亡,可分为四个阶段,第一阶段是细胞凋亡信号的产生;第二阶段是信号传导;第三阶段是中心控制和效应阶段;第四阶段是细胞死亡阶段。心肌细胞凋亡是心肌缺血再灌注损伤的主要形式之一[6]。缺血再灌注损伤作为凋亡信号,通过影响基因表达,上调再灌注后期凋亡蛋白表达致心肌细胞凋亡。Zhao等[7]研究发现,抑制心肌细胞凋亡可明显缩小缺血再灌注心肌梗死面积。Stat3转录因子是许多细胞因子和生长因子受体中重要的信号分子,它在许多人类的肿瘤细胞中持续激活,具备潜在的致癌能力和抗凋亡能力。Stat3通过705位酪氨酸磷酸化被激活,进而诱导它的二聚化,核定位以及DNA结合功能。STAT3的活性经常通过能识别705位酪氨酸磷酸化的抗体来检测。
JAK2-STAT3通路是细胞内重要的转录调节因子,研究[8]发现,其在缺血预处理第二窗心肌保护机制中具有核心地位。我们前期研究[9]结果显示,阻断JAK2-STAT3通路后,缺血后处理减少心肌梗死面积及抗心肌细胞凋亡的作用消失,提示缺血后处理心肌保护作用依赖于JAK2-STAT3通路。
研究[1,2]证实,缓激肽后处理在多种生物模型中均可减轻缺血再灌注损伤,发挥保护作用,PI3K/Akt通路在这种保护机制中具有核心地位。以往关于缓激肽后处理心肌保护作用主要集中于其减少心肌梗死面积,而对于其抗心肌细胞凋亡的研究较少。目前缓激肽后处理抗心肌细胞凋亡的具体机制尚不十分清楚。本研究结果显示,在活体大鼠心肌缺血再灌注损伤模型中,缓激肽后处理不仅可减少再灌注后心肌梗死面积,而且可显著抑制再灌注后心肌细胞凋亡。我们使用AG490阻断JAK2-STAT3通路后,缓激肽后处理抗凋亡作用消失。提示JAK2-STAT3通路参与了缓激肽后处理抗心肌细胞凋亡机制。但缓激肽后处理是否通过JAK2-STAT3通路调控凋亡相关基因表达,上调再灌注后期抗凋亡蛋白,抑制心肌细胞凋亡,还需进一步研究。
综上所述,缓激肽后处理能减少缺血再灌注损伤大鼠心肌梗死面积,抑制心肌细胞凋亡,发挥心肌保护作用;其机制可能与JAK2-STAT3通路介导有关。
参考文献:
[1] Bell RM, Yellon DM. Bradykinin limits infarction when administered as an adjunct to reperfusion in mouse heart:the role of PI3K,Akt and eNOS[J]. Mol Cell Cardiol, 2003,35(2):185-193.
[2] Yang XM, Krieg T, Cui L, et al. NECA and bradykinin at reperfusion reduce infarction in rabbit hearts by signaling through PI3K, ERK, and NO[J]. Mol Cell Cardiol, 2004,36(3):411-421.
[3] Darnell JE. STATs and gene regulation[J]. Science, 1997,277(5332):1630-1635.
[4] Smith RM, Suleman N, Lacerda L, et a1. Genetic depletion of cardiac myocyte STAT-3 abolishes classical preconditioning[J]. Cardiovasc Res, 2004,63(4):611-616.
[5] Boengler K, Buechert A, Heinen Y, et a1. Cardioprotection by ischemic postconditioning is lost in aged and STAT3-deficient mice[J]. Circ Res, 2008,102(1):131-135.
[6] Eefting F, Rensing B, Wigman J, et al. Role of apoptosis in reperfusion injury[J]. Cardiovasc Res, 2004,61(3):414-426.
[7] Zhao ZQ, Nakamura M, Wang NP, et al. Progressively developed myocardial apoptotic cell death during late phase of reperfusion[J]. Apoptosis, 2001,6(4):279-290.
[8] Barry SP, Townsend PA, Latchman DS, et al. Role of the JAK-STAT pathway in myocardial injury[J]. Trends Mol Med, 2007,13(2):82-89.
[9] 夏大川,田轶魁,吴志浩,等.JAK2-STAT3通路介导缺血后处理心肌保护作用的初步研究[J].天津医药,2010,38(1):43-45.
(收稿日期:2014-02-20)
通信作者:魏民新
中图分类号:R542.2
文献标志码:A
文章编号:1002-266X(2015)03-0029-02
doi:10.3969/j.issn.1002-266X.2015.03.010
