硝酸受热分解实验的简易化改进
2015-04-01房寿高
房寿高
摘要:对文献中硝酸蒸气受热分解实验进行了比对并且分析了其各自的不足,受此启发,对浓硝酸受热分解实验作了简易化改进探究。结果只需1滴浓硝酸就能得到理想的实验效果,操作简单,现象明显,显著节约实验药品用量和减少对环境的污染。
关键词:硝酸受热分解;简易化改进;实验研究
文章编号:1005–6629(2015)3–0051–03 中图分类号:G633.8 文献标识码:B
人教版《必修1》和苏教版《必修1》都介绍了浓硝酸的热不稳定性,即“浓硝酸受热产生红棕色的二氧化氮气体”,但两本教材都没有提供相关实验。正如刘怀乐老师所说,浓硝酸的热分解没有相关实验支撑,教师难免在课堂上出现窘态。浓硝酸受热分解实验能否用简易的操作进行演示?笔者进行了相关研究。
1 浓硝酸受热分解的已有研究
关于浓硝酸能否分解,刘怀乐老师做了这样一个实验:试管里注入几毫升浓硝酸,加热煮沸,观察不到有红棕色气体产生[1]。赵中华、伍举培也做了实验[2]:在试管中加入1mL浓硝酸,在酒精灯上直接加热(管口被蘸有浓氢氧化钠溶液的棉花团轻轻堵住),最后发现试管中没有明显变化。鉴于两位老师都没有提供详细的实验细节,于是笔者做了相关实验,实验过程为:在一支洁净而干燥的试管中加入1mL新开瓶的浓硝酸,加热25秒钟左右浓硝酸开始沸腾(室温为24℃),发现如果在酒精灯火焰上继续加热容易爆沸冲出。笔者尝试了在三层铁丝网上加热,发现浓硝酸还是容易爆沸冲出。经过多次尝试,笔者发现加入一小块黄豆般大小的碎瓷片后可以持续加热,而浓硝酸不会爆沸冲出,如果用水银温度计测量其温度,发现温度能持续维持在122℃左右,没有看到红棕色气体产生。继续加热,大概3分钟左右,浓硝酸基本能全部蒸发掉,整个过程始终没有红棕色气体产生。为什么没有红棕色气体产生?因为实验中所用的浓硝酸溶质的质量分数为65%~68%,很接近硝酸恒沸液(69.2%),加热煮沸时仅仅把它变成了硝酸蒸气,远没有达到硝酸热分解的温度,所以观察不到硝酸分解[3]。
是否浓硝酸的浓度不够高呢?笔者向试管(内径1.6cm,长度15cm)中加入了2药匙(该药匙正好能伸入试管中)左右的硫酸钠固体,然后加入了2滴管的浓硝酸,塞好橡皮塞充分振荡,静置。用倾析法取上层清液,加入几小片碎瓷片,加热,观察现象。发现只要试管底部还有浓硝酸时就没有红棕色气体产生,但在浓硝酸接近恰好被蒸干的时候试管中上部出现了红棕色气体。笔者猜想,可能是硝酸蒸气受热分解产生了红棕色的二氧化氮气体。
2 硝酸蒸气受热分解的已有实验与不足
在液态浓硝酸能否分解的实验过程中,笔者有一次在浓硝酸接近被蒸干时,为了防止管壁的冷凝硝酸流到试管底部使试管炸裂,用灯焰对试管中部进行了加热,奇怪的现象发生了:试管中上部出现了少量红棕色气体。后来经过查阅资料,发现对硝酸蒸气受热分解已经有了一些实验研究。例如,刘怀乐老师就采用了如图1的实验方法使硝酸蒸气受热分解。笔者也做了类似实验。先制取少量玻璃粉:在研钵里放入一些碎玻璃,然后用罩有硬纸板的研杵将玻璃研碎(罩硬纸板目的是防止碎玻璃屑飞溅)。把研磨好的玻璃粉加少许于试管底部,然后给试管底部加热。向灼热的玻璃粉上滴加浓硝酸,发现一滴加浓硝酸,试管底部炸裂了。笔者再尝试石英砂:在试管底部加入两小药匙石英砂,然后在酒精灯外焰上加热两分钟左右,滴入1~2滴浓硝酸,发现很快见到红棕色气体产生。如果试管里的石英砂较少,常常会出现试管炸裂现象。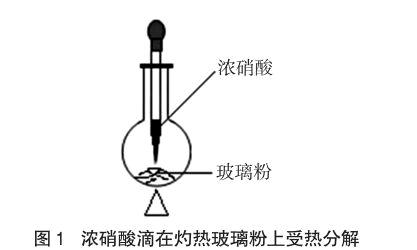
笔者在某日(29℃)的上午做了五氧化二磷的实验,在洁净而干燥的试管底部铺一层五氧化二磷,然后滴几滴新开瓶的浓硝酸,很快出现红棕色气体,且试管壁发烫。测量温度,发现温度很快上升到90℃左右。由于五氧化二磷有很强的吸水性,直接“夺走”硝酸中的“水”,使硝酸变成二氧化氮气体。
齐俊林、赵立国两位老师采用图2的装置利用电炉丝进行加热使硝酸蒸气分解[4]。该改进实验的不足之处在于:装置较复杂,不适合学生分组实验或个别实验。笔者以为:为什么不用酒精灯给试管中部加热,而用电炉丝加热?使用酒精灯应该比使用电炉丝更方便快捷!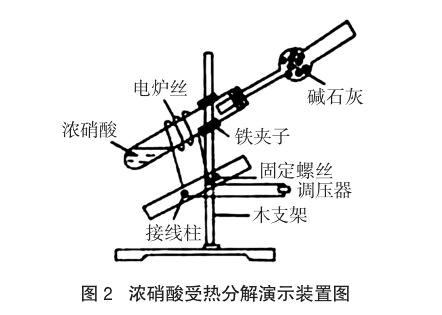
经过查阅资料得知,齐俊林、赵立国两位老师曾于1996年用图3的装置演示过硝酸蒸气受热分解的实验[5]。其实验过程为:将仪器及药品按装置图装好后,用酒精灯加热距硝酸液面1.5~2.0厘米处,片刻,浓硝酸液面上方就出现红棕色的二氧化氮气体。接着将余烬的松木条插入干燥管内,可观察到带有余烬的木条立即复燃。
笔者重做了此实验,结果发现:如果不停地给浓硝酸加热,则中部的红棕色气体很少,球形干燥管里红棕色气体很多,带余烬的松木条很快熄灭。所以,每次实验,最好先给浓硝酸加热至微沸,然后撤走此处的酒精灯,再用酒精灯对准中部位置加热,片刻,可以看到有红棕色的气体产生,但并没有出现“带余烬的松木条复燃”现象。
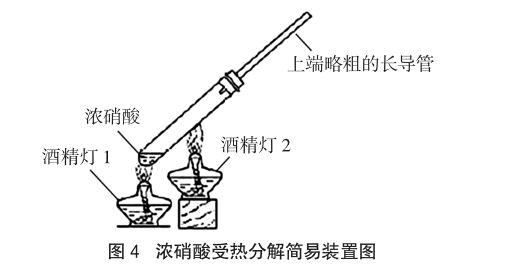
俞建锋老师对浓硝酸受热分解实验进一步作了改进[6],见图4。正如俞老师所说,长导管的作用有两个,其一,减少硝酸的挥发,增大试管内硝酸蒸气的浓度,缩短加热硝酸分解所需要的时间;其二,冷凝回流硝酸蒸气。
但通过对比图2、图3和图4,可以看出3个改进实验基本差不多,都是通过加热浓硝酸产生硝酸蒸气,然后再对硝酸蒸气加热使其分解。稍有不同之处在于加热或增大硝酸蒸气浓度的方式。另外这些改进实验虽都能明显地看到红棕色气体的产生,不足之处在于不仅需要消耗一定量的浓硝酸,而且产生的污染性气体也较多。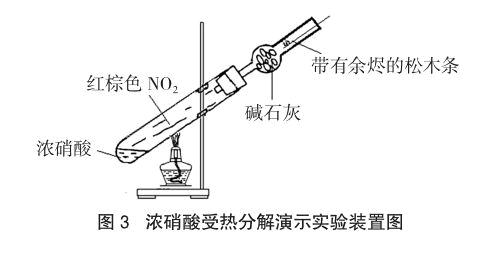
由图2、图3和图4知,这3个实验都是利用浓硝酸产生硝酸蒸气,再对硝酸蒸气进行加热促使其分解。笔者设想,如果浓硝酸的量很少,这样一受热很容易产生硝酸蒸气,然后再对产生的硝酸蒸气进行加热,也应该会得到二氧化氮气体。于是笔者进行了下面的实验探究。
3 气态浓硝酸受热分解实验的最简易化操作
在一支干燥的试管中加入1滴浓硝酸,最好能滴在试管底部,不要滴在试管壁上(下面蒸发时能轻易判断是否完全蒸发),试管口塞一团棉花,然后加热。当试管底部的一滴硝酸全部蒸发后(大概需15秒左右),此时将灯焰加热试管中上部,15秒之后在白纸的映衬下可以看到有红棕色气体产生,继续加热红棕色更加明显。
优点:不仅所需仪器简单,现象明显,而且节约药品,只需1滴浓硝酸;由于用量少,产生的污染也少,对环境的污染微乎其微;实验过程所需时间短,在课堂上适合每个学生动手操作。
4 实验改进的几点感想
“1滴浓硝酸能演示浓硝酸的受热分解实验吗?”很多教师可能持否定态度。首先,要肯或敢于动手做实验。其实这个实验很简单,只要动手做一做就能知道结果,但很少有教师去亲身实践。俗话说,百闻不如一见,一见不如实践。
其次,实验改进时也要关注实验的物质体系。宋心琦教授认为实验体系有三个要素[5]:作为实验对象的物质体系;适当的仪器装置和必要的安全措施;合理的实验步骤和规范的操作技术。这三个要素的重要性是不等同的,是递减的。宋教授还认为,在现在的化学实验教学中人们过多地把注意力放在了第二、三两个方面,化学体系的选择反而被忽视了。所以,从反应的物质体系入手进行改进实验,也应该成为实验改进的一个重要思路。
最后,还要懂得一些创新技法。如“SCAMPER”法,其中“S”代表“代替”(substitute);“C”代表“综合”(combine);“A”代表“改良”(adapt);“M”既可以代表“修改”(modify),又可以表示“放大”(magnify)或“缩小”(minify);“P”代表“挪作他用”(puttootheruses);“E”代表“消除”(eliminate);“R”代表“重新排列”(rearrange)或“逆向”(reverse)。
参考文献:
[1][3]刘怀乐.“硝酸”教学的几点参考[J].化学教学,2011,(2):73.
[2]赵中华,伍举培.硝酸不稳定性的探究实验[J].化学教学,2009,(10):20.
[4]齐俊林,赵立国.介绍一种浓硝酸受热分解演示装置[J].化学教学,2010,(4):13.
[5]齐俊林,赵立国.浓硝酸受热分解实验的设计[J].化学教学,1996,(2):10.
[6]俞建锋.硝酸热分解演示实验的简易做法[J].化学教学,2014,(5):55~56.
