探究pH相同的盐酸、醋酸与活泼金属的初始反应速率
2015-04-01施志斌
施志斌
摘要:通过实验探究了稀盐酸和醋酸溶液分别与镁、锌、铁等金属反应的相对速率大小,发现盐酸和醋酸的pH相同时,镁、锌、铁等金属在醋酸溶液中的初始反应速率更快。从动力学的角度看,HAc、Ac-能促进H+的传质与吸附,并很可能参与了H+与活泼金属反应的历程。
关键词:盐酸;醋酸;活泼金属;反应速率;动力学
文章编号:1005–6629(2015)3–0045–04 中图分类号:G633.8 文献标识码:B
1 问题的提出
在中学“电离平衡”一章的学习过程中,经常会遇到类似于以下的题目:
pH相同且等体积的稀盐酸溶液A和醋酸溶液B,分别加入相同大小的锌粒进行反应,初始反应速率νA____ νB;反应一段时间之后,速率νA ____νB。(填“>”、“<”或“=”。)
不少教师和教辅资料认为:从反应的本质来说,金属是与酸电离出的H+反应。若稀盐酸和醋酸中的[H+]相同,则两种溶液与锌初始反应时速率相同;但醋酸是弱电解质,在反应过程中,溶液中未电离的醋酸能不断电离提供H+,避免[H+]降低太快,因而平均反应速率更快。
以上解析和答案是基于“金属与酸置换氢气的反应速率只由[H+]决定”和“反应过程中,盐酸中[H+]下降快,醋酸中[H+]下降慢”而得出的。那么,实际情况是否与上述的理论分析所得结论一致?
2 实验探究
将中国医药集团生产的分析纯盐酸和冰醋酸分别配成稀溶液,小心地调节pH值使之一致,用大普数字酸度计(PHS-25)型测得pH均为2.03。选取质量均为0.4g圆饼状的锌粒若干备用,使用前均用较浓的盐酸除去表面碱式碳酸锌等覆盖层,然后用蒸馏水将锌粒冲洗干净,并用滤纸吸干其表面的水分。另外,下面实验中所用的镁条裁剪为2.0cm长度,铁片裁剪为1.0cm×1.0cm的正方形,金属表面氧化膜的处理方法与锌粒相同。
实验1 各取40mL pH均为2.03的稀盐酸和醋酸溶液于两只小烧杯,同时加入一粒锌粒,发现醋酸与锌反应产生的气泡更快,具体现象见表1。为了避免锌粒表面积的细微差别对实验结果造成影响,做了两类重复实验:(1)另取40mL两种溶液,将原实验使用过的锌粒清洗干净,交换所投溶液;(2)另取40mL两种溶液和经过处理但未使用过的锌粒,观察现象,5min后实验结束,按操作(1)交换锌粒所投溶液再次进行实验。重复实验结果与原实验相同,锌在醋酸中的反应速率均比在盐酸中快。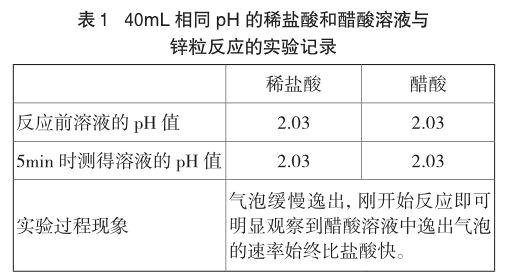
两种酸溶液所取的量较多,且锌在两种溶液中的反应速率都比较慢,因此,反应5min后溶液的pH都没有明显变化。可见,盐酸与锌反应产生的气泡比醋酸慢,并非由于盐酸溶液中的[H+]下降更快造成的。
为了确认锌与酸反应的初始速率是否只与[H+]有关,还需要进一步实验。
实验2 往剩余的稀盐酸中滴加一滴浓盐酸后,测得pH=1.84。各取40mL pH=1.84的稀盐酸和pH=2.03的醋酸溶液于两只小烧杯,同时加入一粒锌粒,具体现象见表2。重复实验的方法与实验1相同。实验发现,虽然醋酸溶液的pH比盐酸大,但锌在醋酸溶液中的反应速率依然更快。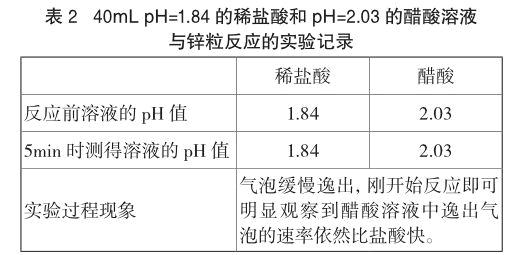
醋酸溶液的pH高,[H+]小,但与锌的反应速率却更快,可以判断盐酸、醋酸pH相同时二者与锌反应的初始速率是不同的。这说明锌与酸反应速率不仅与[H+]有关,还可能与其他一些因素有关。
那么是哪些因素影响了锌与酸反应的速率?这些因素的影响作用大小如何?
实验3 各取40mL醋酸溶液于三只小烧杯,烧杯①加入0.2g氯化钠,烧杯②加入0.2g醋酸钠,烧杯③空白。同时往三只烧杯中加入一粒锌粒,现象见表3。另取溶液和锌粒,重复实验两次,气泡逸出速率大小顺序与表3所列现象一致。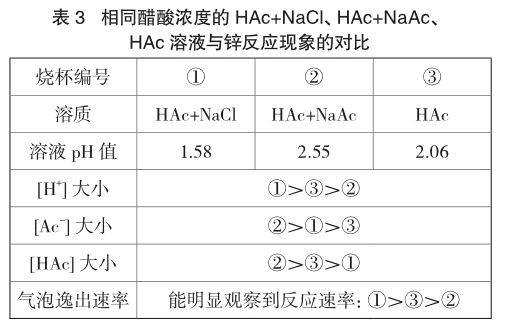
相比于烧杯③,由于烧杯①中存在盐效应,醋酸的电离程度增大,[H+]、[Ac-]增大,[HAc]减小;烧杯②中则受到同离子效应的影响,醋酸的电离程度降低,[Ac-]、[HAc]增大,[H+]减小。从反应速率:①>③>②来看,[H+]对锌与醋酸反应速率的影响比较明显。
实验4 另取醋酸溶液各40mL于三只小烧杯,烧杯④加入0.2g氯化钠,烧杯⑤加入0.2g醋酸钠,烧杯⑥空白,并往烧杯④和烧杯⑥加入水进行稀释(烧杯④加入水的量大于烧杯⑥),使pH值相同。弃去烧杯④和烧杯⑥中部分溶液,使三只烧杯的溶液体积均为40mL。同时往三只烧杯中加入一粒锌粒,现象见表4。另取溶液和锌粒,重复实验两次,气泡逸出速率大小顺序与表4所列现象一致。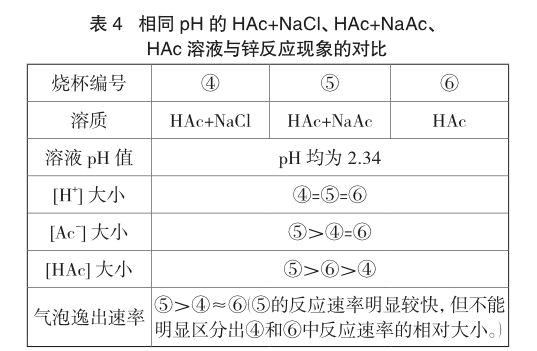
根据电荷守恒,烧杯④中[Na+]=[Cl-]且烧杯④和⑥的pH相等,所以,烧杯④和⑥的[Ac-]相等;相比于烧杯⑥,烧杯④存在盐效应而醋酸电离程度比烧杯⑥大且烧杯④加入更多的水进行稀释,因此,烧杯④中[HAc]比烧杯⑥小。由于烧杯⑤加入醋酸钠产生的同离子效应,[Ac-]、[HAc]均比烧杯⑥中大。从反应速率⑤>④≈⑥来看,当[H+]相同时,[HAc]、[Ac-]对锌与醋酸反应的速率也有一定的影响。
那么,其他金属是否也有与锌一样的现象?
实验5 用镁条、铁片代替锌粒,按实验2、3、4方案进行实验。由于镁与酸反应速率较快,因此重复实验时,另取镁条与溶液反应;而铁在酸中的反应速率比锌慢,所以重复实验的方案与锌相同。实验中,均能观察到与锌类似的现象——Mg、Fe在pH相同的醋酸溶液中反应速率更快,除了[H+]外,[Ac-]和[HAc]对反应速率也有一定的影响。
3 理论分析
从上述实验可以发现,通常[H+]相差较大时(如实验3),[H+]是影响速率的主要因素,而当[H+]相近时(如实验1、2、4),[HAc]、[Ac-]等微粒浓度对反应速率也有一定的影响。那么,HAc、Ac-如何影响活泼金属与醋酸的反应速率?
广义上,金属单质反应生成化合物,即可称为腐蚀。而金属在电解质溶液中反应的问题,均可用腐蚀电化学知识进行解释。活泼金属与酸反应必须发生在金属表面,电子的传递是间接的,反应过程遵循电化学原理。同一金属表面上存在金属失电子和氢离子得电子的电极反应耦合,是一种二重电极[1]。通常,活泼金属与盐酸、醋酸反应时,不易生成阻碍金属继续参加反应的难溶物,因而整体反应速率往往由氢气析出过程所控制。
由于实验中观察到镁、锌与铁的现象类似,因此,镁、锌在醋酸溶液中的反应,吸附在金属表面的HAc、Ac-也很有可能参与了H+与这些金属的反应历程,并促进了反应速率。
4 总结
严宣申教授曾在《化学实验的启示与科学思维的训练》中强调,“即使很简单的问题,也往往涉及几个因素”,因而在进行知识迁移时“单因素考虑问题不全面”[4]。教学过程中为了突出“弱电解质的电离是不完全”的知识,经常以“等物质的量浓度的盐酸、醋酸与活泼金属反应,醋酸的反应速率较慢是由于醋酸不完全电离,[H+]小造成的”为习题加以巩固。但活泼金属与酸发生析氢反应的速率,不仅受到金属本性、[H+]的影响,还受到酸根阴离子和表面吸附微粒等因素的影响。将“物质的量浓度相同”的特定情况下[H+]是影响速率的主要因素,当做是唯一的影响因素加以推广,则会出错。
参考文献:
[1]曹楚南.腐蚀电化学原理[M].北京:化学工业出版社,2004:34~39.
[2]王文英,马建丽.锌含杂质提高产氢速率的热力学和动力学本质[J].衡水师专学报(自然科学版),2001,3(2):34~36.
[3]高延敏,王绍明,徐永祥等.A3钢在乙酸中的腐蚀行为和机理[J].腐蚀与防护,2006,27(1):11~13.
[4]严宣申.化学实验的启示与科学思维的训练[M].北京:北京大学出版社,1993:59.
