粒度及分布可控的亚微米级硫酸钡的制备研究
2015-04-01黄洁芳刘俊康
黄洁芳,刘俊康
(江南大学 化学与材料工程学院,江苏 无锡 214122)
硫酸钡(BaSO4)是一种重要的无机化工材料,具有易于开发、成本低廉,硬度低、无毒、颜色浅、亮度高、防酸碱和分散性好等众多优越性能,因此广泛用于涂料、油墨、造纸、橡胶、塑料、陶瓷、医疗等行业[1]。其中,粒径在0.1 ~1.0 μm 的亚微米级硫酸钡在诸多相关领域都能显示出更好的应用效果和更高的经济价值。
硫酸钡的制备方法大致可分为物理法和化学法两类。物理法主要是机械粉碎法,即对重晶石(一种天然的含硫酸钡的化合物)进行粉碎、洗涤、干燥而获得亚微米颗粒,该法所得产品粒度分布不均,形貌较差。化学法主要为液相法,包括沉淀法[2-4]、微乳液法[5-8]、溶析结晶法[9]等。其中沉淀法因工艺简单、周期短、耗能少而广泛用于工业化生产。但该法受众多因素制约,如反应温度、反应物浓度、搅拌速度、加料方式、杂质存在与否等,反应过程中除了要考虑晶体的成核和生长过程外,还涉及到传质过程、表面反应等,各因素均对颗粒的形貌和粒度有较大影响,不易控制的成核过程将导致所得硫酸钡批次稳定性差。
本文采用EDTA 络合沉淀法制备亚微米硫酸钡颗粒。强络合剂EDTA-2Na 先与金属离子Ba2+络合,以配合物的形式存在,再参与沉淀反应。配离子在一定条件下会以比较稳定的形式存在,有效地控制了溶液中Ba2+的浓度,使得在第一批晶核形成后,过饱和溶液的浓度维持在既能保证晶核生长,又能保证低于再次成核所需离子数值,保证晶体成核和生长过程分开,解决了传统液相沉淀法制备粉体中存在的粒度偏小且分布不均的问题。考察了体系pH 值、反应物浓度、陈化时间对颗粒粒度及形貌的影响,并对反应机理进行了探究。
1 实验部分
1.1 试剂与仪器
氯化钡、无水硫酸钠、乙二胺四乙酸二钠、氨水、无水乙醇均为分析纯;去离子水。
S-4800 型扫描电子显微镜;D8-Advance 型X 射线衍射仪;FTIR2000-104 型傅里叶红外光谱仪。
1.2 硫酸钡制备
在室温条件下,称取一定量BaCl2·2H2O,配成浓度为0.20 mol/L 的溶液,加入等物质的量的络合剂EDTA-2Na,并用氨水调节体系所需pH 值,充分搅拌30 min,使Ba2+与EDTA-2Na 充分络合。向上述溶液中滴加一定浓度的Na2SO4溶液,并维持搅拌。几分钟后开始出现白色沉淀,继续搅拌1 h,将所得沉淀用去离子水和乙醇离心洗涤数次,于80 ℃烘干,最终得白色粉末BaSO4。
2 结果与讨论
2.1 反应机理探究
沉淀的形成一般要经过晶核形成和晶核长大两个过程[10]。溶液中的金属离子遇到沉淀剂后迅速生成小分子,这些小分子通过相互碰撞聚集成分子簇,最终形成微小的晶核。晶核形成后,溶液中的构晶离子不断向晶核表面扩散,并沉积在晶核上,晶核就逐渐长大成沉淀颗粒。通常,为了从液相中析出粒度均一的沉淀颗粒,必须将晶体的成核和生长两个过程严格分开,使已经形成的晶核同步长大,并保证在生长过程中不再有新的晶核析出。
图1 表示单分散颗粒形成过程中液相中溶质浓度随时间的变化曲线。
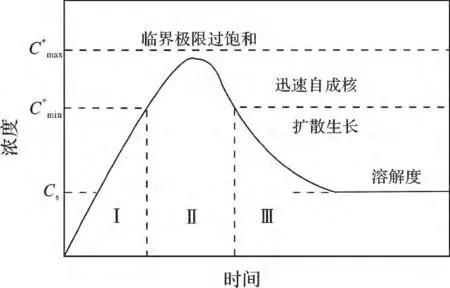
图1 单分散颗粒形成的LaMer 模型Fig.1 The LaMer model of the formation of monodisperse particles
其中,阶段Ⅰ为成核前期,此时,溶质的浓度尚未达到成核所需最小浓度,此时,溶液中无沉淀生成。当溶质浓度超过后,体系开始出现沉淀,进入成核期Ⅱ,在该阶段,晶核的不断形成消耗了体系中的溶质,因此溶质浓度呈现先上升后下降的趋势,当浓度再次到达时,成核阶段终止,进入生长期Ⅲ。此时,构晶离子不断在晶核表面沉积,晶体逐渐长大,直到液相溶质浓度接近溶解度cs。
由于BaSO4的溶度积很小(Ksp=1.1 ×10-10),Ba2+与SO42-接触瞬间即产生大量沉淀,在成核期II 消耗了大量溶质,晶体来不及长大。因此,在常温下若采用一般的液相沉淀法,将获得粒度较小的晶体,无法达到亚微米级别(见图2a)。在本实验中,EDTA-2Na 先与等物质的量的Ba2+形成配离子[BaY]2-,再与后加入的沉淀剂SO42-反应生成沉淀BaSO4。其反应方程式如下:
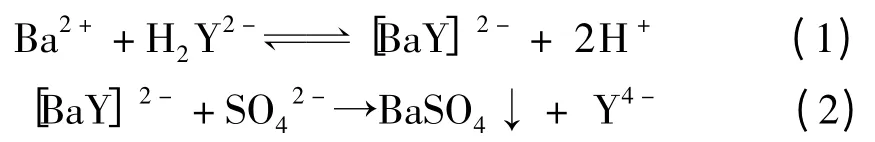
其中,Y 表示EDTA 阴离子。
虽然在水溶液中,配离子[BaY]2-是以比较稳定的结构单元存在,但仍有少量解离,存在如反应方程式(1)所示的配位平衡。当向反应体系中加入Na2SO4溶液时,游离的Ba2+迅速与SO42-结合,生成晶核,使反应(1)不断往解离的方向移动。但由于络合物的稳定常数较大,因此解离的速度较慢,体系中游离的Ba2+的浓度较低,不足以形成新的晶核,致使Ba2+继续与溶液中的SO42-反应并沉积在已形成的晶核上,促使晶核长大。

图2 不同方法制备所得BaSO4 颗粒的SEM 图Fig.2 SEM images of BaSO4 particles obtained via different methods
由图2 可知,采用传统液相沉淀法所制备而得的BaSO4粉体粒度较小,约为0.2 μm,且为了减小表面能,颗粒之间存在团聚;而采用EDTA 络合法在最优条件下制备所得的BaSO4颗粒分散性较好,粒度明显增大,约为1.0 μm,说明该方法控制了反应体系中Ba2+的浓度,避免瞬间形成大量晶核,有效地控制了沉淀的粒度,从而进一步改善了粉体的分散性。
2.2 pH 值对BaSO4 粒度的影响
在配位平衡时,存在配体的酸效应,即溶液酸度增大时,碱性配体与H+结合生成弱酸,使配体浓度降低,配位平衡向解离方向移动,因此,只有在适当的酸度范围内,才能形成稳定的配离子。EDTA 酸效应的大小可由酸效应系数αEDTA(H)衡量,在一定温度下,αEDTA(H)仅随溶液pH 而变化,若仅考虑溶液酸度对配合物稳定性的影响,可得:
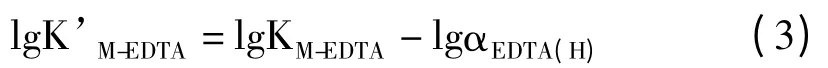
其中,KM-EDTA为稳定常数,K’M-EDTA为条件稳定常数,后者数值大小反映了在溶液酸度影响下配合物的实际稳定程度。当M 表示的金属离子为Ba2+时,其数值[3]见表1。

表1 不同pH 条件下Ba-EDTA 配合物的lgKBa-EDTA,lgαEDTA(H)和lgK’Ba-EDTA值Table 1 The values of lgKBa-EDTA,lgαEDTA(H)and lgK’Ba-EDTA at different pH
由表1 可知,溶液中H+浓度越大,αEDTA(H)越大,表明因H+而引起的EDTA 的副反应越严重。
为探究pH 值对沉淀粒度的影响,用浓氨水调节体系pH,使其分别为5,6,7,8,9,10,制备所得BaSO4颗粒SEM 结果见图3。
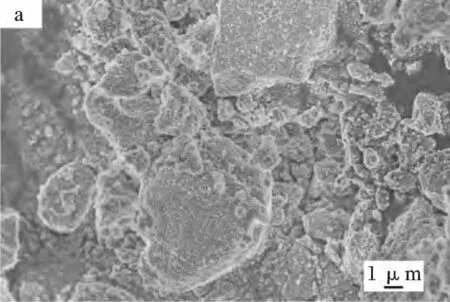

图3 不同pH 条件下制备所得BaSO4 颗粒的SEM 图Fig.3 SEM images of BaSO4 particles obtained at different pH value
由图3 可知,随着反应体系pH 值的增大,所得BaSO4颗粒的粒度逐渐增大,且粒度分布更窄,呈近球形。这是因为,pH 值越小,EDTA 的酸效应越严重,lgK’Ba-EDTA值越小,此时,Ba2+与EDTA-2Na 的络合强度相对较弱,配合物稳定性较差,导致溶液中存在大量游离的Ba2+。当沉淀剂加入瞬间,体系过饱和度较大,满足均相成核的条件,瞬间形成大量细小的晶核,导致晶体粒度较小。为减小比表面积以及表面能,这些细小的晶体通常会发生团聚(见图5a)。随着pH 值的增大,Ba2+与EDTA-2Na 络合强度增强,络合物朝解离方向移动的速率越慢,体系中Ba2+过饱和度低,无法满足均相成核条件,只能在已经形成的晶核上不断包覆,形成粒度较大的颗粒。当pH 值为8 ~9 时,BaSO4呈近球形,沉淀粒度均一,约为1.0 μm。
2.3 反应物浓度对BaSO4 粒度及分布的影响
在该反应体系中,Ba2+先与EDTA-2Na 络合,并不以游离状态存在,直到加入沉淀剂Na2SO4后,Ba2+才缓慢释放,因此BaCl2的初始浓度对沉淀反应的影响较小,故只研究浓度的变化对BaSO4粒度及分布的影响。保持其他条件不变,室温条件下,[Ba2+]=0.20 mol/L,Ba2+/EDTA-2Na =1 ∶1,pH =8,改变浓度,考察了其分别为0.10,0.25,0.50,0.75 mol/L 时对粉体粒度的影响,结果见图4。



图4 不同浓度Na2SO4 制备所得BaSO4 颗粒的SEM 图Fig.4 SEM images of BaSO4 particles obtained with different concentration of Na2SO4
2.4 陈化时间对BaSO4 形貌的影响
沉淀完全后,让初生沉淀与母液一起放置一段时间的过程称为陈化。对于传统的沉淀过程,陈化的意义在于使小颗粒消失并使大颗粒长大,从而得到粒度更加均一、形貌更加规则的颗粒。但对于存在EDTA 的络合沉淀体系,在静置陈化的过程中,溶液本体中游离的EDTA-2Na 会继续与已经形成的BaSO4颗粒表面发生相互作用,使得沉淀表面发生部分“溶解”,从而出现图5b 所示的颗粒表面形貌不规则的现象。此外,由于处于反应器不同位置的沉淀与EDTA-2Na 的接触情况不同,将导致粉体粒度分布更加不均匀。因此,在后处理过程中,应将该反应体系与传统液相沉淀法区分开来,尽量在沉淀结束后就洗涤干燥,从而获得粒度分布更窄,形貌更规则的产物。

图5 不同陈化时间下制备所得BaSO4 颗粒的SEM 图Fig.5 SEM images of BaSO4 particles obtained with different aging time
2.5 BaSO4 表面性质与物相分析
为探究所制备BaSO4颗粒的表面性质,采用压片法对最优条件下所制备的样品进行红外光谱分析,所得光谱图见图6。

图6 最优条件下采用EDTA 络合法制备所得BaSO4 颗粒的FTIR 图Fig.6 FTIR spectrum of BaSO4 particles obtained with EDTA under optimum reaction conditions
由图6 可知,位于3 447 cm-1处宽而平滑的吸收峰归属于分子间氢键或样品中所含水分子的O—H 键的伸缩振动峰,1 408 cm-1是OH-的弯曲振动峰;1 636 cm-1处是离子化或配位的COO-的伸缩振动峰,其出现的位置与金属离子的性质有关。相对于其他的特征峰,该处峰的强度较弱,可能是因为在洗涤过程中大部分EDTA-2Na 都已流失;位于1 173、1 110,982,612 cm-1的几组吸收峰属于SO42-的特征峰[11],位于633 cm-1附近的吸收峰是Ba—O键造成的。FTIR 结果表明,BaSO4表面吸附有EDTA。
图7 为最优条件下采用EDTA 络合法所得BaSO4颗粒的X 射线衍射图谱。

图7 最优条件下采用EDTA 络合法制备所得BaSO4 颗粒的XRD 图Fig.7 XRD pattern of BaSO4 particles obtained with EDTA under optimum reaction conditions
由图7 可知,制备的BaSO4晶体为正交晶系,特征峰与标准卡片(JCPD24-1035)对应。
3 结论
(1)采用EDTA 络合法在室温下制备了亚微米级BaSO4颗粒,EDTA 的存在可有效控制反应体系中Ba2+的浓度,确保了晶体成核和生长过程的分离,从而制备出粒度分布窄、近球形的BaSO4。
(2)体系pH 值与配离子的稳定性直接相关,因此对BaSO4的粒度影响显著。随着溶液pH 值的增大,酸效应系数减小,配合物条件稳定常数增大,配离子稳定性增强,体系中游离的Ba2+浓度减少。加入沉淀剂Na2SO4后,溶液过饱和度相对较小,利于生成较大的颗粒。当pH =8 ~9 时,BaSO4粒度均一,约为1.0 μm。
(3)随着反应物Na2SO4浓度的增大,晶体成核速率加快,短时间内形成的晶核数增多,晶体来不及长大,因此得到的BaSO4颗粒的粒度呈现下降趋势。
(4)与传统沉淀法不同的是,采用EDTA 络合法进行BaSO4制备时,陈化时间的延长并不利于得到粒度均一的颗粒,反而会破坏颗粒原有的球形形貌,得到粒度不均、形貌不规则的产物。因此,为得到粒度分布均匀的近球形BaSO4颗粒,应在反应结束后立即洗涤沉淀,避免体系中的EDTA-2Na 继续与沉淀反应。
[1] 霍红,欧阳朝斌,刘有智.纳米硫酸钡的制备工艺及其应用[J].山东化工,2004(6):23-25.
[2] Nisha Nandakumar,Philip Kurian.Chemosynthesis of monodispersed porous BaSO4nano powder by polymeric template process and its characterisation[J].Powder Technology,2012,224:51-56.
[3] Zhang Ming,Zhang Bao,Li Xinhai,et al.Synthesis and surface properties of submicron barium sulfate particles[J].Applied Surface Science,2011,258:24-29.
[4] 张明,张宝.利用控制结晶技术合成单分散硫酸钡微粒[J].广东化工,2012,39(6):340-341.
[5] 陈英军.反应沉淀法制备超细硫酸钡的研究[J].河北化工,2002(5):15-16.
[6] Chen Guiguang,Luo Guangsheng,Xu Jianhong,et al.Preparation of barium sulfate particles using filtration dispersion precipitation method in O/W system[J].Powder Technology,2005,153:90-94.
[7] Ivanova N I,Rudelev D S,Summ B D,et al.Synthesis of barium sulfate nanoparticles in water-in-oil microemulsion systems[J].Colloid Journal,2001,63(6):783-786.
[8] 王敏,王玉军,郭霖,等.用油包水型微乳液法制备超细硫酸钡颗粒[J].清华大学学报,2002,42(12):1594-1597.
[9] 王晓辉,蒋斌波,陈纪忠.溶析结晶法制备高纯度亚微米硫酸钡粒子[J].无机材料学报,2007,20(4):801-807.
[10]张昭,彭少方,刘栋昌.无机精细化工工艺学[M].北京:化学工业出版社,2002:15-17.
[11] Bala Hari,Fu Wuyou,Zhao Jingzhe,et al.Preparation of BaSO4nanoparticles with self-dispersing properties[J].Colloids and Surfaces,2004,252:129-134.
