秋水仙素对烟草单倍体植株染色体加倍的影响
2015-03-24胡日生蔡长春周真珍贺利雄
赵 璐,胡日生,蔡长春,周真珍,刘 志,贺利雄*
(1 湖南农业大学生物科学技术学院,长沙 410128; 2 湖北省烟草科学研究院,武汉 430030; 3 湖南省烟草公司,长沙 410004)
秋水仙素对烟草单倍体植株染色体加倍的影响
赵 璐1,胡日生2,蔡长春3,周真珍1,刘 志1,贺利雄1*
(1 湖南农业大学生物科学技术学院,长沙 410128; 2 湖北省烟草科学研究院,武汉 430030; 3 湖南省烟草公司,长沙 410004)
为了提高烟草单倍体技术中的染色体加倍率,以K394×云烟87的F1代花药组培单倍体烟苗为供试材料,研究了不同浓度秋水仙素处理对烟草单倍体苗的成苗率、大田移栽成活率和染色体加倍率的影响;以浸苗法为对照,在植物无根的情况下,研究了秋水仙素对烟草单倍体苗的成苗率、大田移栽成活率和染色体加倍率的影响。结果表明:秋水仙素浓度降低,成苗率和大田移栽成活率会升高而染色体加倍率会降低;无根系烟苗在加倍时染色体加倍率普遍比有根的烟苗低。
烟草;单倍体;染色体加倍;秋水仙素
DH群体即单倍体植株经过自然或者人工染色体加倍就可以得到基因位点纯合的加倍单倍体系,具有群体内基因纯合,群体间存在着遗传多样性,是不分离群体[1]的优点。随着单倍体育种技术的发展,许多植物的DH群体被成功构建。如朱惠琴等[2]构建了G28×NC2326和K326×Coker176的DH群体;刘仁祥等[3]构建了(K326×中烟90)×(Corker176×红大)的DH群体;陈学军等[4]构建了红大、Hicks、红大×K326、红大×白肋21、红大×巴斯玛、白肋21×TN86和巴斯玛×沙姆逊的DH群体。烟草DH群体的构建,秋水仙素加倍主要运用的是浸苗法,即将整株组培苗放入秋水仙素中加倍,一般加倍的浓度为0.4%~0.2%,时间一般为24~72 h。许多学者在探索烟草DH群体构建中,也尝试过别的方法加倍,如浸花药法、浸花培苗法、叶片再生法及浸腋芽法,但尚未见有人运用浸根法[5]来加倍烟草。烟草花药培养技术已非常成熟,但与其他植物相比较,如小麦[6]、草莓[7]等,烟草的染色体加倍率较低,获得大量DH群体的技术有待加强。因此以不同类型烟草杂交组合后代为材料进行加倍时,需要考虑多方面的影响因素。
笔者在前人实验的基础上,以K394×云烟87的F1代烟苗为材料,对其加倍方法进行研究,探讨不同浓度秋水仙素对烟苗单倍体成苗率和加倍率的影响,并研究植物有无根系时,对烟草组培苗加倍的影响,以为烟苗染色体加倍提供新的启发,为烟草诱变育种提供理论依据。
1 材料与方法
1.1 试验材料
以K394×云烟87组合的F1代花药组培单倍体烟苗作为试验材料。
2013年下半年,将湖南中烟公司提供的K394×云烟87组合的F1材料,种植在湖南农业大学中国烟草中南农业试验站试验田。在其盛花期的单核靠边期采集花蕾(花冠刚露出花萼或两者平齐),进行花药培养。
1.2 试验方法
1.2.1 染色体加倍方法
选取适当大小(茎长2.5~3.5 cm)的单倍体组培烟苗,对于较长烟苗(茎部长于2.5~3.5 cm),从顶端至下截取2.5~3.5 cm的茎部。共同的方法是:茎上多余的叶片剪去,只留两片顶叶。顶叶的长度保持在1.5~2.0 cm之内。灭菌后的150 mL三角瓶中分别倒入35 mL不同浓度的秋水仙素,分别放入有根的组培苗与无根的组培苗(即从培养基中取出后剪去根系,保留茎部和叶部),并使保留的两片顶叶漂浮在秋水仙素溶液上。
1.2.2 秋水仙素浓度的选取
用不同浓度梯度的秋水仙素进行加倍处理。设定秋水仙素浓度为4 000(0.4%)、2 000、1 500、1 250、1 000、750、500、250、75 mg/L(0.0075%),并对其成苗率、大田移栽成活率和染色体加倍率进行统计。
1.2.3 有根和无根烟苗加倍
在上述750和75 mg/L的秋水仙素浓度中,又分别将烟苗分为带根系的植株和切除根系的植株,标记为有根和无根,并对其成苗率、大田移栽成活率和染色体加倍率进行统计。
1.3 倍性鉴定
1.3.1 叶片气孔大小、数目以及保卫细胞叶绿体计数法
待组培苗长至8~13片真叶时,剪下植株顶端向下第5片真叶。用透明胶带粘取叶片下表皮[8],撕其下表皮置于载玻片上,滴1滴碘-碘化钾(1∶3)溶液,在40×的物镜,10×的目镜下对保卫细胞内的叶绿体计数,每片叶随机选取8个气孔,观察叶绿体数目并计算平均数[9]。撕取下表皮,在40×的物镜,10×的目镜区域对气孔细胞的数目进行统计,每片叶随机选取8片区域。撕取下表皮,在100×的物镜,10×的目镜下对气孔的长宽进行测量,每片叶随机选取8个气孔[10]。
1.3.2 流式细胞仪鉴定法
取秋水仙素处理两周后并生长到同一时期的烟叶,用流式细胞仪鉴定(Quanta SC)其倍性,具体使用方法参考EPICSRXLTM Cytometers中文应用培训手册(美国贝克曼库尔特有限公司)。缓冲液的配制参考文献[11]。
1.4 数据统计
烟草花药再生苗的成苗率、大田移栽成活率及染色体加倍率的计算公式:
成苗率=(加倍处理后成活苗数/加倍处理前的苗数)×100%;
大田移栽成活率=(大田移栽后成活苗数/加倍处理后成活苗数)×100%;
染色体加倍率=(染色体加倍的植株数/大田移栽后成活苗数)×100%;
综合染色体加倍率=(染色体加倍的植株数/加倍处理前的苗数)×100%。
2 试验结果与分析
2.1 流式细胞仪检测烟苗染色体加倍情况
以花药培养得到的单倍体植株和以K394×云烟87组合(二倍体)的烟叶作为标尺,确定单倍体的峰值出现在100道的位置,二倍体的峰值出现在200道的位置。在检测条件不变的情况下,成功加倍的双单倍体峰值在200道出现;未加倍成功的烟草在100道上有峰值(图1)。结果显示,试验的2 218株植株中成功加倍的有29株DH植株,其中有28株为双单倍体,1株为二/四倍体嵌合体,无四倍体的情况。
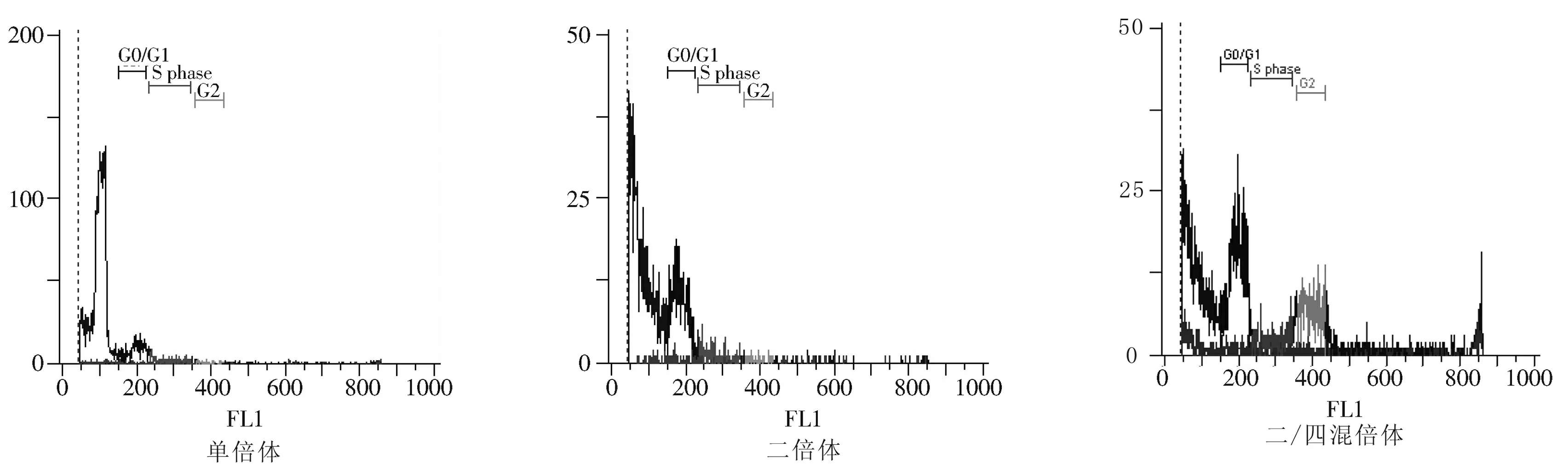
图1 流式细胞仪检测烟苗染色体加倍效果
2.2 叶片气孔大小、数目以及保卫细胞叶绿体计数结果
从表1看出,单倍体植株气孔的长和宽平均值为57.75和50.67 μm,二倍体植株气孔的长和宽平均值为63.92和57.90 μm,较单倍体植株大6.17和7.23 μm;双单倍体植株气孔的长和宽平均值为62.95和56.59 μm,较单倍体植株大5.20和5.92 μm。不同倍性烟叶的气孔长度和宽度有一定的差异,二倍体和双单倍体在长宽度上差异不大(图2)。在10×40的显微镜下,单倍体、二倍体和双单倍体区域气孔数目平均值为66、56和54个。
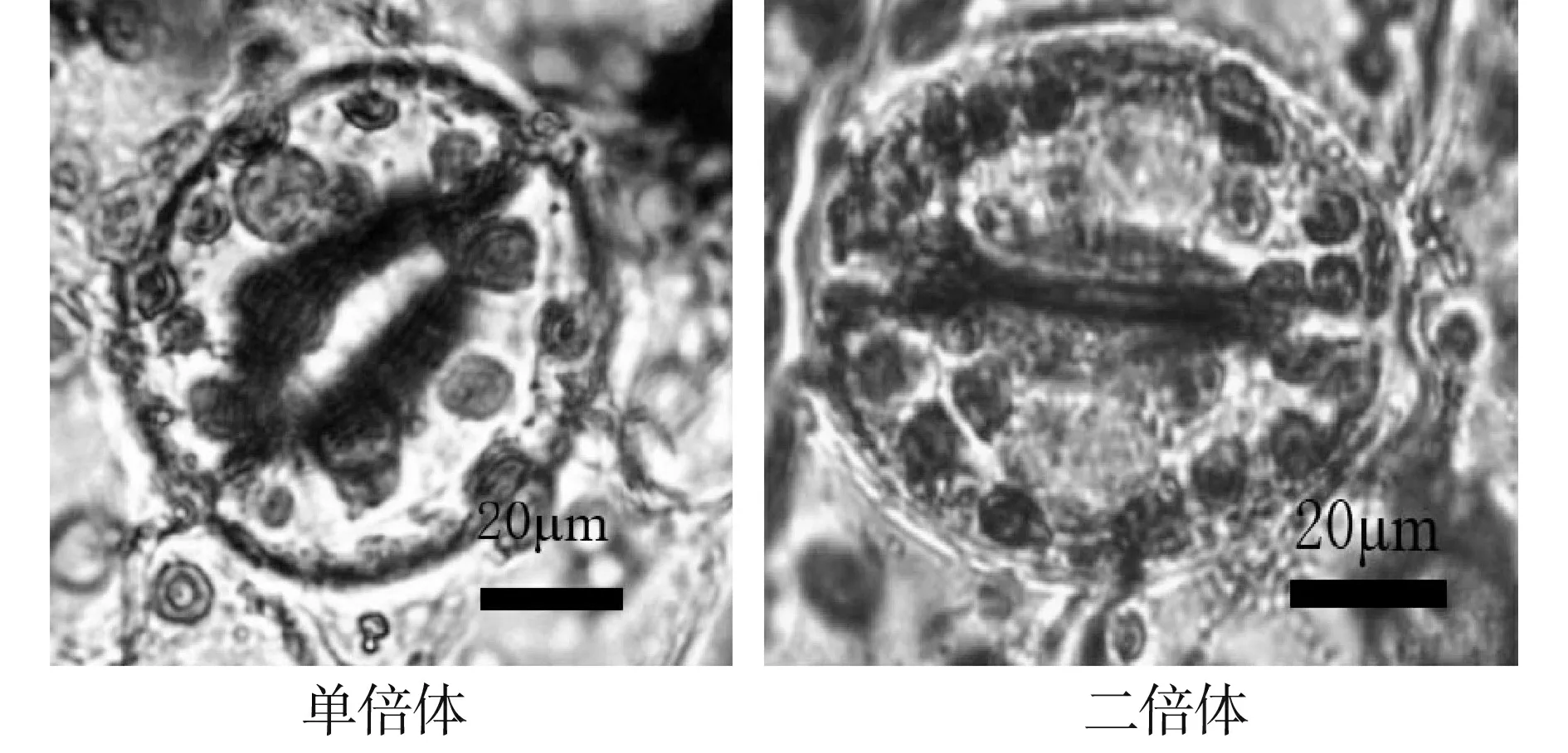
图2 不同倍性植株在10×100倍显微镜下的气孔大小
根据刘仁祥等[12]和贾兴华等[13]的试验,烟草单倍体气孔保卫细胞叶绿体为0~15个,烟草二倍体叶绿体为15~25个,多倍体为25以上。对试验中经流式细胞仪检测显示成功加倍的双单倍体烟草叶片以及未加倍成功的烟草叶片进行气孔保卫细胞叶绿体的观察,统计显示单倍体、双单倍体以及二/四倍体嵌合体烟叶的气孔保卫细胞叶绿体分别为7~17、10~28以及24~30个,平均数分别为11、18和26个,单倍体与双单倍体、双单倍体与二/四倍体嵌合体的比值为0.61和0.69,两个比值都接近1∶2,且差异显著(p<0.05)。显微镜观察结果如图3所示。

图3 叶片气孔保卫细胞叶绿体计数法结果
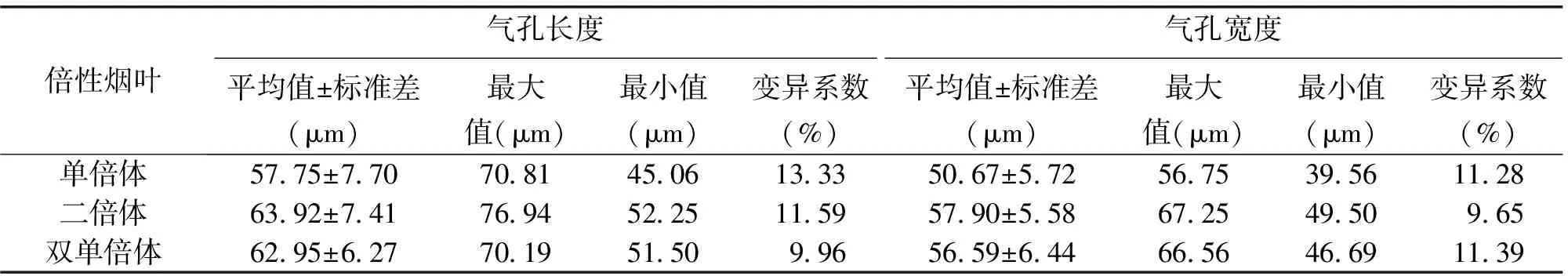
倍性烟叶气孔长度气孔宽度平均值±标准差(μm)最大值(μm)最小值(μm)变异系数(%)平均值±标准差(μm)最大值(μm)最小值(μm)变异系数(%)单倍体5775±7707081450613335067±572567539561128二倍体6392±7417694522511595790±55867254950965双单倍体6295±627701951509965659±644665646691139
2.3 不同浓度秋水仙素处理烟苗的结果
用本试验方法对烟苗进行加倍,发现浓度为1 250、1 500、2 000、4 000 mg/L的秋水仙素由于毒害作用,处理的单倍体烟苗48 h后全部死亡。1 000 mg/L的秋水仙素浓度加倍处理48 h后有5株植株存活,移栽入大田中后也全部死亡。
750 mg/L以下(包含750 mg/L)浓度的秋水仙素处理48 h后,成苗率和大田移栽成活率随着浓度的降低而升高,成苗率从79.98%上升到82.54%,大田移栽成活率从82.15%上升到89.86%。染色体加倍率和综合染色体加倍率在750和500 mg/L有一个小高峰后开始降低,从1.62%下降到0.87%。从加倍效率来说,最佳的秋水仙素浓度为750 mg/L(表2)。
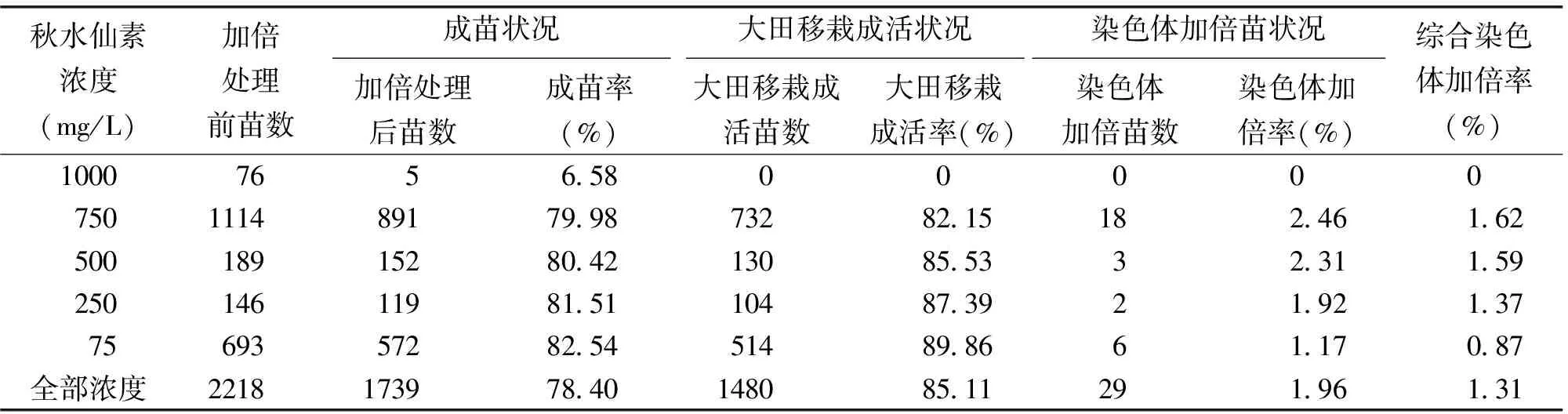
表2 不同浓度秋水仙素处理烟苗结果
2.4 有根与无根烟苗秋水仙素处理结果
在总体趋势上,有根的烟苗比无根的染色体加倍率高;在成苗率上,秋水仙素浓度为750 mg/L时,无根的处理比有根的处理高,而在浓度为75 mg/L时,有根与无根处理的成苗率相似;在大田移栽成活率上,750和75 mg/L的处理,都是无根比有根高(表3)。
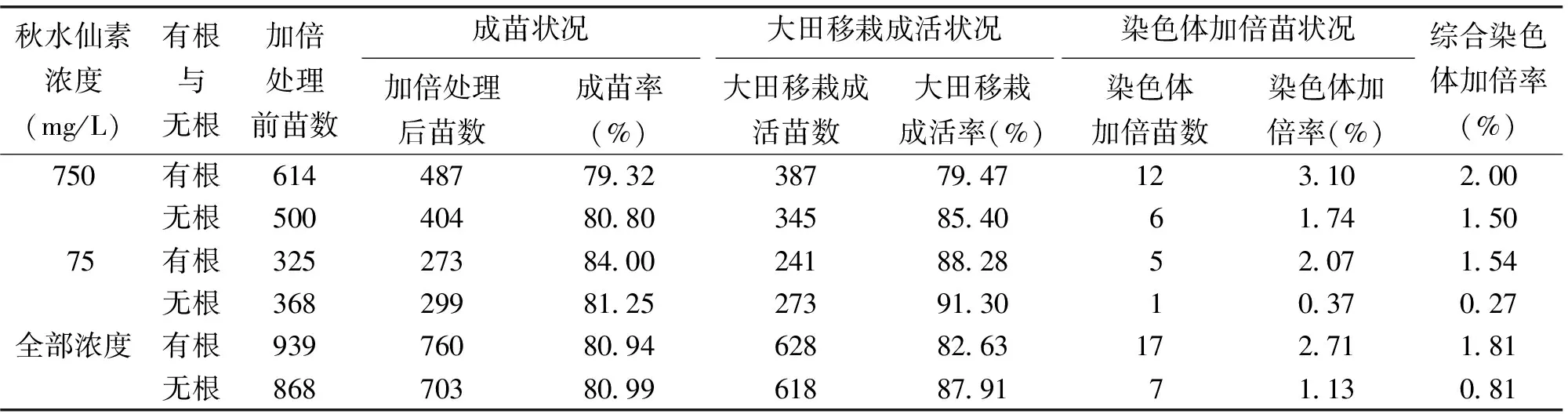
表3 有根与无根处理烟苗结果
3 讨论
3.1 关于综合加倍率
采用低浓度的秋水仙素处理时可以获得较高的成苗率,但亦会导致较低的染色体加倍率,因此有必要对秋水仙素的浓度选择进行综合考虑。本试验采用最大浓度750 mg/L的秋水仙素进行处理,其综合加倍率为1.62%;最小浓度75 mg/L的秋水仙素处理,其综合加倍率为0.87%。陈学军等人采用的高浓度秋水仙素进行处理,其综合加倍率在1.52%到2.76%之间[4]。本试验采用750 mg/L的浓度秋水仙素加倍的一次加倍效果与其相当。
3.2 关于叶片气孔大小、数目以及保卫细胞叶绿体计数结果
国内许多学者都证实过同一倍性的烟叶植株上的不同叶片间及同一叶片的不同部位间,气孔保卫细胞叶绿体数的平均值非常接近,在用叶绿体计数法鉴定倍性时,可以不受叶片发育时期与部位的影响[14],类似情况的还有苹果和梨[15]、辣椒[16]等。
关于叶片气孔大小及单位面积内的数目,在西葫芦[17]、葡萄[18]等作物上有报道,作物的倍性越高,气孔越大,而单位面积内的气孔越少,其中的差异很显著,可以作为鉴定植物倍性的标准。本试验中,烟草单倍体与二倍体之间气孔大小和叶片单位面积内气孔数目是有一定的差异,但差异并不显著,且变幅较大,需要经过大量统计才能得出其中的差异性。因此,对于单株烟草的倍性鉴定,并不推荐用叶片气孔大小及单位面积内气孔数目进行鉴定,具有类似情况的还有甘蓝类蔬菜[19]、黄瓜[20]、大白菜[21]。
3.3 关于烟草成苗率
从表2、3可以看出,秋水仙素浓度的增高会导致成苗率降低。普遍烟草单倍体加倍方法[2,6]一般采用4、2 g/L秋水仙素进行处理,其成苗率在30%左右,而本试验方法的成苗率高达80%左右。如果在此基础上进行反复加倍,可节约烟苗材料。同时本试验降低了秋水仙素的使用量,节约了试验经费,减少了对环境的污染。
3.4 秋水仙素对无根植物加倍的影响
从表3可以看出,秋水仙素处理后,有根处理的染色体加倍率普遍比无根处理的高。笔者认为有根处理染色体加倍率高的原因:无根的烟草组培苗因为没有根系辅助吸收秋水仙素,导致秋水仙素作用于植株内有丝分裂的细胞几率减小,从而导致加倍率降低。
4 问题与展望
(1)对于很多植物来说,不同器官均可以诱导出多倍体,如百合的鳞片、试管苗、不定芽、丛生芽、愈伤组织、叶柄等[22]。不同器官的诱导率不同,对秋水仙素毒害作用的敏感程度也不同。在用植物器官诱导多倍体时,秋水仙素是否对于植物伤口也有一定的毒害作用,国内未见相关报道。
(2)在用秋水仙素加倍时,对于不同的材料、不同的生长时期,一定要多方面考虑影响加倍效率的因素,如时间、温度、浓度等,也可以使用多种方法对烟苗进行加倍。此方面的工作有待深入,还需找出更多更好的方法让烟草DH群体的构建效率更高。
致谢:朱咸鑫、曾繁飞、陈晓焕等参与了实验,一并致谢!
[1] 杨铁钊.烟草育种学[M].北京:中国农业出版社,2003.
[2] 朱惠琴,张宪银,薛庆中.开发实用的染色体加倍体系构建成烟草DH群体[J].分子植物育种,2004,2(5):643-648.
[3] 刘仁祥,黄 莺,蒋光华,等.秋水仙素对烟草单倍体幼苗加倍及成苗效应研究[J].西南大学学报,2009,31(2):89-93.
[4] 陈学军,彭双玉,罗建蓉,等.6个烟草杂交组合花药再生苗的培养和DH群体的构建[J].植物资源与环境学报,2011,20(1):65-85.
[5] 彭尽晖,张良波.秋水仙素在植物倍性育种中的应用进展[J].湖南林业科技,2004,31(5):22-25.
[6] 陈新民,张文祥,崔淑兰,等.小麦×玉米产生小麦单倍体的染色体加倍研究[J].中国农业科学,2002,35(4):447-445.
[7] 张计育,李国平,乔玉山,等.秋水仙素对草莓离体叶片再生和多倍体诱导的影响[J].植物资源与环境学报,2009,18(3):69-73.
[8] 陈佰鸿,李新生,曹孜义,等.一种用透明胶带粘取叶片表皮观察气孔的方法[J].植物生理学通讯,2004,40(2):215-218.
[9] 朱惠琴,张宪银,薛庆中.烟草染色体倍性快速鉴定方法[J].农业生物技术学报,2006,14(2):255-258.
[10] 宋 平,王志安,王志宁.棉属中染色体倍性与叶片气孔形状的关系[J].浙江农业大学学报,1989,15(1):39-44.
[11]程 玲,冯 吉,余 军,等.秋水仙素在烟苗染色体加倍试验中的重复利用研究[J].湖南农业科学,2013(17):17-19.
[12]刘仁祥,蒋光华,杨双剑,等.烟草植株染色体倍数性与叶绿体数的相关性研究[J].河南农业大学学报,2008,42(2):131-134.
[13]贾兴华,陈振吉,艾树理,等.用气孔保卫细胞叶绿体计数法测定烟草单倍体和二倍体[J].中国烟草科学,1980 (4):38-45.
[14]刘仁祥,黄 莺.烟草花粉植株染色体倍性的早期快速鉴定[J].贵州农业科学,1998,26(6):4-7.
[15]李 赟,石荫坪,束怀瑞,等.应用气孔性状对苹果与梨的形状判别分析[J].果树科学,1999,16(1):9-13.
[16]张菊平,巩振辉,刘珂珂,等.辣椒染色体倍性水平的快速检测[J].西北农林科技大学学报:自然科学版,2007,35(8):121-124.
[17]郭永强,王建设,张慧玲,等.西葫芦胚囊再生植株倍性鉴定方法研究[J].华北农学报,2004,19(3):80-83.
[18]戴洪义,孙 敏,商传明,等.葡萄的染色体倍性与气孔性状的关系及其判别分析[J].葡萄栽培与酿酒,1990(2):5-9.
[19]袁素霞,刘玉梅,方智远,等.甘蓝类蔬菜小孢子再生植株染色体倍性与气孔保卫细胞叶绿体的相关性[J].中国农业科学,2009,42(1):189-197.
[20]韩毅科,杜胜利,王 鸣,等.黄瓜染色体制片及倍性研究[J].华北农学报,2003,18(1):72-74.
[21]韩 阳,叶雪凌,冯 辉,等.大白菜小孢子植株的倍性变异及倍性鉴定方法的研究[J].中国蔬菜,2006(11):9-11.
[22]宋 平,王学凤,蔡 明,等.秋水仙素诱导观赏植物多倍体研究进展[J].湖北农业科学,2009,48 (6):1150-1153.
Influence of Colchicines on Chromosome Doubling of Tobacco Haploid
ZHAO Lu1,HU Ri-sheng2,CAI Chang-chun3,ZHOU Zhen-zhen1,LIU Zhi1,HE Li-xiong1*
(1 College of Bio-science and Technology,Hunan Agricultural University,Changsha,Hunan 410128,China2 Tobacco Research Institute of Hubei Province, Wuhan, Hubei 430030, China;3 Hunan Province Tobacco Company, Changsha, Hunan 410004, China)
To increase the chromosome doubling rate during tobacco haploid technique,the effects of different concentrations of colchicines on the seedling rate of haploid tobacco seedlings,surviving rate of cropland transplanting and the chromosome doubling rate were studied with haploid Tobacco seedling,produced from anthers tissue culture method via the K394×Yunyan87’s F1generations of tobacco,as the experimental materials.Taking the soaking seedling method as comparison,under the condition of rootless tobacco plants,the influence of colchicines on the seedling rate of haploid tobacco seedlings,the surviving rate of cropland transplanting and the chromosome doubling rate were studied.The results indicated that the seedling rate of haploid tobacco seedlings and the surviving rate of cropland transplanting were increased while the chromosome doubling rate decreased with the decrement of concentration of colchicines.And the chromosome doubling rate of the plants without roots was lower than those with roots.
tobacco;haploid;chromosome doubling;colchicines
2014-10-31
赵 璐(1989-),女,河北省冀州市人,硕士研究生,Email:263542334@qq.com。
中国烟草总公司科技重大专项(110201301009(JY-09))。
Q943.1;S572.01
A
1001-5280(2015)03-0235-05
10.3969/j.issn.1001-5280.2015.03.04
*通信作者。
