Am80和TSA对鸡Stra8基因启动子活性的调控作用
2015-03-23刘志永左其生肖天荣韦光辉陈庭峰张振韬王怡临蒋舒颖张亚妮李碧春
刘志永,左其生,肖天荣,韦光辉,陈庭峰,朱 睿,张振韬,王怡临,蒋舒颖,张亚妮,李碧春
(扬州大学动物科学与技术学院,扬州 225009)
Am80和TSA对鸡Stra8基因启动子活性的调控作用
刘志永,左其生,肖天荣,韦光辉,陈庭峰,朱 睿,张振韬,王怡临,蒋舒颖,张亚妮,李碧春*
(扬州大学动物科学与技术学院,扬州 225009)
旨在确定鸡Stra8基因启动子的主要调控区域,预测调控元件结合位点,探索用他米巴洛丁(Am80)或曲古抑菌素(TSA)诱导对Stra8启动子活性的调控作用。将鸡Stra8基因5′侧翼系列缺失片段插入到pGL3-basic载体构建重组质粒,并转染DF-1和GC-1,通过检测荧光素酶活性和预测启动子区域调控元件的结合位点,选取合适的启动子片段并构建其重组质粒Stra8-EGFP;将Am80和TSA分别按一定的浓度梯度诱导转染细胞,进行荧光素酶活性检测以筛选最佳诱导浓度;用最适剂量的Am80和TSA分别单独或联合诱导转染重组质粒Stra8-EGFP的P19,并检测各诱导组的绿色荧光表达程度。结果表明,鸡Stra8基因启动子-1 055~+54 bp片段的活性较强,且含有RARα、RXRα和RARβ的结合位点;分别单独或联合使用Am80和TSA对转染的细胞进行诱导,结果显示,Am80和TSA协同作用的荧光素酶活性最高;重组质粒Stra8-EGFP转染细胞后,用Am80(10-5mol·L-1)和TSA(10-6mol·L-1)联合诱导可见绿色荧光强度最强。本研究成功分析了鸡Stra8基因启动子的活性和调控元件的结合位点,确定Am80和TSA共同诱导可显著提高Stra8基因启动子调控活性。
Stra8基因;启动子活性;调控元件;Am80;TSA
Stra8是生殖细胞由有丝分裂转变为减数分裂前特异表达的基因,在调控哺乳类和鸟类减数分裂的起始过程中起到关键作用[1]。Stra8一旦缺失,生殖细胞将不能完成减数分裂。据研究报道,Stra8缺失的雄鼠不能进入减数分裂前期;在雌性,Stra8缺失后,生殖细胞没有出现进入减数分裂的一系列特征,这表明,Stra8对雄性和雌性均是诱发减数分裂和正常减数分裂前期进行的关键[2]。生殖细胞在视黄酸(RA)的激活下表达Stra8,继而才能从有丝分裂进入减数分裂前期,产生有性生殖配子[3]。RA的生物活性是通过RA受体(Retinoic receptor,RAR)和RXR受体(Retinoid receptor,RXR)的激活而介导的[4]。RARs和RXRs都具有由不同基因编码的α、β、γ 3种亚型,RA的生理学功能可被不同的RARs亚型调节,其与RXRs结合形成二聚体,RXR具有支架蛋白的作用促进DNA和受体结合[5]。多种辅激活物和辅阻遏物可与RARE结合,影响RA应答基因上RAR-RXR-RA复合物的活性。在RA缺失时,RAR/RXR二聚体招募含有组蛋白去乙酰化酶活性的辅阻遏物复合物,诱发转录抑制[6];当RA存在时,其与RAR/RXR二聚体结合,组蛋白乙酰转移酶活性的辅激活物替代辅阻遏物,其能够诱导转录激活,从而发生与RA应答基因诱导和抑制有关的表观遗传修饰[7]。
他米巴洛丁(Tamibarotene,Am80)是RARα的激活剂,其能够与RARα特异性结合[8],且其活性大约是全反式视磺酸(ATRA)的10倍。Stra8启动子上与RARE结合的组蛋白去乙酰化酶(HDAC),能使染色质凝聚,基因转录沉默[9]。曲古抑菌素(Trichostin A,TSA)与HDAC结合,使其失去活性。目前在Stra8基因的相关研究中,ATRA是常用的诱导剂,而其他对Stra8有较好诱导作用的诱导剂的研究还甚少。本试验通过应用生物信息学分析和双荧光素酶活性检测系统技术,寻找与Stra8基因转录有关的调控元件,以此来检验Am80和TSA对Stra8基因启动子调控活性的影响。通过研究Am80和TSA对Stra8基因启动子活性的调控作用,以期为Stra8基因诱导剂的筛选提供参考依据。
1 材料与方法
1.1 材料和试剂
试验动物购自中国家禽研究所,采集苏秦黄鸡公鸡的睾丸组织,经液氮速冻后-70 ℃长期保存。大肠杆菌DH5α感受态细胞、克隆载体pMD19-T Vector以及各种限制性内切酶和修饰酶 购自TaKaRa公司;pGL3-Basic(萤火虫荧光素酶报告基因载体)和pRL-SV40(海肾荧光素酶对照报告基因载体)购自Promega公司;离心柱型动物组织基因组DNA提取试剂盒购自北京鼎国昌盛生物技术有限责任公司;去内毒素小提试剂盒购自Omega公司;双荧光素酶检测系统购自Promega公司;Lipofectamine 2000购自Invitrogen公司。DF-1(鸡胚成纤维细胞)和P19(小鼠胚胎畸胎瘤细胞)均为本实验室保存;GC-1(小鼠精原细胞系)购自ATCC。引物合成及测序由上海Invitrogrn生命技术公司完成。
1.2 试验方法
1.2.1 生物信息学分析 利用在线软件TFsearch(http://www.cbrc.jp/research/db/TFSEARCH.html)和AliBaba 2.1(http://www.gene-regulation.com/pub/programs/alibaba2/index.html)对Stra8基因启动子区及其潜在的转录因子结合位点进行预测和分析。
1.2.2 鸡Stra8基因启动子区系列缺失片段的扩增 根据GenBank上红色原鸡Stra8基因序列(GeneID:XM_416179)翻译起始位点(ATG)上游3 kb区域的序列特征分析结果,采用系统缺失的方法设计引物,上下游引物5′端分别有KpnⅠ和HindⅢ酶切位点(引物序列见表1,酶切位点序列加有下划线),酶切位点前面为保护碱基,以保证酶切位点不丢失。
以基因组DNA 为模板,使用PrimeSTAR®Max进行PCR扩增。经1%琼脂糖凝胶电泳检测后进行切胶回收,将纯化后的PCR产物与pMDTM19-T Vector进行连接,并转化至感受态细胞DH 5α中,经KpnⅠ和Hind Ⅲ双酶切鉴定及测序验证,构建正确的克隆载体。
表1Stra8基因系列缺失片段引物序列
Table 1 Primer sequences ofStra8 gene missing mutants

名称Name引物序列(5'→3')Primersequence退火温度/℃Tm片段长度/bpSizepGL3-P1(-201~+54bp)F:GGGGTACCGGGAGCAAAGCTGCGTCCR:CCAAGCTTCCCGTTACCAATTGCACGTA61.5255pGL3-P2(-500~+54bp)F:GGGGTACCGGTCCGCCTTGATCTCCGR:CCAAGCTTCCCGTTACCAATTGCACGTA60.5554pGL3-P3(-739~+54bp)F:GGGGTACCATTAGCGAGCGGCACGAAGR:CCAAGCTTCCCGTTACCAATTGCACGTA60.5793pGL3-P4(-1055~+54bp)F:GGGGTACCTCGATACAGGCTGGTTTTCAGR:CCAAGCTTCCCGTTACCAATTGCACGTA58.51109pGL3-P5(-1209~+54bp)F:GGGGTACCATCACATAAGGACTGCCCGAR:CCAAGCTTCCCGTTACCAATTGCACGTA60.51263pGL3-P6(-1629~+54bp)F:GGGGTACCCCAAATTAAGCTCCAGGCAAR:CCAAGCTTCCCGTTACCAATTGCACGTA58.51683pGL3-P7(-1901~+54bp)F:GGGGTACCGGGAGCAAAGCTGCGTCCR:CCAAGCTTCCCGTTACCAATTGCACGTA591955
下划线字母分别表示限制性内切酶KpnⅠ和Hind Ⅲ的酶切位点
Underlines indicate the restriction sites ofKpnⅠ和Hind Ⅲ
1.2.3 系列缺失表达载体和Stra8-EGFP表达载体的构建 用KpnⅠ和Hind Ⅲ分别双酶切克隆载体和pGL3-basic载体,酶切片段经回收纯化后,使用T4 DNA Ligase进行连接,并转化至感受态细胞DH5α中,经KpnⅠ和Hind Ⅲ双酶切鉴定及测序验证正确后分别命名为pGL3-P1、pGL3-P2、pGL3-P3、pGL3-P4、pGL3-P5、pGL3-P6、pGL3-P7。
以重组质粒pGL3-P4为模板进行PCR扩增,用AseⅠ和Hind Ⅲ对获得的目的片段和pEGFP-N1进行双酶切。对目的片段和载体片段进行回收纯化、连接,并转化至感受态细胞DH5α中,经AseⅠ和Hind Ⅲ双酶切鉴定及测序验证正确后分别命名为Stra8-EGFP。
1.2.4 细胞瞬时转染 转染前将细胞以5×105的密度铺于24孔板,待细胞完全贴壁生长至80%融合时,参照Lipofectamine 2000使用说明书,分别将各重组质粒和内参质粒pRL-SV40以25∶1的比例共转染到DF-1和GC-1细胞中,同时设置阴性对照组(pGL3-basic空质粒与pRL-SV40质粒共转),6 h后换液,换液后4 h,把Am80和TSA分别按一定的浓度梯度加入培养基中,并加入ATRA(10-6mL·L-1)作为对照来筛选最佳诱导浓度;其后用最适剂量的Am80和TSA单独或联合诱导转染的细胞,均在48 h后收集细胞,进行双荧光素酶活性检测,每组重复3次。
1.2.5 双荧光素酶活性检测 将收集后的细胞取100 μL加入到96孔板中,按Dual-Glo®Luciferase-Assay system 试剂说明书要求,首先加入100 μL Dual-Glo®Luciferase Buffer,15 min后检测萤火虫荧光素酶活性值;然后,加入100 μL Dual-Glo®Stop & Glo®Buffer,15 min后检测海肾荧光素酶活性值,两者之比值即为荧光素酶相对活性值(Relative luciferase activity,RLA),采用“平均值±标准差”形式表示(具体操作步骤见Promega Dual-Glo®Luciferase Assay System)。
1.2.6 稳定转染质粒Stra8-EGFP的细胞筛选和GFP检测 用G418按一定的浓度梯度筛选转染过Stra8-EGFP质粒的P19细胞2周左右,能使P19细胞全部死亡的G418最低浓度为最佳筛选浓度,该筛选浓度的确定可用于后续的G418抗性阳性细胞的筛选。对经过筛选的细胞培养、接种于24孔板,待细胞生长汇合至80%~90%时,转染Stra8-EGFP质粒。转染4 h后,将Am80和TSA以最适剂量单独或者联合对转染的细胞进行诱导,并加入ATRA(10-6mL·L-1)作为对照,在36 h后使用荧光显微镜检测不同诱导组的绿色荧光表达情况。
2 结 果
2.1 鸡Stra8基因启动子区系列缺失片段的PCR扩增
2%琼脂糖凝胶电泳检测结果表明,所获得的一系列缺失体的PCR产物大小分别与预期长度一致(图1),表明成功获得目的DNA片段。

M.DNA相对分子质量标准;1~7.P1(255 bp)、P2(554 bp)、P3(793 bp)、P4(1 109 bp)、P5(1 263 bp)、P6(1 683 bp)、P7(1 955 bp)M.DNA marker DL5000;1-7.PCR products using primers of P1,P2,P3,P4,P5,P6,P7图1 启动子缺失片段的PCR结果Fig.1 PCR products of different promoters
2.2 鸡Stra8基因启动子区系列缺失载体的构建
用KpnⅠ和Hind Ⅲ双酶切7个系列缺失载体,1%琼脂糖凝胶电泳,获得相应启动子片段和载体片段的两条带,大小与预期结果相符,说明载体构建正确,可用于后续试验。酶切电泳见图2。

M.DNA相对分子质量标准;1~7.分别为重组质粒pGL3-P1(-201~+54 bp),pGL3-P2(-500~+54 bp),pGL3-P3(-739~+54 bp),pGL3-P4(-1 005~+54 bp),pGL3-P5(-1 209~+54 bp),pGL3-P6(-1 629~+54 bp),pGL3-P7(-1 901~+54 bp)的酶切结果M.DNA marker DL5000;1-7.Restriction enzyme digestion products of the vector pGL3-Stra8图2 质粒pGL3-Stra8酶切电泳结果Fig.2 Identification of pGL3-Stra8 plasmid
2.3 鸡Stra8基因启动子系列缺失片段活性比较
用上述构建的7个重组质粒和pRL-SV40质粒分别共转染DF-1和GC-1细胞系,pGL3-basic质粒作为阴性对照,检测各自启动子活性(图3)。结果表明,鸡Stra8基因启动子系列缺失片段在这两种细胞中的活性变化趋势基本一致,重组质粒pGL3-P2的启动子活性最强,pGL3-P1启动子活性基本丧失,说明启动子的核心区域位于-554~-255 bp。
2.4Stra8基因启动子区转录调控及调控元件分析
根据启动子活性分析结果Stra8基因上游存在着不同的调控功能区域,使用TFsearch和AliBaba 2.1在线软件分析Stra8启动子-1 955~+45 bp区域发现了调控元件RARα、RXRα和RARβ (图4)。结合启动子缺失片段的活性高低,选取重组质粒pGL3-P4的启动子片段来构建Stra8-EGFP重组质粒用于后续研究。

图3 Stra8基因启动子缺失片段在DF-1和GC-1细胞中的活性Fig.3 Activity of different promoters of Stra8 in DF-1 and GC-1 cells
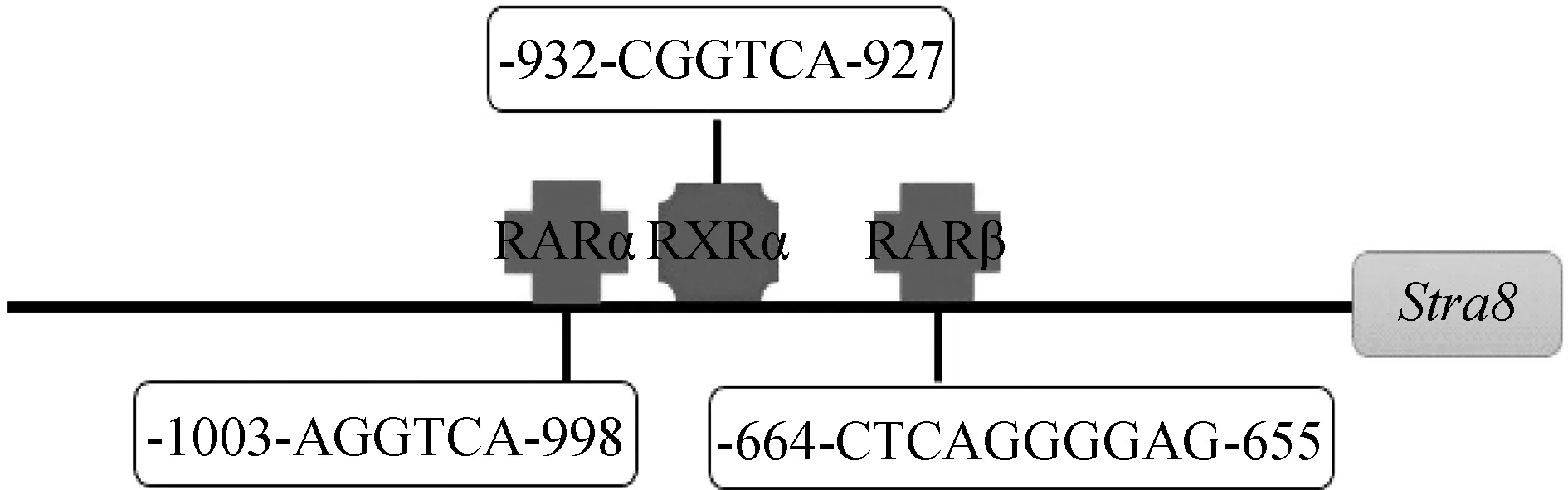
图4 Stra8基因-1 955~+45 bp区调控元件结合位点预测Fig.4 Prediction of regulatory elements binding sites at -1 955-+45 bp of Stra8 gene
2.5 Stra8-EGFP质粒的构建
用和AseⅠ和Hind Ⅲ对重组质粒Stra8-EGFP双酶切,1%凝胶电泳检测,获得相应启动子和载体片段,酶切电泳见图5。
2.6 Am80和TSA诱导对Stra8启动子活性的影响
使用不同浓度的Am80和TSA对重组质粒pGL3-P4转染的DF-1细胞进行诱导,结果表明,二者分别在浓度为10-5和10-6mol·L-1时相对荧光素酶活性值最高,说明此浓度是Am80和TSA最佳诱导浓度。因TSA和Am80调控基因表达的作用方式不同,二者可共同使用而发挥较高调控活性。当TSA和Am80联合诱导时,其相对荧光素酶活性值达到最高,比ATRA诱导组提高94倍,且与其他诱导组相比差异极显著(P<0.01),这表明TSA和Am80共同作用时诱导效果最好(图6)。

M.DNA相对分子质量标准;1.重组质粒Stra8-EGFP(1 109 bp)的双酶切鉴定结果M.DNA marker DL5000;1.Restriction enzyme digestion products of the vector Stra8-EGFP图5 重组质粒Stra8-EGFP酶切电泳结果Fig.5 Identification of recombination plasmid Stra8-EGFP

**.差异极显著(P<0.01);*.差异显著(P<0.05)。A.Am80和TSA分别在不同浓度(mol·L-1)时对Stra8基因基因启动子活性的影响;B.Am80(10-5mol·L-1)或TSA(10-6mol·L-1)对Stra8基因启动子活性的影响**.P<0.01;*.P<0.05.A.Effects of Am80 and TSA at different concentrations on the activity of Stra8 promoter;B.Effects of Am80(10-5mol·L-1) and TSA(10-6mol·L-1) on the activity of Stra8 promoter图6 Am80和TSA诱导作用对质粒pGL3-P4启动子活性的影响Fig.6 Effects of the induction of Am80 and TSA on the promoter activity of plasmid pGL3-P4
2.7 Am80和TSA在细胞水平上对Stra8启动子的调控作用
经过2周的筛选,在浓度为400 μg·mL-1时P19细胞基本全部死亡,故此为最佳筛选浓度。在转染过Stra8-EGFP质粒,待培养后加入ATRA、Am80和TSA,36 h后用荧光显微镜观察,结果,Am80和TSA共同诱导组的绿色荧光表达强度最高(图7),且不同诱导组的荧光表达强度的趋势与其相对荧光素酶值的趋势一致,由此可知,Am80和TSA共同作用对Stra8启动子的调控作用最强。

1.ATRA诱导组;2.Am80诱导组;3.TSA诱导组;4.Am80和TSA联合诱导组1.ATRA induction group;2.Am80 induction group;3.TSA induction group;4.Am80 and TSA in combination induction group图7 Am80 和TSA诱导作用对质粒Stra8-EGFP绿色荧光表达强度的影响 200×Fig.7 Effects of the induction of Am80 and TSA on the expression of green fluorescence of Stra8-EGFP plasmid 200×
3 讨 论
Stra8是ATRA诱导小鼠P19畸胎瘤干细胞分化中分离的重要基因片段[10],而且在诱发减数分裂和正常减数分裂前期进行的过程中发挥重要作用。全反式维甲酸(Alltransretinoic acid,ATRA)作为RA的天然异构体,在体内除部分代谢灭活外,主要的是经过异构酶的作用代谢为活性产物:11cis-RA、13cis-RA、9cis-RA这些顺式维甲酸与维甲酸受体(RARs)及维甲酸类受体(RARs)结合,在mRNA的水平对细胞的增殖和分化发挥作用[11]。Am80是维生素A活性代谢产物,全反式视磺酸的类似物。组蛋白是染色体折叠所必须的蛋白,其和DNA结合的松散程度被认为是转录因子和启动子结合的关键因素[12]。具有HAT活性的组蛋白可以充当辅助激活剂,而具有HDAC活性的组蛋白能够诱导转录激活[13]。TSA是去乙酰化组蛋白酶(HDAC)的最有效抑制剂[14],组蛋白去活化是减数分裂过程中染色体准确折叠所必须的[15]。鉴于Stra8基因启动子的调控原理,本试验选用Am80和TSA来探索其对Stra8启动子活性的影响。
为了筛选比ATRA更有效的Stra8基因的诱导剂,本研究根据鸡Stra8基因启动子序列,构建了7个不同长度的启动子片段,分别转染DF-1及GC-1细胞系。双荧光素酶活性检测的结果表明,不同重组质粒pGL3-P1、pGL3-P2、pGL3-P3、pGL3-P4、pGL3-P5、pGL3-P6和pGL3-P7在细胞系DF-1和GC-1中的活性趋势一致,而pGL3-P7在两细胞系中基本没有活性。根据此检测结果,运用TF search和AliBaba2.1对Stra8基因启动子序列进行生物学信息分析,发现在此区域存在受体RARα、RXRα和RARβ。Am80以配体的形式与核受体-视磺酸受体(RARα)结合,在被激活后RAR和RXR结合形成RAR/RXR二聚体,并结合到特异性DNA片段上[16],从而启动目的基因的表达。TSA作为组蛋白去乙酰化酶(HDAC)的抑制剂,其能够通过与其结合使其失去活性,利于RAR/RXR二聚体招募组蛋白乙酰化酶(HAT),因HAT具有辅助激活的作用,从而产生诸如染色质重塑的表观遗传修饰,诱导目的基因表达。使用Am80对重组质粒pGL3-P4转染的DF-1细胞进行诱导时,相对荧光素酶活性值比ATRA诱导组的值提高;当Am80和TSA联合诱导时,其相对荧光素酶活性值比ATRA诱导组的值提高。在用ATRA和TSA对重组质粒pEGFP-Stra8转染的F19细胞诱导时,发现Am80和TSA诱导组表达GFP的强度高于ATRA诱导组。以上研究结果说明,Am80和TSA协同作用可以显著提高Stra8基因启动子的调控活性。
4 结 论
本研究利用双荧光素酶报告基因检测系统,结合生物信息学分析确定了Stra8基因启动子区域上调控元件(RAR、RXR)存在,并通过检测Am80和TSA对Stra8启动子的调控作用,验证了Am80(10-5mol·L-1)和TSA(10-6mol·L-1)共同诱导对Stra8启动子转录调控活性影响最大,为进一步筛选Stra8基因的诱导剂提供参考依据。
[1] 米美玲,杨 蓓,徐斯凡,等.Stra 8:生殖细胞有丝分裂转变为减数分裂前特异表达的基因[J].中华男科学杂志,2009,15(1):51-55. MI M L,YANG B,XU S F,et al.Stra 8:The specifically expressed gene before Mitosis to Meiosis in germ cellsJ].NationalJournalofAndrology,2009,15(1):51-55.(in Chinese)
[2] SMITH C A,ROESZLER K N,BOWLES J,et al.Onset of meiosis in the chicken embryo;evidence of a role for retinoic acid[J].BMCDevBiol,2008,8(1):85.[3] BALTUS A E,MENKE D B,HU Y C,et al.In germ cells of mouse embryonic ovaries,the decision to enter meiosis precedes premeiotic DNA replication[J].NatGenet,2006,38(12):1430-1434.
[4] EVANS R M.The steroid and thyroid hormone receptor superfamily[J].Science,1988,240(4854):889-895.
[5] ZIOUZENKOVA O,ORASANU G,SHARLACH M,et al.Retinaldehyde represses adipogenesis and diet-induced obesity[J].NatMed,2007,13(6):695-702.
[6] GERMAIN P,IYER J,ZECHEL C,et al.Co-regulator recruitment and the mechanism of retinoic acid receptor synergy[J].Nature,2002,415(6868):187-192.[7] KUMAR S,DUESTER G.SnapShot:retinoic acid signaling[J].Cell,2011,147(6):1422.
[8] NAKAGOMI M,SHUDO K,NAKATANI-PAWLAK A.Synthetic retinoid Am80 results in improved exploratory and emotional behavior in the P8 substrain of senescence-accelerated mice[J].PharmacolBiochemBehav,2013,104:1-9.
[9] HOGARTH C A,AMORY J K,GRISWOLD M D.Inhibiting vitamin A metabolism as an approach to male contraception[J].TrendsEndocrinolMetab,2011,22(4):136-144.
[10] BOUILLET P,OULAD-ABDELGHANI M,VICAIRE S,et al.Efficient cloning of cDNAs of retinoic acid-responsive genes in P19 embryonal carcinoma cells and characterization of a novel mouse gene,Stra1 (mouse LERK-2/Eplg2)[J].DevBiol,1995,170(2):420-433.
[11] KANATSU-SHINOHARA M,LEE J,INOUE K,et al.Pluripotency of a single spermatogonial stem cell in mice[J].BiolReprod,2008,78(4):681-687.
[12] STRUHL K.Histone acetylation and transcriptional regulatory mechanisms[J].GenesDev,1998,12(5):599-606.
[13] SPENCER V A,DAVIE J R.Role of covalent modifications of histones in regulating gene expression[J].Gene,1999,240(1):1-12.
[14] DE RUIJTER A,VAN GENNIP A,CARON H,et al.Histone deacetylases (HDACs):characterization of the classical HDAC family[J].BiochemJ,2003,370:737-749.
[15] FENIC I,HOSSAIN H M,SONNACK V,et al.Invivoapplication of Histone deacetylase inhibitor trichostatin-A impairs murine male meiosis[J].JAndrol, 2008,29(2):172-185.
[16] ZOU F,LIU Y,LIU L,et al.Retinoic acid activates human inducible nitric oxide synthase gene through binding of RARα/RXRα heterodimer to a novel retinoic acid response element in the promoter[J].BiochemBiophysicResComm, 2007,355(2):494-500.
(编辑 郭云雁)
Regulatory Effects of Am80 and TSA on ChickenStra8 Gene Promoter Activity
LIU Zhi-yong,ZUO Qi-sheng,XIAO Tian-rong,WEI Guang-hui,CHEN Ting-feng,ZHU Rui,ZHANG Zhen-tao,WANG Yi-lin,JIANG Shu-ying,ZHANG Ya-ni,LI Bi-chun*
(CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China)
The aims of this study were to identify the main regulatory regions of the chickenStra8 gene promoter,to predict the binding sites of the transcription elements,and to investigate the regulatory effects of Am80 and TSA on the chickenStra8 gene promoter activity.A series of promoter missing mutants were directly subcloned into pGL3-Basic vector,and the recombinant plasmids were transfected into DF-1 and GC-1 cells.By detecting luciferase activity and predicting binding sites of regulatory elements of promoter regulatory region,the optimal promoter fragment was selected to construct recombinant plasmid Stra8-EGFP.Am80 and TSA were applied to screen the best induced concentration,Am80 and TSA with optimal dose singly and in combination were used to induce transfected cells,and the green fluorescence expression levels in induced groups were detected.The chickenStra8 gene promoter fragment -1 055-+54 bp had stronger activity,and had the binding sites of RARα,RXRα and RARβ;Am80 and TSA singly and in combination were applied to induce the transfected cells,and the luciferase activity was highest in the cells induced by Am80 and TSA in combination.After the cells were transfected by Stra8-EGFP,the expression of green fluorescence were the highest in cells induced by Am80(10-5mol·L-1) and TSA(10-6mol·L-1) in combination.The activity and binding sites of regulatory elements of chickenStra8 gene promoter were successfully analyzed,and combined actions of Am80 and TSA significantly could promote the activity ofStra8 gene promoter.
Stra8 gene;promoter activity;regulatory element;Am80;TSA
10.11843/j.issn.0366-6964.2015.06.004
2013-12-27
国家自然科学基金项目(31272429)
刘志永(1986-),男,河南商丘人,硕士,主要从事胚胎工程和发育生物学研究,E-mail:864886521@qq.com
*通信作者:李碧春,教授,E-mail:yubcli@yzu.edu.cn
S831;S813.3
A
0366-6964(2015)06-0896-07
