墨西哥鼠尾草挥发油的抗菌活性研究
2015-03-23李晓旭
王 芳 李晓旭 高 瑾 梁 倩
(1.西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224,2.中央民族大学生命与环境科学学院,北京 100081)
墨西哥鼠尾草挥发油的抗菌活性研究
王 芳1李晓旭2高 瑾1梁 倩1
(1.西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224,2.中央民族大学生命与环境科学学院,北京 100081)
采用抑菌圈法和抑制菌丝生长速率法研究了墨西哥鼠尾草挥发油对大肠杆菌、普通变形杆菌、枯草芽孢杆菌、铜绿假单胞菌和金黄色葡萄球菌5种细菌及可可葡萄座腔菌、尖孢镰刀菌、腐皮镰刀菌、多主棒孢霉和尖孢炭疽菌5种真菌的抑制作用。结果表明:鼠尾草挥发油对5种供试的细菌菌株均有不同程度的抑制作用,且其最低抑菌浓度(MIC)分别为8、8、4、8、8 mg/mL;对5种真菌也有不同程度的抑制作用,其中对尖孢镰刀菌的抑制作用最强,EC50值为0.879 mg/mL;其次是尖孢炭疽菌和腐皮镰刀菌,EC50值分别为7.565和10.731 mg/mL。
墨西哥鼠尾草;挥发油;抗菌活性;细菌;真菌
挥发油(volatile),又称为植物精油(essential oils),是一类存在于植物体内、常温可以挥发、可随水蒸汽蒸馏、具有香味的挥发性油状液体的总称[1]。一般植物精油主要用于制作香水和香精,但随着人们生活质量的不断提高及环保意识的不断增强,植物精油的应用范围也日渐扩大,其在食品添加剂、害虫防治、杀菌抗菌和防腐等方面的功能也日益受到人们的关注与重视[2-3]。近年来的研究发现,不同来源的挥发油具有较强的抗菌谱,对细菌、真菌、病毒、原核生物和昆虫等都具有一定的抑制和杀灭作用[4],可作为一种有待开发的新型杀菌物质。
鼠尾草属(Salvia)植物是一个重要的药用植物类群,全世界有900多种。我国鼠尾草植物品种资源丰富且分布广泛,据《中国药物志》记载有83种,其中药用有30余种,分布于全国各地[5]。鼠尾草属植物地上部分大多含精油,使大多数植物具有挥发性芳香气味,其中很多种还具有抑菌、杀菌活性,如从鼠尾草属植物南欧丹参(Salviasclarea)中提取的精油,不仅可制成胶囊剂治疗胃肠胀气、消化不良、咽炎、喉头炎、口腔炎、舌炎和牙龈炎等[6],还能显著抑制革兰氏阳性菌和革兰氏阴性菌引起的感染[7]。
墨西哥鼠尾草(Salvialeucantha)是唇形科(Lamiaceae)鼠尾草属的一种多年生草本植物,原产于中南美洲地区,具有较强的耐热、耐旱性,极少有病虫害发生[8],在我国很多地方均有引种,但未见关于该植物化学成分抗菌活性方面的相关报道,因此本试验对该植物挥发油的抗菌活性进行分析,为探索其天然抗菌活性成分、开发天然药物制剂提供一定的参考依据。
1 材料与方法
1.1 试验植物材料
墨西哥鼠尾草于2013年6月18日采自云南省昆明市金马路路边花坛,经西南林业大学林学院杜凡教授鉴定为唇形科鼠尾草属墨西哥鼠尾草,阴干备用。
1.2 挥发油的提取
将墨西哥鼠尾草的地上部分样品阴干,切成长度0.5 cm左右的小段,放入2 000 mL的圆底烧瓶中,采用水蒸气蒸馏法提取得到浅黄色透明油状物,然后用0.2 μm的滤膜过滤,进行物理杀菌后,密封于冰箱中冷冻保存备用。
1.3 挥发油的抑菌试验
1.3.1 供试菌种 供试细菌大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、普通变形杆菌(Proteusvulgaris)均由西南林业大学植物病理学实验室提供;金黄色葡萄球菌(Staphylococcusaureus)和铜绿假单胞菌(Pseudomonasaeruginosa)由中国科学院微生物研究所提供。供试真菌可可葡萄座腔菌(Botryosphaeriarhodina)、尖孢镰刀菌(Fusariumoxysporum)、腐皮镰刀菌(Fusariumsolani)、多主棒孢霉(Corynesporacassiicola)和尖孢炭疽菌(Colletotrichumacutatum)由西南林业大学植物病理学实验室提供。
1.3.2 抑菌试验所用培养基 本试验所用培养基为牛肉膏蛋白胨培养基和马铃薯培养基(PDA)[9]。牛肉膏蛋白胨培养基:牛肉膏3 g 、蛋白胨10 g、氯化钠5 g,去离子水1 000 mL,pH 调至7.4~7.6;马铃薯培养基为:马铃薯200 g,葡萄糖20 g,琼脂15 g,去离子水1 000 mL[0]。
1.3.3 抑细菌活性试验 抑菌圈法[10]:将牛肉膏蛋白胨固体培养基溶化后,倒入培养皿,每皿加入约20 mL,待冷凝后涂布5种细菌菌悬液200 μL(菌悬液所含活菌量在106~107 CFU/mL[11])。取直径6 mm的无菌滤纸片,在以石油醚为溶剂的鼠尾草挥发油(0.48 g/mL)中充分浸泡后,放在含菌平板上,37 ℃倒置培养24 h,测量抑菌圈直径。
最低抑菌浓度(MIC)法[12]:以具有明显抑菌圈的菌种为供试菌种进行MIC值的测定。以石油醚为溶剂,对墨西哥鼠尾草挥发油样品进行二倍梯度稀释(0.32、0.16、0.08、0.04、0.02 g/mL),取稀释后的样品1 mL,加入到灭菌的19 mL牛肉膏培养基中,混匀,制成含药平板。待冷凝后涂布细菌菌悬液200 μL,37 ℃倒置培养24 h,观察细菌的生长情况,以完全无菌生长的样品浓度作为供试挥发油样品溶液的MIC值。
1.3.4 抑真菌活性试验 采用菌丝生长速率法[13]:取墨西哥鼠尾草挥发油样品原液(浓度为480 mg/mL)进行二倍梯度稀释,后取1 mL,加入到19 mL已溶化好的PDA培养基中,摇匀,制成含药平板。待冷凝后,加入已制备好的供试植物病原真菌菌饼,菌饼的直径为6 mm,28 ℃培养4 d,用十字交叉法测量各个菌落的直径,用下式求出抑菌率:
D净生长=D测量-6
R抑菌=(D对照-D处理)/D对照×100%
式中:D净生长为菌落净生长直径(mm);D测量为菌落测量直径(mm);R抑菌为抑菌率;D对照为对照菌落直径;D处理为处理菌落的直径。
真菌半抑菌浓度(EC50)的测定[14]:将抑菌效果好的菌种的抑制率转换为几率值,相应的抑菌浓度转换为其对数形式,后以浓度对数(X)为横坐标,抑制率的几率值(Y)为纵坐标,作毒力曲线,得毒力方程和EC50值。以EC50作为衡量样品,对不同植物病原真菌生长抑制活性大小的指标。
2 结果与分析
2.1 抑细菌活性
经试验,墨西哥鼠尾草挥发油溶液对5种细菌菌株均有不同程度的抑制作用(表1),在浓度为0.48 g/mL时,对大肠杆菌、枯草芽孢杆菌、普通变形杆菌、金黄色葡萄球菌和铜绿假单胞菌5种供试细菌菌株的抑菌圈平均直径分别为13.2、10.4、16.0、6.4 mm和9.1 mm;可见鼠尾草挥发油对5种供试细菌的的抑菌效果为普通变形杆菌>大肠杆菌>枯草芽孢杆菌>铜绿假单胞菌>金黄色葡萄球菌,其中对普通变形杆菌的抑菌圈直径最大,说明对普通变形杆菌的抑菌效果最好。以这些菌为供试菌株指示菌,测定得墨西哥鼠尾草挥发油的MIC值分别为8、8、4、8、8 mg/mL(表1)。
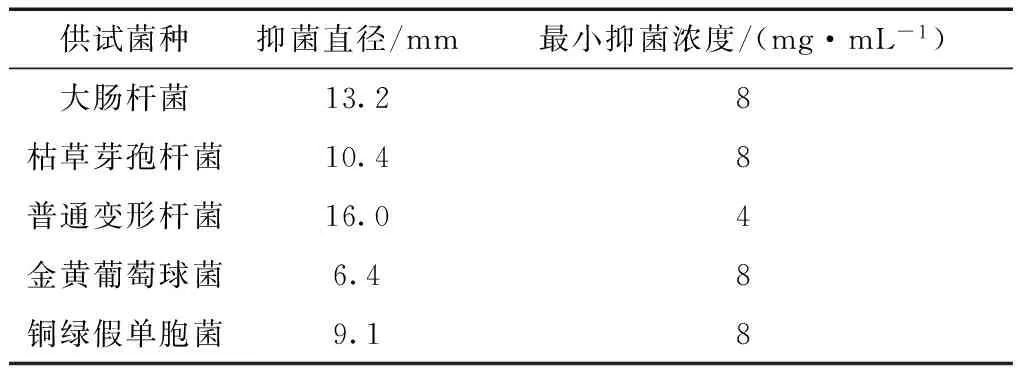
表1 墨西哥鼠尾草挥发油的抑细菌作用Tab.1 Anti-bacterial activitives ofessential oil from S. leucantha
2.2 抑真菌活性
对墨西哥鼠尾草挥发油的抑真菌活性的测定结果见表2。

表2 不同浓度墨西哥鼠尾草挥发油对植物病原真菌的抑制作Tab.2 Inhibition effect of essential oil from S. leucantha to 5 types of pathogenic fungi
从表2可以看出,鼠尾草挥发油对5种植物病原菌均具有不同程度的抑制作用,且其抑菌率基本随药液浓度的增加而增加。当浓度为24 mg/mL时,对5种植物病原真菌中的尖孢镰刀菌的抑制效果最好,抑菌率为72.97%;其次是腐皮镰刀菌和尖孢炭疽菌,其抑菌率分别为63.65%和54.62%。
根据上述不同浓度挥发油的抑菌率大小,作毒力回归曲线,得毒力方程,根据毒力方程计算其对各个真菌的EC50值,结果见表3。鼠尾草挥发油对5种植物病原真菌中的尖孢镰刀菌的抑制效果最好,其EC50为0.88 mg/mL;其次是腐皮镰刀菌和尖孢炭疽菌,其EC50分别为10.73 mg/mL和7.57 mg/mL,对多主棒孢霉和可可葡萄座腔菌的抑菌活性相对较弱。此外,从毒力回归曲线可以看出,墨西哥鼠尾草挥发油对植物病原菌的抗菌活性与其浓度呈正相关性,其对植物病原菌的毒力随着浓度的升高而增强。
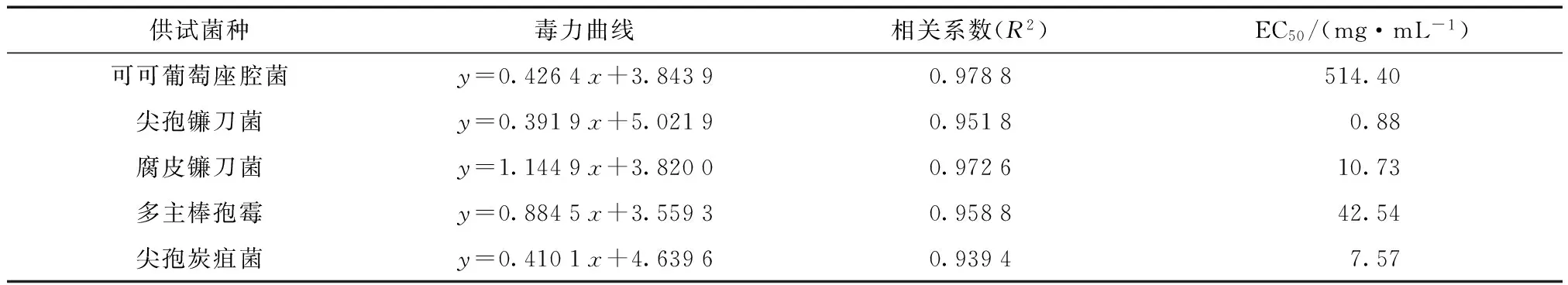
表3 墨西哥鼠尾草挥发油对植物病原菌菌丝生长抑制的毒力测定结果Tab.3 Virulence of essential oil from S. leucantha on different pathogenic fungi
3 结论与讨论
本试验通过抑菌圈法和抑制菌丝生长速率法分别测定了墨西哥鼠尾草挥发油对5种供试细菌和5种供试真菌的的抑菌活性。结果显示,墨西哥鼠尾草挥发油在同一浓度下,对细菌中普通变形杆菌的抑制效果最好,对真菌中尖孢镰刀菌的抑制效果最好;但无论是对其他细菌还是真菌,鼠尾草挥发油溶液均具有不同程度的抑制作用,具有潜在的广谱抗菌特点,对开发天然抗菌新制剂具有很大潜力,是一种开发利用价值很高的潜在抗菌资源。
植物挥发油具有独特的组成和生物活性,但目前对于挥发油的研究主要集中在寻找广泛的抗菌材料及其抗菌作用上,而对于其抗菌活性成分、抗菌作用机理及可应用范围研究的还不够充分[15]。一般来说,挥发油的组成成分、结构及功能性基团决定了其抗菌能力大小,其含有的萜类、醇类、酚类等化合物赋予了挥发油具有较强的抗菌能力[15]。高良姜挥发油中由于含有大量的香叶烯、萜品烯、莰烯、柠檬烯及芳樟醇、香茅醇和桉叶醇等物质,对念珠菌(Candidaspp.)、大肠杆菌、金黄色葡萄球菌等细菌和石膏样毛癣菌(Trichophytonmentagrophyte)、红色毛癣菌(Trichophytonrubrum)等皮肤致病菌具有一定的抑制作用[16-17]。鼠尾草属植物种类繁多,分布广泛,其功能也多样,具有广泛的生物活性,在采用现代科技方法的基础上,随着对该属植物活性成分及其药理作用研究的深入,该属植物必将具有更广阔的应用前景。本试验对鼠尾草属中墨西哥鼠尾草挥发油的抗菌作用进行初步研究,发现其挥发油具有广谱抗菌作用,但其抗菌作用,可能是挥发油中某种单体成分或多种成分协同作用的结果,关于其具体的抑菌活性化合物的分离、鉴定,及各活性成分间可能存在的复杂的拮抗或者增效作用,有待于后续进一步深入研究。
[1] 胡林峰, 许明录, 朱红霞. 植物精油抑菌活性研究进展[J]. 天然产物研究与开发, 2011, 23(2):384-391.
[2] 张东峰. 植物精油的研究开发新进展[J]. 河北化工, 2008, 31(2):10-12.
[3] 王广要, 周虎, 曾晓峰. 植物精油应用研究进展[J]. 食品科技, 2006, 31(5):11-14.
[4] Kalemba D K A. Antibacterial and antifungal properties of essential oils[J]. Current Medicinal Chemistry, 2003, 10(10):813-829.
[5] 王和英, 胡德禹, 薛伟,等. 贵州鼠尾草化学成分的研究[J]. 天然产物研究与开发, 2011, 23(1):63-65.
[6] Hanes K R. Antidepressant effects of the herbSalviadivinorum: a case report.[J]. J Clin Psychopharmacol, 2001, 21(6):634-635.
[7] 屈英薇. 鼠尾草属植物的化学成分及药理活性[J]. 河北医科大学学报, 2005, (6):701-702.
[8] 徐慧, 刘宝勇, 钟汉冬. 4种鼠尾草的生物学特性及在武汉地区的应用[J]. 中国园艺文摘, 2011, 27(2):72-73.
[9] 沈萍, 陈向东. 微生物学实验[M]. 北京:高等教育出版社, 2013.
[10] 张佳, 王莹, 张峰, 等. 滤纸片法测定黄花蒿提取物对霉菌的抑制活性[J]. 湖北农业科学, 2009, 48(5):1153-1154.[11] 王芳,梁倩,宋晓梅,等. 粉花月见草粗提物抗菌活性的初步研究[J]. 时珍国医国药, 2014, 25(10):2339-2341.
[12] He F, Yang Y, Yang G, et al. Studies on antibacterial activity and antibacterial mechanism of a novel polysaccharide fromStreptomycesvirginiaH03 [J].Food Control, 2010, 21(9):1257-1262.
[13] 郭道森, 杜桂彩, 李丽, 等. 迷迭香酸对几种植物病原真菌的抗菌活性[J]. 微生物学通报,2004, 31(4):72-73.
[14] 吴文君.植物化学保护实验技术导论[M]. 西安:陕西科学技术出版社, 1987.
[15] 易德玮, 方俊, 蒋红梅,等. 植物挥发油及其主要化学成分抗菌作用研究综述[J]. 现代农业科技, 2008(23):358-359.
[16] 桂蜀华, 蒋东旭, 袁捷. 花椒、高良姜挥发油体外抗真菌活性研究[J]. 中国中医药信息杂志, 2005, 12(8): 21-22.
[17] Jirovetz L, Buchbauer G, Shafi M P, et al. Analysis of the essential oils of the leaves, stems, rhizomes and roots of the medicinal plantAlpiniagalangafrom southern India.[J]. Acta Pharm, 2003 (2):73-81.
(责任编辑 曹 龙)
Chemical Constituents and Anti-microbial Activity of the Essential Oils fromSalvialeucantha
Wang Fang1, Li Xiaoxu2, Gao Jin1, Liang Qian1
(1.Key Laboratory of State Forestry Administration for Biodiversity Conservation in Southwest China, Southwest Forestry University, Kunming Yunnan 650224,China;2. College of Life & Environmental Science, Minzu University of China, Beijing 100081, China)
The inhibition zone method and hypha growth-inhibiting method were used to investigate the inhibition effects of essential oils from the aerial part ofSalvialeucanthawhich were extracted by steam distillation on the five types bacteria ofEscherichiacoli,Bacillussubtilis,Proteusvulgaris,StaphylococcusaureusandPseudomonasaeruginosaand the five types plant pathogenic fungi ofBotryosphaeriarhodina,Fusariumoxysporum,Fusariumsolani,CorynesporacassiicolaandColletotrichumacutatum. The results showed that the essential oils fromSalvialeucanthahad different anti-microbial activity to the five types of bacteria, and the minimum inhibitory concentration (MIC) were 8 mg/mL, 8 mg/mL, 4 mg/mL, 8 mg/mL and 8 mg/mL respectively; and also had different inhibition activity to the five species of fungi, which the best inhibitory effect onFusariumoxysporumwith the EC50value of 0.879 mg/mL, followed byColletotrichumacutatumandFusariumsolaniwith the EC50values of 7.565 mg/mL and 10.731 mg/mL respectively.
Salvialeucantha;essential oils; anti-microbial activity;bacteria;fungi
2015-04-15
国家自然科学基金项目(31360003,31201572)资助。
梁倩(1975—),女,博士,讲师。研究方向:药用植物研究。Email:liangqian533@163.com。
10.11929/j.issn.2095-1914.2015.05.017
S786
A
2095-1914(2015)05-0092-05
第1作者:王芳(1981—),女,博士,讲师。研究方向:资源微生物。Email:35445230@qq.com。
