蚤状溞doublesex的克隆及在不同生殖状态时的表达特征
2015-03-22宁波大学海洋学院宁波315211
(宁波大学 海洋学院, 宁波 315211)
蚤状溞doublesex的克隆及在不同生殖状态时的表达特征
王 琪, 宁俊佳, 张清科, 张萌萌, 周 伟, 吴仓仓, 王丹丽
(宁波大学 海洋学院, 宁波 315211)
利用RACE技术从蚤状溞(Daphniapluex)中克隆到doublesex(dpdsx),dpdsxcDNA全长为1636 bp,其中开放阅读框(ORF)1008 bp,编码335个氨基酸,含有1个DM结构域和1个Dimersation domain。同源性比对结果显示蚤状溞dpdsx与大型溞(Daphniamagna)同源性最高为77%,其次盔形溞(Daphniagaleata)为61%,模糊网纹溞(Ceriodaphniadubia)为54%;进化分析发现蚤状溞dpdsx与盔形溞、大型溞、模糊网纹溞等溞科的亲缘关系最近;Real time-PCR实验结果表明,dpdsx在雄溞表达水平最高,其次是孤雌溞(带夏卵)和两性溞(带冬卵),雌溞与雄溞有显著性差异(P>0.05)。表明doublesex有可能在蚤状溞生殖转化和性别分化调控上起一定作用。
蚤状溞;doublesex;Real time-PCR;生殖转化
蚤状溞(Daphniapulex)为一种常见的枝角类小型浮游动物,属节肢动物门(Arthropoda)、甲壳纲(Crustacea)和鳃足亚纲(Branchiopoda),是第一个基因组序列测序出来[1-2]的溞类(Daphnia),已经作为一种新的模式生物被研究。其生殖方式特殊:当外界条件如光照、食物、种群密度等适宜时进行孤雌生殖(无性生殖);当环境条件恶化时如食物缺乏、短光照、种群密度增加等会产生雄溞进行两性生殖(有性生殖)。一些研究[3]还表明用保幼激素类似物(JHA)也可以诱导雄性的产生而无须环境因素的诱导,证明JHA可能是性别决定通路中的一种关键信号分子。两种生殖方式的交替,是其对外界环境的一种适应,孤雌生殖有助于其种群的迅速发展,而有性生殖形成的休眠卵(受精卵)能确保其渡过恶劣环境,以维持种群的存在与延续。许多研究中已经证实了环境因子对生殖转化和性别决定的影响,但有时环境条件的改变并不会导致枝角类生殖方式或性别的转变或者环境条件良好的状况下仍有雄体和两性雌体出现[4-5]。因此,有学者认为枝角类进行有性生殖可能主要是由自身基因决定,环境变化在一定程度上仅起诱导作用。但是有关枝角类的生殖转化和性别决定的相关基因及其分子机制尚不明了。
目前一些研究者已经在果蝇(Drosophilamelanogaster)、线虫(Caenorhabditiselegans)、蜜蜂(Apismellifera)和大型溞(Daphniamagna)等生物中发现了一些性别决定基因及它们对两性分化的影响[6-8]。Doublesex(dsx)就是最先在果蝇(D.melanogaster)里发现的性别决定级联通路中具有复合基因座的基因[6-7],其编码的雌雄两种蛋白DSX-F和DSX-M,控制着性别分化并直接决定果蝇的性别发育。尽管性别决定通路上游因子在不同物种中是变化多样的[9],但作为性别决定通路的下游因子dsx在后生动物中却很保守且与性别决定及分化直接相关。到目前为止,dsx同系基因已经在很多物种中被克隆和研究。其中研究最多的是昆虫类和脊椎动物的鼠等[10-11],溞科仅见大型溞(D.magna)。 此外,DSX蛋白还控制着卵黄蛋白的表达,以及外周神经系统的感觉通路的形成[12]。可见doublesex在性别决定及分化中起着重要的作用。
因此,为了深入探究蚤状溞的生殖转化和性别分化的分子机制,本文以水域中常见蚤状溞为研究对象,采用同源克隆和RACE-PCR的方法,克隆了蚤状溞dsx的cDNA全长,利用Real-time PCR技术分析了蚤状溞在不同生殖状态下的dsxmRNA表达水平。该研究不仅有利于阐明dsx在蚤状溞的性别决定与生殖转化中的调控作用,而且为研究枝角类的生殖转化提供理论依据和参考。
1 材料与方法
1. 1 实验材料
试验用蚤状溞由本实验室单克隆培养获得,体长(3.3±1.2)mm。挑选健康活力强的个体暂养于实验室玻璃培养箱内,培养温度(24±3)℃,光周期为14 h光照和10 h黑暗。用“Banta粪土培养液”(1.5 g兔子粪+2 g干稻草+10 g土壤+950 mL自来水经煮沸后取上清液)培养,并交叉投喂小球藻等单细胞藻类,每天投喂饵料1次。雄溞的获得:培养2周后当溞密度达到3 000只/L以上时,培养箱内溞的生殖方式逐渐转为有性生殖,即可出现雄溞。
提取总RNA的试剂盒为Axygen公司产品。Realltime-PCR采用TaKaRa公司的PremixExTaqTMHot Start Version试剂盒,逆转录酶、限制性内切酶及其他主要试剂为TaKaRa公司产品;RACE PCR扩增使用Clontech公司的SMARTerTMRACE cDNA Amplification试剂盒; PCR的扩增引物由上海桑尼生物公司合成,PCR产物由上海Invitrogen生物公司克隆测序。
1.2 实验方法
1.2.1 蚤状溞总RNA的提取及第一链cDNA的合成
收集不同生殖状态下的孤雌溞(带夏卵)、两性溞(带冬卵)和雄溞的活溞各300只,各取100~200 mg用 (Axygen, USA) RNA提取试剂盒进行总RNA的提取。并用反转录试剂盒内含Oligo (dT)12-18 primer和random primers (PrimeScript RT Master Mix Kit,Invitrogen) 进行1 st cDNA的合成或者是PowerScriptTMreverse transcriptase (Clonte ch,USA)进行RACE反应的First Strand cDNA Synthesis,反应程序均按说明书上执行。合成的cDNA产物于-20°C保存备用。
1.2.2 蚤状溞doublesex(dpdsx)cDNA全长序列的克隆
设计1对兼并引物dsxF和dsxR用反转录PCR(RT-PCR)扩增dsxcDNA核心片段,兼并引物设计参照了黑腹果蝇(D.melanogastr,GenBank accession AY060257)、大型溞(D.magna,AB569297.1)、盔形溞(Daphniagaleata,AB693160.1)、多刺裸腹溞(Moinamacrocop,AB693164.1)和模糊网纹溞(Ceriodaphniadubia,AB693162.1)。PCR反应体系为50 μL,优化后扩增条件:94℃预变性 1 min;94℃变性10 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸3~5 min;4℃保存。 PCR产物于1.5%琼脂糖凝胶电泳检测,得到期望的片段后进行切胶纯化回收,然后连入pMD19-T载体经转化筛选菌液验证正确后送上海Invitrogen公司进行测序。测序结果在NCBI数据库(http://www.ncbi.nlm.nih.gov)中进行BlastX分析比对,若以上实验所得doublesex部分序列与其它物种的doublesex同源,则根据测得的部分序列再设计正向(dsx5′R)、反向(dsx3′F)两条引物用于RACE以扩增dpdsxcDNA全长。采用SMARTTMRACE cDNA试剂盒进行5′和3′ RACE PCR,验证测序同上。比对正确后用Vector NTI 11.5进行拼接获得全长cDNA,并设计验证引物dsx-YR和dsx-YF进行序列的验证,引物序列见表1。
1.2.3 荧光定量PCR(Quantitative real-time PCR)
试验分组 根据不同生殖状态分为3个组,孤雌溞组(带夏卵)、两性溞组(带冬卵)和雄溞组,每组3个重复。实验室设置3个10 L玻璃钢,每只缸接种密度50只/L孤雌蚤,进行充气培养,其它培养条件一样。当培养密度达到3 000只/L以上时进行采样,从每只缸分别采孤雌溞、两性溞和雄溞3种样品。
实时荧光定量PCR 根据测序验证后所得的蚤状溞dsx全长cDNA设计实时定量PCR引物dsxF1/dsxR1,18 S基因的特异性引物根据之前的报道[13]进行设计(表1)。每个组织的样品进行3次重复。反应条件如下:95°C预变性15 s;95°C变性5 s,57°C退火30 s,40个循环;反应结束后确定Real-time PCR的扩增曲线和溶解曲线,数据采集和处理在ABI StepOnePlusTMInstrument上进行。试验所得数据以平均值(Mean, M)±标准差(Stdeva, SD)表示,所测数据以SPSS 17.0软件进行数据统计分析,采用One-Way ANOVA 法进行显著性检验,并用Duncan检验法进行多重比较。本实验根据Livak[14]的方法进行引物的效率检测。采用2-△△Ct法分析处理qRT-PCR结果,ΔCt 定义为内标18 S Ct 值与目的基因(dpdsx)Ct 值的差值。

表1 试验中用到的引物名称及序列
注: R=A or G,K=T or G。
1.2.4 生物信息学分析
用Protparam软件(http://au.expasy.org/tools/protparam.html)进行蛋白理化特性预测, 核酸和蛋白序列相似性比较利用http://www.ncbi.nlm.nih.gov网站上的BlastX工具进行比对分析;通过NCBI的ORF Finder进行开放阅读框分析并预测氨基酸序列;氨基酸功能域预测用ExPASy-PROSITE网站(http://prosite.expasy.org/); SignalP程序分析信号肽;Smart软件预测功能域;采用Clustal W软件进行多序列比对分析;用MEGA4.0 软件中的N-J (Neighbor-Joining) 法构建进化树,用自展法(Bootstrap)进行1000 次重复检验。
2 结果
2.1 蚤状溞doublesex(dpdsx)全长cDNA的克隆
以两性溞第一链cDNA为模板,用兼并引物进行PCR扩增,获得1条约500 bp的片段,经克隆测序,与NCBI数据库中已知的doublesex氨基酸序列做BlastX分析,显示与已登录的盔形溞、大型溞、模糊网状溞和多刺裸腹溞doublesex具有较高的同源性。以这段序列设计5′和3′ RACE引物分别进行5′-RACE和3′-RACE,测序后所得序列通过比对拼接得到了1条1639 bp的全长doublesex序列(GenBank登录号:KC470706),为验证序列的可靠性,重新设计dsx-YF、dsx-YR克隆dpdsx全长序列,结果与拼接结果一致,证明完整cDNA克隆成功。将该溞dsx的全长cDNA序列命名为dpdsx。
2.2 蚤状溞dpdsx序列特征分析
蚤状溞dpdsx全长核苷酸序列和推导出的氨基酸序列如图1所示,cDNA全长为1639 bp,包含了一个169 bp的5′-UTR区域和一个458 bp的3′-UTR区域,其中包括一个终止密码子(TAA),1个多聚腺苷酸加尾信号(Polyadenylation Signal Site)(AATAAA)。1008 bp的开放阅读框(ORF)编码了335个氨基酸。Dpdsx的理论等电点(pI)为8.84,计算分子量约为37.27 ku。根据SignalP 4.0 Server分析,此多肽无信号肽序列。
2.3 蚤状溞doublesex结构域分析
蚤状溞doublesex含有两个结构域(图1) :DM结构域(残基71~120位)和Dimerisation domain(残基208~278位)。其中位于蛋白N末端的DNA结合结构域DM 功能域,是一个富含半肤氨酸的锌指结构基序,能与相应的启动子的DNA小沟结合;Dimerisation domain位于多肽链的C末端,由α螺旋二级结构组成,是DOUBLESEX蛋白中二聚化结构的功能域。与NCBI数据库中其它含DM和Dimerisation结构域基因的物种进行氨基酸序列同源性比对,可见从无脊椎动物到脊椎动物,DM结构域保守性很好,尤其是鳃足亚纲溞科的几种溞类完全相同。而Dimerisation domain结构域则在昆虫纲的同源序列中很保守(图2)。
2.4 蚤状溞doublesex氨基酸序列同源性分析
利用MEGA4.0软件对27种节肢动物的doublesex的氨基酸序列进行了分子系统同源性分析,结果显示蚤状溞dpdsx与大型溞同源性最高为77%,其次盔形溞是为61%,模糊网纹溞为54%和多刺裸腹溞为39%。在构建系统进化树的基础上研究了蚤状溞doublesex和其它种类的进化关系(见图3)。结果显示不同物种来源的doublesex之间是保守的,而且这些物种的doublesex在进化树上的位置与它们分类学上的地位是一致的,鳃足亚纲内的几种溞类保守性很强。从系统进化树上可以看到doublesex被分为两个亚群5个分支。蚤状溞与盔形溞、大型溞、多刺裸腹溞和模糊网纹溞在一个分支。与另一分支膜翅目(Hymenoptera)的小蜜蜂(A.florea)、熊蜂(Bombusimpatiens)、蝇蛹金小蜂(N.vitripennis)、切叶蜂(Megachilerotundata)和意大利蜜蜂(A.mellifera)聚在一个亚群。鳞翅目(Lepidoptera)的家蚕(B.mori)等与双翅目(Diptera)的黑腹果蝇等先聚为一支,再与另一分支的鞘翅目(Coleoptera)的赤拟谷盗(T.castaneum)等构成另一个亚群。我们发现蚤状溞doublesex在进化上与盔形溞、大型溞、模糊网纹溞和蒙古裸腹溞进化上亲缘关系很近,其次与小蜜蜂、意大利蜜蜂、切叶蜂和灿金小蜂等膜翅目的doublesex相关联,而与家蚕、南美按实蝇(A.fraterculus)、冈比亚按蚊(A.gambiae)、黑腹果蝇和赤拟谷盗等亲缘关系较远。

图1 蚤状溞doublesex的两个结构域位置示意图
Fig 1 Distribution of two domain ofdoublesexfromD.pluex

图2 蚤状溞doublesex与其它物种DM结构域和Dimerisation domain同源序列的比对
*显示高度保守的氨基酸残基位点。
2.5 蚤状溞dpdsxmRNA 在各生殖状态下的特异性表达
Doublesex一般存在性别特异性的选择性剪切,即基因有着雌雄两种转录产物dsx-F和dsx-M,起着决定性别的作用。所以,我们用RT-PCR检测了doublesex是否在雄性溞和雌性溞cDNAs中存在着不一样的片段。结果发现,在雄性溞和雌溞中都只扩增出一条同样大小的条带,且测序结果显示雌雄两性的序列一样,说明在两性之间只有一种doublesex转录本。但其表达量有差异,在雌溞的表达量很少,在雄溞中表达量则较多,且雄溞的表达量显著高于雌溞(图4)。
利用Real time PCR 相对定量法分析了蚤状溞doublesexmRNA在不同生殖状态下的表达(图5)。结果显示:doublesex在雄溞中表达量最高,其次是孤雌溞(带夏卵)和两性溞(带冬卵);在雄溞中的表达量是孤雌溞的2.6倍,两性溞的4.9倍,三者之间有显著性差异(P<0.05), 表现出性别差异性表达,可见doublesex在不同生殖状态下的表达具有特异性。
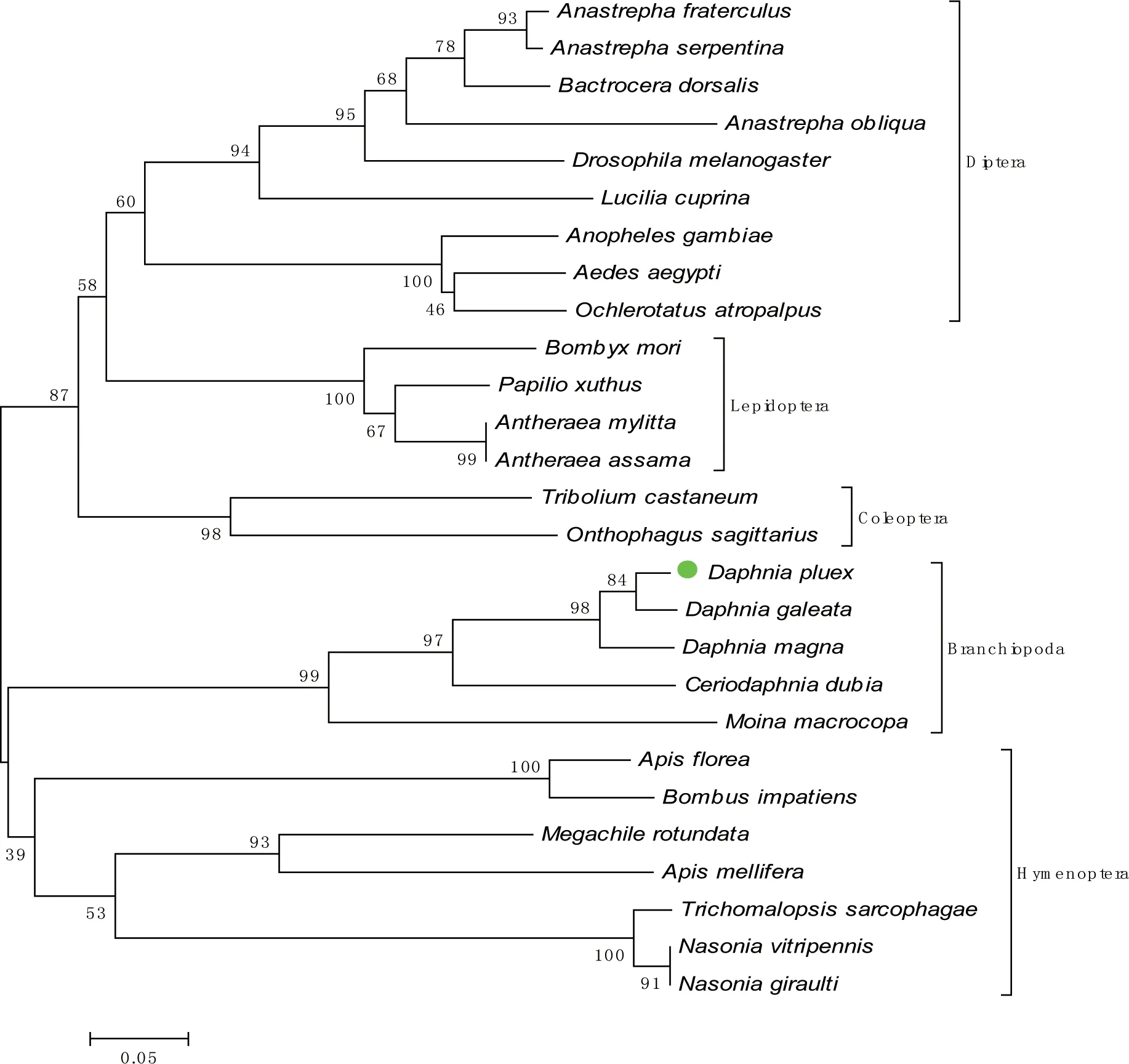
图3 根据NJ法绘制的27种节肢动物的doublesex基因进化树
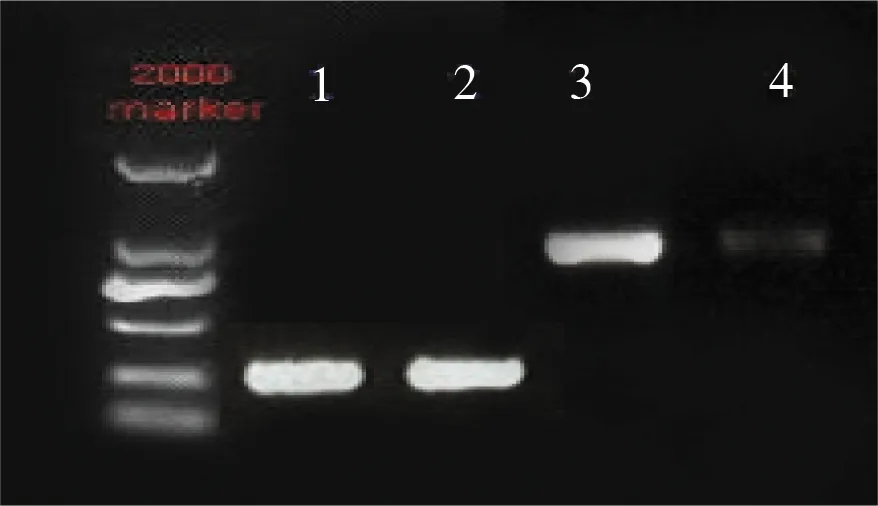
图4 dsx CDS区及内参GADPH在雄溞和雌溞半定量表达电泳图
1,2为内参GADPH在雄溞和雌溞的表达带;3为dsx在雄溞的表达带,4为dsx在雌溞的表达带。
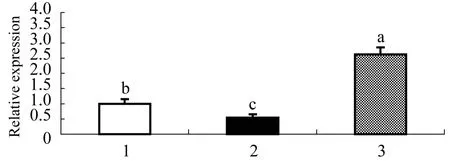
图5 doublesex mRNA 在蚤状溞不同生殖状态下的表达水平
1—孤雌溞; 2—两性溞; 3—雄溞 a, b, c不同表示dsx的表达有显著性差异(P<0.05)。
3 讨论
枝角类生殖转换和性别分化调控一般分为环境决定性别(ESD)和基因决定性别(GSD)。在ESD中,已知环境因素在枝角类的生殖转化和性别分化中普遍存在,如温度、食物、光照周期、种群密度、代谢产物及捕食等改变均会诱发两性雌体的产生, 且能够增加子代幼溞中雄性的比例[15]。而这些因素可能是触发基因决定性别(GSD)的信号,从而引发和调控性别相关多基因的表达。处于GSD底部较保守的基因可能也在ESD中发挥同样的性别决定作用[16-17],其中研究较多的是和性别相关的含DM结构域的一些基因,如线虫(C.elegans)的Mab-3是一种促雄性个体发育的基因,并且抑制卵黄原蛋白基因的转录[9];果蝇(D.melanogaster)的dsx在性别决定基因三级联通路中所表达的蛋白质直接决定果蝇的性别发育[18];DM结构域基因是一类在后生动物中很保守的基因,目前已经发现在很多物种中控制性别发育并在性腺发育中促使雄性性腺的发育从而决定性别并维持着第二性征[19]。本文的研究为解释隐藏在ESD中的GSD做了一些补充。
DOUBLESEX蛋白含有两个功能域:DM结构域是一个富含半胱氨酸的锌指结构基序,其中CCHC和HCCC即为Zn离子结合位点,该位点也是和DNA小沟进行结合的位点; Dimerisation domain结构域可加强DSX蛋白的二聚化[12],该结构域的突变则会影响DSX发挥作用[20]。将蚤状溞DOUBLESEX蛋白的DM domain氨基酸残基及其相邻Dimer domain氨基酸序列与数据库其它物种序列进行比较,显示蚤状溞与许多种类的doublesex具有显著同源性,尤其是DM结构域氨基酸高度保守(图2),显示了DM domain进化和功能上的保守性,可能具有大型溞DM domain的功能(雄性表型维持的关键调控因子)[21]。在本研究中dpdsx的推导氨基酸序列在种系进化树上显示与昆虫纲最古老的膜翅目在进化上最接近,这表明DPDSX和膜翅目的DSX在进化上可能有一个共同的进化起源。
Doublesex一般存在性别特异性的选择性剪切,即基因有着雌雄两种转录产物dsx-F和dsx-M,起着决定性别的作用。在黑腹果蝇、橄榄果蝇Bactroceraoleae和冈比亚疟蚊Anophelesgambiae等dsx有着雌雄两种产物dsx-F和dsx,各自特异性控制着性别分化[8];在家蚕Bombyxmori中发现3种雌性转录产物和1种雄性转录产物;在蜜蜂Apismellifera中发现两种雌性转录产物和1种雄性转录产物[22]。而在蚤状溞中我们用RT-PCR检测了doublesex仅发现在雄性和雌性中都只扩增出1种相同的转录产物(图4),只有一个加尾信号,所以不存在性别特异性选择性剪切。
根据 Wilkins[23]的假说性别决定级联通路进化是以反转的顺序发生的,也就是处于通路底部的基因往往是保守的,处于上游的基因容易随进化而改变且失去原来的功能。Dsx就是性别决定通路中处于底部的最重要的基因,从线虫(C.elegans)的mab3到哺乳动物的Dmrt 1都很保守。从本研究dpdsx在不同生殖状态下的表达可以看到doublesex在雄溞、孤雌溞和两性溞中表达量有显著性差异,且雄溞中的表达显著高于后两种溞,这与Eads等[24]和Ignace等[25]对蚤状溞和大型溞的研究结果相似。也与Kato等认为大型溞的dsx1在精巢的表达比卵巢中高的研究结果相似,这可能是因为dsx1是维持雄性表型的重要调控基因[21]。这也验证了doublesex在性别决定中发挥着决定作用,它的表达直接决定性别的发育。两性溞已经含有受精卵,dsx对它的性别维持要减弱,而雄溞和孤雌溞是处于有性生殖和无性生殖的两个阶段,dsx对它们两性的维持起到很大作用,所以doublesex的表达量在孤雌溞(带夏卵)中又显著高于两性溞(带冬卵)(P<0.05)。和处于底部的相比,变化各异的上游基因有很多如果蝇中的trasformer类似功能基因,家蚕中的的fem和蜜蜂中的csd,都没有性别特异性差异表达[26],这些都验证和支持了上述假说。
以上研究表明doublesex很有可能在调控生殖转化和性别分化上发挥作用。那么dsx在蚤状溞中的具体作用及其作用机理等问题,我们将会通过RNA干扰、相关功能基因过量表达以及免疫组化技术等去进一步的研究。
[1]Colbourne J K, Pfrender M E, Gilbert D, et al. The ecoresponsive genome ofDaphniapulex[J]. Science, 2011, 331(6017): 555-561.
[2]Colbourne J K, Singan V R, Gilbert D G. wFleaBase: theDaphniagenome database [J]. BMC bioinformatics, 2005, 6(1): 45.
[3]Tatarazako N, Oda S, Watanabe H, et al. Juvenile hormone agonists affect the occurrence of maleDaphnia[J]. Chemosphere, 2003, 53(8): 827.
[4]Innes D J, Dunbrack R L. Sex allocation variation inDaphniapulex[J]. Journal of Evolutionary Biology, 1993, 6(4): 559-575.
[5]王金秋,张佳忆,黄 博. 生态因子的波动对多刺裸腹溞雄体发生的影响[J].应用生态学报,2000,11 (1): 135-137.
[6]Baker B S, Wolfner M F. A molecular analysis of doublesex, a bifunctional gene that controls both male and female sexual differentiation inDrosophilamelanogaster[J]. Genes & Development, 1988, 2(4): 477-489.
[7]Cline T W, Meyer B J. Vive la difference: males vs females in flies vs worms [J]. Annual Review of Genetics, 1996, 30(1): 637-702.
[8]Cho S, Huang Z Y, Zhang J. Sex-specific splicing of the honeybee doublesex gene reveals 300 million years of evolution at the bottom of the insect sex-determination pathway [J]. Genetics, 2007, 177(3): 1733-1741.
[9]Shukla J, Nagaraju J. Doublesex: a conserved downstream gene controlled by diverse upstream regulators [J]. Journal of Genetics, 2010, 89(3): 341-356.
[10]Scali C, Catteruccia F, Li Q, et al. Identification of sex-specific transcripts of theAnophelesgambiaedoublesexgene[J]. The Journal of Experimental Biology, 2005, 208(Pt19): 3701-3709.
[11]Oliveira D C, Werren J H, Verhulst E C, et al. Identification and characterization of the doublesex gene ofNasonia[J]. Insect Molecular Biology, 2009, 18(3): 315-324.
[12]Alvarez M, Ruiz M F, Sanchez L. Effect of the gene doublesex of anastrepha on the somatic sexual development ofDrosophila[J]. PloS one, 2009, 4(4): e5141.
[13]Miyakawa H, Imai M, Sugimoto N, et al. Gene up-regulation in response to predator kairomones in the water flea,Daphniapulex[J]. BMC Developmental Biology, 2010, 10(1):45.
[14]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔC T Method [J]. Methods, 2001, 25:402-408.
[15]Zaffagnini F. Reproduction inDaphnia[J]. Memoirie Instituto Italiano Idrobiologia, 1987, 45:245-284.
[16]Crews D, Bull J J. Mode and tempo in environmental sex determination in vertebrates[J]. Semin cell Dev Biol, 2009,20(3): 251-255.
[17]Shoemaker C M, Crews D. Analyzing the coordinated gene network underlying temperature-dependent sex determination in reptiles[J]. Semin Cell Dev Biol, 2009,20(3): 293-303.
[18]Rideout E J, Dornan A J, Neville M C,et al. Control of sexual differentiation and behavior by the doublesex gene inDrosophilamelanogaster[J]. Nature Neuro Science, 2010,13(4) :458-466.
[19]Zhao D, Mcbride D, Nandi S, et al. Somatic sex identity is cell autonomous in the chicken [J]. Nature, 2010, 464(7286): 237-242.
[20]Bayrer J R, Zhang W, Weiss M A. Dimerization of doublesex is mediated by a cryptic ubiquitin-associated domain fold: implications for sex-specific gene regulation [J]. The Journal of Biological Chemistry, 2005, 280(38): 32989-32996.
[21]Kato Y, Kobayashi K, Watanabe H, et al. Environmental sex determination in the branchiopod crustaceanDaphniamagna: deep conservation of aDoublesexgene in the sex-determining pathway [J]. PLoS Genetics, 2011, 7(3): e1001345.
[22]Duan J, Xu H, Wang F, et al. Novel female-specific trans-spliced and alternative splice forms of dsx in the silkwormBombyxmori[J].Biochemical and Biophysical Research Communication, 2012, 431(3): 630-635.
[23]Wilkins A S. Moving up the hierarchy: a hypothesis on the evolution of a genetic sex determination pathway[J]. Bioessays, 1995, 17(1): 71-77.
[24]Eads B D, Colbourne J K, Bohuski E, et al. Profiling sex-biased gene expression during parthenogenetic reproduction inDaphniapulex[J]. BMC genomics, 2007, 8(464).
[25]Ignace D D, Dodson S I, Kashian D R. Identification of the critical timing of sex determination inDaphniamagna(Crustacea, Branchiopoda) for use in toxicological studies [J]. Hydrobiologia, 2010, 668(1):117-123.
[26]Chen P, Xu S L, Zhou W, et al. Cloning and expression analysis of a transformer gene inDaphniapulexduring different reproduction modes. Animal Reproduction Science, 2014, 146:227-237.
Cloning and expression features of aDoublesexgene inDaphniapulexduring different reproduction modes
WANG Qi, NING Jun-jia, ZHANG Qing-ke, ZHANG Meng-meng, ZHOU Wei, WU Cang-cang, WANG Dan-li
(School of Marine Science, Ningbo University, Ningbo 315211, China)
The full-length cDNA of adoublesex(dpdsx) gene was cloned from the cladoceranDaphniapulexusing rapid amplification of complementary DNA ends (RACE) method. ThedpdsxcDNA is 1636 bp in length; and it has a 1008-bp open reading frame (ORF) that encodes a 335-amino-acid polypeptide containing a DM structural domain and a dimersation domain. Homology comparison showedDaphniapulex′sdpdsxsharing homology of up to 77% withDaphniamagna, 61% withDaphniamagnaand 54% withCeriodaphniadubia. Phylogenetic analysis revealed thatDaphniapulex′sdpdsxhad a close genetic relationship with Daphniidae such asD.magna,D.magna,C.dubiaand so on. Real time-PCR showed thatdpdsxhad the highest expression level in the male, followed by the parthenogenetic female (with summer egg) and sexual female (with winter egg). The expression had significant difference (P>0.05) between the male and the female. The experiment indicated thatdoublesexgene may be play a role in reproduction switching and controlling sex differentiation ofD.pulex.
Daphniapulex;doublesex; Real time-PCR; reproduction switching
2015-01-07;
2015-02-11
国家自然科学基金资助项目(31172043);浙江省自然科学基金资助项目(LY12C19003);宁波市创新团队项目(2011B81003);王宽诚教育基金会资助
王 琪,研究方向为从事水生动物研究,E-mail: 543598687@qq.com;
王丹丽,教授,研究方向为从事水生动物学研究,E-mail: wangdanli@nbu.edu.cn。
Q78;S917.4
A
2095-1736(2015)05-0025-05
doi∶10.3969/j.issn.2095-1736.2015.05.025
