神经细胞黏附分子在乳腺癌发生发展中的作用
2015-03-22曾英男
曾英男, 王 欣, 关 锋
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122)
神经细胞黏附分子在乳腺癌发生发展中的作用
曾英男, 王 欣, 关 锋
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122)
神经细胞黏附分子(Neural cell adhesion molecule, NCAM)是一种定位在细胞膜上的糖蛋白,它能介导细胞与细胞及细胞与细胞外基质间相互作用,影响细胞黏附、迁移以及增殖等。首先,对比研究NCAM在正常乳腺细胞和恶性乳腺肿瘤细胞中的表达情况,发现恶性肿瘤细胞NCAM表达水平明显高于正常细胞;当正常乳腺细胞发生上皮间质转化(Epithelial-mesenchymal transition, EMT)后,NCAM表达水平上调;正常乳腺细胞稳定转染NCAM-140后,E-cadherin表达水平下调,N-cadherin表达水平上调,细胞运动能力明显增强,且激活EGFR和STAT3信号通路。说明了NCAM能够促进细胞发生EMT过程,揭示NCAM在乳腺肿瘤发生发展中起到的重要作用。
NCAM;EMT;细胞运动;信号通路
神经细胞黏附分子(Neural cell adhesion molecule,NCAM)属于免疫球蛋白超基因家族,根据不同的分子量,主要有NCAM-120、140和180 3种亚型,它们均含有相同的胞外区,其中包括5个Ig同源结构域和两个纤维结合素Ⅲ(FibronectionⅢ,FnⅢ)结构域[1]。NCAM-120存在于胞内区,它通过GPI连接在细胞膜上,主要表达在神经胶质细胞中。NCAM-140和NCAM-180均属跨膜蛋白,NCAM-180的胞内区比NCAM-140的胞内区含氨基酸残基多[2],NCAM-180主要表达在神经元中,而NCAM-140主要表达在神经胶质细胞和神经元中。NCAM能介导细胞之间的相互作用,其中NCAM的胞外结构域能参与到同源黏附(即NCAM与NCAM之间的黏附)、异源黏附(即NCAM与其他不同蛋白之间的黏附,例如成纤维细胞生长因子受体),因此NCAM在细胞的识别以及肿瘤的浸润、生长起着一定的作用。
上皮间质转化(Epithelial-mesenchymal transition)简称EMT,是指上皮细胞通过特定程序转化为具有间质表型细胞,获得显著的迁移和侵袭能力,它是肿瘤细胞转移中一个重要过程。通过转化生长因子(TGF-β1)诱导正常乳腺细胞发生EMT[3],在这个过程中伴随着E-cadherin(上皮细胞标志物)等连接分子表达缺失,N-cadherin(间质细胞标志物)和Vimentin(间质细胞标志物)表达上调[4],以及TGF-β、Wnt/β-catenin、FGFR等信号通路的变化。
NCAM在EMT过程中起到非常重要的作用,并且在具有侵袭能力的恶性肿瘤中,NCAM主要存在形式是NCAM-140[5],因此选用NCAM-140作为主要研究对象。人NCAM基因定位于11号染色体,鼠NCAM基因定位于9号染色体,同源性高达90%,本文采用的是将鼠源NCAM-140转染到MCF10A细胞中,建立稳定过表达NCAM的细胞模型,为进一步探索研究NCAM对EMT以及乳腺癌的影响奠定基础。

图1 NCAM的结构
1 材料与方法
1.1 材料
人源正常乳腺上皮细胞MCF10A和人源恶性乳腺肿瘤细胞MDA-MB-231细胞来自于美国模式培养物集存库ATCC。cDNAs编码鼠NCAM-140于真核表达载体pcDNA3.1(+)中,由本实验室构建保存(本文简称pcDNA3.1(+)/NCAM-140)[6]。
DMEM培养基、胎牛血清、青霉素/链霉素溶液和LipofectamineTM3000转染试剂均购于Life technologies公司;BCA蛋白检测试剂盒购自碧云天生物技术研究所;NCAM抗体、E-cadherin抗体、STAT3抗体和转化生长因子TGF-β1购于美国BD公司;N-cadherin抗体购于SANTA CRUZ;EGFR、Phospho-EGFR、Phospho-STAT3均购自Cell signaling;Vimentin抗体、β-tubulin和抗生素G418购于美国SIGMA公司;辣根过氧化物酶标记山羊抗小鼠IgG抗体购于碧云天生物技术研究所;Pro-Light HRP化学发光检测试剂购于天根生化科技有限公司。
1.2 方法
1.2.1 细胞培养
人源正常乳腺上皮细胞MCF10A培养在含有10%胎牛血清、1 mM丙酮酸钠、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中,人源恶性乳腺肿瘤细胞MDA-MB-231培养在含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中,这两种细胞均在37℃含5%CO2的细胞培养箱中培养。
1.2.2 蛋白质印迹法
收集细胞,预冷PBS溶液洗细胞3次,加入RIPA总蛋白抽提试剂,在冰上裂解细胞30 min,12 000 r/min离心15 min取上清,利用BCA方法检测蛋白浓度。样品加入5×Loading Buffer,煮沸5 min,取30 μg蛋白,用7.5%聚丙烯酰胺凝胶电泳。电泳后,将蛋白转移至0.22 μm PVDF膜,用5%脱脂奶粉37℃封闭2 h。之后,加入稀释的NCAM(1∶1 000)/E-cadherin(1∶50 000)/N-cadherin(1∶1 000)/Vimentin(1∶1 000)/β-tubulin(1∶1 000)/EGFR(1∶1 000)/P-EGFR(1∶1 000)/STAT3(1∶1 000)/P-STAT3(1∶1 000)一抗,4℃孵育过夜,用1×TBST洗5次;加辣根过氧化酶(HRP)标记稀释的二抗,室温作用1 h,用1×TBST洗5次,然后用Pro-Light HRP化学发光检测试剂显色,用Bio-Rad ChemiDocTMXRS+扫描拍照,利用软件对蛋白强度进行分析,相对系数=目的蛋白强度/β-tubulin蛋白强度。
1.2.3 细胞转染
在12孔板接种细胞,70%~90%汇合度时转染,按照LipofectamineTM3000的说明书,将鼠源pcDNA3.1(+)/NCAM-140重组载体转染到MCF10A细胞中,转染6 h后换为含10%血清的培养基进行培养,24 h后用500 μg/mL G418抗生素筛选14 d,挑取单克隆细胞,继续在添加500 μg/mL G418抗生素的培养基中扩大培养。然后提取总蛋白,利用蛋白质印迹法进行筛选,得到稳定过表达NCAM-140的永久转染细胞株(简称为MCF10A/NCAM-140)。
1.2.4 细胞运动实验(胶体金法)
12孔板在室温下用1%BSA封闭3 h,吸出后用100%乙醇进行清洗,再放置在紫外线下照射30 min,制备胶体金悬液[7]并加入到12孔板中,室温沉淀40 min后吸出,用无血清培养基清洗1次,每孔加入1 000个细胞,37℃培养18 h后于显微镜下进行观察,拍照分析细胞迁移。
2 结果与分析
2.1 NCAM在正常乳腺细胞和恶性乳腺肿瘤细胞中的表达
人源正常乳腺上皮细胞MCF10A呈腺体样的形态,人源恶性乳腺肿瘤细胞MDA-MB-231呈细长梭状结构(图2A)。在EMT过程中,E-cadherin是研究上皮细胞的标志物,N-cadherin和Vimentin是间质细胞的标志物,这3个标志物可以用于监测EMT。利用蛋白质印迹法检测,发现MCF10A细胞中E-cadherin表达水平高,不表达N-cadherin和Vimentin。而MDA-MB-231细胞中N-cadherin和Vimentin表达水平高,不表达E-cadherin。另外,发现MDA-MB-231细胞NCAM的表达水平显著高于MCF10A细胞(图2B)。通过胶体金实验检测细胞的运动能力,表明MDA-MB-231细胞运动能力明显强于MCF10A细胞(图2C)。
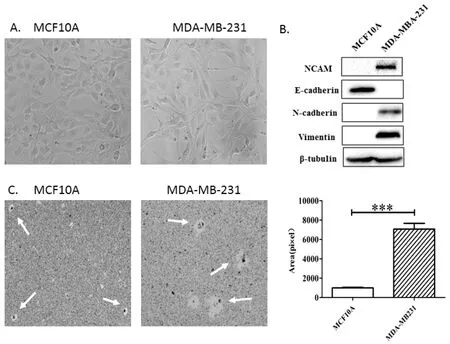
图2 正常乳腺细胞MCF10A和恶性乳腺肿瘤细胞MDA-MB-231的特征比较
A—细胞形态(×200); B—蛋白标志物表达; C—细胞运动能力(×100)。
2.2 NCAM在上皮间质转化过程中的表达

图3 TGF-β1处理MCF10A细胞前后的变化
A—细胞形态(×200); B—蛋白标志物表达; C—细胞运动能力(×100)。
在培养基中添加4 ng/mL的TGF-β1处理细胞48 h,如图3A所示,发现TGF-β1处理后MCF10A细胞形态发生改变,由典型的上皮细胞形态变为明显梭状,细胞极性丧失且间隙增宽。在蛋白水平上,EMT的标志物N-cadherin表达上调,E-cadherin下调,不表达Vimentin。值得注意的是,TGF-β1处理后细胞NCAM的表达水平上调(图3B),细胞运动能力明显强于对照组。实验结果表明,在TGF-β1诱导正常乳腺细胞MCF10A发生EMT的过程中,NCAM由不表达到表达水平上调,揭示NCAM在肿瘤的转移与发展中起到重要作用。
2.3 NCAM对上皮间质转化的影响
正常乳腺上皮细胞不表达NCAM,但是发生EMT后NCAM表达水平上调,因此为了进一步研究NCAM在上皮间质转化过程中的作用,将鼠源pcDNA3.1(+)/NCAM-140重组载体转染到MCF10A细胞,进行筛选,获得MCF10A/NCAM-140稳定转染细胞株。和正常乳腺上皮细胞MCF10A相比,过表达NCAM-140后细胞形态几乎没变化(图4A),但是EMT标志物发生改变,E-cadherin表达下调,N-cadherin表达上调(图4B),说明发生钙黏蛋白转化。过表达NCAM-140细胞的运动能力明显强于对照组(图4C)。以上结果表明,过表达NCAM-140能促进细胞发生EMT,因此说明NCAM参与到EMT过程中,并扮演着非常重要的角色。

图4 过表达NCAM-140对MCF10A细胞的影响
A—细胞形态(×200); B—蛋白标志物表达; C—细胞运动能力(×100)。
2.4 NCAM与EGFR、STAT3信号通路
NCAM在介导细胞之间相互作用的异源黏附中,NCAM的胞外结构域能与表皮生长因子受体(Epidermal growth factor receptor,EGFR)、成纤维生长因子受体(Fibroblast growth factor receptors,FGFR)相结合,伴随如酪氨酸激酶p59fyn、黏着斑激酶、磷脂酶途径(PLC-γ pathway)、Ras-丝裂原蛋白活化激酶途径(p42/44 MAPK pathway)的激活等[8]。在乳腺癌中,信号转导和转录激活因子3(Signal transducer and activator of transcription 3, STAT3)和EGFR在肿瘤形成及转移中均起重要作用[9]。通过蛋白质印迹法和对蛋白强度的分析,发现过表达NCAM-140的MCF10A细胞表达EGFR、STAT3并没有显著变化,但是对应的磷酸化的EGFR(P-EGFR)和磷酸化的STAT3(P-STAT3)则显著增强,说明过表达的NCAM激活了EGFR、STAT3信号通路。
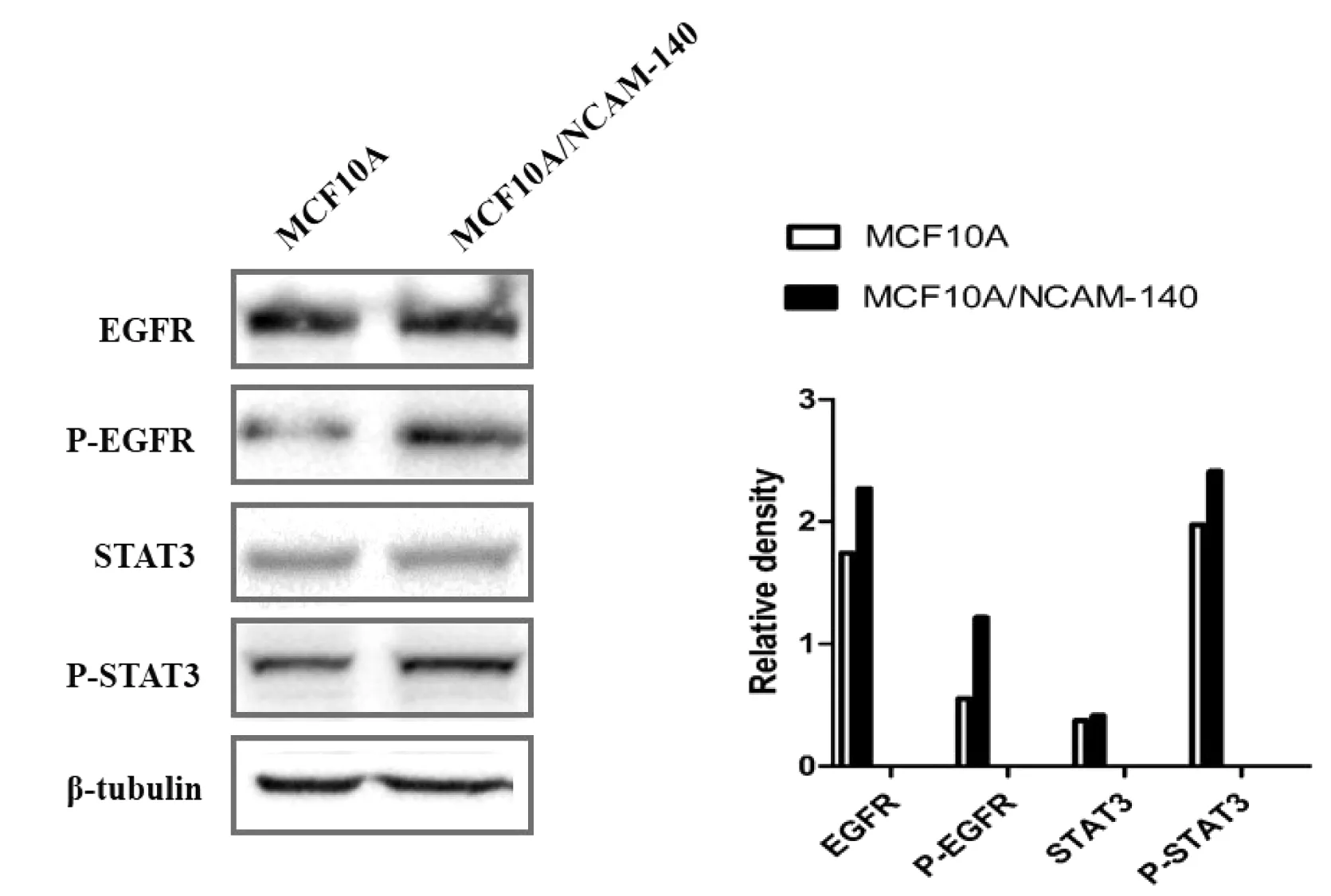
图5 过表达NCAM-140对EGFR、STAT3信号通路的影响
3 讨论
肿瘤转移是一个非常复杂的过程,包括侵袭破坏基底膜、局部浸润、进入血管、存活于血液,迁移到另一远隔部位或器官、继续增殖等一系列的过程[10],其中具有活跃的移动能力是完成侵袭转移的重要因素之一。而EMT存在于多细胞生物的胚胎发生过程中,在原发肿瘤细胞的脱落和侵袭过程中扮演着重要角色,它更是乳腺癌具有高侵袭性、高转移能力的重要步骤。很多报道指出,NCAM在神经母细胞瘤、小细胞肺癌、脑瘤、卵巢癌中均有所表达[11-12],且在肿瘤发生发展中起到重要的作用。因此,本文主要研究NCAM的表达对EMT和乳腺癌的影响。
通过实验发现,正常乳腺上皮细胞不表达NCAM,而恶性乳腺肿瘤细胞中NCAM表达比较高,NCAM的表达影响EMT上皮细胞标志物E-cadherin下调,间质细胞标志物N-cadherin上调,发生钙黏蛋白转化,细胞运动能力增强。Lehembre等也说明E-cadherin的丢失会引起NCAM表达上调,NCAM的表达和细胞的迁移、侵袭有着重要联系[13]。而NCAM和一些胞外基质成分例如肝素、胶原、钙黏素、硫酸软骨素之间也相互影响[14-16]。另外,EGFR依赖JAK的STAT途径、Src激酶介导的途径以及EGFR直接激活STATS的途径,分别可以激活STATS[17]。在本实验中,NCAM上调后发现,EGFR和STAT3磷酸化水平得到增强。EGFR和STAT3的协同作用以及相关的信号通路相互影响,均能够促进癌细胞的转移[18]。
本文发现NCAM能够通过激活EGFR-STAT3通路促进EMT过程,这些结果为进一步研究NCAM与肿瘤生长和肿瘤细胞的转移提供了前期基础。将来的工作将以多种细胞模型及临床样本加以验证,以深入阐明NCAM的分子作用机制。
[1]Rønn L C B, Hartz B P, Bock E. The neural cell adhesion molecule (NCAM) in development and plasticity of the nervous system[J]. Experimental Gerontology, 1998,33(7/8):853-864.
[2]Niethammer P, Delling M, Sytnyk V, et al. Cosignaling of NCAM via lipid rafts and the FGF receptor is required for neuritogenesis[J]. J Cell Biol, 2002, 157(3):521-532.
[3]Valcourt U, Kowanetz M, Niimi H, et al.TGF-beta and the Smad signaling pathway support transcriptomic reprogramming during epithelial-mesenchymal cell transition[J]. Mol Biol Cell, 2005, 16(4):1987-2002.
[4]Greenburg G, Hay E D. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J]. J Cell Biol, 1982, 95(1):333-339.
[5]Gattenlohner S, Stuhmer T, Leich E, et al.Specific detection of CD56 (NCAM) isoforms for the identification of aggressive malignant neoplasms with progressive development[J]. Am J Pathol, 2009, 174(4):1160-1171.
[6]何 发, 王 欣, 郭 佳.ldlD-14细胞表达NCAM并控制其N-聚糖合成的细胞模型的建立[J].生物工程学报,2014,30(5):1-10.
[7]Geerts H, De Brabander M, Nuydens R, et al. Nanovid tracking: a new automatic method for the study of mobility in living cells based on colloidal gold and video microscopy[J]. Biophys J, 1987, 52(5):775-782.
[8]Wang X, Guan F. The impact of polysialic acid (PSA) and polysialylated neural cell adhesion molecule (PSA-NCAM) on tumor and cell signaling pathways[J]. Yi Chuan, 2014, 36(8):739-746.
[9]Berclaz G, Altermatt H J, Rohrbach V, et al. EGFR dependent expression of STAT3 (but not STAT1) in breast cancer[J]. International Journal of Oncology, 2001, 19(6):1155-1160.
[10]Huber M A, Kraut N, Beug H. Molecular requirements for epithelial-mesenchymal transition during tumor progression[J]. Curr Opin Cell Biol, 2005, 17(5):548-558.
[11]Jensen M, Berthold F. Targeting the neural cell adhesion molecule in cancer[J]. Cancer Lett, 2007, 258(1):9-21.
[12]Zecchini S, Bombardelli L, Decio A, et al. The adhesion molecule NCAM promotes ovarian cancer progression via FGFR signalling[J]. EMBO Mol Med, 2011, 3(8):480-494.
[13]Lehembre F, Yilmaz M, Wicki A, et al. NCAM-induced focal adhesion assembly[J]. The EMBO Journal, 2008, 27(19):2603-2615.
[14]Storms S D, Rutishauser U. A role for polysialic acid in neural cell adhesion molecule heterophilic binding to proteoglycans[J]. Journal of Biological Chemistry, 1998, 273(42):27124-27129.
[15]Fujimoto I, Bruses J L, Rutishauser U. Regulation of cell adhesion by polysialic acid. Effects on cadherin, immunoglobulin cell adhesion molecule, and integrin function and independence from neural cell adhesion molecule binding or signaling activity[J]. J Biol Chem, 2001, 276(34):31745-31751.
[16]Walmod P S, Kolkova K, Berezin V, et al. Zippers make signals: NCAM-mediated molecular interactions and signal transduction[J]. Neurochemical Research, 2004, 29(11):2015-2035.
[17]郑君芳,陈慧敏,贺俊崎.表皮生长因子受体结合蛋白及其在肿瘤治疗中的前景[J].生理科学进展,2013,44(6):403-408.
[18]Lo H W, Hsu S C, Xia W, et al. Epidermal growth factor receptor cooperates with signal transducer and activator of transcription 3 to induce epithelial-mesenchymal transition in cancer cells via up-regulation of TWIST gene expression[J]. Cancer Res, 2007, 67(19):9066-9076.
Effects of neural cell adhesion molecule in occurrence and development of breast cancer
ZENG Ying-nan, WANG Xin, GUAN Feng
(Key Laboratory of Carbohydrate Chemistry & Biotechnology, Ministry of Education,School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Neural cell adhesion molecule(NCAM), a kind of glycoproteins expressing on the cell surface, engages in both cell-cell and cell-extracellular matrix interactions. It also influences cell adhesion, migration and proliferation. First, NCAM expression was compared in normal breast cells and malignant breast tumor cells. It was detected that the expression level of NCAM-140 in malignant breast cancer cells was higher than normal breast cells. When normal breast cells underwent epithelial to mesenchymal transition(EMT),NCAM expression was upregulated. The expression level of E-cadherin in normal breast cells after stable transfection with NCAM-140 was decreased, N-cadherin was increased, cell motility was enhanced, and EGFR and STAT3 signal pathways were activated. This study demonstrated that NCAM could promote EMT process, and provided a significant basis that NCAM played an important role in occurrence and development of breast cancer.
NCAM; EMT; cell motility; signal pathway
2014-12-22;
2015-01-06
国家自然科学基金项(编号:81201572)资助
曾英男,硕士研究生,专业方向为糖生物学,E-mail:zengyingnan1989@gmail.com;
关 锋,博士,教授,研究方向为糖生物学,E-mail:fengguan@jiangnan.edu.cn。
R737.9
A
2095-1736(2015)05-0011-04
doi∶10.3969/j.issn.2095-1736.2015.05.011
