基于电子鼻的青蛤(Cyclina sinensis)软组织多氯联苯的快速检测方法研究*
2015-03-22王祖忠胡玲萍君张春丹苏秀榕
吕 燕 王祖忠 胡玲萍 黄 健 周 君张春丹 李 晔 苏秀榕①
(1. 宁波大学海洋学院 宁波 315211; 2. 北京普析通用仪器责任有限公司 北京 101200)
多氯联苯(Polychlorinated biphenyls, PCBs)是联苯苯环上的氢被氯取代而形成的多氯化合物, 对生物体有积蓄性毒害作用的一类持久性有机污染物的总称, 被列为斯德哥尔摩公约中优先控制的12类持久性有机污染物之一(穆季平, 2006; 蒋慧等, 2010),具有致畸、致癌和致突变性(Ross, 2004)。多氯联苯是德国施米特和舒尔茨于1881年首先合成的, 美国于1929年最先开始生产, 20世纪60年代中期, 全世界多氯联苯的产量达到高峰, 年产约为10万吨(陈春花,2010)。据估计, 全世界已生产的和使用中的PCB远超过100万吨, 其中已有1/4—1/3进入人类环境, 造成危害。虽然多氯联苯等持久性有机污染物(POPs)已被国际禁止生产和使用, 但是由于当时使用量大, 在环境中具有持久污染性, 至今仍能在环境样品和食品中检测到这些有机氯化合物(Chiaet al, 2006; 朱云海等,2012)。作为水产品生产大国, 目前我国海域水产品体内多氯联苯等的污染物的含量还是比较高的, 有些已严重超标(甘居利等, 2009; 刘敏霞等, 2013)。这些污染物一般通过地表径流、工业废水和大气沉降等各种途径进入生物体内, 即使浓度极低, 在鱼、贝类等低营养级生物的脂肪中被富集和放大, 不仅影响水生生物的生长、发育和繁殖, 也对食物链高层生物包括人类及其它高等动物形成危害(梁恕坤, 2009; 彭艳超等,2010; 李娜等, 2012)。目前可通过检测贝类等水产品软组织中富集的有机污染物含量来反映水体被污染的程度。因此, 对其在水产品中的检测研究非常必要。
目前多氯联苯的检测方法主要有以下几种: 免疫测定方法(陈寒玉等, 2011), 荧光检测方法(Wanget al, 2010), 气相色谱分析法(杨左军等, 2011), 气质联用分析法(王道玮等, 2013), 液相色谱分析法(张琦等,2009; 邢红等, 2015)等。这些方法仪器昂贵, 需要在稳定的环境下进行检测, 而且样品前处理比较复杂,不能满足社会发展的需求。
本文主要采用电子鼻对青蛤软组织中的多氯联苯进行快速检测, 用线性判别式分析(LDA)、主成分分析(PCA)对结果进行定性定量研究, 运用欧式距离、马氏距离、判别函数法和相关性, 对不同浓度的PCB15海水所养殖的青蛤样品进行检测和判别, 并利用HS-SPME-GC-MS检测技术加以验证(Ameeretal,2005; 徐亚丹等, 2006)。
1 材料与方法
1.1 材料
青蛤(Cyclina sinensis)购于宁波大学农贸市场。标准品 PCB15, 浓度为 10 µg/mL, 购自德国 Dr.Ehrenstorfer GmbH公司。手动SPME进样器、65µm聚二甲基硅氧烷/二乙烯苯(PDMS/DVB)涂层萃取头,购于美国SUPELCO公司。
1.2 方法
1.2.1 样品前处理 青蛤购回后, 立即清洗去除壳上附着物, 剔除死亡及有破损的个体。按大小随机分为5组。置于海水中暂养2 d, 为了避免排泄物及食物对实验可能造成的影响, 暂养和前处理期间均不喂食。两天更换一次海水, 同时除去死亡个体。水温在18—25°C, 气泵加氧。
实验组根据海水中PCB15浓度分为5组, 每组50只青蛤, PCBs浓度依次为0、0.005、0.1、0.5和1μg/L;在此期间, 每两天更换海水一次, 每天查看、记录死亡情况, 并及时去除死亡个体和清理壳体附着物。当青蛤长时间保持开壳状态, 用细玻棒碰触壳体和软组织而无反应者, 可判断为已死亡。整个实验过程持续8d, 依次在处理72 h和144 h时取样测定, 每次平均取样10只。用于电子鼻和气质联用测定。
用手术刀将五组青蛤直接撬壳, 取出软组织, 剪碎, 称0.4 g放入15 mL螺纹样品瓶中, 拧紧瓶盖。每组5个平行, 用于电子鼻及后续气质联用的测定。
1.2.2 电子鼻检测
检测: 将各样品瓶在55—60°C恒温水浴中加热保温30min, 室温下冷却15min, 使瓶中顶空气体平衡后利用电子鼻(PEN 3, Airsense公司, 梅克伦堡州, 德国)检测, 数据采集时间为200s, 清洗时间为300s, 进气量为300mL/min。
数据分析: 运用电子鼻配套的WinMuster软件对电子鼻采集的样品数据进行主成分分析(PCA)以及线性判别分析( LDA)。
1.2.3 HS-SPME-GC-MS测定
萃取: 将萃取头在气相色谱的进样口 250°C, 老化0.5h后, 插入样品瓶于55°C水浴吸附30min, 然后用气质联用仪(GC-MS联用仪, 美国安捷伦科技公司,北京普析通用仪器有限责任公司)进样口于 220°C解吸附5min, 启动气质联用仪采集数据。
色谱条件: DB-5毛细管色谱柱(30 m×0.25 mm×2.5 µm); 载气He, 流速1 mL/min; 不分流模式进样,进样时间3 min, 恒流1 mL/min; 进样口温度: 220°C,程序升温: 起始柱温120°C保持4 min, 15°C/min 升至280°C, 保留3 min。
质谱条件: 离子源为电子轰击源(EI), 电离电压70 eV, 离子源温度250°C, 传输线温度为280°C, 扫描范围45—450 u。
数据分析: 通过计算机检索NIST谱库相互匹配进行定性分析, 对谱库中化合物相似度高于80的组分加以标定, 按照峰面积归一化法计算各组分相对百分含量(何红萍等, 2013a, b)。
2 结果与分析
2.1 电子鼻检测结果
2.1.1 青蛤PCB15的模版建立 图1a和图1b为处理72h和144h青蛤软组织中PCB15检测结果, 其中每个椭圆代表一个所检测到的PCB15浓度, 横坐标、纵坐标分别表示在LDA转换中得到的LD1(判别函数1)和LD2(判别函数2)以及PCA转换中得到的PC1(第一主成分)和PC2(第二主成分)的贡献率。从图1a可以看出, 第一判别式函数方差贡献率LD1与第二判别式函数方差贡献率LD2分别为54.44%和33.65%,总贡献率为88.09%; 从图1b看出, 第一、二主成分PC1、PC2分别为75.29%和17.25%, 总贡献率达到92.54%。可见, PCA的分析效果优于LDA, 具有更高的分辨率。
图2a、图2b分别为144 h后PCB15在青蛤软组织中残留的LDA、PCA分析图。从图2a可以看出, 样品处理144h后, 第一判别式函数方差贡献率LD1与第二判别式函数方差贡献率LD2分别为78.82%和10.24%,总贡献率为89.06%; 从图2b看出, 第一、二主成分PC1、PC2分别为75.29%和17.25%, 总贡献率达到92.54%。PCA的分析效果优于LDA, 不同浓度PCB15在PCA分析图中能够完全分开。在LDA分析图中呈现有一定的聚类特性, 空白组与0.05μg/L组在空间分布上有微小的交集, 当浓度达到0.1μg/L以上时区分效果很明显。PCA的分辨效果明显优于LDA, 电子鼻的PCB15浓度的检测限最低为0.05μg/L。
图3a、图3b是电子鼻采集到的不同时间处理后PCB15在青蛤软组织中残留的LDA、PCA分析图, 总贡献率分别为90.99%、88.28%, 第二主成分贡献率PC2明显升高, 达到23.14%。可以看出不同浓度组基本没有交集, 还是能够明显区分开来。说明PCB15浓度随着作用时间的延长, 气味会发生明显变化, 但是浓度仍可以区分。综合图1、图2和图3的分析结果, 青蛤的气味虽受作用时间影响, 但是还在一个气味区域中。因此, 无论作用时间如何变化, 电子鼻都能够准确地识别出青蛤软组织中PCB15的浓度。

图1 处理72h的青蛤软组织中PCB15的LDA和PCA分析结果Fig.1 LDA and PCA score plots of PCB15 in 72h from C. sinesis soft tissue a. LDA分析图; b. PCA分析图
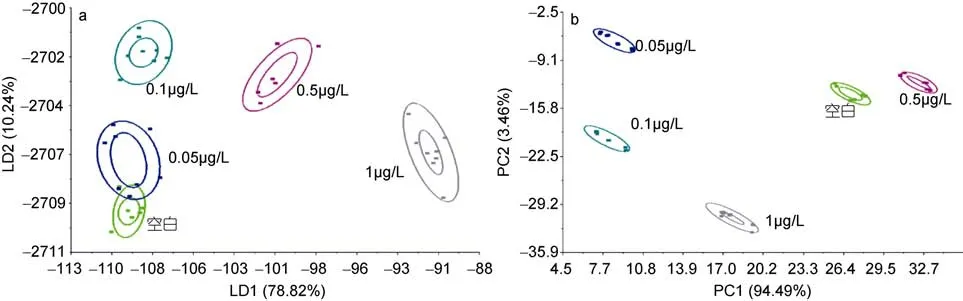
图2 处理144h的青蛤软组织中PCB15的LDA和PCA分析结果Fig.2 LDA and PCA score plots of PCB15 in 144h from C. sinensis soft tissue a. LDA分析图; b. PCA分析图
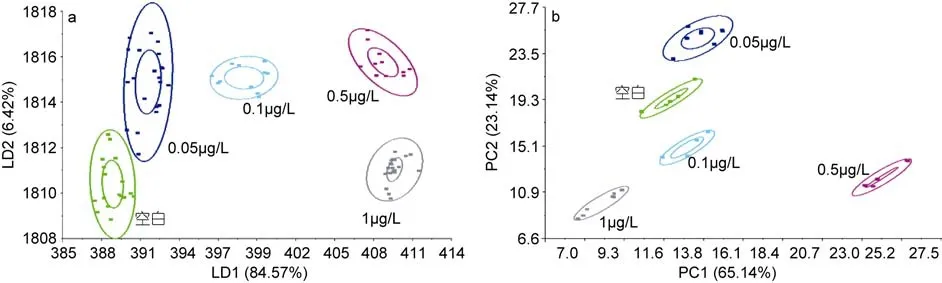
图3 青蛤PCB15的LDA和PCA分析模板Fig.3 LDA and PCA score plots of PCB15 in C. sinensis a. LDA分析图; b. PCA分析图
2.1.2 青蛤PCB15模版的验证和各个浓度的识别 分别取不同浓度下PCB15海水中培养108h的青蛤样品,用判别函数分析(DFA)法验证模板的准确性, 由图4—图8可以看出, 不同种类的待测样品的气味曲线穿过PCB15模板各浓度到达和自己相近的浓度终点,经过电子鼻分析, 对待测样品进行归类以及判定, 找到样品所属的数据区域(图4), 从而判定待测样品所属浓度。欧氏距离、相关性、判别函数法、马氏距离等方法的鉴别率分别为100%、92%、96%、92%。四种方法总的鉴别率均达到90%以上, 能够较准确地对电子鼻结果进行验证(见表1)。
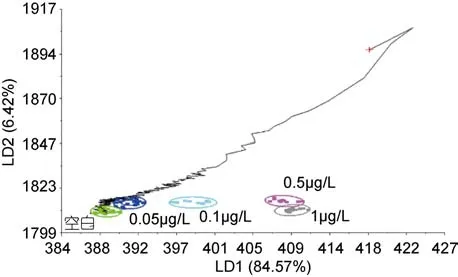
图4 空白组的识别结果Fig.4 Validation results of control check
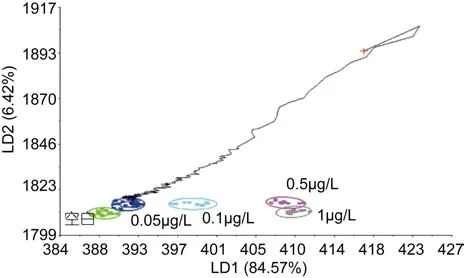
图5 PCB15浓度为0.05μg/L的识别结果Fig.5 Validation results of 0.05μg/L
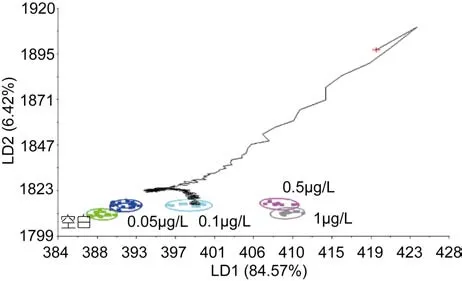
图6 PCB15浓度为0.1μg/L的识别结果Fig.6 Validation results of 0.1μg/L
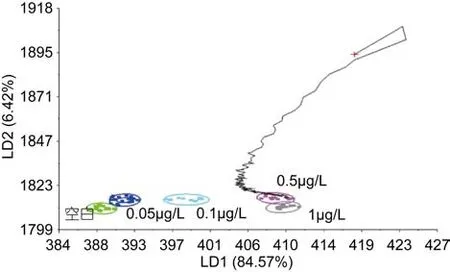
图7 PCB15浓度为0.5μg/L的识别结果Fig.7 Validation results of 0.5μg/L
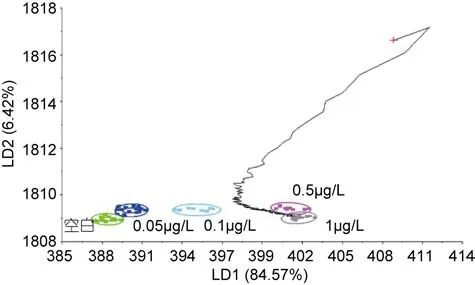
图8 PCB浓度为1μg/L的识别结果Fig.8 Validation results of 1μg/L

表1 4种模型对PCB15浓度识别结果Tab.1 Identification results of PCB15 concentrations in four models
2.2 GC-MS检测结果
青蛤软组织匀浆中添加不同浓度的PCB15, 测定各浓度相应的峰面积并以其为纵坐标, 以浓度为纵坐标绘制标准曲线。其中, 回归方程是y=7248.32x–135.09,R2= 0.9998。表2是根据方程所得的定量值、相对误差和回收率。可以看出, 在各浓度水平下, 相对误差在3.8%—18%, 回收率保持在85%—118%之间。
表3是青蛤软组织中PCB15作用一段时间后的GC-MS检测结果, 通过外标法定量。从表3可以看出,在PCBs浓度低于0.1μg/L的海水中养殖的青蛤软组织中没有检测到PCB15。

表2 GC-MS检测方法的回收率Tab.2 The recovery rate of GC-MS detection method

表3 青蛤PCBs的GC-MS检测结果Tab.3 The detection results of GC-MS for PCBs in C. sinensis
3 讨论
电子鼻能够快速检测青蛤软组织中的多氯联苯,检测限可以达到 0.05μg/L, 检测时间仅用 10min。采用LDA和PCA分析, 建立多氯联苯的浓度识别模板;在处理方法相同的情况下, PCB15作用72 h组的PCA的分析效果优于LDA, 具有更高的分辨率; 而144 h组的 PCA的分析效果同样优于 LDA, 区分效果较72h组的更好。说明处理时间对电子鼻更高效的检测青蛤软组织中的多氯联苯有重要作用, 随着处理时间的延长, 两种方法的总贡献率越高, 辨别效果越好,推测这可能与贝类对海水中多氯联苯的富集作用有关。运用欧氏距离、马氏距离、判别函数法和相关性对样品中 PCB15浓度进行鉴别验证, 四种方法总的鉴别率也均达到 90%以上, 可以较准确地对样品进行检测。
在电子鼻检测青蛤软组织多氯联苯时, PCA分析效果明显优于LDA分析。PCA主要是从特征的协方差角度去找到比较好的投影方式, 因此不同浓度组的样本能够有明显差异, 区分效果较为明显。而LDA更多的是考虑了标注, 即希望投影后不同类别之间数据点的距离更大, 同一类别的数据点更紧凑。概括来说, PCA选择样本点投影具有最大方差, LDA选择分类性能最好。LDA的缺点是抗干扰容错能力差, 不能保证最大程度排除青蛤在培养过程中环境的变化。而当样本数据较多, 需要验证判别未知样品归类或者浓度时, 考虑到标注的 LDA分析分类效果要优于PCA分析。因此两者各有利弊, 应该结合使用(张亮等, 2013)的分析方法。
用气质联用分析青蛤软组织中的多氯联苯浓度时发现: 青蛤在海水中PCB15浓度为0.5μg/L以上时才能在软体中检测到。HS-SPME-GC-MS检测方法相对误差在3.8%—18%的区间内。而电子鼻欧氏距离、相关性、判别函数法、马氏距离等方法的鉴别率均达到 90%以上, 与 HS-SPME-GC-MS的检测结果相比,效果更好。在实际应用中, 电子鼻的最低检出限0.05μg/L要比GC-MS的0.5μg/L要低, 说明电子鼻适用于贝类产品中的多氯联苯污染的快速检测。为了提供更可靠的依据, 可以把电子鼻检测与 GC-MS方法结合起来, 分析出海水中不同有害物质存在下贝类的特征挥发性物质及其所占的比例, 从而为贝类监督检验提供参考。
王道玮, 赵世民, 金 伟等, 2013. 加速溶剂萃取-固相萃取净化-气相色谱/质谱法测定沉积物中多氯联苯和多环芳烃.分析化学, 41(6): 861—868
甘居利, 贾晓平, 林 钦等, 2009. 中国海洋贻贝观察: 华南沿海近江牡蛎(Crassostrea rivularis)体多氯联苯含量时空变化. 海洋与湖沼, 40(6): 726—731
邢 红, 梅宝贵, 黎 娜, 2015. 高效液相色谱法测定百菌清中六氯苯、十氯联苯. 农药, 54(2): 103—104
朱云海, 尤仲杰, 申屠基康等, 2012. 宁波滩涂贝类养殖区沉积物中有机氯农药和多氯联苯残留及生态风险评估. 应用生态学报, 23(06): 1689—1694
刘敏霞, 杨玉义, 李庆孝等, 2013. 中国近海海洋环境多氯联苯(PCBs)污染现状及影响因素. 环境科学, 34(8):3309—3315
李 娜, 聂湘平, 黎华寿等, 2012. 多氯联苯(PCB153与PCB28)对 大型 溞的毒性效应研究. 农业环境科学学报,31(5): 891—897
杨左军, 王成云, 顾浩飞等, 2011. 纸品中多氯联苯的气相色谱法测定. 中华纸业, 32(4): 56—59
何红萍, 周 君, 李 晔等, 2013a. 基于电子鼻和 HS-SPMEGC-MS方法研究海水中七氯的快速检测技术. 海洋与湖沼, 44(5): 1347—1352
何红萍, 周 君, 张春丹等, 2013b. 利用化学传感器检测海水中的多氯联苯. 海洋与湖沼, 44(6): 1544—1549
张 亮, 侯云丹, 黄 健等, 2013. 加热温度对贻贝挥发性成
分的影响. 中国食品学报, 13(9): 227—233
张 琦, 董慧茹, 2009. 固相萃取-高效液相色谱法同时测定水中的对二氯苯与六氯苯. 分析试验室, 28(1): 88—91
陈春花, 2010. 1例肌注有机磷农药中毒患者的护理体会. 内蒙古中医药, 29(21): 170—171
陈寒玉, 庄惠生, 杨光昕, 2011. 环境样品中多氯联苯的生物检测方法研究进展. 环境化学, 30(5): 953—957
徐亚丹, 王 俊, 赵国军, 2006. 基于电子鼻的对掺假的“伊利”牛奶的检测. 中国食品学报, 6(5): 111—118
梁恕坤, 2009. 多氯联苯对水生生物的生态毒性研究进展. 山东省农业管理干部学院学报, 25(4): 155—158
彭艳超, 黄根华, 孙 敏, 2010. 多氯联苯对人体危害的研究.中国新技术新产品, (3): 23—24. DOI:10.3969/j.issn.1673-9957.2010.03.023
蒋 慧, 赵 力, 娄彩荣, 2010. 环境中多氯联苯(PCBs)的分析方法研究. 环境研究与监测, 23(4): 50—53
穆季平, 2006. 持久性有机污染物(POPs)研究进展. 环境科学技术, 29(增刊): 140—143
Ameer Q, Adeloju S B, 2005. Polypyrrole-based electronic noses for environmental and industrial analysis. Sensors and Actuators B: Chemical, 106(2): 541—552
Chia K J, Huang S D, 2006. Analysis of organochlorine pesticides in wine by solvent bar microextraction coupled with gas chromatography with tandem mass spectrometry detection. Rapid Communication in Mass Spectrometry,20(2): 118—124
Ross G, 2004. The public health implications of poly-chlorinated biphenyls (PCBs) in the environment. Ecotoxicology and Environmental Safety, 59(3): 275—291
Wang M, Guowen M, Qing Het al, 2010. Fluorescence detection of trace PCB101 based on PITC immobilized on porous AAO membrane. Analyst, 136(2): 278—281
