生物浸出过程中的藻酸盐作用及其 机理的研究进展
2015-03-18余润兰刘亚楠彭堂见刘学端顾帼华邱冠周曾伟民
余润兰 ,刘亚楠 ,周 丹 ,彭堂见 ,刘学端 ,顾帼华 ,邱冠周 ,曾伟民
(1. 中南大学 资源加工与生物工程学院,长沙 410083; 2. 中南大学 生物冶金教育部重点实验室,长沙 410083)
随着人类环境保护意识的加强,微生物冶金作为一种绿色工艺,备受关注。我国资源短缺,加上开发过度,形成了富矿少、贫矿多、矿石复杂资源难回收的局面。生物湿法冶金技术具有工艺成本低、污染小,能有效开发低品位、难处理矿产资源的特点,因而,成为当今冶金领域研究的热点[1]。生物湿法冶金是指利用浸矿微生物(细菌、古菌和真菌)将矿石中的有价金属离子溶解到浸出液中的过程,能够有效地处理各种低品位矿石[2]。目前,生物湿法冶金技术主要应用于黄铁矿、黄铜矿、砷黄铁矿等难处理硫化矿,浸矿微生物的研究主要集中在嗜酸氧化硫硫杆菌、嗜酸氧化亚铁硫杆菌、氧化亚铁钩端螺菌等硫化矿物浸矿 菌[3]。该技术具有较多显著的优点,如流程短、成本低、环境友好和污染低等。因此,生物湿法冶金已广 泛应用于国内外各大矿山,如江西德兴铜矿、福建紫金山矿业等。据报道,截止到21世纪初,全世界约21%的铜产量是由生物湿法冶金所得[4]。
微生物胞外多聚物(EPS)是生物冶金基础研究领域的热点,在微生物与矿物的吸附过程以及微生物对矿物氧化溶解过程中有重要的作用。但是,目前关于生物冶金领域EPS的研究仍然局限在对EPS提取方法探讨和组成成分分析等方面,而对其中关键组分的作用及其机理研究较少,不利于EPS在生物冶金过程中作用机制的阐明,阻碍了生物冶金目前该方面的研究理论深层次的发展。
胞外多糖是EPS的重要组成成分,普遍存在于各种环境下形成的生物膜中,以杂多糖为主,且多属聚阴离子性多糖,相对分子量一般为0.5×106~2×106,本文作者所在课题组前期研究发现,中等嗜热浸矿微生物浸出黄铜矿过程中胞外多糖主要有鼠李糖、海藻糖、木糖、甘露糖、葡萄糖、糖醛酸(藻酸盐的主要成分)[5](见表1)。RYDER等[6]认为主要的胞外多糖包括藻酸盐、生物膜胞外基质多聚糖(Psl)和与菌膜和生物膜形成相关的胞外多糖(Pel)等。在菌株分泌EPS初期,藻酸盐的含量较高,对菌株吸附到载体表面起重要作用。随着EPS分泌量的增加和生物膜的形成,藻酸盐和一些胞外蛋白类物质共同组成生物膜的网状骨架,维持生物膜的机械稳定性[7]。另外,由于胞外多糖藻酸盐中含有较多糖醛酸成分,易于吸附或结合环境中的Fe3+、Zn2+、Cd2+、Mn4+等金属离子,从而为细胞提供微量元素,保证细胞的持续生长与功能活性。生物冶金过程中,SAN等[8]猜测矿物的溶解主要依赖于矿物表面富集的大量Fe3+,而这些Fe3+可能就是通过藻酸盐中的糖醛酸成分结合而来。
综上所述,藻酸盐是胞外多聚物中重要组分之一。不仅在构成生物膜骨架,维持生物膜结构方面发挥重要作用,而且藻酸盐中的糖醛酸能够吸附金属离子,其研究能够促进胞外多聚物的深入研究,进一步促进浸矿机理的说明。
1 藻酸盐的合成途径及作用机制
1.1 藻酸盐的发现及结构
藻酸盐是一类物质的总称,可以分为细菌产生的细菌藻酸盐和藻类产生的海藻酸盐。GORIN等[9]于1966年报道了从土壤中分离的棕色固氮菌能够产生细菌藻酸盐,同年,LINKER等[10]从自然生境中分离得到多株能够产生细菌藻酸盐的铜绿假单胞菌菌株。1992年,BRUUS等[11]认为细菌藻酸盐有利于活性污泥絮体的形成,而林跃梅[12]对好氧颗粒污泥中的细菌藻酸盐进行提取、鉴定和深入研究,确定好氧颗粒污泥的多糖骨架,揭示颗粒污泥形成的必要条件。而在生物冶金领域,关于细菌藻酸盐在胞外多聚物中所发挥作用的报道甚少。
细菌藻酸盐和海藻酸盐具有相同的基本结构,是由β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)为单体随机聚合形成的线性高分子聚合物,其一级结构受不同来源决定。其基石结构有3种:1) 完全由β-D-甘露糖醛酸按照β-(1→4)键结合的M-M型;2) 完全由α-L-古洛糖醛酸按α-(1→4)键结合的G-G型;3) 由β-D-甘露糖醛酸和α-L-古洛糖醛酸混合交替结合的G-M型,如图1所示。细菌藻酸盐是一种乙酰化的线性多糖,在C2C3羟基上被不同程度地乙酰化,乙酰化的程度随着菌株和生长条件的不同而改变。藻酸盐及生物膜的激光共聚焦扫描电镜图[13]如图2所示,其中,SYTO 9是一种绿色荧光染料,能够对革兰氏阳性细菌和革兰氏阴性细菌的活细胞和死细胞进行染色,最大激发光波长488 nm,最大散射光波长522 nm。标记荧光素四甲基异硫氰酸罗丹明(TRITC)最大吸收光谱550 nm,最大发射光谱为600~620 nm,能与蛋白质结合。
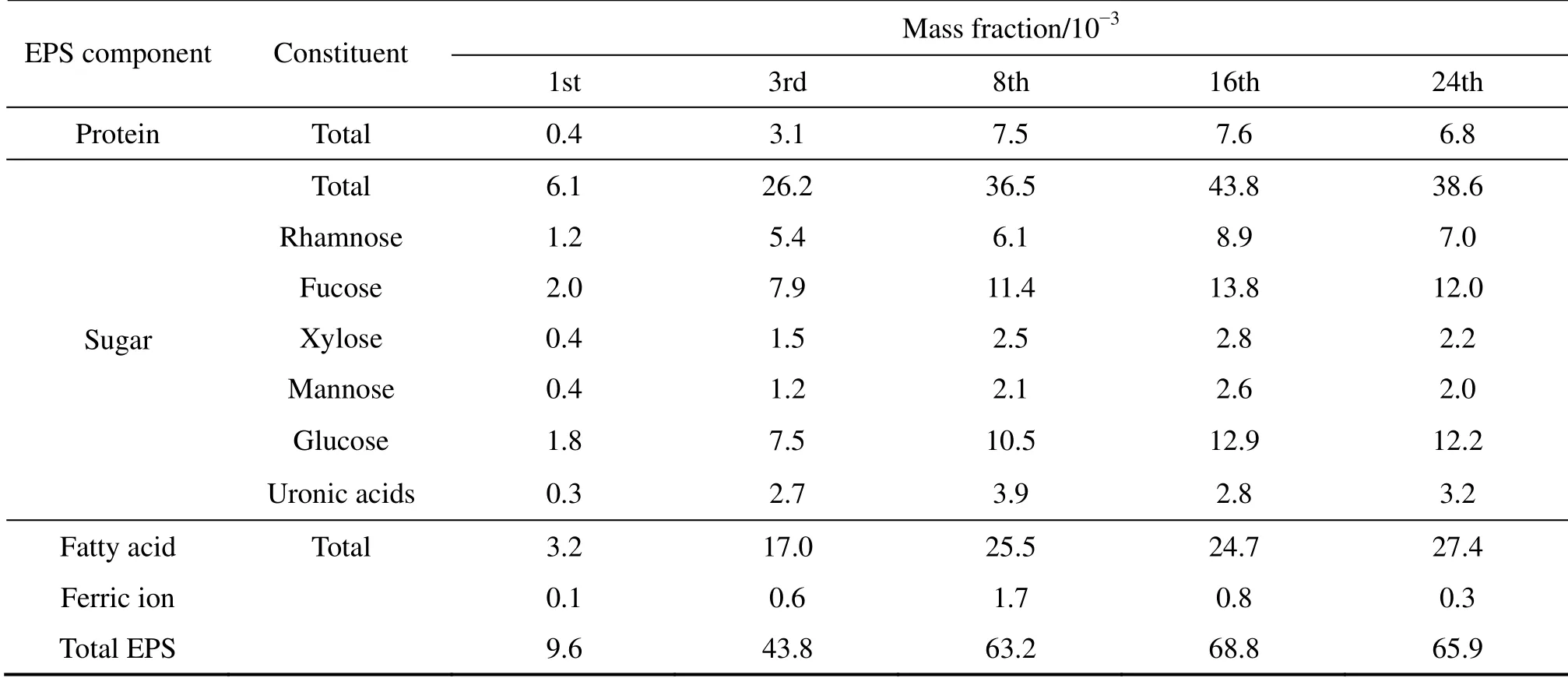
表1 中等嗜热浸矿微生物浸出黄铜矿过程中矿物表面EPS的成分和含量[5] Table1 EPS components and contents in ore residue during bioleaching of chalcopyrite concentrate by mixed culture of moderately thermophilic microorganisms[5]
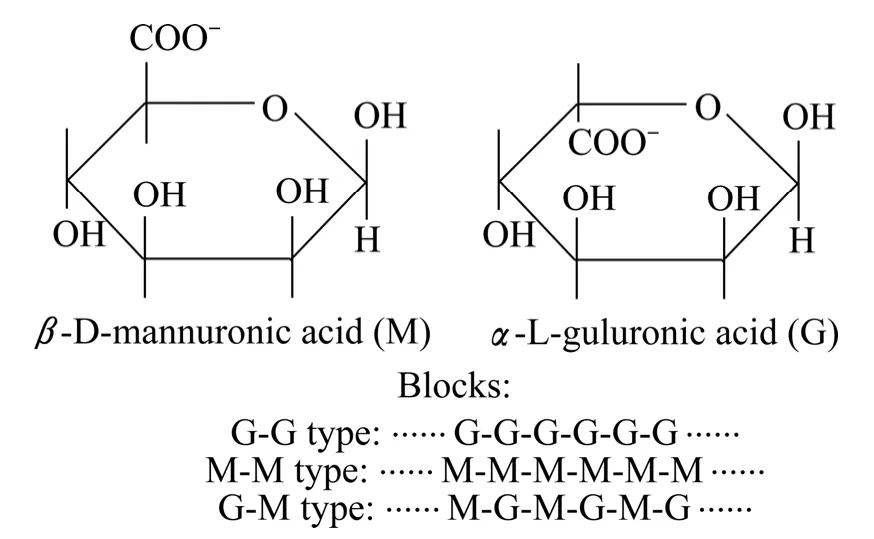
图1 藻酸盐单体和基石的结构[12] Fig.1 Structures of alginates monomers and blocks[12]
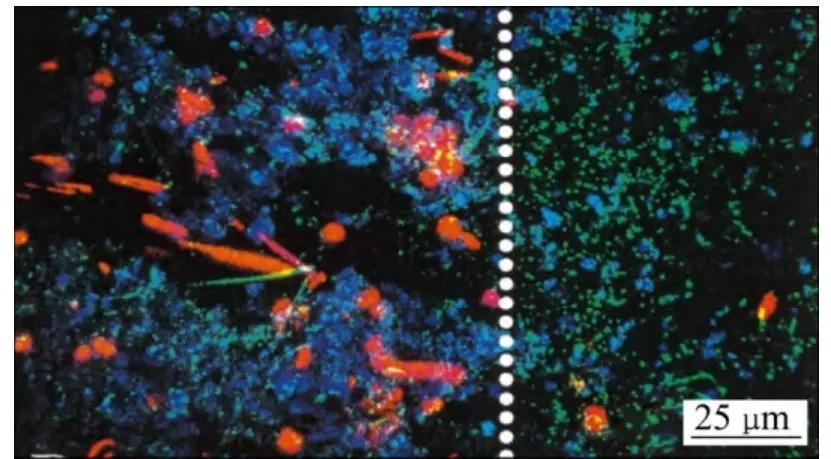
图2 激光共聚焦扫描电镜Z系列下观察到的生物膜结构[13] Fig.2 Z series projections of ungrazed (left side of dotted line in image) and grazed (right side) areas of biofilm visualized by CLSM[13] (Far red image of algal autofluorescence (647 nm ex); Green image of nucleic acid stained bacteria labeled by SYTO 9; Red channel image of TRITC conjugated lectin labeled polymer (588 nm ex,605/32 nm em))
1.2 藻酸盐的作用
目前,藻酸盐已经成为一种重要的工业化生产的微生物多糖,它最初的作用是在肺炎致病菌如铜绿假单胞菌菌株中发现,具体包含以下几点:
1) 加强细菌对固体表面的粘附。在Ca2+等金属离子的诱导作用下,产生的细菌藻酸盐发生分子自组装,随浓度的增加具有形成大的网状聚集体的趋势,作为生物膜的主要结构成分,使微菌落镶嵌其间。并可通过与细菌细胞膜作用而附着在细菌表面。已发生聚集的藻酸盐还可通过相互之间的短程作用力(如氢键)进一步组装,形成粒径更大的聚集体,成为细菌细胞黏附的重要介质[12]。
2) 作为一保护屏障,保护细菌避免与抗生素和免疫攻击物接触,提高菌种抗性。医学领域中,铜绿假单胞菌分泌的高分子量的藻酸是造成患囊性纤维化病人肺感染的原因。藻酸包裹着菌体附着在肺表面,形成一道牢固的屏障阻止抗微生物药物的穿透。只有使用藻酸盐裂合酶将藻酸解聚,才能对病人进行治疗。ALKAWASH等[14]研究铜绿假单胞菌(Pseudomonas aeruginosa)时还发现, 当EPS中藻酸盐含量较高时,该菌对抗生素类杀菌剂的抗性增强。当采用藻酸盐裂解酶处理该菌EPS后,该菌的抗性急剧下降,说明EPS中藻酸盐在提高菌种抗性方面也起到了重要作用。
随着研究的深入,研究人员发现藻酸盐的每一个糖醛酸残基中都有带电基团—COO-[12]。藻酸盐分子含有M-M、G-G和G-M链段,各链段与金属的结合能力主要取决于分子的立体化学结构及金属离子的半径和所带的电荷。G-G嵌段相邻糖单元的羧基和糖苷键氧以及羟基氧在主链的同侧,形成具有蛋壳形状的空穴,非常适合金属离子的嵌入。这一发现为矿物生物氧化机制的研究奠定了重要理论基础。
在生物冶金基础理论研究中,人们开始注重对浸矿菌藻酸盐中的糖醛酸成分的研究。SAND等[15]指 出,生物浸出的过程就是界面作用的结果,由糖醛酸富集溶液中的Fe3+,在矿物表面和细菌之间形成的微氧化空间中氧化溶解矿物。比较在FeSO4溶液中与黄铁矿中生长的细菌所产生的胞外聚合物数量,在黄铁矿中生长的细菌所产生的胞外聚合物的数量大约为FeSO4溶液中的3倍,但二者的胞外聚合物的成分是相似的,均存在有Fe3+、糖醛酸以及中性多糖,且Fe3+与糖醛酸的物质的量的比为1:2[16]。2003年, KINZLERA等[17]指出,由亚铁或黄铁矿培养的铁氧化菌中,胞外聚合物中的糖醛酸成分普遍存在,而在硫培养的硫氧化菌菌种中,却不存在糖醛酸成分。而在2006年,HAMEIT等[18]对A. ferrooxidans,Acidithiobacillus thiooxidans和Leptospirillum ferrooxidans的EPS组成进行化学分析,发现它们均含糖醛酸。但组成因菌株和生长基质不同而有很大差异。分析3种菌发现,由亚铁或黄铁矿培养的铁氧化菌A. ferrooxidans,L.ferrooxidans的EPS中能检测到三价铁离子,而A. thiooxidans的EPS中检测不到。
1.3 藻酸盐的生物合成途径
PINDAR等[19]测定了棕色固氮菌生物合成细菌藻酸盐所必需的酶,这些酶包括葡糖激酶、果糖激酶、磷酸甘露糖异构酶、GDP-甘露糖焦磷酸化酶和GDP-甘露糖脱氢酶。在此基础上,结合海藻酸盐生物合成途径,提出了棕色固氮菌细菌藻酸盐的生物合成途径,藻酸盐的生物合成是由果糖-6-磷酸开始的。
MAY等[20]进一步说明了藻酸盐的生物合成途径,绘制了细菌藻酸盐基因簇的遗传图谱,并探究藻酸盐合成过程中涉及的分子和酶的作用,基因表达调控和环境因素的影响。
LYNN等[21]分别用含有放射性同位素14C标记葡萄糖,认为合成细菌藻酸盐过程中E-D途径起着重要作用。ANDERSON等[22]用含有放射性同位素14C标记的[1-14C]果糖和[6-14C]果糖分别作为唯一碳源,培养棕色固氮菌SM52B生产细菌藻酸盐,结果来自[1-14C]果糖和[6-14C]果糖的放射性同位素14C均大量进入细菌藻酸盐中。ANDERSON等[22]认为细菌藻酸盐的大量产生,主要是由果糖以完整己糖单位的形式聚合而成的。
综上所述,胞外多聚物中的藻酸盐的合成途径如图3所示。藻酸盐的合成始于果糖-6-磷酸(F6P),在磷酸甘露糖异构酶(PMI)作用下生成甘露糖-6-磷酸(M6P),然后在磷酸甘露糖酶(PMM)作用下生成甘露糖-1-磷酸(M1P), 进一步在GDP-甘露糖焦磷酸化酶(GMP)、GDP-甘露糖脱氢酶(GMD)作用下生成GDP-甘露糖(GDPM)和GDP-甘露糖醛酸(GDPMA)。图3中箭头1234分别代表聚合、乙酰化、输出和差向异构化。GDP-甘露糖醛酸被糖基载体脂即十一聚类异戊二烯醇磷酸脂运往胞外,先合成聚甘露糖醛酸。然后在胞 外聚甘露糖醛酸C-5-差向异构酶的作用下将聚甘露糖醛酸中的甘露糖醛酸部分异构化,转化为古洛糖醛酸残基[23]。该酶的活性需要激活剂Ca2+。提高培养基中的Ca2+浓度,可增加胞外多糖中古洛糖醛酸的含量。位于图3中方框上端的是编码各种酶的基因,其中基因algA编码PMI和GMP两种酶。
2 研究藻酸盐的关键技术与手段
2.1 藻酸盐的提取及分析方法
微生物胞外多聚物中藻酸盐的提取方法主要包括物理提取法和化学试剂法。物理提取法主要是利用各种外力如重力、离心力增加成分在溶液中的溶解度,如超声波法、高速离心法。化学试剂法是利用离子或分子的作用使成分可溶性增加,如NaOH法、EDTA法。1966年,LINKE等[10]首次发现假单胞菌多糖的藻酸盐,其组成与海藻多糖类似,他采用纸层析、红外光谱法等提取和分离藻酸盐成分,然后用咔唑比色法分析糖醛酸含量,苯酚硫酸法分析多糖含量。KASHEF等[24]也介绍了铜绿假单胞菌中藻酸盐提取的方法,以及成分的化学分析。王琳等[25]为探寻细菌藻酸盐对好氧污泥颗粒化的作用,借鉴海藻酸盐的提取方法, 对好氧颗粒污泥中的细菌藻酸盐提取和鉴定。提取物鉴别反应如下:1%提取物溶液中加 CaCl2溶液产生冻胶状的沉淀;加饱和硫酸铵溶液不产生沉淀;加稀硫酸产生冻胶状的沉淀;加酸式硫酸铁溶液显樱桃红色;加间苯三酚-盐酸试液显红紫色。当鉴别反应均呈阳性时,根据FAO的鉴定标准,可以判断提取物为藻酸盐。而接种污泥中不含褐藻,因此该藻酸盐由细菌产生。此法也可应用于浸矿菌提取的藻酸盐的鉴定。本文作者课题组前期采用玻璃珠振荡、超声波等方法提取了生物浸出过程中的矿物表面的胞外多聚物,经过GC-MS等方法分析了其中藻酸盐的主要成分糖醛酸的含量及其随生物浸出的变化情况,为研究胞外多聚物在生物浸出过程中的作用提供了重要理论基础[5,26-27]。
2.2 藻酸盐相关基因的定量研究方法
有关藻酸盐的基因定量表达研究可采取以下几种手段:
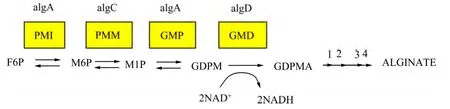
图3 藻酸盐生物合成途径[20] Fig.3 Biosynthesis pathway of alginate[20]
1) 实时荧光定量PCR(Real time polymerase chain reaction,RT-PCR)。实时荧光定量是近几年新发展起来的方法,以RNA为模板,在反转录酶的作用下,由人工合成引物介导生成cDNA第一链,以此再作为聚合酶链反应的模板,在TaqDNA聚合酶作用下,扩增产生大量DNA片断。RT-PCR是一种常用的具有很高灵敏度和特异性的基因表达检测方法[28]。该方法理论上有一个单拷贝cDNA模板即可完成扩增,因此,它比较适合作基因表达的定量研究。
2) 常见的还有Northern杂交法。杂交法由ALWINE等[29]在Southern技术的基础上建立起来的。是用DNA探针来检测特异序列的RNA。具体的步骤为首先从要研究的组织或细胞中抽提完整RNA,然后将RNA变性琼脂糖凝胶电泳分离,再通过毛细管作用或负压法装置使 RNA条带转移到纤维膜上,进行必要的处理后,用32P 标记的DNA探针与纤维膜进行杂交,在放射自显影情况下可检测出特定的 RNA条带。这种方法主要是检测特异mRNA,以分析该基因的表达情况及mRNA的分子大小,特别是对细胞生长、分化、发育过程中有关基因的表达。该方法具有较高的特异性。
3) S1核酸酶保护法(S1 nuclease protection)。S1核酸酶保护法是BERK和SHARP[30]开发的一种新的实验技术,其程序是首先将未标记的RNA高特异性活性32P标记的DNA杂交,然后用核酸内切酶S1处理杂交分子,在适当的条件下单链核苷酸被水解,而杂交双链不受影响。最后,在碱性的琼脂糖凝胶电泳中可精确地检测出被保护的互补的单链DNA的片段大小,并通过运用一系列的重叠的DNA限制片段,这个被鉴定出的转录子就可准确定位。与Northern blot相比,该技术使用了间接的方法来定位和检测mRNA,主要用于基因表达调控方面的研究,对于详细地阐述真核细胞基因表达和表达的调节十分重要。
4) 田余祥等[31]用高效毛细管电泳法(High performance capillary electrophoresis,HPCE)用于基因表达产物的定量分析上,目的是想寻求一种能利用统计学对基因表达产物进行定量分析比较的方法。
以上4种方法都常用于藻酸盐合成基因的定量表达研究。其中,RT-PCR技术由于操作简便、灵敏度高、重复性好等优点,被广泛地用于基因的差异表达分析、SNP检测、等位基因的检测等。Northern杂交法主要用于mRNA的特异表达检测,而S1核酸酶保护法使用了间接的方法来定位和检测 mRNA,主要用于基因表达调控方面的研究,它对于分析真核细胞基因表达和调节十分重要。高效毛细血管法则是针对基因表达产物的分析。一般来说,基因表达定量分析方法的选择主要根据实验对象和设备等情况来判断。
2.3 藻酸盐原位观察手段及方法
近年来,国内外多采用多种电镜组合技术和光谱学方法研究生物膜,主要包括激光共聚焦显微镜(CLSM)、拉曼显微镜技术(CRM)、核磁共振光谱技术(MRI)、环境扫描电镜(ESEM)、场发射扫描电镜(FESEM)、原子力显微镜(AFM)和荧光显微镜(EFM)等。BRIDIER等[32]提出了一种高通量研究生物膜形成和结构的方法,将CLSM同96孔板结合起来,具有高分辨率,能更清晰地研究生物膜的结构。ZHANG等[33]采用CLSM、SEM、AFM等研究了生物浸出过程中极端嗜酸古菌Ferroplasma acidiphilum在矿物表面的聚集现象和生物膜的形成,F. acidiphilum菌能在黄铁矿表面快速形成生物膜,其细胞的分布、生物膜的形成以及EPS的产量都可较为清晰地观察到。WAGNER等[34]利用CRM作为CLSM的辅助手段,对生物膜基质进行更为详细的分析。GARNY等[35]将共聚焦激光扫描电镜技术与核磁共振光谱技术结合起来,用于研究生物膜的结构、组成和分子流动性。BRIDIER等[36]利用一系列显微镜技术包括CLSM、ESEM和FESEM来分析生物膜周围基质的三维空间排布。不同技术的组合克服了单个技术的限制,使我们对生物膜结构有了更进一步的认识。
同时,也可以借鉴这些广泛应用在生物膜和EPS上的方法,将它们应用在藻酸盐研究上。LAWRENCE等[13]利用藻酸盐自发荧光,通过CLSM可以较为准确、特异性地分析EPS中藻酸盐的含量,从而为实时定量分析关键胞外多糖藻酸盐成分奠定了基础。HENTZER等[37]研究了藻酸盐过度表达对生物膜结构和功能的影响,用绿色荧光蛋白(GFP)标记菌株生物膜,利用CLSM观察生物膜形态。DAVIESANDG 等[38]用激光扫描共聚焦显微镜原位检测藻酸盐操纵子algC转录融合产物β-半乳糖苷酶基因的表达情况。
在今后藻酸盐的研究中应结合多种组学技术,从分子生物学角度探讨其生物作用和形成途径,进一步了解藻酸盐在细菌与矿物界面中的作用,为提高浸矿速率、缩短浸矿周期提供理论基础。
综上所述,藻酸盐是胞外多聚物中的关键组成成分,通过参考废水处理等领域的藻酸盐研究方法与手段,分析生物浸出过程中藻酸盐的含量变化、原位分布、基因表达等情况,从而揭示胞外多聚物关键组分藻酸盐的作用机理,为阐明微生物浸矿行为奠定基础。
3 展望
藻酸盐是胞外多聚物的关键组分,它在维持生物膜结构和功能方面有重要的作用。随着分子生物学技术、显微观察技术和光谱技术的不断发展,微生物生物膜中藻酸盐的微观结构逐步被人们所认识,尤其是在医学微生物、环境微生物研究等方面,藻酸盐在生物膜中的作用及其机理逐步被阐明。但是在生物冶金领域,矿物表面胞外多聚物关键组分如藻酸盐的研究一直是个盲区,不利于探索矿物生物氧化的微观行为,较大程度上阻碍了生物冶金理论的发展。未来生物冶金界面研究方向将是更微观、更深层次地探讨胞外多聚物组分及其作用机理,如胞外多聚物关键组分藻酸盐、胞外蛋白、胞外DNA等在矿物表面的含量、分布规律和功能地位。这些将有助于了解生物浸出不同时期胞外多聚物关键组分的生成情况,结合矿物氧化中间产物、微生物生态、微生物功能基因表达等方面的分析,从而更系统地、科学地揭示微生物的浸矿行为。
[1] 余润兰,石丽娟,周 丹,邱冠周,曾伟民. 生物浸出过程中微生物协同作用机制的研究进展[J]. 中国有色金属学报,2013,23(10): 3010-3014.
YU Run-lan,SHI Li-juan,ZHOU Dan,QIU Guan-zhou,ZENG Wei-min. Research development of microorganism synergy mechanisms during bioleaching[J]. The Chinese Journal of Nonferrous Metals,2013,23(10): 3010-3014 .
[2] RAWLINGS D E. Heavy metal mining using microbes[J]. Annual Review of Microbiology,2002,56(1): 65-91.
[3] 王朝华,陆建军,陆现彩,李 娟. 微生物胞外聚合物特征组分影响黄铁矿分解作用的实验研究[J]. 岩石矿物学杂志,2009,28(6): 553-558.
WANG Zhao-hua,LU Jian-jun,LUN Xian-cai,LI Juan. The effects of the typical components of extracellular polymeric substances (EPS) of microorganism on the bio-decomposition of pyrite[J]. Acta Petrologica et Mineralogica,2009,28(6): 553-558.
[4] SCHIPPERS A,HEDRICH S,VASTERS J,DROBE M,SAND W,WILLSCHER S. Biomining: Metal recovery from ores with microorganisms[C]// Advances in Biochemical Engineering/ Biotechnology. Berlin,Germany: Springer,2013: 1-47.
[5] ZENG Wei-min,QIU Guan-zhou,ZHOU Hong-bo,LIU Xue-duan,CHEN Miao,CHAO Wei-liang,ZHANG Cheng-gui,PENG Juan-hua. Characterization of extracellular polymeric substances extracted during the bioleaching of chalcopyrite concentrate[J]. Hydrometallurgy,2010,100(3/4): 177-180.
[6] RYDER C,BYRD M,WOZNIAK D J. Role of polysaccharides in Pseudomonas aeruginosa biofilm development[J]. Current Opinion in Microbiology,2007,10(6): 644-648.
[7] FLEMMING H C,WINGENDER J. The biofilm matrix[J]. Nature Review of Microbiology,2010,8(9): 623-633.
[8] SAND W,GEHRKE T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology,2006,157(1): 49-56.
[9] GORIN P A J,SPENCER J F T. Exocellular alginic acid from Azotobacter vinelandii[J]. Canadian Journal of Chemistry,1966,44: 993-998.
[10] LINKER A,JONES R S. A new polysaccharide resembling alginic acid isolated from pseudomonads[J]. The Journal of Biological Chemistry,1966,24(16): 3845-3851.
[11] BRUUS J H,NIELSEN P H,KEIDING K. On the stability of activated sludge flocs with implications to dewatering[J]. Water Research,1992,26(12):1597–1604.
[12] 林跃梅. 好氧颗粒污泥中细菌藻酸盐的研究[D]. 青岛: 中国海洋大学,2007: 1-147.
LIN Yue-mei. Studies on bacterial alginates in aerobic granules[D]. Qingdao: Ocean University of China,2007: 1-147.
[13] LAWRENCE J R,NEU T R,SWERHONE G D W. Application of multiple parameter imaging for the quantification of algal,bacterial and exopolymer components of microbial biofilms[J]. Journal of Microbiological Methods,1998,32(3): 253-261.
[14] ALKAWASH M A,SOOTHILL J S,SCHILLER N L. Alginate lyase enhances antibiotic killing of mucoid Pseudomonas aeruginosa in biofilms[J]. Acta Pathologica,Microbiologica,et Immunologica Scandinavica,2006: 114(2): 131-138.
[15] SAND W,GEHRKE T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology,2006,157(2): 49-56.
[16] 钟代立. A.f菌胞外聚合物表面性质随培养基质和时间的演变研究[D]. 长沙: 中南大学,2011: 1-70.
ZHONG Dai-li. Evolvement of surface property of extracellular polymeric substances of A.ferrooxidans with culture and time[D]. Changsha: Central South University,2011: 1-70.
[17] KINZLERA K,GEHRKEA T,TELEGDIB J,SAND W. Bioleaching—A result of interfacial processes caused by extracellular polymeric substances(EPS)[J]. Hydrometallurgy,2003,71(1/2): 83-88.
[18] HAMEIT K,GOKSEL A,KOCK D,KLOCK JH,GEHRKE T,SAND W. Adhesion to metal sulfide surfaces by cells of Acidithiobacillus ferrooxidans,Acidithiobacillus thiooxidans and Leptospirillum ferrooxidans[J]. Hydrometallurgy,2006,83(1/4): 245-254.
[19] PINDER D F,BUCKE C. The biosynthesis of alginic acid by Azotobacter vinelandii[J]. Biochemical Journal,1975,152(3): 617-622.
[20] MAY T B,SHINABARGER D. Alginate synthesis by Pseudomonas aeruginosa: A key pathogenic factor in chronic pulmonary infections of cystic fibrosis patients[J]. Clinical Microbiology Reviews,1991,4(2): 191-206.
[21] LYNN A R,SOKATCH J R. Incorporation of isotope from specifically labeled glucose into alginates of Pseudomonas aeruginosa and Azotobacter vinelandii[J]. Bacteriol,1984,158(3): 1161-1162.
[22] ANDERSON A J,HACKING A J,DAWES E A. Alternative pathways for the biosynthesis of alginate from fructose and glucose in Pseudomonas mendocina and Azotobacter vinelandii[J]. Journal of General Microbiology,1987,133(4): 1045-1052.
[23] 邱立友. 细菌藻酸盐研究进展[J]. 微生物学报,1994,21(6): 360-363.
QIU Li-you. Research progress in bacterial alginate[J]. Microbiology China,1994,21(6): 360-363.
[24] KASHEF N,QORBAN B N. Preliminary investigation on the isolation of alginate produced by mucoid Pseudomonas aeruginosa[J]. Annals of Microbiology,2005,55(4): 279-282.
[25] 林跃梅,王 琳. 好氧颗粒污泥藻酸盐提取物的聚集形态研究[J]. 环境科学,2008,29(5): 1181-1186.
LIN Yue-mei,WANG Lin. Self-aggregation property of bacterial alginates extracted from aerobic granules[J]. Environmental Science,2008,29(5): 1181-1186.
[26] ZENG Wei-min,CHEN Miao,TAN S,QIU Guan-zhou. Detection and analysis of attached microorganisms on the mineral surface during bioleaching of pure chalcopyrite with moderate Thermophiles[J]. Hydrometallurgy,2011,106(1/2): 46-50.
[27] 曾伟民. 黄铜矿生物浸出过程中钝化膜的形成机制及其消除方法探讨[D]. 长沙: 中南大学,2011: 1-147.
ZENG Wei-min. The formation mechanism of passivation layer and its elimination way during bioleaching of chalcopyrite[D]. Changsha: Central South University,2011: 1-147.
[28] ZHANG R B,WEI M M,JI H G,CHEN X H,QIU G Z,ZHOU H B. Application of real-time PCR to monitor population dynamics of defined mixed cultures of moderate Thermophiles involved in bioleaching of chalcopyrite[J]. Applied Microbiology and Biotechnology,2009,81(6): 1161-1168.
[29] ALWINE J C,KEMP D J,STARK G R. Method for detection of specific RNAs in agarose gels by transfer to diazobenzyloxymethyl-paper and hybridization with DNA probes[J]. Proceedings of the National Academy of Sciences,1977,74(12): 5351-5354.
[30] BERK A J,SHARP P A. Sizing and mapping of early adenovirus mRNAs by gel electrophoresis of S1 endonuclease-digested hybrids[J]. Cell,1977,12(3): 721-732.
[31] 田余祥,于秀萍,崔秀云. 基因表达的一种定量研究方 法——高效毛细管法[J]. 大连医科大学学报,1997,19(1): 5-7.
TIAN Yu-xiang,YU Xiu-ping,CUI Xiu-yun. A quantitative method of gene expression—High performance capillary electrophoresis method[J]. Journal of Dalian Medical University,1997,19(1): 5-7.
[32] BRIDIER A,BRISSONNET F D,BOUBETRA A,THOMAS V,BRIANDET R. The biofilm architecture of sixty opportunistic pathogens deciphered using a high throughput CLSM method[J]. Journal of Microbiological Methods,2010,82(1): 64-70.
[33] ZHANG R,BELLENBERG S,CASTRO L,NEU T R,SAND W,VERA M. Colonization and biofilm formation of the extremely acidophilic archaeon Ferroplasma acidiphilum[J]. Hydrometallurgy,2014,150: 245-252.
[34] WAGNER M,NATALIA P. IVLEVA,HAISCH C,NIESSNER R,HORN H. Combined use of confocal laser scanning microscopy (CLSM) and Raman microscopy (RM): Investigations on EPS-Matrix[J]. Water Research,2009,43(1): 63-76.
[35] GARNY K,NEU T R,HORN H,VOLKE F,MANZ B. Combined application of13C NMR spectroscopy and confocal laser scanning microscopy-Investigation on biofilm structure and physico-chemical properties[J]. Chemical Engineering Science,2010,65(16): 4691-4700.
[36] BRIDIER A,MEYLHEUC T,BRIANDET R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM,ESEM and FESEM)[J]. Micron,2013,48: 65-69.
[37] HENTZER M,TEITZEL G M,BALZER G T,HEYDORN A,MOLIN S,GIVSKOV M,PARSEK M R. Alginate overproduction affects Pseudomonas aeruginosa biofilm structure and function[J]. Journal of Bacteriology,2001,183(18): 5395-5401.
[38] DAVIESANDG D G,GEESEY G. Regulation of the alginate biosynthesis gene algC in Pseudomonas aeruginosa during biofilm development in continuous culture[J]. Applied and Environmental Microbiology,1995,61(3): 860-867.
