盐酸石蒜碱对人食管癌细胞Eca-109增殖及凋亡的影响
2015-03-14伍春莲
彭 聪,徐 佳,伍春莲
(西华师范大学生命科学学院,四川 南充 637009)
盐酸石蒜碱对人食管癌细胞Eca-109增殖及凋亡的影响
彭 聪,徐 佳,伍春莲
(西华师范大学生命科学学院,四川 南充 637009)
近期研究发现从石蒜科植物体内提取的生物碱,如石蒜碱、盐酸石蒜碱等,具有广泛的抗肿瘤活性功能.本实验通过MTT法测定经不同梯度浓度盐酸石蒜碱(LH)处理后,食管癌Eca-109细胞的存活率;通过AO/PI(吖啶橙/碘化丙啶)双染色法观测不同浓度盐酸石蒜碱处理下,食管癌Eca-109细胞凋亡的形态;通过流式细胞仪检测Eca-109细胞的凋亡率.结果显示,盐酸石蒜碱以时间和剂量依赖性方式抑制食管癌Eca-109细胞增殖,晚期凋亡和死亡细胞随盐酸石蒜碱浓度的增大而增多.因此,盐酸石蒜碱能抑制Eca-109细胞增殖并诱导其凋亡.
盐酸石蒜碱;Eca-109细胞;细胞活性;细胞凋亡
食管癌是发生在食管上皮组织的恶性肿瘤,占所有恶性肿瘤的2%.全世界每年约有40万人死于食管癌.我国是食管癌高发区,男、女性发病率和死亡率均居全球第一.2008年,我国新增食管癌患者22.8万,占全球新增病例的53.6%,因食管癌死亡人数21万,占全球死亡人数51.7%[1].2010年,全球大约40.7万人死于食管癌(占所有因癌症死亡人数的5.4%)[2].当前,治疗早期食管癌的方案主要是食管切除术,并结合化疗和放疗[3].通过这种方案,虽然病人的存活率有所提高,但是伴随着极大的风险,而且仅适用于早期食管癌,超过65%的患者都无法得到治疗[4].
许多中草药可以在癌症的治疗中起到良好的辅助性作用,既能增强化疗的功效,又能降低化疗过程中产生的副作用以及耐药性.研究发现,从这些中草药中提取的某些成分可以抑制肿瘤细胞的增殖[5,6],并诱导肿瘤细胞凋亡[7,8].盐酸石蒜碱是从石蒜科植物中提取的一种生物碱.2011年和2013年研究发现,盐酸石蒜碱能抑制黑色素瘤细胞和卵巢癌细胞的增殖,以及抗肿瘤血管生成[9,10].本实验选取食管癌Eca-109细胞,经不同浓度的盐酸石蒜碱处理,检测其对Eca-109细胞的活性、形态及凋亡的影响.
1 实验材料与方法
1.1 实验材料
1.1.1 细胞株:人食管癌细胞Eca-109购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所.
1.1.2 试剂:RPMI1640培养基,胎牛血清,双抗,磷酸缓冲生理盐水PBS,胰蛋白酶,MTT(均购于Gibco公司);盐酸石蒜碱(Lycorine hydrochloride,简写LH,购于上海源叶生物有限公司,纯度≧98%);AO/PI(吖啶橙/碘化丙啶);PE-Annexin V凋亡检测试剂盒(购于美国BD公司);DMSO(二甲基亚砜,购于上海生工生物工程有限公司).
1.2 实验方法
1.2.1 细胞培养
Eca-109细胞株用含有10%的灭活胎牛血清(fetal bovine serum,FBS)100μg/mL青霉素、100μg/mL链霉素、pH7.4的RPMI-1640完全培养液于37℃、5%CO2培养箱中进行培养.
1.2.2 盐酸石蒜碱的配制
盐酸石蒜碱用二甲基亚砜(DMSO)配成100mmol/L的母液,-80℃储存备用.使用前,用含10%胎牛血清的RPMI-1640培养液配成不同浓度的工作液,DMSO的终浓度不超过0.1%.
1.2.3 MTT检测细胞活性
取对数生长期的细胞,制成细胞悬液,调整细胞密度为5×104个/mL,按每孔100μL接种于96孔板,放置于37℃、5%的CO2培养箱中过夜培养.待细胞贴壁生长后,加入不同浓度(0,0.3,0.6,1.2,2.4,4.8μmol/L)的盐酸石蒜碱.培养24和48h后,每孔加MTT(5mg/mL)10μL,放置于37℃、5%的CO2培养箱中培养4h,向每孔加200μL的DMSO,震荡10min,用酶标仪在492nm处测定OD值.按下式计算不同浓度的药品对细胞的生长活性的影响,细胞活性=(给药组平均OD值/对照组平均OD值)×100%.每组设8个平行孔.
1.2.4 AO/PI染色观测肿瘤细胞形态
在6孔板每孔内放置一块经消毒灭菌的玻片,接入Eca-109细胞(1×106/孔),放置于37℃、5%的CO2培养箱中培养.待玻片表面细胞数目增长至60%,取出6孔板,分别加入浓度为0μM,1.2μM,2.4μM,4.8μM的盐酸石蒜碱,放置于37℃、5%的CO2培养箱中培养24h,取出6孔板,用PBS清洗玻片,避光滴加30μL AO/PI(吖啶橙/碘化丙啶),反扣在载玻片上,迅速置于荧光显微镜下观察.
1.2.5 流式细胞仪测细胞凋亡
取对数生长期的细胞,制成细胞悬液,调整细胞密度为5×105个/mL,接种细胞到6孔板内,放入37℃,5%的CO2培养箱培养过夜,待其长至80%无血清培养18h使细胞同步化.取出6孔板,放在超净工作台上,吸尽培养液,依次加人预先配制好的浓度分别为0,1.2,2.4,4.8μmol/L的盐酸石蒜碱溶液2mL于准备处理的细胞中,培养24h后,收集细胞及其上清液,用凋亡试剂盒进行处理,并进行流式检测.
2 实验结果
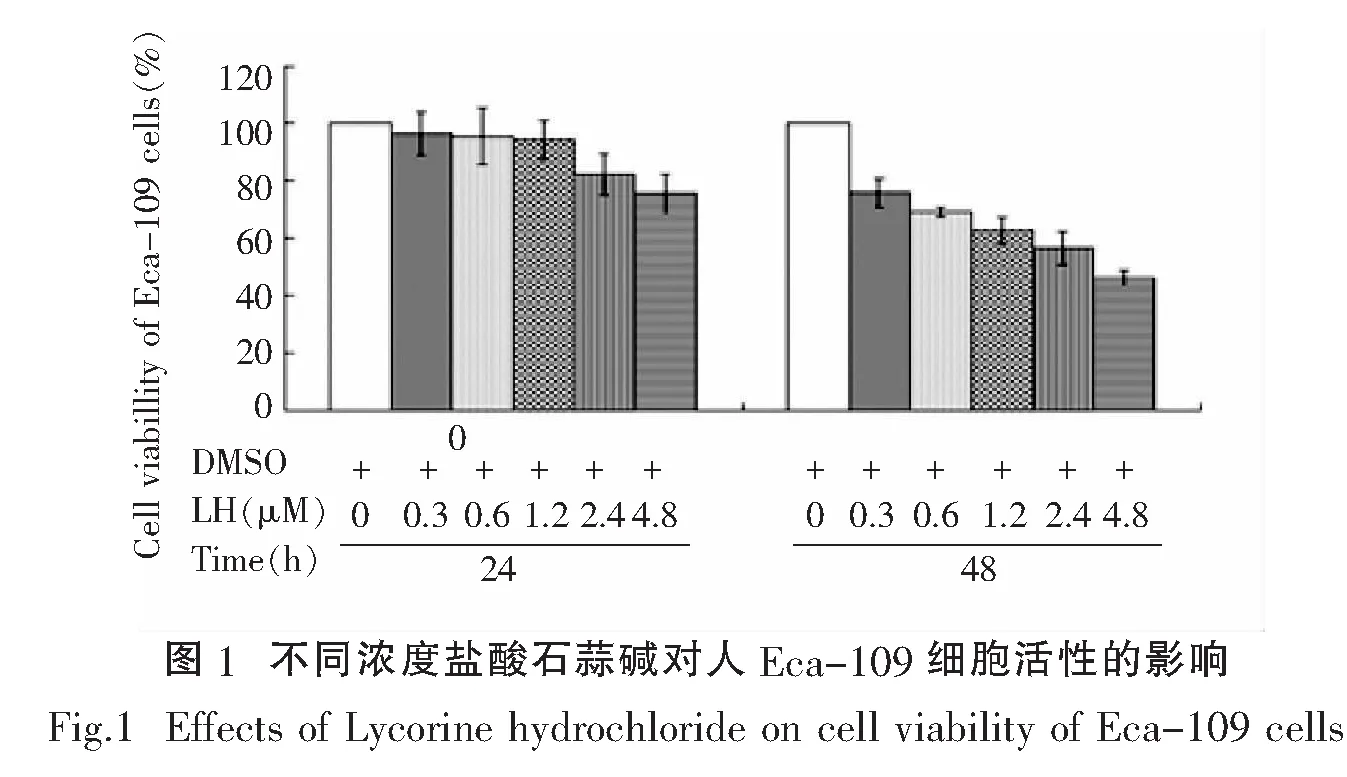
2.1 盐酸石蒜碱对Eca-109细胞生长的影响
我们用梯度浓度(0,0.3,0.6,1.2,2.4,4.8μmol/L)的盐酸石蒜碱处理Eca-109细胞24h和48h,然后通过MTT实验检测细胞活性,结果显示,盐酸石蒜碱浓度越高,细胞活性越低.并且经不同浓度的盐酸石蒜碱处理48h后,细胞活性都明显低于24h的处理结果,见图1.由此可见,Eca-109细胞活性的抑制与所加入的盐酸石蒜碱(LH)呈剂量与时间依赖性关系.
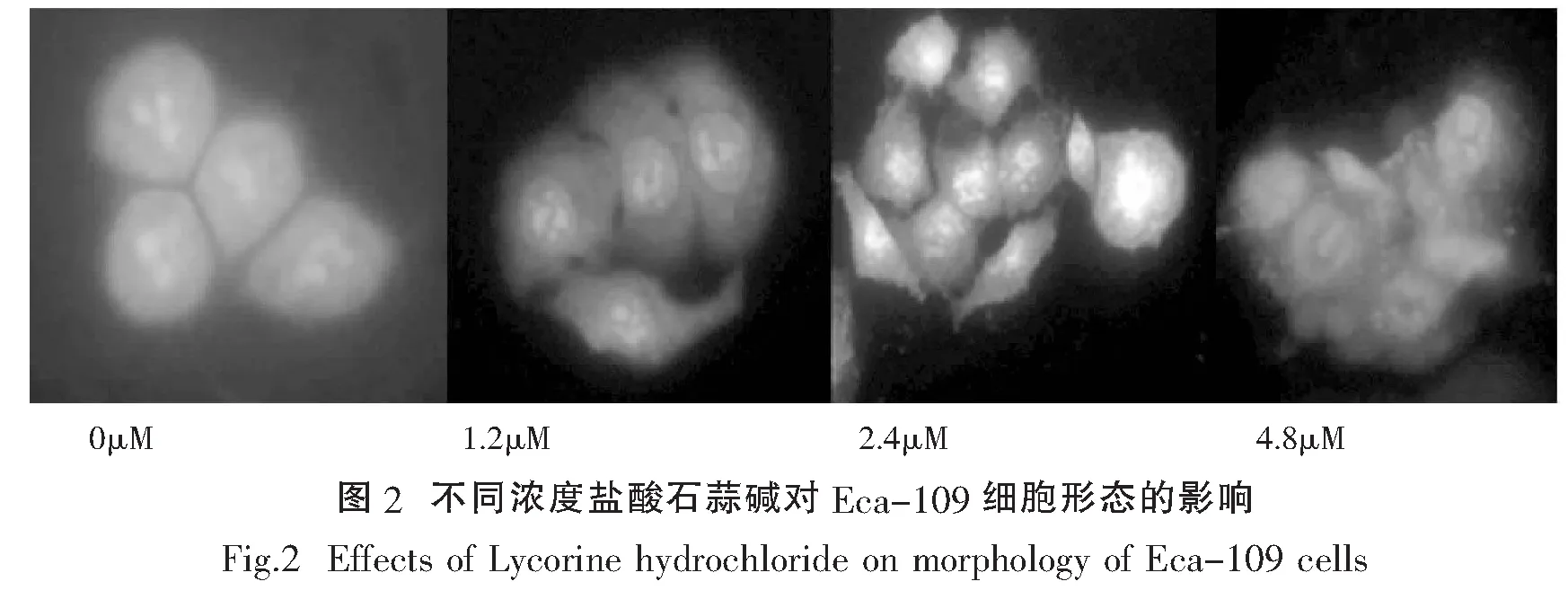
2.2 盐酸石蒜碱对Eca-109细胞形态的影响
经不同浓度的盐酸石蒜碱处理Eca-109细胞24h后,用AO/PI(吖啶橙/碘化丙啶)染色,在荧光显微镜下观察,可以明显看到细胞不同的凋亡状态,见图2.经1.25μM盐酸石蒜碱处理Eca-109细胞24h后,观察到大部分核染色质呈绿色,局部有发橘红色荧光,此时细胞处于早期凋亡.随着盐酸石蒜碱浓度增加,经过相同的处理时间,Eca-109细胞凋亡程度加深.经2.4μM盐酸石蒜碱处理Eca-109细胞24h后,观察到大部分核染色质发橘红色荧光,此时细胞处于中期凋亡.经4.8μM盐酸石蒜碱处理Eca-109细胞24h后,核染色质基本全为红色并呈固缩状或圆珠状,并扩散至整个细胞,此时细胞已达到晚期凋亡.
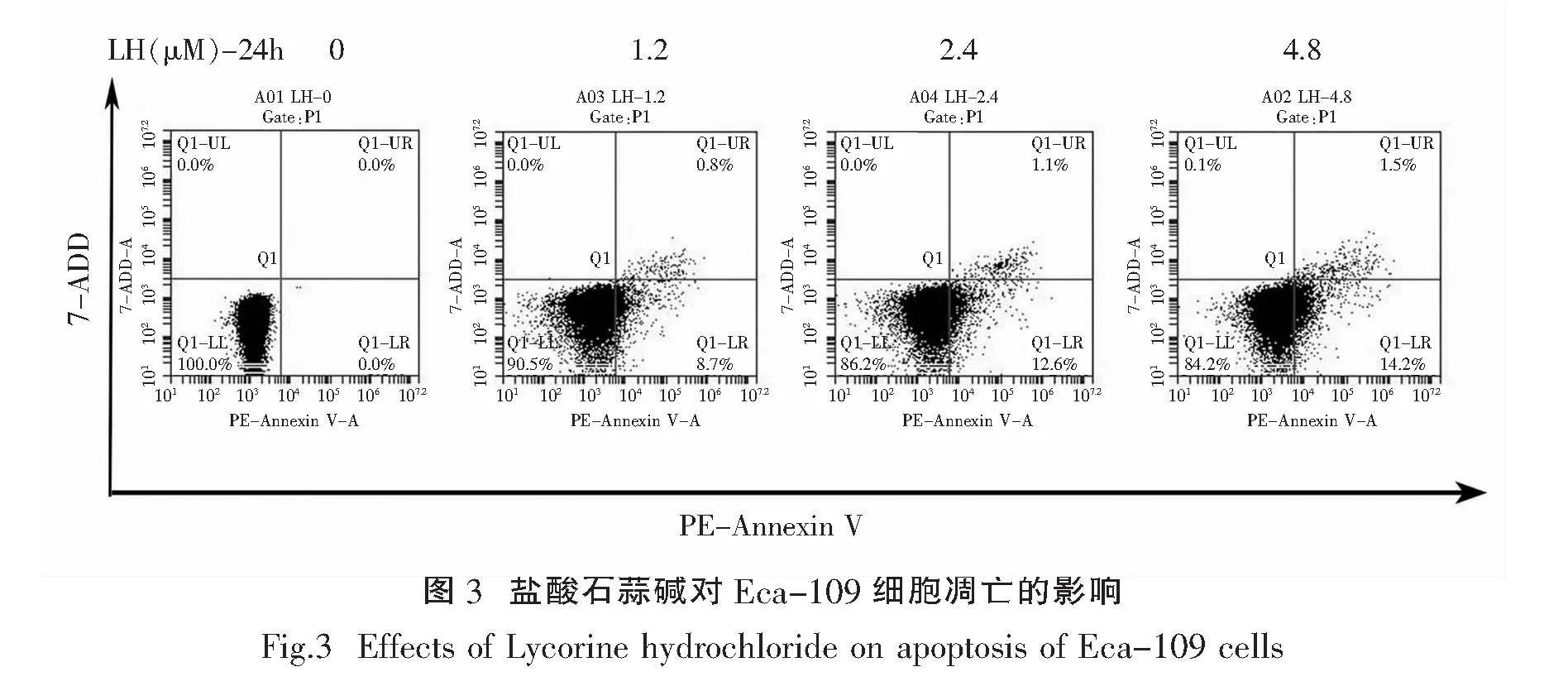
2.3 盐酸石蒜碱对Eca-109细胞凋亡的影响
通过细胞凋亡试剂盒和流式细胞仪检测不同浓度盐酸石蒜碱对Eca-109细胞凋亡的影响发现,经浓度为0,1.2,2.4,4.8μmol/L的盐酸石蒜碱处理Eca-109细胞24h,得出的凋亡率,见图3,Eca-109细胞的晚期凋亡细胞和死亡细胞随LH浓度的增大而增多.由此可见,盐酸石蒜碱能诱导Eca-109细胞凋亡.
3 讨 论
近年来研究证实盐酸石蒜碱(LH)能抑制多种癌细胞的生长,即盐酸石蒜碱具有广谱的抗肿瘤活性功能,并且毒性较低[10-12].此外,研究还发现盐酸石蒜碱对肿瘤细胞的影响远大于正常细胞[12-14].本实验我们选择食管癌细胞Eca-109,通过梯度浓度(0,0.3,0.6,1.2,2.4,4.8μM)的盐酸石蒜碱分别处理24h和48h.结果显示盐酸石蒜碱同样能抑制Eca-109细胞的生长和增殖,且呈时间剂量依赖性关系.经4.8μM盐酸石蒜碱处理Eca-109细胞48h后,细胞存活数目降低至50%.而Cao等发现盐酸石蒜碱抑制卵巢癌细胞Hey1B增殖过程中,盐酸石蒜碱的半致死浓度为1.2μM[10].这说明卵巢癌细胞Hey1B对盐酸石蒜碱更为敏感。此外,经梯度浓度(0,1.2,2.4,4.8μM)的盐酸石蒜碱处理Eca-109细胞24h,AO/PI荧光染色实验结果显示Eca-109细胞的凋亡程度随盐酸石蒜碱浓度增大而加深。我们发现经过5μM盐酸石蒜碱处理后,大部分Eca-109细胞被染成红色,说明细胞膜通透性几乎完全丧失,细胞核碎片化严重,并且出现细胞膨胀,这可能与细胞坏死相关。流式细胞实验结果显示,Eca-109细胞的凋亡率随盐酸石蒜碱浓度升高而增加.
我们的研究证实了盐酸石蒜碱能抑制Eca-109细胞增殖并诱导其凋亡.接下来我们将对盐酸石蒜碱抗肿瘤功效的机制进行深入研究.我们依然选择Eca-109细胞,从细胞周期的阻断靶点[7,8]和细胞凋亡途径中相关家族蛋白表达量[15,16]的改变两方面开展研究实验。盐酸石蒜碱抗肿瘤活性功能机制的探索已成为当下研究热点.研究成果将为今后相关抗肿瘤药物的开发提供重要理论依据.
[1] GUO PI,LI KUN.Trends in Esophageal Cancer Mortality in China during 1987-2009:Age,Period and Birth Cohort Analyzes[J].Cancer Epidemiol.2012,36:99-105.
[2] YUMI Y,TOSHIYUKO S,MORIOKA T T,et al.Joint Effects of Smoking and Alcohol Drinking on Esophageal Cancer Mortality in Japanese Men:Findings from the Japan Collaborative Cohort Study.Asian Pac[J].Cancer Prev.2009,15(2):1023-1029.
[3] CORTI L,SKARLATOS J,BOSO C,et al.Outcome of Patients Receiving Photodynamic Therapy for Early Esophageal Cancer[J].Radiat Oncol Biol Phys.2000,47:419-24.
[4] TEW WP,KELSEN DP,ILSON DH.Targeted Therapies for Esophageal Cancer[J].Oncologist.2005,10:590-601.
[5] ATASSI G,LEONCE S,RENARD P,et al.Novel Antitumor Artemisinin Derivatives Targeting G1 Phase of the Cell Cycle[J].Bioorg Med Chem Lett.2001,11:5-8.
[6] PEZZUTO JOHN.Plant-derived Anticancer Agents[J].Biochem.Pharm.1997,53:121-133.
[7] JING L,WEI X,HU L F,et al.Effects of Lycorine on HL-60 Cells Via Arresting Cell Cycle and Inducing Apoptosis[J].FEBS Letters.2004,578:245-250.
[8] YAN L,JING L,WEI R,et al.Apoptosis Induced by Lycorine in KM3 Cells is Associated with the G0/G1 Cell Cycle Arrest[J].Oncology Reports,2007,17:377-384.
[9] LIU R F,TU J,PAN J Y,ZHANG C,et al.Lycorine Hydrochloride Inhibits Metastatic Melanoma Cell-Dominant Vasculogenic Mimicry[J].Pigment Cell Melanoma Res.2012,25(5):630-638.
[10] CAO Z F,YU D,FU S L,et al.Lycorine Hydrochloride Selectively Inhibits Human Ovarian Cancer Cell Proliferation and Tumor Neovascularization with very Low Toxicity[J].Toxicology Letters.2013,218:174-185.
[11] INGRASSIA L,LEFRANC F,MATHIEU V,et al.Amaryllidaceae Isocarbostyril Alkaloids and their Derivatives as Promising Antitumor Agents[J].Transl.Oncol.2008:1,1-13.
[12] VAN G,ANDOLFI A,LALLEMAND B,et al.Amaryllidaceae Alkaloids belonging to Different Structural Subgroups Display Activity against Apoptosis-Resistant Cancer Cells[J].Nat.Prod.2010,73:1223-1227.
[13] LIU X S,JIANGJ,IAO X Y,et al.Lycorine Induces Apoptosis and Down-Regulation of Mcl-1 in Human Leukemia Cells[J].Cancer Lett.2009,274:16-24.
[14] LI Y,LIU J,TANG L J,et al.Apoptosis Induced by Lycorine in KM3 Cells is Associated with the G0/G1 Cell Cycle Arrest[J].Oncology Reports.2007,17:377-384.
[15] TSUJIMOTO YOSHIHIDE.Bcl-2 Family:Life-or-Death Switch[J].FEBS Lett.2000,466:6-10.
[16] JAMES M,JERALD J,JAUME B,et al.Structure-Activity Studies on the Lycorine Pharmacophore:A Potent Inducer of Apoptosis in human Leukemia Cells[J].Phytochemistry.2009,70:913-919.
Effects of Lycorine Hydrochloride on Eca-109 Cells via Inhiting Prolife-raion and Inducing Apoptosis
PENG Cong,XU Jia,WU Chun-lian
(College of Life Science,China West Normal University,Nanchong,637009,China)
Studies in recent years have shown lycorine or lycorine hydrochloride(LH),a kind of alkaloid extracted from Amaryllidaceae possesses extensive antitumor activities. In this study,we designed MTT assay to measure the survival rate of Eca-109 cells treated by lycorine hydrochloride(LH) in gradient concentration.By AO/PI(acridine orange/propidium iodide) double staining,we observed morphological apoptotic characteristics of Eca-109 cells treated by lycorine hydrochloride(LH).We carried out analysis of apoptotic cells by flow cytometry.The results showed that LH inhibited Eca-109 cells proliferation in a time and dose-dependent manner,and the amount of late apoptotic cells and necrotic cells increased with the increasing concentration of LH.Thus LH can inhibit proliferation of Eca-109 cells and induce apoptosis.
lycorine hydrochloride(LH);Eca-109 cells;cell viability;cell apoptosis
1673-5072(2015)01-0007-05
2014-09-10
四川省教育厅重大培育项目(13CZ0029),三峡库区生态环境与生物资源省部共建重点实验室开放课题基金项目(SKL-2011-05),中国博士后基金(2013M540391)
彭 聪(1988-),男,湖北省潜江人,西华师范大学硕士研究生,主要从事细胞学与天然抗肿瘤活性成分的研究.
伍春莲(1976-),女,四川彭州人,西华师范大学生命科学学院副教授,博士,主要从事细胞和分子生物学的研究和教学.
R285
B
