贡嘎山东坡典型植被类型土壤动物群落特征
2015-03-13吴鹏飞
李 萌, 吴鹏飞, 王 永
西南民族大学生命科学与技术学院, 成都 610041
贡嘎山东坡典型植被类型土壤动物群落特征
李萌, 吴鹏飞*, 王永
西南民族大学生命科学与技术学院, 成都610041
为了掌握贡嘎山垂直植被带间土壤动物群落结构及多样性,2012 年5 月至10 月间对贡嘎山东坡的常绿阔叶林、落叶阔叶林、针阔混交林和暗针叶林4 种典型植被土壤动物群落进行了调查。共捕获土壤动物347 只,隶属于10 纲29 目68 类,其中山蛩属(Spirobolus)为优势类群。土壤动物的群落密度、生物量以及多样性呈常绿阔叶林>落叶阔叶林>针阔混交林>暗针叶林趋势,其中密度、类群丰富度和Shannon-Wiener指数的变化具有显著差异(P<0.05);落叶阔叶林和针阔混交林间的土壤动物群落结构差异明显,其他植被类型间的差异性受季节影响。从各功能群结构来看,腐食性和杂食性土壤动物占主要地位;各功能群的生物量均以常绿阔叶林和落叶阔叶林较高,针阔混交林和暗针叶林较低,而相对生物量的变化趋势各不相同,仅有腐食性功能群的生物量及植食性功能群的相对生物量在各垂直植被带间有显著差异(P<0.05)。群落密度、生物量、类群丰富度、Shannon-Wiener指数以及腐食性和捕食性功能群的生物量与土壤温度呈显著相关(P<0.05)。研究结果表明:贡嘎山东坡土壤动物的群落组成、多样性及功能群结构在各典型植被类型间有明显差异,土壤温度是影响土壤动物垂直分布格局的主要环境因子。
垂直植被带; 土壤动物; 多样性; 功能群; 贡嘎山
土壤动物在地下生态系统中分布极广,其生物量也很可观[1]。由于生态系统地下与地上部分紧密相关,在自上而下的调控过程中,地上植被的改变也会显著影响土壤动物群落的分布[2- 4]。随着海拔梯度的变化,气候因子及植被类型分布均会发生变化,从而对土壤动物群落结构和多样性造成影响[5]。目前,已有关于土壤动物群落沿海拔梯度变化的研究[6- 8],但多数研究区域海拔较低,而且变化幅度较小,各海拔梯度上的植被类型差别较小[9- 11],研究结果只能反映低海拔条件下土壤动物群落的垂直分布特点。当海拔梯度变化较大时,植被类型也必然会发生变化,但目前关于不同垂直植被带谱下土壤动物群落的研究较少[12]。
贡嘎山位于青藏高原东缘,主峰海拔7556 m,被誉为“蜀山之王”。其东坡30 km水平距离内形成了6400 m的垂直落差,造就了多种典型的垂直植被带谱。本文对贡嘎山东坡4 个不同植被类型的土壤动物群落进行调查,主要研究目标:(1)查明贡嘎山东坡土壤动物群落的组成结构;(2)阐明土壤动物群落多样性及功能群在不同垂直植被带间的变化趋势。
1 研究区概况与研究方法
1.1研究区概况
贡嘎山(101°30′—102°15′ E,29°20′—30°20′ N)位于青藏高原东缘,主峰海拔7556 m,受东南季风的影响,气候温暖潮湿。年均气温4.3 ℃,最冷月1 月和最热月7 月的平均气温分别为-4.3 ℃和11.9 ℃。年均降水量约1900 mm,主要集中在6—12月;年蒸发量小于300 mm。
贡嘎山海拔每升高100 m,气温降低0.67 ℃,降雨量增加67.5 mm。随着海拔上升水热因子等条件的改变,贡嘎山的植被分布形成其独特的垂直地带性,从低海拔到高海拔依次分布次生阔叶林、常绿阔叶林、落叶阔叶林、针阔混交林、暗针叶林、亚高山灌丛及亚高山草甸。本研究选择其中的常绿阔叶林(EBF)、落叶阔叶林(DBF)、针阔混交林(CBF)以及暗针叶林(DCF)4种典型的植被类型作为样地,其基本情况见表1。
1.2研究方法
2012 年5、7和10 月,在每个观测样地中各选取6 个50 cm × 50 cm 样方,各样方间距5 m左右,采用手拣法收集0—15 cm土层的土壤动物,用5%的福尔马林溶液现场固定保存,带回实验室。由于分类的限制,以所鉴定到的目、科或属进行分类[13]。土壤动物营养功能群依据土壤动物食性进行划分[10,14- 15]。采用土壤动物的干重作为各功能群的生物量,其占所在样方总生物量的比例为相对生物量。在样地内土层10 cm左右埋设温度传感器(U22- 001,HOBO Water Temp Pro v2)连续监测土壤温度,4 h记录1 次数据,取采样所在3 个月温度数据的平均值为该样地的土壤温度;采用烘干法获得土壤含水率,取3 次所得18 个含水率的平均值作为该样地的土壤湿度。

表1 样地基本概况Table 1 Basic information of the study plots
同一列中不同上标字母表示差异显著(P<0.01)
1.3数据分析
类群数量等级划分个体数量占总捕获量10%以上者为优势类群;1%—10%者为常见类群;不足1%者为稀有类群[16]。
群落多样性采用类群数代表丰富度Richness,另外计算群落的Shannon-Wiener多样性指数H′,Pielou均匀度指数E以及Simpson优势度指数C。各指数的计算公式如下:

式中,S为类群数,Pi为第i种类群个体数在群落总个体数中所占的比例。
采用Repeated measures ANOVA分析不同植被类型之间的差异显著性。LSD 法(方差齐性)和Tamhane 法(方差不齐)进行多重比较。对不服从正态分布数据进行log(X+1)转换,如果仍不服从正态分布,则采用Kruskal-Wallis Test (H) 进行非参数检验,获得显著性后再用Mann-Whitney U进行多重比较。采用Pearson相关系数和Two-tailed显著性检验对土壤动物群落与土壤温湿度的关系进行双变量相关分析(Bivariate correlation analysis)。主成分分析(Principal Component Analysis,PCA)对不同植被带下的土壤动物群落以目为单位进行排序。以上分析及作图采用Microsoft Excel 2010、CANOCO 4.5、以及SPSS 18.0完成。
2 结果与分析
2.1土壤动物群落组成
在贡嘎山东坡共捕获土壤动物347 只,隶属于10 纲29 目58 科68 类(附表1)。其中,山蛩属(Spirobolus)为优势类群,占总捕获量的24.21%。单向蚓属(Haplotaxis)、金龟甲科(Scarabaeidae)、狂蛇马陆属(Orsiboe)及正蚓属(Lumbricus)等为常见类群,分别占7.49%、5.76%、5.19%和4.90%等,共占总捕获量的57.64%,与优势类群一起构成贡嘎山土壤动物的主体。稀有类群为路舍蚁属(Tetramorium)、缩头甲科(Chelonariidae)及鹬虻科(Rhagionidae)等,共占18.16%。
土壤动物各功能群中,腐食性、杂食性、植食性和捕食性功能群的生物量分别为17.31、4.33、2.49 g和2.40 g,各占总生物量的65.25%、16.34%、9.38%和9.04%。
2.2土壤动物群落分布
从常绿阔叶林向暗针叶林演替过程中,土壤动物的群落密度和生物量在总体上均呈下降趋势(图1), Repeated measures ANOVA结果(表2)表明不同植被带间的土壤动物群落密度有显著差异(F=4.69,P<0.05),其中落叶阔叶林显著高于针阔混交林和暗针叶林(图1),而各植被带间的生物量差异不显著(F=2.62,P> 0.05)。
土壤动物群落密度和生物量的季节变化趋势在不同气候带间存在一定差异,但仅有暗针叶林的密度和生物量的季节差异显著(密度F=19.23,P<0.01;生物量H=11.656,P<0.01),表明不同植被带土壤动物群落对季节变化的响应不同,暗针叶林土壤动物群落对季节变化响应较敏感。

图1 土壤动物密度和生物量的变化(平均值±标准误)Fig.1 Dynamics of soil faunal densities and biomass(Mean ± SE)

表2 土壤动物群落密度、生物量重复测量方差分析Table 2 Repeated measures ANOVA on the density and biomass of soil fauna
从常绿阔叶林向暗针叶林过渡中,腐食性功能群的生物量呈显著下降趋势(图2),其中,常绿阔叶林显著高于针阔混交林和暗针叶林(F=4.70,P<0.05);其他功能群的生物量在不同植被带之间无明显变化趋势(P> 0.05)。在4个主要功能群中,仅暗针叶林的腐食性功能群(H=8.35,P<0.05)和落叶阔叶林的植食性功能群(H=11.91,P<0.01)有显著的季节变化,其他植被类型的各功能群均无显著季节差异(P> 0.05)。
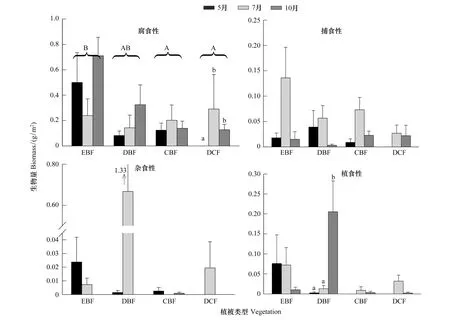
图2 不同植被带各功能类群的生物量(平均值±标准误)Fig.2 Biomass of each functional group of soil fauna under different vegetation types(Mean±SE)
此外,从常绿阔叶林向暗针叶林过渡中,腐食性功能群的相对生物量呈波动性下降,捕食性功能群呈逐渐增加趋势,植食性和杂食性功能群无明显变化趋势(图3)。统计分析结果表明,仅植食性的相对生物量在落叶阔叶林与针阔混交林间有显著差异(F=3.16,P< 0.05)。相对生物量的变化动态表明,在阔叶林向针叶林演替过程中,腐食性功能群在群落中的地位逐渐下降,捕食性功能群的地位逐渐提高,植食性和杂食性功能群呈波动性变化,但植食性受垂直植被带变化影响最显著。

图3 不同植被带各功能类群的相对生物量(平均值±标准误)Fig.3 Biomass percentage of each functional group at different climatic zone (Mean ± SE)
2.3土壤动物群落多样性
不同植被带的土壤动物群落类群丰富度指数和Shannon-Wiener指数从常绿阔叶林向暗针叶林过渡中均逐渐下降(图4),并具有显著差异性(丰富度F=3.26,P<0.05;Shannon-Wiener指数F=3.12,P<0.05)(表3),但均匀度和优势度指数无明显变化趋势(P> 0.05)(表3)。多样性指数的变化动态表明植被类型变化可以影响土壤动物的多样性,但不影响各类群间的竞争排斥强度。

图4 土壤动物群落多样性指数(平均值±标准误)Fig.4 Diversity of soil fauna communities (Mean ± SE)
不同植被类型间多样性指数的季节变化趋势有所不同(图4),One-way ANOVA结果表明类群丰富度指数在常绿阔叶林(F=3.81,P<0.05)和暗针叶林(F=8.99,P<0.01)有显著的季节差异,Shannon-Wiener指数仅在暗针叶林有显著差异(F=3.67,P<0.05),优势度指数在落叶阔叶林(F=9.69,P<0.01)和暗针叶林(F=5.44,P<0.05)有显著的季节差异,而均匀度指数在各植被带均无显著季节差异(P> 0.05)。表明季节变化对暗针叶林土壤动物群落多样性的影响最大,对针阔混交林的影响最弱。

表3 土壤动物群落密度、生物量及多样性的重复测量方差分析Table 3 Repeated measures ANOVA on density, biomass and diversity of soil fauna
2.4环境因子对土壤动物群落分布的影响
Pearson相关分析(表4)表明,Shannon-Wiener指数、类群丰富度指数和密度仅与土壤温度有显著正相关;群落的总生物量及腐食性和捕食性的生物量也与土壤温度呈显著正相关,而前两者还与海拔呈显著负相关。土壤湿度与土壤动物群落群落的各项指数均无显著相关性。相关分析结果表明在土壤动物群落的垂直分布受土壤温度影响较大,受海拔和土壤湿度的影响相对较小。
主成分分析(PCA)对各植被类型土壤动物群落的排序结果如图5。在3 个月份中,落叶阔叶林和针阔混交林均被排序轴PC 1和PC 2清晰地分开。5 月份的常绿阔叶林与落叶阔叶林、暗针叶林之间相互独立,7 月份的针阔混交林与暗针叶林相互独立,其余植被类型之间均有重叠,说明不同植被带间的土壤动物群落结构差异不明显,并受季节的影响。由图5还可知,影响PC 1排序轴的主要是山蛩目(Spirobolida)和鞘翅目幼虫(Coleoptera larvae),影响PC 2排序轴的主要为小蚓类(Microdrile oligochaetes)和大蚓类(Megadrile oligochaetes)。

表4 土壤动物群落与环境的相关分析Table 4 Pearson correlation analysis on the relationships between soil fauna and environmental factors
*P<0.05,**P<0.01

图5 土壤动物群落PCA排序图Fig.5 PCA ordination diagrams of soil fauna communities
3 讨论
3.1土壤动物群落与植被类型及海拔的关系
贡嘎山东坡各垂直植被带间的土壤动物群落结构存在较大差异。常绿阔叶林优势类群为单向蚓属,落叶阔叶林为山蛩属和金龟甲科,针阔混交林优势类群为山蛩属、华蚖属、正蚓属和食虫虻科,而暗针叶林则为狂蛇马陆属,其中单向蚓属与海拔呈显著负相关关系(r=0.44,P<0.05),狂蛇马陆属与海拔呈显著正相关(r=0.41,P<0.05)。另外,贡嘎山东坡土壤动物的主要功能群为腐食性土壤动物,其生物量由常绿阔叶林到暗针叶林逐渐减少,可能与其食物来源(腐殖质)有关。已有研究表明落叶树种凋落物的分解要快于常绿树种[17],被子植物的凋落物分解要快于裸子植物[18],说明植物群落类型的变化也可以影响腐殖质的形成。本研究中植物群落类型由落叶阔叶林逐渐过渡到针叶林,凋落物的分解速率和数量逐渐降低,因此使腐食性土壤动物的生物量逐渐降低。
垂直植被带随着海拔上升,土壤动物的群落密度、生物量、类群丰富度及Shannon-Wiener多样性指数均呈逐渐下降的趋势,与武夷山及百山祖的土壤动物群落类群数和个体数的变化趋势一致[6,8,19],但与米亚罗林区和高黎贡山土土壤动物的垂直变化有所不同[6,8,19]。米亚罗林区海拔中部为人工冷杉纯林,植物多样性较其他海拔低,其土壤动物的个体数和类群数也低于其他海拔[6,8,19]。高黎贡山的中山地带植被最茂密,因此土壤动物最丰富[6,8,19]。由此可知,土壤动物群落沿海拔高度上的变化与各海拔的植被分布紧密相关。
3.2土壤动物群落与土壤温湿度的关系
土壤动物群落密度、生物量、类群丰富度及Shannon-Wiener多样性指数与温度有显著的正相关关系,与土壤湿度的相关性均不显著。其原因可能是贡嘎山东坡各海拔梯度的降水量(年降水量在1223—2003 mm之间)相对丰富[20],土壤水分不足以限制土壤动物的生存和分布。因此在贡嘎山东坡,影响垂直植被带间土壤动物群落变化的主要气候因子是土壤温度。其他研究[6,8,19]也发现,土壤动物群落的密度和多样性随海拔的增加呈下降趋势,而温度是导致这一变化的直接或间接原因。可见在垂直海拔格局中,温度是决定土壤动物群落分布的主要环境因子。
腐食性功能群的生物量及相对生物量在由常绿阔叶林向暗针叶林过渡中逐渐降低,并与土壤温度显著正相关。腐食性动物主要取食降解后的动植物残体,温度增加有助于土壤中凋落物的降解[21]。随着海拔升高,气温降低,凋落物的分解速率快速下降[22- 23]。贡嘎山东坡的常绿阔叶林海拔低气温高,凋落物高速降解能为腐食性土壤动物提供充足的食物来源。此外,降雨量也会影响凋落物的分解速率[22,24],从而影响到腐殖质的形成。在贡嘎山东坡暗针叶林的降雨量最高[20],也可能降低凋落物的分解效率,继而减少腐食性功能群的生物量。此外,贡嘎山暗针叶林的凋落物氮含量低于阔叶林[25],而含氮量高的凋落物分解速率高于含氮量低的[26],使其降解形成腐殖质的速度要低于阔叶林。因此,常绿阔叶林中腐食性功能群的生物量显著高于针阔混交林和暗针叶林。
由常绿阔叶林向暗针叶林过渡中,捕食性功能群的生物量逐渐降低,但相对生物量则逐渐升高。在地下食物链中,捕食性土壤动物处于营养级的顶端,其群落动态与其捕食对象紧密相关[27]。捕食性与腐食性功能群相对生物量的变化趋势相反,两者呈显著负相关关系(r=0.34,P<0.01)。在我国东北的大、小兴安岭森林群落中也存在相似的情况[28- 29]。其原因可能是,常绿阔叶林温度较高,腐食性功能群的食物资源丰富,而向暗针叶林过渡中,温度逐渐降低,腐食性动物的食物资源减少,而捕食性动物的食物资源增加,从而使捕食性动物的相对生物量逐渐增加。这也意味着由常绿阔叶林向暗针叶林过渡中,地下食物网对能量的利用效率逐渐提高。
3.3不同植被类型下土壤动物群落季节差异
土壤动物群落的季节动态在不同植被类型中呈现出不同的变化趋势,其中针阔混交林的季节差异最小,暗针叶林的季节差异最大,其土壤动物群落密度、生物量、类群数、Shannon-Wiener指数及Simpson指数均有显著的季节差异。其原因是暗针叶林所处的海拔较高,5 月份地面仍有少量冰雪,属于于冬季;而7、10 月份温度则分别相当于夏秋季,群落环境差异较大,因此5 月份的土壤动物群落及多样性指数与7、10 两月之间的差异较显著。而其他几种植被类型所处的海拔较低,5 月温度已经较高,相当于春季,并且群落环境与7、10 月间差异较小,因此不同月份间土壤动物群落差异较小。
致谢:张洪芝、何先进、鄂鹏宇参加部分野外采样工作,中国科学院华南植物园侯恩庆老师对写作给予帮助,特此致谢。
[1]尹文英. 中国土壤动物. 北京: 科学出版社, 2000.
[2]Yin X Q, Song B, Dong W H, Xin W D, Wang Y Q. A review on the eco-geography of soil fauna in China. Journal of Geographical Sciences, 2010, 20(3): 333- 346.
[3]LaossiK R, Barot B, Carvalho D, Desjardins T, Lavelle P, Martins M, Mitja D, Rendeiro A C, Roussin G, Sarazin M, Velasquez E, Grimaldi M. Effects of plant diversity on plant biomass production and soil macrofauna in Amazonian pastures. Pedobiologia, 2008, 51(5/6): 397- 407.
[4]Wardle D A, Bardgett R D, Klironomos J N, Setälä H, van der Putten W H, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[5]Briones M J I, Philip I, Trevor G P. Effects of climate change on soil fauna; responses of enchytraeids, Diptera larvae and tardigrades in a transplant experiment. Applied Soil Ecology, 1997, 6(2): 117- 134.
[6]王邵军, 阮宏华, 汪家社, 徐自坤, 吴焰玉. 武夷山典型植被类型土壤动物群落的结构特征. 生态学报, 2010, 30(19): 5174- 5184.
[7]Wu P F, Liu S R, Liu X L. Composition and spatio-temporal changes of soil macroinvertebrates in the biodiversity hotspot of northern Hengduanshan Mountains, China. Plant and Soil, 2012, 357(1/2): 321- 338.
[8]严莹, 李恺, 方燕. 浙江百山祖自然保护区不同海拔土壤动物群落结构及季节动态. 生态学杂志, 2010, 29(9): 1754- 1761.
[9]刘继亮, 殷秀琴, 邱丽丽. 左家自然保护区大型土壤动物与土壤因子关系研究. 土壤学报, 2008, 45(1): 130- 136.
[10]林英华, 孙家宝, 刘海良, 张夫道, 孙龙, 金森. 黑龙江帽儿山土壤动物群落组成与多样性分析. 林业科学, 2006, 42(4): 71- 77.
[11]陈小鸟, 由文辉, 易兰. 浙江天童太白山不同海拔土壤动物的群落结构. 生态学杂志, 2009, 28(2): 270- 276.
[12]肖能文, 刘向辉, 戈峰, 欧阳志云. 高黎贡山自然保护区大型土壤动物群落特征. 生态学报, 2009, 29(7): 3576- 3584.
[13]尹文英. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998.
[14]Doblas-Miranda E, Sánchez-PiF, González-Megías A. Soil macroinvertebrate fauna of a Mediterranean arid system: Composition and temporal changes in the assemblage. Soil Biology and Biochemistry, 2007, 39(8): 1916- 1925.
[15]Yang X D, Chen J. Plant litter quality influences the contribution of soil fauna to litter decomposition in humid tropical forests, southwestern China. Soil Biology and Biochemistry, 2009, 41(5): 910- 918.
[16]李志伟, 童晓立, 张维球, 谢国忠, 戴克元. 广东石门台自然保护区森林土壤无脊椎动物群落多样性. 华南农业大学学报: 自然科学版, 2004, 25(1): 80- 84.
[17]Cornelissen J H C. An experimental comparison of leaf decomposition rates in a wide range of temperate plant species and types. Journal of Ecology, 1996, 84(4): 573- 582.
[18]Monk C D, Gabrielson F C. Effects of shade, litter and root competition on old-field vegetation in South Carolina. Bulletin of the Torrey Botanical Club, 1989, 112(4): 383- 392.
[19]赵世魁, 刘贤谦. 关帝山华北落叶松天然林和人工林土壤动物的群落多样性. 林业科学, 2007, 43(6): 105- 110.
[20]王琳, 欧阳华, 周才平, 张锋, 白军红, 彭奎. 贡嘎山东坡土壤有机质及氮素分布特征. 地理学报, 2004, 59(6): 1012- 1019.
[21]He X B, Song F Q, Zhang P, Lin Y H, Tian X J, Ren L L, Chen C, Li X N, Tan H X. Variation in litter decomposition-temperature relationships between coniferous and broadleaf forests in Huangshan Mountain, China. Journal of Forestry Research, 2007, 18(4): 291- 297.
[22]Vitousek P M, Turner D R, Parton W J, Sanford R L. Litter decomposition on the Mauna Loa environmental matrix, Hawai′i: patterns, mechanisms, and models. Ecology, 1994, 75(2): 418- 429.
[23]Heaney A, Proctor J. Chemical elements in litter on Volcán Barva, Costa Rica // Proctor J, ed. Mineral Nutrients in Tropical Forest and Savanna Ecosystems. Oxford: Blackwell Scientific, 1989: 225- 271.
[24]Anderson J M, Swift M J. Decomposition in tropical forests // Sutton S L, Whitmore T C, Chadwick A C, eds. Tropical Rain Forest: Ecology and Management. Oxford, UK: Blackwell Scientific, 1983: 287- 309.
[25]罗辑, 程根伟, 陈斌如, 李伟. 贡嘎山垂直带林分凋落物及其理化特征. 山地学报, 2003, 21(3): 287- 292.
[26]Flanagan P W, van Cleve K. Nutrient cycling in relation to decomposition and organic matter quality in taiga ecosystems. Canadian Journal of Forest Research, 1983, 13(5): 795- 817.
[27]Walter D E, Hunt H W, Elliot E T. The influence of prey type on the development and reproduction of some predatory soil mites. Pedobiologia, 1987, 30: 419- 424.
[28]张雪萍, 侯威岭, 陈鹏. 东北森林土壤动物同功能种团及其生态分布. 应用与环境生物学报, 2001, 7(4): 370- 374.
[29]黄丽荣, 张雪萍. 大兴安岭北部森林生态系统土壤动物组成与多样性分析. 土壤通报, 2008, 39(5): 1017- 1022.
Vertical distributions of soil fauna communities on the eastern slope of Gongga Mountain
LI Meng, WU Pengfei*, WANG Yong
CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China
Gongga Mountain, the third highest mountain in China with an altitude up to 7556 m, is located in the middle of Hengduan Mountains. In general, annual temperature is around 4 ℃ and annual precipitation is around 1900 mm in this region. Moreover, with every 100 m increasing in altitude, temperature decreases about 0.67 ℃ and precipitation increases about 68 mm. The changes in temperature, precipitation and other environmental factors, with elevation might have shaped the varied vegetation types at different altitudes in Gongga Mountain. Temperature and precipitation are also usually considered as the determinant environmental factors for the diversity and abundance of soil fauna. At present, few studies on such vertical distributions of soil fauna were reported, especially in China. Therefore, this study aimed to: (1) examine whether soil fauna communities shift along the elevation gradient in the Gongga Mountain; if occur, (2) whether the shift(s) is (are) due to the changes in temperature and/or precipitation along the elevation gradient. In this study, four vegetation types, including evergreen broadleaved forest (EBF, at an altitude of 1930 m), deciduous broadleaved forest (DBF, 2343 m), coniferous and broad-leaved mixed forest (CBF, 2780 m) and dark coniferous forest (DCF, 3160 m), were selected along the altitude gradient on the eastern slope of Gongga Mountain. Soil fauna in these forests were investigated in spring (May), summer (July) and autumn (October) in 2012. In total, 347 individuals of soil fauna, belonging to 10 classes, 29 orders and 68 phyla, were collected. Averaged density of soil fauna community was 19.28 ind./m2in the study forests, withSpirobolusas the dominant genus (24.21% of the total individuals) and detritivore and omnivore fauna as the major functional groups (64.26% and 16.28% of the total community biomass, respectively). Both the abundance and diversity of soil fauna showed a trend of decrease with increasing altitude, with significant differences in the density, richness and Shannon-Wiener index of the soil fauna community. The biomass of detritivore and omnivore fauna also revealed a trend of decrease with increasing altitude, with significant difference in the biomass of detritivore fauna. The abundance and diversity of soil fauna differed significantly between the DBF and the CBF throughout the three sampling times. Pearson correlation analysis showed that soil temperature was significantly and positively correlated with the Shannon-Wiener index, richness, biomass and density of the soil fauna communities, and the same results were also founded to the biomass of herbivore and omnivore fauna. In contrast, soil moisture was not significantly correlated to any selected parameter of soil fauna. Based on these results, we concluded that soil fauna community significantly shifted along the altitude gradient on the eastern slope of Gongga Mountain and the shifts were mainly resulted from the change in soil temperature with elevation.
Vertical vegetation zones; Soil fauna; Diversity; Functional group; Gongga Mountain

附表1 贡嘎山大型土壤动物群落组成和结构Appendix table 1 Taxonomic composition and community structure of soil macrofunna on Gongga Mountain
D: 腐食性Detritivore;P: 捕食性Predator;O: 杂食性Omnivore;H: 植食性Herbivore; ***: 优势类群;**: 常见类群,*: 稀有类群
国家科技支撑计划项目(2012BAD13B06, 2011BAK12B004); 国家自然科学基金项目(41371270, 40801092); 四川省青年基金项目(2012JQ0030); 四川省教育厅创新团队项目(14TD0049)
2013- 05- 31;
日期:2014- 05- 08
10.5846/stxb201305311258
*通讯作者Corresponding author.E-mail: wupf@ swun.cn
李萌, 吴鹏飞, 王永.贡嘎山东坡典型植被类型土壤动物群落特征.生态学报,2015,35(7):2295- 2307.
Li M, Wu P F, Wang Y.Vertical distributions of soil fauna communities on the eastern slope of Gongga Mountain.Acta Ecologica Sinica,2015,35(7):2295- 2307.
