油田硫酸盐还原菌的分离鉴定及生长特性研究
2015-03-13谷国栋
陈 颖,谷国栋,朱 葛,莫 瑞,何 晗
(东北石油大学化学化工学院,黑龙江大庆163318)
硫酸盐还原菌(简称SRB)广泛存在于土壤、海水、河水、油气井及地下管道等缺氧的环境中,是一种厌氧型的微生物[1],在油田集输系统中,SRB 是导致腐蚀的主要因素之一,同时也是引起油层堵塞和油田酸化的主要原因[2]。SRB 将还原为S2-,与集输管道上的铁形成硫化物,进而使设备腐蚀,SRB腐蚀的产物主要是FeO 和Fe(OH)2,腐蚀产物又被油污包裹使管线堵塞,致使注水量下降,影响原油产量。SRB 在集输系统中生长繁殖而产生的大量腐蚀产物存在于油水界面,逐渐累积,在油田脱水系统中形成过滤层,导致电脱水器运行不稳定、跳闸或者击穿。硫酸盐还原菌还原所产生的硫化氢不仅污染环境,而且影响工人的身体健康,石油工业中的硫化物污染问题和微生物腐蚀问题已经引起了高度重视[3],研究油田SRB 的生长特性对油田防腐和H2S 的抑制都有重要的意义。本文研究了不同温度、pH 值、盐度、Fe3+及硝酸盐等因素对SRB 还原硫酸盐的影响。
1 材料与方法
1.1 菌种来源
实验菌种取自某油田注水系统水样。
1.2 培养基的选定
硫酸盐还原菌培养基:CaCl20.1g,FeSO42.5g,Na2SO41.0g,NH4Cl 1.0g,K2HPO40.5g,(NH4)2SO40.5g,乳酸2.5mL,L-半胱氨酸0.6g,0.1%刃天青1mL,酵母膏1.0g;
硫酸盐还原菌固体培养基:加入2%琼脂。
1.3 硫酸盐还原菌的分离纯化
在150mL 三角瓶中接种2%的油田水样,加入液体富集培养基至充满状态,再加入少量石蜡进行密封,在30℃厌氧条件下培养。待培养基变黑且瓶口散发臭鸡蛋气味时,说明培养基中已存在大量的SRB,采用稀释涂布-叠皿夹层法进行菌种分离,5d 后,平皿上出现了黑色的球状菌落即为SRB,在液体培养基中接种挑取的单个菌落进行厌氧培养。反复进行稀释涂布-夹层厌氧培养-液体厌氧培养等数次,便可获得纯SRB 菌株,将其命名为G11。
1.4 分离菌株的16S rDNA 测序
离心收集菌体,按试剂盒(北京普博欣生物)说明提取DNA,使用PCR 扩增仪进行扩增,采用通用引物,16SrDNA序列引物27F:5'-AGAGTTTGATC-CT GGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACT T-3'。
PCR 反应体系(25μL):Taq 酶0.5μL,dNTPs 0.5μL(10 mmol·L-1),1.0μL DNA,10×PCR 缓冲液2.5μL,ddH2O19.5μL,两个引物1.0μL(10pmol·μL-1)。扩增程序[4]:94℃3min,94℃1min,56℃1min,72℃2min,循环30 次,再72℃10min,用1.0%琼脂糖检测PCR 扩增产物。
所测序列利用Blast 软件进行序列相似性分析,从GenBank 中选取同源序列,利用邻位连接法构建系统发育树(图1),并用Bootstrap 法分析树的可靠性,迭代100 次。将G11 基因序列和数据库中的16S rDNA 进行比较,结果显示G11 属于脱硫弧菌(Desulfovibrio),与Desulfovibrio vulgaris RCH1 ctg00052 同源性达到92%。
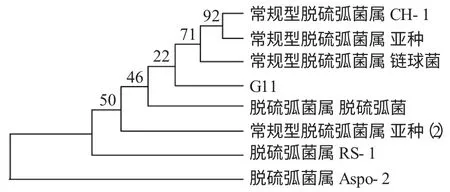
图1 以16S rDNA 为基础的菌珠G11 的系统发育树Fig.1 Phylogenetic analysis of strain G11 based on 16S rDNA
2 实验部分
培养基组成:KH2PO40.5g,NH4Cl 1.0g,CaCl2·2H2O 0.1g,Na2SO41.0g,MgSO4·7H2O 2.0g,乳酸钠(80%)3.5mL,酵母浸膏1.0g,FeSO4·7H2O 0.5g,抗坏血酸0.1g,半胱酸胺盐酸盐0.5g,蒸馏水1000mL。
试验菌种为G11 富集培养后菌液,经绝迹稀释法测定其SRB 浓度为1×103mL·L-1,采用间歇实验,在经过高压蒸汽灭菌锅灭菌的250mL 细口瓶中进行,细口瓶中加入菌液、培养液、硫酸盐等,用1mol·L-1NaOH 和1mol·L-1HCl 调节pH 值,定时取样测定分析的浓度,考察不同因素对SRB 的影响。
3 结果与讨论
3.1 温度对SRB 的影响
初始温度分别为5、10、20、30、40、50、60℃,250mL 细口瓶中加入180mL 培养基,注入10mL 菌液,调节pH 值为7,硫酸盐浓度调至为1g·L-1。不同温度对SRB 的影响见图2。
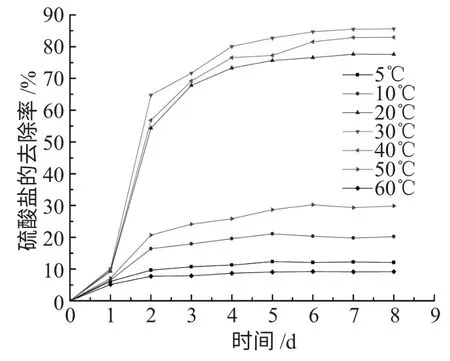
图2 初始温度对硫酸盐还原的影响Fig.2 Influence of initial temperature of sulfate reduction
由图2 可看出,温度为5℃和10℃时,SRB 还原硫酸盐受到抑制,其去除率仅为12.26%和20.19%,这是由于环境温度很低时,对SRB 的影响主要是影响了细胞中的蛋白质,因为低温能减弱蛋白质的斥水键强度,其立体结构会随之改变,导致蛋白质的功能及调控方式与常温时不同,因而影响SRB 正常的生理代谢[5]。随着温度的逐渐升高,蛋白质的合成及功能都恢复正常,SRB 细胞中的各种酶的活性逐渐恢复,从图中可以看出,当温度为20、30、40℃时,硫酸盐的去除率分别为77.57%、85.61%、82.93%,此温度范围适宜SRB 的生长,30℃为最佳。随着温度的继续升高,SRB 对硫酸盐的还原率明显下降,50℃和60℃时,硫酸盐去除率为29.85%和9.14%,说明高温抑制SRB 的生长,这是由于SRB 的生命活动主要是由细胞内的酶催化的,酶又是由蛋白质构成的,而蛋白质易发生热变性,所以高温导致蛋白质变质,SRB 的酶失活。马保国等人研究[6]SRB生长的最适温度为35℃,本实验结果与其较为相符。
3.2 pH 值对SRB 的影响
初始pH 值分别为3、4、5、6、7、8、9、10,250mL细口瓶中加入180mL 培养基,注入10mL 菌液,硫酸盐浓度调至为1g·L-1,在30℃下培养。不同pH 值对SRB 的影响见图3。

图3 初始pH 值对硫酸盐还原的影响Fig.3 Initial pH value on the influence of sulfate reduction
由图3 可看出,pH 值为4~9,SRB 还原硫酸盐能正常进行,趋势为先上升后下降,硫酸盐的去除率最高为pH为7 时的85.44%,而在pH值为3 和10 的情况下,硫酸盐的还原受到明显的抑制,去除率仅为16.28%和24.34%,说明强酸强碱的环境不适宜SRB 的生长。这是因为过酸过碱改变了核酸、蛋白质等生物大分子所带的电荷,影响了生物活性;同时过酸过碱也导致了细胞膜电荷发生变化,降低了SRB 对营养物质的吸收能力[7]。刘艳等人[8]证实7.0为SRB 的最佳生长pH 值,在pH 值为5~8 下都能较好的生长,本实验结果与之相符。
3.3 盐度对SRB 的影响
初始盐度分别为0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,250mL 细口瓶中加入180mL 培养基,注入10mL 菌液,调节pH 值为7,硫酸盐浓度调至为1g·L-1,在30℃下培养。不同NaCl 含量对SRB 的影响见图4。

图4 初始NaCl 含量对硫酸盐还原的影响Fig.4 The initial impact on sulfate reducing sodium chloride content
3.4 铁元素对SRB 的影响
加入的Fe0、Fe2+、Fe3+元素浓度为500mg·L-1,250mL 细口瓶中加入180mL 培养基,注入10mL 菌液,调节pH 值为7,硫酸盐浓度调至为1g·L-1,加入100mg·L-1的Na2S,在30℃下培养。不同价态铁元素对SRB 的影响见图5。

图5 铁元素对硫酸盐还原的影响Fig.5 The influence of iron for sulfate reduction
3.5 硝酸盐对SRB 的影响
250mL 细口瓶中加入180mL 培养基,注入10mL 原菌样,硫酸盐浓度调至为1g·L-1,调节S/N分别为5∶0、5∶1、5∶3、5∶5、5∶7,调节pH 值为7,在30℃下培养。S/N 对SRB 的影响见图6。
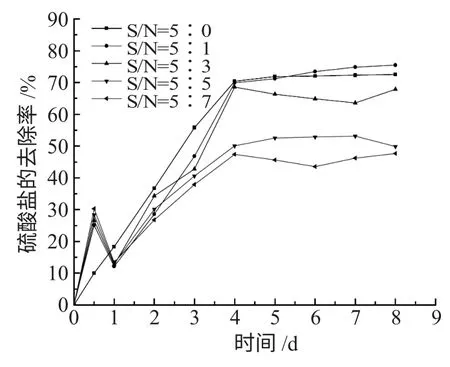
图6 S/N 对硫酸盐还原的影响Fig.6 The influence of S/N of sulfate reduction
从图6 可以看出,S/N 增加,硫酸盐的去除率下降,说明硝酸盐的增多可以明显抑制SRB 对硫酸盐的还原。这可能是由于溶液是混合菌样,其中存在着反硝化细菌(DNB),它的生活环境与SRB 极为相似,同属专性厌氧菌,可存在于同一环境中。当系统中的营养物质和基质有限时,会产生对生存空间和基质的竞争。而许多研究也表明,DNB 与SRB 的竞争占优势,优先利用基质,进而抑制SRB 的生长,表现出硫酸盐去除率很低。需要注意的是,S/N 为5∶1 时硫酸盐去除率75.47%比5∶0 时的72.54%还高,说明此时加入硝酸盐的量增强了SRB 对硫酸盐的还原,这可能是因为加入的少量硝酸盐为环境提供了氮源[16],促进了SRB 的生长繁殖,表明低浓度硝酸盐促进作用高于抑制作用,而在其余的S/N下,都是抑制作用高于促进作用。刘洪玉等人的研究[17]证实硝酸盐对SRB 的生长确实有抑制作用,并且随着硝酸盐浓度的升高抑制效果也随之提高。
4 结论
(1)分离提纯油田水样得到一株硫酸盐还原菌,通过PCR 扩增技术,和16S rDNA 对比分析,鉴定其为脱硫弧菌属。
(2)体系在温度范围为20~40℃时SRB 还原硫酸盐的效果较好,其中30℃为最佳温度,硫酸盐去除率为85.61%。过高和过低的温度都不利于SRB的生长,5℃和60℃硫酸盐去除率仅为12.26%和9.14%。
(3)SRB 在pH 值为4~9 的范围内还原硫酸盐的效果都较好,其中pH 值为7 时为最佳,硫酸盐去除率达到了85.44%。pH 值低于4 或高于9 时,会抑制SRB 的生长繁殖。
(4)盐度主要是影响溶液的渗透压,盐度过高会使SRB 的脱水死亡。盐度在0.5%~2%时,SRB 可以正常生长,在2.5%和3%时硫酸盐去除率严重下降,仅为18.39%和8.27%,SRB 的生长受到抑制。
(5)不同价态的铁元素对SRB 的影响不同,Fe0和Fe2+对SRB 的生长起促进作用,而Fe3+的投加则会起到显著的抑制作用,可以在油田采用Fe3+作为抑制剂抑制SRB 的生长。
(6)硝酸盐可以抑制SRB 的生长,实验得出,S/N≤5∶5 就有明显的抑制效果。
[1]康群,罗永明,赵世玉,等.江汉油区硫酸盐还原菌的生长规律研究[J].江汉石油职工大学学报,2005,4(18):79-81.
[2]万里,郑连爽,陈丽娥,等.嗜热硫酸盐还原菌的分离及生长影响因素研究[J].环境科学与技术,2009,32(10):57-60.
[3]陈一鸣,吴雁,马远荣,等.硫酸盐还原菌的分离纯化及生长特性研究[J].河南化工,2011,28(1):29-32.
[4]Martins M,Faleiro M,Barros R,et al.Characterization and activity studies of highly heavy metal resistant sulfate-reducing bacteria to be usedin acid mine drainage decontamination[J].Journal of Hazardous Materials,2009,166:706-713.
[5]Laura M.Nevatalo,Martijn F.M.Bijmans,Piet N.L.Lens,et al.The effect of sub-optimal temperature on specific sulfidogenic activity of mesophilic SRB in an H2-fed membrane bioreactor[J].Process Biochemistry,2010 45(3):363-368.
[6]马保国,胡振琪,张明亮,等.高效硫酸盐还原菌的分离鉴定及其特性研究[J].农业环境科学学报,2008,27(2):608-611.
[7]FERNANDEZ DE ROMERO,Matilde;PEREZ.Influence of ferrous ions,pH and H2S at the interface on the corrosion mechanism of iron by Sulfate-Reducing Bacteria[J].Revista Técnica de la Facultad de Ingeniería Universidad del Zulia,2007,30(5):223-233.
[8]刘艳,党志,刘云,等.一株硫酸盐还原菌DSRBa 的分离鉴定及特性分析[J].农业环境科学学报,2011,30(1):176-182.
[9]Vallero MV;Sipma J;Lettinga G;Lens PN. High-rate sulfate reduction at high salinity (up to 90mS·cm-1)in mesophilic UASB reactors[J].Biotechnology and Bioengineering,2004,86(2):226-235.
[10]汤浩,程健明,魏刚,等.生态因子对煤系地下水中硫酸盐还原菌生长的影响[J].广东化工,2014,41(9):12-13.
[11]Kimio Ito;Satoshi Wakai;Hirohito Tsurumaru. Iron Corrosion by Methane-Producing Archaea(MPA)and Sulfate-Reducing Bacteria (SRB)Utilizing Metallic Iron as an Electron Donor..Corrosion engineering,2011,60(9):336-345.
[12]Kimio Ito;Taku Uchiyama;Takao Iino,et al. Iron Corrosion under the Enrichment Culture of Anaerobic Microorganisms Utilizing Metallic Iron as an Electron Donor[J].Zairyo-to-Kankyo,2010,59(8):298-304.
[13]刘岳林,谢水波.影响硫酸盐还原菌还原U(Ⅵ)的因素探讨[J].铀矿冶,2010,29(4):192-195.
[14]蒋永荣,周亶,容翠娟,等.高效硫酸盐还原菌的分离及特性研究[J].环境科学与技术,2009,32(11):13-17.
[15]刘晓华,万海清.亚硫酸盐还原酶的分离纯化和酶学性质的研究[J].酿酒科技,2006,144(6):28-31.
[16]Mohanakrishnan J;Kofoed MV;Barr J,et al.Dynamic microbial response ofsulfidogenic wastewater biofilmtonitrate[J].Appl Microbiol Biotechnol,2011,91(8):1647-1657.
[17]刘洪玉,史荣久,张颖,等.对渤海湾油藏中硫酸盐还原菌还原活性的抑制效应[J].应用生态学报,2014,25(8):1-8.
