貂源大肠杆菌的分离鉴定及耐药性研究
2015-03-13杨青石有斐陈静王苗利徐鸿王贵升
杨青,石有斐,陈静,王苗利,徐鸿,王贵升
(1.山东农业大学动物科技学院, 山东泰安271018;2.山东省动物疫病预防与控制中心, 山东济南250022)
貂源大肠杆菌的分离鉴定及耐药性研究
杨青1,石有斐1,陈静2,王苗利2,徐鸿2,王贵升2
(1.山东农业大学动物科技学院, 山东泰安271018;2.山东省动物疫病预防与控制中心, 山东济南250022)
为了初步探究山东省貂源大肠杆菌耐药性及耐药基因情况,对30日病死貂脑组织分离得到的大肠杆菌进行O抗血清型鉴定、药敏试验及耐药基因检测。结果显示,该分离菌血清型为O114,且对多种药物产生耐药,并携带至少3种耐药基因。试验所分离的貂源大肠杆菌能够穿过血脑屏障,耐药性严重且存在交叉耐药现象。
大肠杆菌;分离鉴定;血脑屏障;耐药基因
大肠杆菌(Escherichiacoli),又被称为大肠埃希氏菌,是肠杆菌科、埃希氏菌属的代表菌[1]。致病性大肠杆菌给山东省畜牧业带来了一定危害,以水貂养殖为例,水貂大肠杆菌病以断乳前后的仔貂发生最多,潜伏期2~5 d,一旦发病,短时间内即可导致病貂死亡,该病的爆发和流行,严重威胁我国养貂业的发展[2]。为了防治水貂大肠杆菌病,抗生素类药物的长期、不合理的使用导致耐药菌株不断出现,并呈现出高水平耐药、多重耐药和交叉耐药的严重发展态势[3]。血脑屏障是在脑和脊髓内的毛细血管与神经组织之间存在的一个调节界面,血脑屏障不单纯是被动保护性屏障,还可以选择性的将脑内有害或过剩物质泵出脑外,保持脑的内环境恒定[4]。目前,水貂脑组织中分离得到的大肠杆菌的耐药情况还不清楚,本文从耐药性等方面探究穿过血脑屏障的大肠杆菌的相关生物学特性。
1 材料与方法
1.1 材料
1.1.1 病料 来自山东省潍坊市某大型貂场的30 日龄病死雏貂27 只。无菌取病死貂的脑组织,编号、待检。
1.1.2 实验动物 20~30 g昆明小鼠由山东大学实验动物中心提供。
1.1.3 培养基及主要试剂 沙门氏菌显色培养基、尿路菌群显色培养基,上海欣中生物工程有限公司;LB培养基、麦康凯培养基、普通肉汤培养基、琼脂糖凝胶,北京路桥技术有限公司; 大肠埃希氏O抗原定型血清,中国兽医药品监察所; PCR反应液、双蒸水、DNA Marker DL2000,宝生物工程(大连)有限公司。
1.1.4 主要设备 VITEK 2 生化药敏鉴定系统及配套比浊仪,生化、药敏实验卡,法国梅里埃公司;ALS-1296 PCR仪,美国BIO-RAD ;BDA-BOX2紫外凝胶成像系统,BIOMETRA;微量移液器,德国艾本德(中国)有限公司;MIR-253-20 ℃超低温冰箱,日本三洋株式会社;奥林巴斯BX-43显微镜,日本奥林巴斯株式会社。
1.2 方法
1.2.1 细菌的分离培养与形态观察 参照文献方法[5],取无菌采集的病死貂的脑组织,划线接种于沙门氏菌显色培养基和尿路菌群显色培养基,于37 ℃培养12 h,观察菌落的生长情况及菌落的形态,并用接种环无菌挑取单个生长良好的菌落,按常规方法涂片,进行革兰氏染色,并观察菌体大小和形态。从沙门氏菌显色培养基挑取疑似大肠埃希菌的菌落接种于麦康凯培养基,于37 ℃培养12 h,观察菌落的大小、形态和颜色。
1.2.2 生化试验 按VITEK2 生化药敏鉴定仪的说明,将3 mL无菌盐水加入到清洁塑料管中,以无菌棉拭子挑取麦康凯琼脂平板上形态相同的菌落至盐水管中,混匀,用已校正的VITEK2比浊仪调至0.50~0.60麦氏浊度,将革兰氏阴性细菌鉴定卡悬浮吸管插入盐水管,并置于载卡台上,将载卡台置于VITEK2生化药敏鉴定仪中,自动读取结果。
1.2.3 药敏试验 按VITEK2生化药敏鉴定仪的说明,将3 mL无菌盐水加入到清洁塑料管中,以无菌棉拭子挑取麦康凯琼脂平板上形态相同的菌落至盐水管中,混匀,用已校正的VITEK2比浊仪调至0.50~0.60麦氏浊度,微量移液器吸取该无菌盐水145 μL,转移至另一清洁塑料管内3 mL无菌盐水中,将革兰氏阴性细菌药敏卡悬浮吸管插入第二支盐水管,置于载卡台上,并将载卡台放入仪器中,由仪器自动读取结果。
药敏结果分为三种敏感S(Susceptible)、中介I(Intermediate susceptibility)和耐药R(Resistant)三种。
1.2.4 O抗血清型鉴定 按照大肠杆菌O型抗原定型血清说明进行[5]。在麦康凯培养基上挑选光滑、完整的粉红色菌落1~2个,接种于半固体小管,37 ℃培养24 h,取半固体培养物分别接种普通琼脂斜面小管、普通肉汤小瓶培养基(50 mL),置37 ℃培养24 h,培养期间振荡普通肉汤数次。用0.50 %石炭酸生理盐水溶液2 mL洗下普通琼脂斜面小管培养物,置小圆底试管中,制成浓稠菌悬液,然后与普通肉汤小瓶培养物一起于121 ℃高压2 h,破坏其“K”抗原,制成高压抗原。取制备的待检菌的O抗原及大肠埃希菌O抗原定型血清各10 μL,在玻片上混匀,30 s内出现明显凝集现象者为阳性反应。同时,以制备的待检菌O抗原与0.50 %石炭酸生理盐水混合物作对照,观察有无自凝集现象。
1.2.5 动物试验 取该菌12 h普通肉汤培养物,将菌液浓度调整为麦氏浊度1.0,腹腔注射接种于5只20~30 g的小鼠,每只0.2 mL,同时设立2只以同样途径接种等量无菌普通肉汤的小鼠作为对照。接种后隔离饲养观察,记录死亡小鼠的死亡时间,并从死鼠脑组织中分离病原菌[5]。
1.2.6 DNA模板的制备 用煮沸法提取细菌DNA[6],操作方法如下:
将分离菌在LB平板上复苏37 ℃培养18~24 h。
用接种环挑取单个菌落,于无菌生理盐水中制成麦氏浊度为0.50的菌悬液。取500 μL菌悬液于1.5 mL离心管中12000 rpm离心5 min.
弃上清,将沉淀重新用200 μL 1*TE溶液稀释,100 ℃煮沸10 min,12000 rpm离心5 min。将上清液转移到干净无菌EP管中,-20 ℃保存备用。
1.2.7 引物设计 根据Gen Bank 报道的CFR、OqxA、tetA、qnrA、gyrA、TEM基因及其两侧部分序列设计了引物序列如下(表1):

表1 引物序列
由生工生物工程(上海)股份有限公司合成。
1.2.8 PCR反应 根据文献方法[6],PCR反应体系总体积为25 μL,在1.5 mL洁净离心管中按计算结果依次加入双蒸水8 μL,PCR反应液(包含dNTPs、Taq酶)13 μL,该分离菌DNA模板2 μL,耐药基因上下游引物各1 μL。
PCR反应条件为:94 ℃预变性5 min,一个循环;94 ℃变性1 min,退火温度55 ℃30 s,72 ℃延伸1 min,30个循环;终延伸72 ℃7 min,一个循环。对PCR产物进行琼脂糖凝胶电泳检测。
1.2.9 琼脂糖凝胶电泳 PCR产物用1.0 %琼脂糖凝胶电泳。称取1.0 g琼脂糖,加至100 mL 1*TBE缓冲液,微波炉加热使琼脂完全溶解,稍冷却即加Gel Red 4 μL,混匀后倒入选择好的模具中,静置30 min,待胶完全凝固后,撤去封条,将凝胶放入电泳槽中,小心拔掉梳子,将1*TBE缓冲液缓慢倒入电泳槽至没过胶面。
以DNA Marker DL2000作参照,用微量移液器将PCR扩增产物5 μL,加入点样孔中。电泳条件:电压150 V,时间30 min。用BIOMETRA 紫外凝胶成像系统在紫外灯下成像,观察结果,记录并保存照片。
2 结果与分析
2.1 分离菌的培养特性及形态特征 经37 ℃培养12 h,分离菌在沙门氏菌显色培养基中形成灰蓝色、圆滑、隆起菌落(图1-A);在尿路显色培养基中形成浅粉紫色、圆形菌落(图1-B),在麦康凯琼脂培养基上形成粉红色,圆形,隆起、光滑湿润的中等大小菌落(图1-C),符合大肠杆菌的培养特性。挑取单个菌落革兰氏染色后,在显微镜下可见革兰氏阴性, 两端钝圆的短小杆菌(图1-D)。
2.2 生化试验鉴定结果 VITEK2系统生化试验鉴定结果如表2所示,该结果显示该分离菌可以利用D-葡萄糖、D-麦芽糖等糖类,VP试验为阴性,柠檬酸盐(钠)利用试验为阴性。该分离菌符合大肠杆菌生化反应特征。

A:在沙门氏菌显色培养基上生长的菌落(10×);B:在尿路显色培养基上生长的菌落(10×);C:在麦康凯琼脂培养基上生长的菌落(10×);D:经革兰氏染色后镜检照片(400×)图1 分离菌培养特性及形态特征

试验项目结果试验项目结果侧金盏花醇(0.19mg)-L-阿拉伯醇(0.30mg)-D-纤维二糖(0.30mg)-β-半乳糖苷酶(0.04mg)+尿素酶(0.15mg)-β-N-乙酰葡萄糖苷酶(0.04mg)-D-葡萄糖(0.30mg)+VP试验-葡萄糖发酵(0.45mg)+β-葡萄糖苷酶(0.04mg)-D-麦芽糖(0.30mg)+β-木糖苷酶(0.03mg)-蔗糖(0.30mg)-柠檬酸盐(钠)(0.05mg)-α-半乳糖苷酶(0.04mg)+β-葡萄糖苷酸酶(0.04mg)+
2.3 药敏试验结果 VITEK2系统对分离纯化的菌株进行药敏试验的结果如表3所示,表明该分离菌株对哌拉西林、头孢替坦、厄他培南、亚胺培南等敏感,对头孢唑林、头孢他啶、庆大霉素、环丙沙星、左氧氟沙星等多种药物耐药,交叉耐药性严重。

表3 分离菌药敏试验结果(S:敏感R:不敏感)
2.4 分离菌株O抗血清型鉴定 制备的待检菌O抗原与0.50 %石炭酸生理盐水混合无凝集现象,说明该待检菌O抗原无自凝集现象。与O114单因子血清混合后发生浑浊,有白色絮状物出现(图2-A),与其他O抗原单因子血清混合后仍然呈透明均一状态(图2-B)。说明该分离菌O血清型为O114。
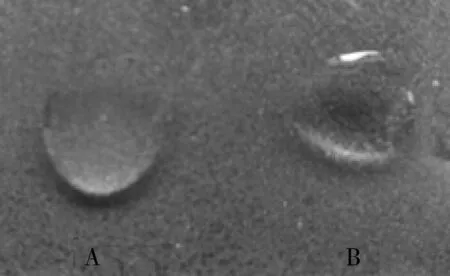
A:与O114抗原单因子血清混合后出现白色絮状物;B:与其他抗原单因子血清混合后仍呈均一状态。图2 分离菌株血清型鉴定
2.5 动物试验 试验组小鼠72 h内全部死亡,取死亡小鼠脑组织接种于麦康凯琼脂培养基37 ℃培养12 h,有红色菌落生长,与图1-C形态一致;革
兰氏染色后镜检符合大肠杆菌特征,与图1-D一致,而对照组2只小鼠全部存活,说明该分离菌株为致病性大肠杆菌。
2.6 耐药基因 该分离菌PCR扩增产物经琼脂糖凝胶电泳结果见图3。

图3 该分离菌 PCR产物电泳结果图
由图3观察得知,该分离菌包含tetA、gyrA、oqxA、qnrA耐药基因,产超广谱β-内酰胺酶(ESBLs)的分型为TEM,可介导多重耐药的CFR基因在本次试验中未检出,结果见表4。

表4 耐药基因测序结果
3 讨论
经过生化鉴定试验证明该分离菌为大肠杆菌,动物回归试验结果表明该分离大肠杆菌具有致病性。药敏试验结果显示,该菌株对哌拉西林、头孢替坦、厄他培南等药物敏感,对头孢他啶、头孢吡肟、庆大霉素等药物产生耐药。表明该菌株已对多种抗生素产生了耐药性,耐药性明显增强。耐药基因结果显示该致病菌至少携带包括qnrA、tetA、oqxA、gyrA在内的4种耐药基因。产超广谱β-内酰胺酶(ESBLs)分型结果为TEM型,该类型常见于大肠杆菌和肺炎克雷伯菌,是我国分布较为广泛的类型。
大肠杆菌是仔貂脑膜炎最常见的致病菌,大肠杆菌性脑膜炎一般是由于细菌的血型播散引起的[8],但是,血液中的大肠杆菌如何穿过由脑微血管内皮细胞组成的血脑屏障,目前尚不清楚[9]。血脑屏障能够阻止某些物质由血液进入脑组织[10],血脑屏障的存在能够保持脑组织内环境的基本稳定,对维持中枢神经系统正常生理状态具有重要的生物学意义。试验中不仅分离得到了致病性大肠杆菌,且该分离菌对多种抗生素类药物产生了耐药性[11],应引起足够的重视。试验检测的4类耐药基因,经测序发现,均存在于大肠杆菌质粒中,质粒是独立于细菌染色体之外的具有自我复制能力的小型环状DNA,因此,位于质粒上的耐药基因,在细菌自我复制的过程中发生遗传变异的可能性更大,给细菌耐药性的防治带来一定的难度。在畜牧养殖过程中,可通过在饲料中添加益生素[12]或中药免疫增强剂来提高动物免疫力,减少动物发病,从而减少抗菌药的使用。
研究从耐药性等方面探究穿过血脑屏障的大肠杆菌的相关生物学特性,针对山东省水貂脑组织分离得到的致病性大肠杆菌的耐药及耐药基因携带情况的报道尚属首次。
[1] 陈溥言. 兽医传染病学.第五版.[M].北京 :中国农业出版社 , 2006: 116.
[2] 倪金花. 水貂大肠杆菌病的预防和治疗 [J].养殖技术顾问,2014, (1):170.
[3] 姜晓冰.大肠杆菌质粒介导喹诺酮耐药机制研究[D].广州:华南理工大学,2012.
[4] 曹荣峰, 田洪宇, 王继芳, 等.水貂细菌性疾病的病原学调查[J]. 经济动物学报, 2008, (12):21-23.
[5] 范京惠,左玉柱,张晓波,等.鸭源大肠杆菌O88的分离鉴定及药敏试验[J].河北农业大学学报,2008(31):93-94.
[6] 巩岩霞.煮沸法提取模板及随意引物分析大肠杆菌O157:H7的DNA图谱[J].国外医学临床生物化学与检验学分册,1996,17(4):132-134.
[7] 钟洁,陈乐然,刘洋,等.可介导多药耐药的CFR基因的原核表达及多克隆抗体的制备[J].中国兽医科学,2014,(10):13-14.
[8] 陈丽丹. 致脑膜炎大肠杆菌穿透血脑屏障机制的研究进展[J].中国人兽共患病杂志2005,21(5):426-428.
[9] 周宓,王志强.跨血脑屏障药物转运的研究进展[J].生命科学研究,2009,13(4):370-376.
[10]赵伟东,陈誉华.大肠杆菌血脑屏障侵袭基因ibeB的稳定转染能够促进HeLa细胞片状伪足的形成[J].生物化学与生物物理进展,2005,32(2):116-121.
[11]陈伟.动物源大肠杆菌耐药基因与HPI毒力基因的检测及相关性分析[D] 合肥: 安徽农业大学,2013.
[12]荆祎, 李光玉, 刘晗璐,等. 不同益生菌添加剂对水貂生长性能及血清生化指标的影响 [J].经济动物学报, 2013,17(3):141-145.
(编 辑:陈希)
Isolation, Identification ofEscherichiacolifrom Mink and Related Research of Some Biological Characteristics
YANG Qing1,SHI You-fei1,CHEN Jing2,WANG Miao-li2,XU Hong2,WANG Gui-sheng2
(1.CollegeofAnimalScienceandTechnology,AgriculturalUniversityofShandong,Taian271018,China;2.CenterforcontrolandpreventionofanimaldiseasesinShandongProvince,Jinan250022,China)
To preliminary explore the resistance and resistance genes ofE.colifrom mink of Shandong province, O antiserum identification, drug sensitivity test and resistance gene test toE.coliwhich from 30 d dead mink’s brain. The result shows that the O antiserum type of this isolated is O114.The isolated resistance to many drugs and have three resistance genes at least. The result confirm that the isolated can through blood brain barrier and serious drug resistance, the phenomenon of cross drug resistance is serious.
Escherichiacoli;isolation and identification;blood brain barrier; drug resistance gene
杨 青,硕士研究生,从事细菌耐药性方面工作。E-mail: qingy013@163.com
2015-04-07
A
1002-1280 (2015) 08-0014-06
S852.61
