鼎湖山不同演替阶段森林土壤pH值和土壤微生物量碳氮对模拟酸雨的响应
2015-03-12梁国华吴建平熊鑫吴小映褚国伟周国逸曾任森张德强
梁国华,吴建平,熊鑫,吴小映,褚国伟,周国逸,曾任森,张德强*
1. 华南农业大学资源环境学院,广东 广州 510642;2. 中国科学院华南植物园,广东 广州 510650;3. 中国科学院大学,北京 100039
鼎湖山不同演替阶段森林土壤pH值和土壤微生物量碳氮对模拟酸雨的响应
梁国华1,吴建平2, 3,熊鑫2, 3,吴小映1,褚国伟2,周国逸2,曾任森1,张德强2*
1. 华南农业大学资源环境学院,广东 广州 510642;2. 中国科学院华南植物园,广东 广州 510650;3. 中国科学院大学,北京 100039
摘要:开展酸雨增加对森林土壤酸化和土壤微生物活性的影响,可以为正确评估森林生态系统碳氮过程及其对全球气候变化的响应提供依据。以鼎湖山处于不同演替阶段的3种森林类型(马尾松Pinus massoniana)针叶林、针阔叶混交林和季风常绿阔叶林)为研究对象,从2009年6月开始,在自然林里喷施4个不同处理水平的模拟酸雨,即CK(pH=4.5左右的天然湖水)、T1(pH=4.0)、T2(pH=3.5)和T3(pH=3.0);2009年12月─2013年3月对模拟酸雨下土壤pH值和土壤微生物量碳、氮含量进行长期观测研究。重复测量方差分析表明,观测周期内,模拟酸雨没有显著影响松林的土壤pH值和土壤微生物量碳、氮含量,但却显著地降低了阔叶林的这3个指标(P<0.05),而对混交林的降低程度也接近显著。具体表现为:与CK处理相比,松林、混交林和阔叶林表层土壤pH值在T1、T2和T3处理分别下降了0.01、0.01和0.04,0.01、0.06和0.07,0.04、0.09和0.10;相应地,土壤微生物量碳含量分别下降了-1.0%、2.7%和0.4%,4.2%、4.4%和13.6%,12.3%、12.6% 和18.4%;土壤微生物量氮含量则分别下降了0.8%、4.2%和9.7%,5.4%、17.4%和15.6%,12.3%、16.2%和25.1%。这表明模拟酸雨加速了土壤酸化,同时降低了土壤微生物活性,而从降低的幅度和差异的显著性可看出,3个林型的响应敏感性随森林的顺行演替而增强,处于演替后期的阔叶林敏感性最强。同时,这种处理效应大体上随着模拟酸雨处理时间的延长而逐渐显著。以阔叶林为例,表现为实验初期,模拟酸雨并没有显著降低其土壤pH值和土壤微生物量碳、氮含量,而在模拟酸雨24、30和36个月后,T3和T2处理的土壤pH值显著低于CK和T1处理(P<0.05);同样,在模拟酸雨24、36和45个月后,T3处理的土壤微生物量碳、氮含量显著低于CK处理(P<0.05);这表明模拟酸雨对土壤酸化和土壤微生物活性的影响是一个逐渐累积的过程。
关键词:模拟酸雨;土壤酸化;土壤微生物活性;不同演替阶段森林;鼎湖山
引用格式:梁国华,吴建平,熊鑫,吴小映,褚国伟,周国逸,曾任森,张德强. 鼎湖山不同演替阶段森林土壤pH值和土壤微生物量碳氮对模拟酸雨的响应[J]. 生态环境学报, 2015, 24(6): 911-918.
LIANG Guohua, WU Jianping, XIONG Xin, WU Xiaoying, CHU Guowei, ZHOU Guoyi, ZENG Rensen, ZHANG Deqiang. Responses of Soil pH Value and Soil Microbial Biomass Carbon and Nitrogen to Simulated Acid Rain in Three Successional Subtropical Forests at Dinghushan Nature Reserve [J]. Ecology and Environmental Sciences, 2015, 24(6): 911-918.
自上个世纪以来,酸雨已成为当今世界最严重的环境问题之一。尽管欧美发达国家的酸性气体排放量近年来有所下降,但是发展中国家的排放量却在增加。目前,中国受酸雨影响的地区仍占国土面积的40%左右(吴丹等,2006)。赵艳霞等(2006)的研究表明,2005年全国88个国家级酸雨站中,81.8%的台站有不同程度的酸雨出现;杨宗慧(2002)也指出,许多南方城市的酸雨频率达80%,其中西南、南昌、福厦等酸雨区的酸雨频率更达90%以上。与酸雨频率增加的同时,中国南方酸雨区的降水pH值也在逐渐下降,如徐义刚等(2001)的研究表明,1998─1999年间,广州降雨pH值年平均值为4.45,且所占比例最大的都在pH值为4.0~4.5这一范围,也曾观测到极端最低值3.3;而贵阳、厦门及庐山等地更检测到极端pH值低于3.0的酸雨(潘根兴和冉炜,1994)。伴随着酸雨频率增加和酸雨pH值降低的是土壤酸化问题,其实质是酸雨中的H+与土壤胶体表面上吸附的盐基性离子进行交换反应而被吸附在土粒表面,被交换下来的盐基性离子随渗漏水淋失(邵宗臣等,1997)。但酸雨引起土壤酸化的问题也有争议,有学者认为,与自然原因和土地利用方式相比,酸雨对北美和西欧土壤酸化作用相对较小(Krug等,1983);另外,不同类型或不同层次的土壤对酸雨的响应不一样(俞元春等,2001)。
森林作为陆地生态系统的主体,也是酸雨的主要受体,日益严重的酸雨问题必然会影响森林生态系统的结构和功能(Busch等,2001);鉴于森林土壤碳氮库在全球碳氮循环中发挥的重要作用(Cole和Rapp,1981;Sedjo,1993),其对酸雨的响应一直备受关注(Vanhala等,1996)。土壤微生物是土壤生态系统碳氮转化过程的生物因素,其自身也是土壤活性碳氮库的重要组成部分(何容等,2009)。土壤微生物量可用土壤微生物量碳(SMBC)与土壤微生物量氮(SMBN)表征,尽管SMBC含量仅占土壤总有机碳含量的1%~5%(何振立,1997),SMBN含量仅为土壤全氮含量的2%~6%(Brookes等,1985),但它们直接参与调控土壤能量流动和养分循环,对土壤养分转化与有效供应起着重要作用(漆良华等,2009),能反映土壤同化和矿化能力,是土壤生物活性大小的标志。此外,土壤微生物对气候、土壤和植被等变化非常敏感(Wardle,1992),因而土壤微生物量也是环境变化最为敏感的生命指标。而以往的研究表明,土壤pH值是影响土壤微生物的一个重要因素,土壤微生物量往往与土壤pH值相关(Jenkinson等,1979),因此可推测酸雨导致的土壤酸化将会通过影响土壤微生物量从而影响森林土壤碳氮循环。
但无论国内还是国外,目前关于森林土壤酸化和微生物活性对酸雨响应的研究相对有限,且受野外实验条件的限制,研究者普遍采用室内模拟酸雨淋洗土柱的方法来分析土壤理化性质的变化,评价酸雨对土壤酸化的影响程度,以及土壤的酸化敏感性(俞元春等,2001);而酸雨胁迫对土壤微生物量的研究也大多采用室内盆栽的方法(谢小赞等,2009),其研究结果能否适用于野外自然状况还难以定论。故在酸雨问题日益严重的中国南亚热带地区,开展野外人工模拟酸雨实验,深入研究酸雨对森林土壤酸化和土壤微生物活性的影响显得非常紧迫。再者,以往的研究尚未涉及不同森林类型对酸雨的响应差异,而处于不同演替阶段的森林因为土壤的理化性质和地上植被和凋落物等差异,可能会导致土壤酸化和土壤微生物活性对酸雨的响应不一样。
为此,我们在鼎湖山以南亚热带具有典型代表性且分别处于不同演替阶段的3种森林类型(马尾松Pinus massoniana针叶林、针阔叶混交林和季风常绿阔叶林)为研究对象,通过在自然林里开展模拟酸雨对土壤pH值和土壤微生物量碳、氮含量的长期观测研究,试图回答以下问题:(1)南亚热带森林土壤酸化和土壤微生物活性对酸雨响应的规律如何?(2)处于不同演替阶段的森林其土壤酸化和土壤微生物活性对酸雨的响应是否具有差异?
1 材料与方法
1.1研究区域与样地概况
研究地所在的鼎湖山自然保护区位于广东省中西部的肇庆市境内,东经112°30′39″~112°33′41″,北纬23°09′21″~23°11′30″,最高峰鸡笼山海拔达1000.3 m,坡度平均为30°~45°。鼎湖山地区气候季节交替明显,属亚热带季风性气候型。年平均气温为21.4 ℃,最冷月(1月)和最热月(7月)的平均温度分别为12.6和28.0 ℃;年降雨量1927 mm,其中4─9月的降雨量约占全年的80%;年平均蒸发量1115 mm,年平均相对湿度为80.3%(黄展帆等,1982)。保护区内有着群落演替进程处于不同阶段的3种森林,即马尾松针叶林、针阔混交林和季风常绿阔叶林。马尾松针叶林(PF)是20世纪50年代原始森林受破坏后人工种植的,已有约60年的历史,是演替系列前期阶段森林的典型代表。针阔叶混交林(MF)为演替系列中间阶段的典型类型,是人工种植的松林由于阔叶树种的自然入侵经一段时间的演替而形成,林龄约100年。季风常绿阔叶林(BF)为演替系列后期的典型类型地带性植被,已有约400年的人为保护历史(Zhou等,2006)。3个林型的土壤和凋落物的相关特征见表1(Liang等,2013)。
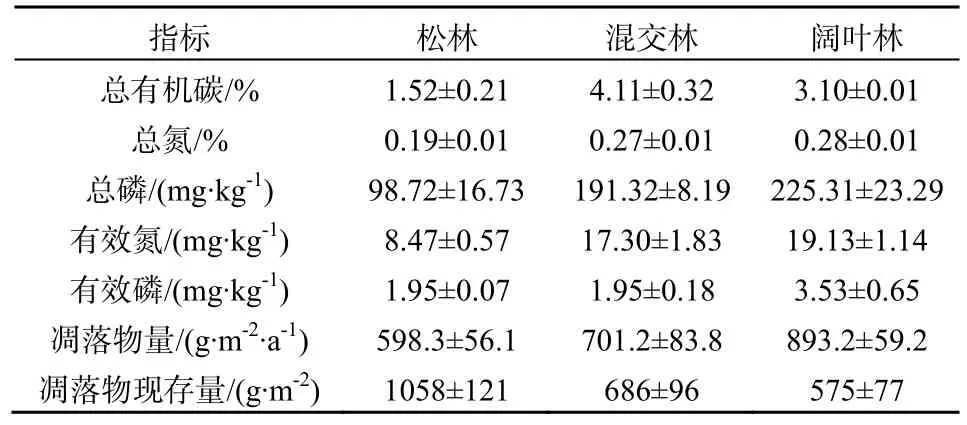
表1 3个林型的土壤和凋落物的相关特征(平均值±标准偏差)Table 1 Characteristics of soil and litter of three forest types (mean±SD)
1.2试验样地设计
2009年初在上述3种林型选取坡度和坡向接近的林地,分别设置12个10 m×10 m的样方用于模拟酸雨实验。每个样方四周用水泥板材围起,水泥板材插入地表15 cm,地上部分高出地表5 cm,每个样方之间预留3 m宽的缓冲带。设计CK、T1、T2和T3 4个模拟酸雨处理,其中CK为当地的天然湖水,pH值约为4.5;根据鼎湖地区近年来降雨的pH值(刘菊秀等,2003b),设T1为pH=4.0(接近自然降雨的最低pH值),考虑到降雨pH值未来的下降趋势,设T2和T3的pH值分别为3.5和3.0。另外,根据鼎湖地区近年来降雨中主要成分的比例以及变化趋势,设计模拟酸雨H2SO4∶HNO3=1∶1(摩尔比);每个处理设3个重复。2009年6月份开始进行模拟酸雨处理,每月月初和月中将配置好的40 L酸液,用汽油动力喷雾机人工均匀喷洒在每个样方中。CK样方则喷洒等量的天然湖水,以减少因外加的水而造成对森林生物地球化学循环的影响。模拟酸雨实验期间,T1、T2和T3处理的每个样方所输入的H+量分别为9.6、32和96 mol·hm-2·a-1,分别约相当于自然穿透雨H+输入量的0.3、1.0和3.0倍。
1.3土壤温度和土壤湿度的测定
2010年6月到2013年3月,每隔3个月一次,测定样方内0~5 cm的土壤温度和土壤湿度,共进行了12次测定。土壤温度(℃)和土壤湿度(%)分别用电子温度计和TDR土壤测墒仪(MPKit,江苏瑞迪生科技有限公司,南京)测定,测定时在每个样方内随机选取4个点,其平均值代表该样方的土壤温度和土壤湿度。
1.4土壤pH值和土壤微生物量碳、氮含量的测定
于2009年12月、2010年6月和12月、2011 年6月和12月、2012年6月和2013年3月,分别在上述3种林型的实验样地采集土壤样品。在每个样方内随机选取4个点,去除表土覆盖的枯枝落叶,用内径2.5 cm的不锈钢空心圆柱采集0~10和10~20 cm两层土壤,每个点取4钻,采集到的新鲜土壤样品立即取出植物残体、根系和土壤动物(如蚯蚓等),然后迅速过2 mm筛后装入布袋,封口处塞小团棉花以保持空气与外界相通,然后置于4 ℃冰箱中保存。土壤微生物量碳、氮含量采用氯仿熏蒸-K2SO4提取法(FE)测定。微生物量碳、氮的换算系数均为0.45(Jenkinson,1987)。土壤pH值以1 mol·L-1氯化钾浸提(水土比为2.5∶1)后用pH计测定。
1.5数据的分析
本论文所有数据均利用SAS10.0软件(SAS Institute Inc.,Cary,NC,USA)进行统计分析,用SigmaPlot10.0软件作图。
2 结果与分析
2.1模拟酸雨对土壤温度与土壤湿度的影响
2010年6月至2013年3月的实验周期内,鼎湖山3个林型土壤温度和土壤湿度在不同处理下均具有明显的季节动态(表2,图1)。3个林型在CK样方的年平均土壤温度分别为松林(22.42±0.18)℃>混交林(21.36±0.10)℃>阔叶林(20.86±0.07)℃(P<0.05);在年平均土壤湿度上,混交林(27.71±0.31)%和阔叶林(27.53±0.87)%没有显著差异,而松林(13.97±0.11)%则显著低于混交林和阔叶林(P<0.05)。重复测量方差分析表明,3个林型不同处理间的土壤温度和土壤湿度均无显著差异(P>0.05),表明模拟酸雨对土壤温度和土壤湿度的影响不显著。
2.2模拟酸雨对土壤pH值和土壤微生物量碳氮的影响
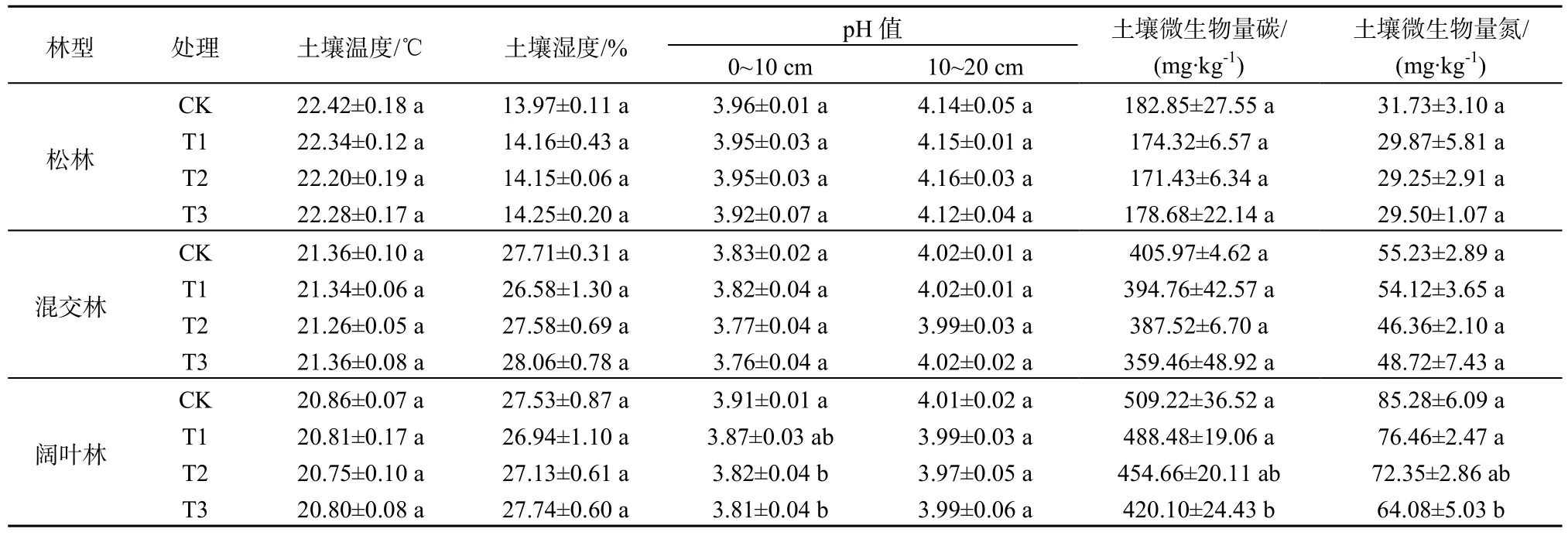
表2 实验周期内不同处理下各指标的平均值(平均值±标准偏差)Table 2 Mean values of all the index under different treatments during the experimental period (mean±SD)
如表2和图2、图3所示,松林、混交林和阔叶林在CK样方的表层(0~10 cm)土壤pH值分别为3.96±0.01、3.83±0.02和3.91±0.01;次层(10~20 cm)则分别为4.14±0.05、4.02±0.01和4.01±0.02,均为强酸性土壤。方差分析表明,3个林型的表层土壤pH值均显著低于次层(P<0.05),而无论是表层还是次层,混交林和阔叶林的平均土壤pH值均没有显著差异(P>0.05),但它们都显著低于松林(P<0.05)。松林、混交林和阔叶林在CK样方的平均土壤微生物量碳含量分别为(182.85±27.55)、(405.97±4.62)和(509.22±36.52) mg·kg-1,土壤微生物量氮含量则分别为(31.73±3.10)、(55.23±2.89)和(85.28±6.09) mg·kg-1。方差分析表明,无论是土壤微生物量碳还是土壤微生物量氮含量,均为松林<混交林<阔叶林(P<0.05)。
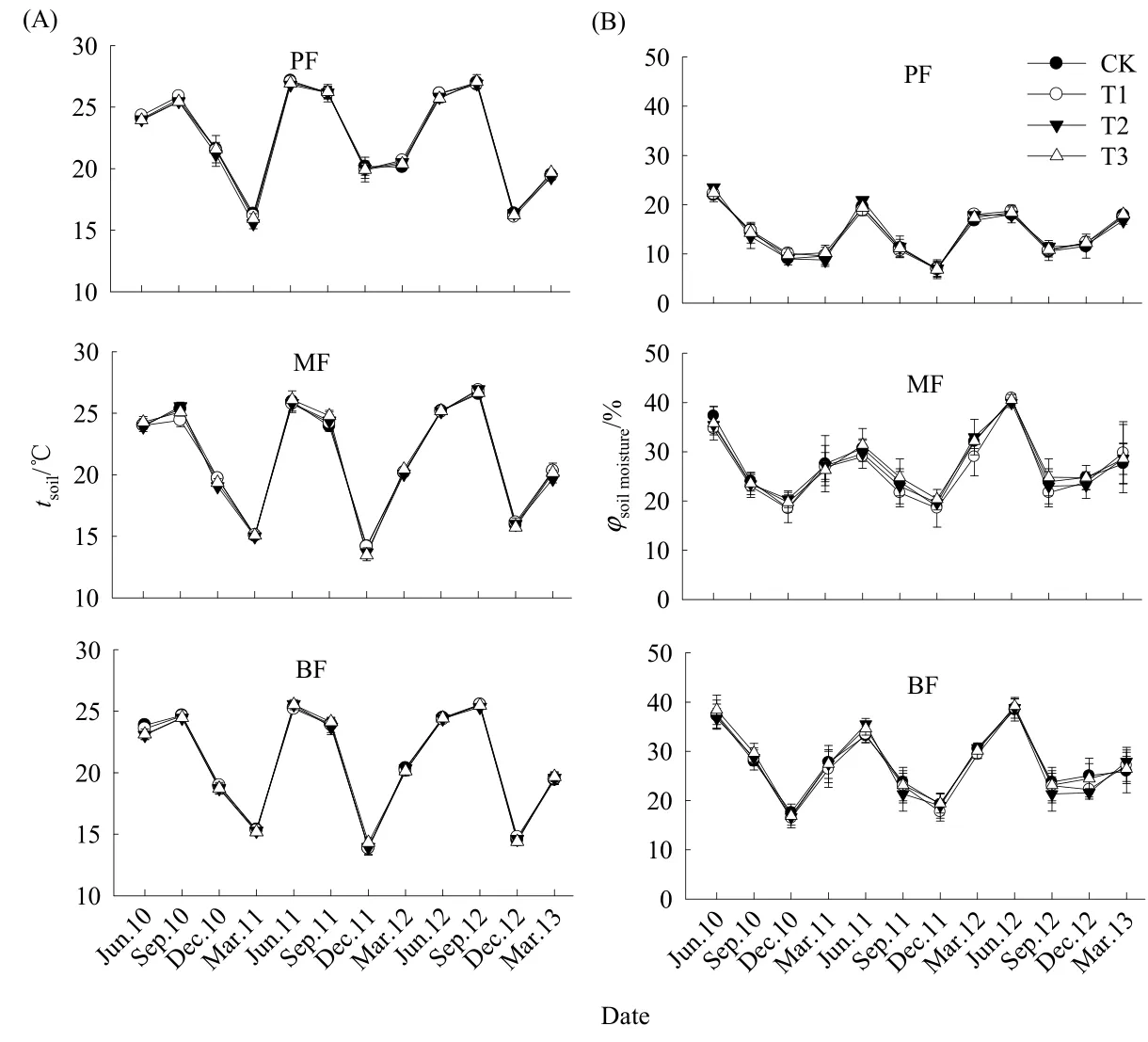
图1 不同处理间土壤温度(A)和土壤湿度(B)的季节动态Fig. 1 Seasonal dynamics of soil temperatures (A) and soil moistures (B) under different treatments
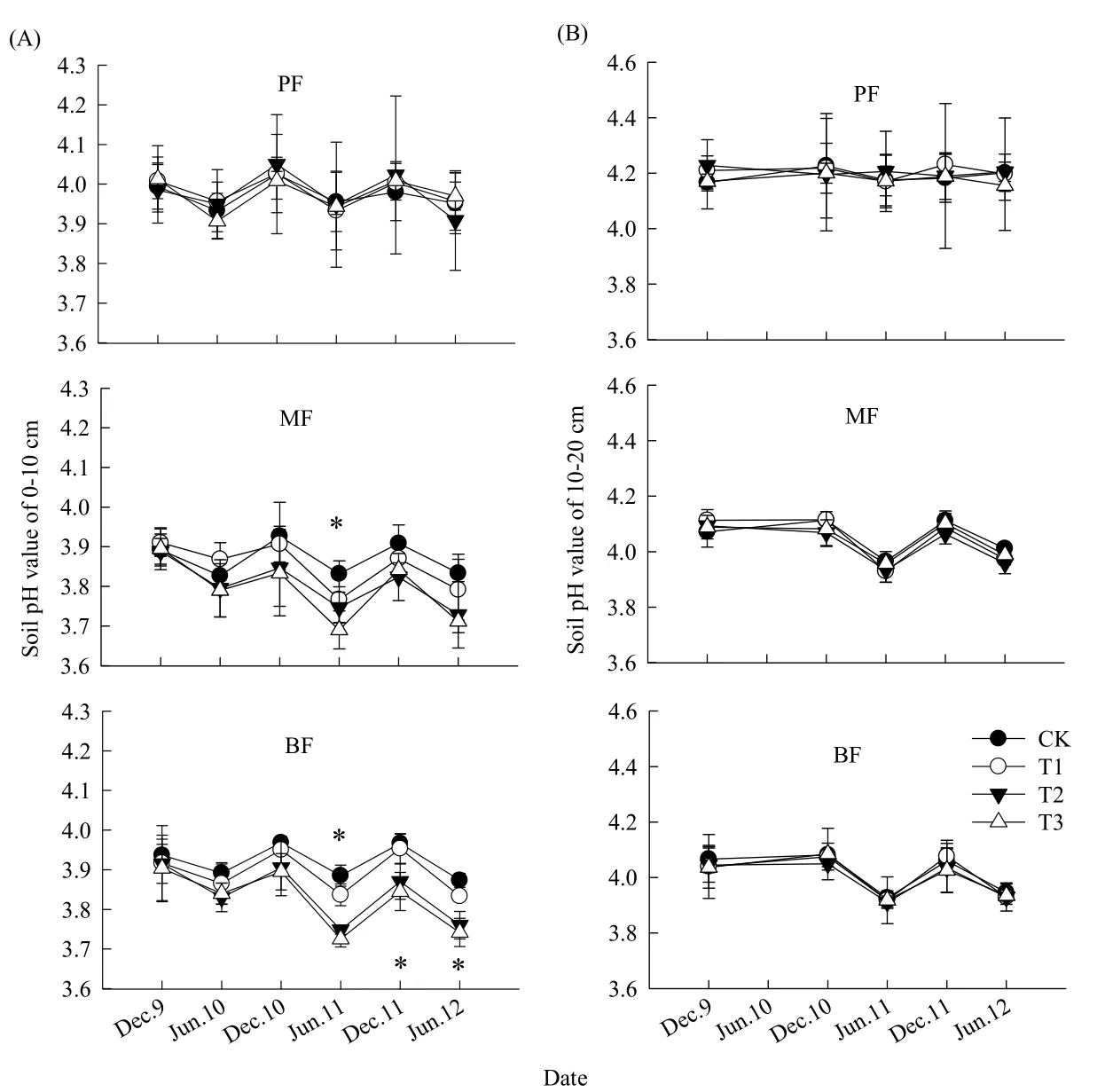
图2 不同处理间土壤pH值的动态Fig. 2 Dynamics of soil pH value under different treatments
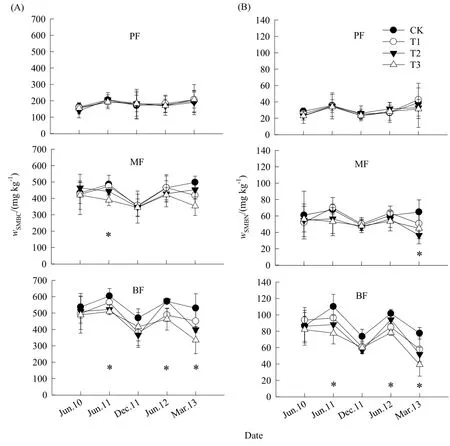
图3 不同处理间土壤微生物量碳(A)和土壤微生物量氮(B)的动态Fig. 3 Dynamics of soil microbial biomass carbon (SMBC) (A) and soil microbial biomass nitrogen (SMBN) (B) under different treatments
重复测量方差分析表明,模拟酸雨对松林两个土层以及混交林和阔叶林次层的土壤pH值均没有显著影响(P>0.05),但模拟酸雨却显著地降低了阔叶林表层土壤pH值(P=0.01),而对混交林表层土壤pH值的降低程度也接近显著(P=0.07);模拟酸雨对松林土壤微生物量碳、氮含量和混交林的土壤微生物量碳含量都没有显著影响(P>0.05),但却显著地降低阔叶林的土壤微生物量碳、氮含量(P<0.05),而对混交林土壤微生物量氮的降低程度也接近显著(P=0.08)。可见,模拟酸雨降低了鼎湖山森林土壤表层的pH值,使得土壤酸化加剧;同时,降低了鼎湖山森林土壤微生物量碳、氮含量,抑制了微生物活性。而从降低的幅度和显著性可看出,3个林型土壤酸化和微生物活性对模拟酸雨的响应敏感性随森林的顺行演替而增强,处于演替后期的阔叶林敏感性最强。表现为:与CK处理相比,松林、混交林和阔叶林表层平均土壤pH值在T1、T2和T3处理分别下降了0.01、0.01和0.04,0.01、0.06和0.07,0.04、0.09和0.10。相应地,土壤微生物碳含量分别下降了-1.0%、2.7%和0.4%,4.2%、4.4%和13.6%,12.3%、12.6%和18.4%;土壤微生物量氮含量则分别下降了0.8%、4.2%和9.7%,5.4%、17.4%和15.6%,12.3%、16.2%和25.1%。
同时,模拟酸雨对土壤的酸化效应和对土壤微生物活性的抑制效应大体上会随着模拟酸雨处理时间的延长而逐渐显著。以阔叶林为例,表现为实验初期,模拟酸雨并没有显著降低其表层的土壤pH值和土壤微生物量碳、氮含量,而在2011年6月和12月及2012年6月(模拟酸雨24、30和36个月后),T3和T2处理的土壤pH值显著低于CK 和T1处理(P<0.05);在2011年6月和2013年3月(模拟酸雨24和45个月后),T3处理的土壤微生物量碳、氮含量显著低于CK处理,2012年6月(模拟酸雨36个月后)T3和T2处理的土壤微生物量碳、氮含量显著低于CK和T1处理(P<0.05)。结果同时表明,总体上只有强酸处理T3均显著降低了混交林和阔叶林的土壤pH值和土壤微生物量碳、氮含量,其中在2011年6月,与CK处理相比,两个林型土壤pH值在T3处理的下降幅度均达0.14;在2013年3月,混交林和阔叶林土壤微生物量碳含量下降幅度分别达到29.06%和36.90%,土壤微生物量氮含量则为49.53%和30.66%。
3 讨论
土壤是森林生态系统中酸雨的最终受体,土壤pH值下降是土壤酸化的最直接指标,能反应酸雨下土壤酸化的敏感性(刘源月等,2010)。本研究中,土壤表层和次层均为强酸性土壤,与1994年和1996年的测定结果(刘菊秀等,2003c)相比有下降的趋势,说明土壤有继续酸化的可能。经过三年多的模拟酸雨处理,阔叶林表层土壤pH值显著地降低,混交林表层土壤pH值的降低程度也接近显著(表2,图2),这表明土壤酸化加剧的趋势。许多在亚热带和温带森林相关的研究也表明,模拟酸雨降低了土壤pH值(Neuvonen和Suomela,1990;谢小赞等,2009;刘源月等,2010)。
由于各研究区域的气候条件、土壤营养状况以及植被类型等不同,模拟酸雨对土壤微生物活性的影响往往不一致。例如,Greszta等(1992)的研究结果表明,酸雨使细菌如氨化细菌、固氮细菌的数量减少,且硝化作用、纤维素分解及土壤呼吸均受到酸雨的抑制。但也有研究表明,模拟酸雨单独或联合重金属处理均不影响微生物总生物量(Pennanen等,1998)。Blagodatskaya和Anderson (1999)甚至还观察到,随着模拟酸雨中H+浓度增加,土壤微生物量碳含量呈增加的趋势。在本实验中,混交林和阔叶林的T3处理显著降低了土壤微生物量碳、氮含量(表2,图3),结果与一些温带和亚热带的报道一致(Pennanen等,1998),表明了模拟酸雨抑制了土壤微生物活性。
土壤微生物对环境变化十分敏感,而土壤温度和土壤湿度无疑是影响土壤微生物活性的重要因素(丛静等,2014),但在本实验中,土壤温度和土壤湿度在各处理间无明显差异(表2,图1),这一方面表明我们所选样地在各处理间土壤环境比较均一,另一方面表明模拟酸雨对土壤温湿度影响较小,所以微生物活性的差异不是由于土壤温湿度差异导致的。而模拟酸雨下土壤微生物活性的抑制可能与酸雨胁迫下土壤持续酸化有关,因为酸化的土壤由于H+的毒害作用,能改变土壤分解者微生物种类、结构以及生物活性(Falappi等,1994)。高志红等(2004)也指出各种微生物都有最适宜的pH值范围,pH值过低会对微生物活性产生抑制作用。有研究者在德国中部地区森林进行了土壤酸梯度实验,结果发现,当土壤pH值小于5的时候,土壤微生物量明显减少(Joergensen等,1995)。一方面,酸雨的酸化累积效应会加速了营养元素从森林土壤的流失(Renner等,1995),即在酸雨作用下,土壤一方面消耗来自淋入液的H+,同时释放出K+、Na+、Ca2+和Mg2+等阳离子(Turner和Tingey,1990),导致微生物可利用的营养源减少;另一方面,酸雨的酸化累积活化了土壤中重金属和Al等有害元素,如汪雅各等(1988)的研究结果也表明,在pH值为3.5以下的模拟酸雨70 d淋洗后,土壤中重金属浓度增加,对土壤微生物产生毒害作用(Friedland等,1990)。
由于土壤在短期内对酸雨具有一定的缓冲能力,在实验的初期,模拟酸雨没有显著降低土壤pH值,而随着模拟酸雨处理的时间延长,这种下降效应才变得显著。而纵观整个实验周期的土壤微生物量碳、氮含量的动态变化也可以看出,随着模拟酸雨的进行,酸雨处理对土壤微生物活性的影响逐渐明显,并在实验的后期达到显著差异,这与土壤pH值的下降趋势相对应,表明酸雨对土壤微生物活性的抑制作用也是一个逐渐累积的过程。
处于不同演替阶段的森林其土壤酸化和土壤微生物活性对模拟酸雨响应的敏感性有所不同,处于演替早期的松林,其响应敏感性明显低于演替中期的混交林和演替后期的阔叶林。我们推测3个森林土壤酸化和土壤微生物活性对模拟酸雨响应差异的原因在于其土壤层和凋落物层的差异,而这最终也是源于不同演替阶段的差异。首先,3个林型土壤层缓冲酸雨的能力不同。土壤类型不同,盐基饱和度和土壤pH值会有所不同,对酸雨的缓冲能力亦不一样(周青和黄晓华,2002)。与混交林和阔叶林的情况不同,实验期间内,松林的土壤pH值在不同模拟酸雨处理间并没有显著差异,表明其土壤未发生酸化。俞元春等(2001)指出,酸雨下的土壤酸化跟原土壤的pH值密切相关,原土壤的pH值越低,在酸雨胁迫下越容易发生土壤酸化,反之亦然。一方面,本实验中,松林对照样方的土壤pH值显著高于混交林和阔叶林(表2,图2),暗示着松林土壤抗酸化能力强于其他两个林型。另一方面,鼎湖山森林土壤盐基饱和度随着森林的顺行演替而降低,即阔叶林<混交林<松林(温达志等,2000),这也意味着松林土壤缓冲酸雨的能力最强。其次,3个林型凋落物层缓冲酸雨的能力不同。凋落物层是酸雨作用于森林土壤亚系统的最先承受者,Salim等(1994)的研究表明,土壤表层凋落物通过自身的盐基离子与酸雨中的H+交换,致使盐基离子迅速淋溶,从而缓解酸雨的酸化作用。虽然鼎湖山森林年凋落物输入量随着森林的顺行演替而增加,但由于凋落物分解速率也是随着森林的顺行演替而加快(Huang等,2011),这导致了3个林型凋落物现存量与凋落物输入量呈现相反的趋势,即松林>混交林>阔叶林。因此,松林较厚的凋落物层的酸雨缓冲能力强于混交林和阔叶林。刘楠等(2011)在中国西南部亚热带森林的研究结果也表明,在6种森林类型中,松林凋落物层的酸雨缓冲能力最强。综上所述,松林土壤和凋落物层具有较强的酸雨缓冲能力,在模拟酸雨胁迫下没有发生土壤酸化。因此,在模拟酸雨下,松林没有出现类似混交林和阔叶林的土壤微生物活性降低的效应。
4 结论
综上所述,鼎湖山不同演替阶段森林土壤pH值和土壤微生物量碳氮对模拟酸雨的响应可以得出以下结论:
(1)模拟酸雨没有显著影响松林的土壤pH值和土壤微生物量碳、氮含量,但却显著地降低阔叶林的这3个指标(P<0.05),而对混交林的降低程度也接近显著;这表明3个林型土壤酸化和土壤微生物活性对模拟酸雨的响应敏感性随森林的顺行演替而增强;我们推测3个森林对模拟酸雨出现响应差异的原因在于其土壤层和凋落物层的差异,而这最终也是源于不同演替阶段的差异。
(2)模拟酸雨对土壤pH值和土壤微生物量碳、氮含量的处理效应随着模拟酸雨处理时间的延长而逐渐显现,处理间的差异只在测定周期的后期才逐渐达到显著水平(P<0.05),这表明酸雨对土壤酸化和土壤微生物活性的影响是一个逐渐累积的过程。
参考文献:
BLAGODATSKAYA E V, ANDERSON T H. 1999. Adaptive responses of soil microbial communities under experimental acid stress in controlled laboratory studies [J]. Applied Soil Ecology, 11(2-3): 207-216.
BROOKES P C, LANDMAN A, PRUDEN G, et al. 1985. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil [J]. Soil Biology and Biochemistry, 17(6): 837- 842.
BUSCH G, LAMMEL G, BEESE F O, et al. 2001. Forest ecosystems and the changing patterns of nitrogen input and acid deposition today and in the future based on a scenario [J]. Environmental Science and Pollution Research, 8(2): 95-102.
FALAPPI D, FARINI A, RANALLI G, et al. 1994. Effects of simulated acid rain on some microbiological parameters of subacid soil [J]. Chemosphere, 28(6): 1087-1095.
FRIEDLAND A J. 1990. The movements of metals through soils and ecosystems [M]. In: Shaw AJ, ed. Heavy-metal tolerant plants. Boca Raton: CRC Press, 7-19.
GRESZTA J. 1992. Humus degradation under the influence of simulated acid rain [J]. Water, Air, and Soil Pollution, 63(1-2): 51-66.
HUANG Y H, LI Y L, XIAO Y, et al. 2011. Controls of litter quality on the carbon sink in soils through partitioning the products of decomposing litter in a forest succession series in South China [J]. Forest Ecology and Management, 261(7): 1170-1177.
JENKINSON D S, DAVIDSON S A, POWLSON D S. 1979. Adenosine triphosphate and microbial biomass in soils [J]. Soil Biology and Biochemistry, 2: 521-527.
JENKINSON D S. 1987. Determination of microbial biomass carbon and nitrogen in soil [M]. In: Wilson JR, eds. Advances in N Cycling in Agricultural Ecosystem. Wallingford, UK: Commonwealth Agricultural Bureau International press: 368-386.
JOERGENSEN R G, ANDERSON T H, WOLTERS V. 1995. Carbon and nitrogen relationships in the microbial biomass of soils in beech (Fagus sylvatica L) forests [J]. Biology and Fertility of Soils, 19(2-3): 141-147.
KRUG E C, FRINK C R. 1983. Acid rain on soils: a new perspective [J]. Science, 221(4610): 520-525.
LIANG G , LIU X , CHEN X, et al. 2013. Response of soil respiration to acid rain in forests of different maturity in southern China [J]. PLoS ONE, 8(4): e62207.
NEUVONEN S, SUOMELA J. 1990. The effects of simulated acid rain on pine needle and birch leaf litter decomposition [J]. Journal of Applied Ecology, 2(3): 857-872.
COLE D W, RAPP M. 1981. Elemental cycling in forest ecosystems [M]. In: Heichle D E(ed) Dynamic Properties of Forest Ecosystems. London: Cambridge University Press: 341- 409.
PENNANEN T, FRITZE H, VANHALA P, et al. 1998. Structure of a Microbial Community in Soil after Prolonged Addition of Low Levels of Simulated Acid Rain [J]. Applied and Environmental Microbiology, 64(6): 2173-2180.
RENNER R. 1995. “Scientific uncertainty” scuttles new acid rain standard [J]. Environmental science and technology, 29(10): 464-466.
SALIM R, KHALAF S. 1994. A role for decaying leaves in mitigating the harmful effects as acid rain [J]. Journal of Environmental Science and Health. Part A: Environmental Science and Engineering and Toxicology, 29(1): 115-127.
SEDJO R A. 1993. The carbon cycle and global forest ecosystem [J].Water, Air, and Soil Pollution, 70(1): 295-307.
TURNER D P, TINGEY D T. 1990. Foliar leaching and root uptake of Ca, Mg and K in relation to acid fog effects on Douglas-fir [J]. Water, Air, and Soil Pollution, 49(1-2): 205-214.
VANHALA P, FRITZE H, NEUVONEN S. 1996. Prolonged simulated acid rain treatment in the subarctic: Effect on the soil respiration rate and microbial biomass [J]. Biology and Fertility of Soils, 23(1): 7-14.
WARDLE D A. 1992. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil [J]. Biological Reviews, 67(3): 321-358.
ZHOU G Y, LIU S G, LI Z A, et al. 2006. Old-Growth forests can accumulate carbon in soils [J]. Science, 314(5804): 1417.
丛静, 刘晓, 卢慧, 等. 2014. 神农架自然保护区土壤微生物生物量碳氮沿海拔梯度的变化及其影响因素[J]. 生态学杂志, 33(12): 3381-3387.
高志红, 张万里, 张庆费. 2004. 森林凋落物生态功能研究概况及展望[J]. 东北林业大学学报, 32(6): 79-80, 83-83.
何容, 汪家社, 施政, 等. 2009. 武夷山植被带土壤微生物量沿海拔梯度的变化[J]. 生态学报, 29(9): 5138-5144.
何振立. 1997. 土壤微生物生物量及其在养分循环和环境质量评价中的意义[J]. 土壤, 29(2): 61-69.
黄展帆, 范征广. 1982. 鼎湖山的气候[J]. 热带亚热带森林生态系统, 1(1): 11-23.
刘菊秀, 张德强, 周国逸, 等. 2003a. 鼎湖山酸沉降背景下主要森林类型水化学特征初步研究[J]. 应用生态学报, 14(8): 1223-1228.
刘菊秀, 周国逸, 褚国伟. 2003b. 鼎湖山季风常绿阔叶林土壤酸度对土壤养分的影响[J]. 土壤学报, 40(5): 763-767.
刘菊秀, 周国逸, 张德强. 2003c. 酸雨对鼎湖山土壤的累积效应及荷木的反应[J]. 中国环境科学, 23(1): 90-94.
刘楠, 王玉杰, 赵占军, 等. 2011. 西南亚热带典型林分枯落物层对酸沉降的响应[J]. 水土保持学报, 25(2): 108-120.
刘源月, 江洪, 李雅红, 等. 2010. 模拟酸雨对杉木幼苗-土壤复合体系土壤呼吸的短期效应[J]. 生态学报, 30(8): 2010-2017.
潘根兴, 冉炜. 1994. 中国大气酸沉降与土壤酸化问题[J]. 热带亚热带土壤科学, 3(4): 243-252.
漆良华, 张旭东, 周金星, 等. 2009. 湘西北小流域不同植被恢复区土壤微生物数量、生物量碳氮及其分形特征[J]. 林业科学, 45(8): 14-20.
邵宗臣, 何群, 王维君. 1997. 模拟酸雨对红壤铝形态的影响[J]. 热带亚热带土壤科学, 6(3): 187-193.
汪雅各, 盛沛麟, 袁大伟. 1988. 模拟酸雨对土壤金属离子的淋溶和植物有效性的影响[J]. 环境科学, 9(2): 22-26.
温达志, 周国逸, 孔国辉, 等. 2000. 南亚热带酸雨地区陆地生态系统植被、土壤与地表水现状的研究[J]. 生态学杂志, 19(5): 11-18.
吴丹, 王式功, 尚可政. 2006. 中国酸雨研究综述[J]. 干旱气象, 24(2): 70-77.
谢小赞, 江洪, 佘树全, 等. 2009. 模拟酸雨胁迫对马尾松和杉木幼苗土壤呼吸的影响[J]. 生态学报, 29(10): 5713-5720.
徐义刚, 周光益, 吴仲民, 等. 2001. 广州市典型森林区酸雨的化学组成、季节变化及其成因探讨[J]. 生态学报, 21(11): 1775-1781.
杨宗慧. 2002. 我国酸雨状况和对策[J]. 云南环境科学, 21(1): 24- 26.
俞元春, 丁爱芳, 胡茄, 等. 2001. 模拟酸雨对土壤酸化和盐基迁移的影响[J]. 南京林业大学学报(自然科学版), 25(2): 39-42.
赵艳霞, 侯青, 徐晓斌, 等. 2006. 2005年中国酸雨时空分布特征[J]. 气候变化研究进展, 2(5): 242-245.
周青, 黄晓华. 2002. 酸雨对陆地生态系统影响与防治研究[J]. 自然杂志, 24(6): 315-320.
Responses of Soil pH Value and Soil Microbial Biomass Carbon and Nitrogen to Simulated Acid Rain in Three Successional Subtropical Forests at Dinghushan Nature Reserve
LIANG Guohua1, WU Jianping2, 3, XIONG Xin2, 3, WU Xiaoying1, CHU Guowei2, ZHOU Guoyi2, ZENG Rensen1, ZHANG Deqiang2*
1. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China; 2. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 3 University of Chinese Academy of Sciences, Beijing 100039, China
Abstract:Determining the effects of elevated acid rain on forest soil acidification and soil microbial activity can provide useful information for understanding of the process of carbon and nitrogen cycle of forest ecosystem and its response to global change. Therefore, a simulated acid rain (SAR) experiment was conducted in three subtropical forests of different successional stages [i.e. a young pine forest (PF), a transitional mixed conifer and broadleaf forest (MF), and an old-growth broadleaved forest (BF)] at the Dinghushan Nature Reserve. Acid rain treatments included CK (the local lake water, pH 4.5), T1 (pH 4.0), T2 (pH 3.5), and T3 (pH 3.0) with three replicates. SAR experiment was initiated in June 2009. Responses of soil pH value and soil microbial biomass carbon and nitrogen to the SAR were studied from December 2009 to March 2013. The repeated measures ANOVA showed that, during the study period, the SAR did not affect soil pH value and soil microbial biomass carbon and nitrogen in the PF (P>0.05), but it significantly reduced soil pH value and soil microbial biomass carbon and nitrogen in the BF (P<0.05), and the reduction was marginally significant in the MF. Compared with the CK treatment, mean rate of soil pH value were 0.01~0.04, 0.01~0.07, and 0.04~0.10 lower in the acid treatment plots in the PF, MF, and BF, respectively; similarly, mean rate of soil microbial biomass carbon were -1.0%~0.4%, 4.2%~13.6%, and 12.3%~18.4% lower, and mean rate of soil microbial biomass nitrogen were 0.8%~9.7%, 5.4%~17.4%, and 12.3%~25.1% lower in the acid treatment plots in the PF, MF, and BF, respectively. These results indicated the aggravation of soil acidification and the inhibition of soil microbial activity under the SAR in our forests, and more over, the sensitivity of the response of soil acidification and soil microbial activity to the SAR showed an increasing trend with the progressive succession of three forests. In addition, by analyzing the responses of soil pH value and soil microbial biomass carbon and nitrogen of each year, we found that these negative effects had been strengthened over time with significant difference among treatments occurred only in the later period of the experiment. Take the BF for example, treatment effects was not evident in the initial stage of this study. However, after exposing to the SAR for 24, 30, and 36 months, soil pH value of the T3 and T2 treatments were significant lower than the CK and T1 treatments; similarly, soil microbial biomass carbon and nitrogen of the T3 treatment were significant lower than the CK treatment after exposing to the SAR for 24, 36, and 45 months. These results indicated that the acidification and the inhibition of soil microbial activity under the SAR was a gradual process in the forests.
Key words:simulated acid rain; soil acidification; soil microbial activity; forests of different successional stages; Dinghushan Nature Reserve
收稿日期:2015-04-22
*通信作者:张德强,研究员。E-mail: zhangdeq@scib.ac.cn
作者简介:梁国华(1985年生),男,博士,主要从事森林生态学研究。E-mail: lianggh@scbg.ac.cn
基金项目:中国博士后科学基金项目(2014M552207);广东省科技计划项目(2014A020216031;2014A020216028)
中图分类号:Q 948; X171
文献标志码:A
文章编号:1674-5906(2015)06-0911-08
DOI:10.16258/j.cnki.1674-5906.2015.06.001
