重组囊素肽的构建表达及其对禽流感灭活苗免疫效果的影响
2015-03-09姬向波徐秋良冯秀丽陈溥言
姬向波,徐秋良,冯秀丽,陈溥言*
(1.河南牧业经济学院,河南 郑州 450016;2.南京农业大学 动物医学学院,江苏 南京 210095)
法氏囊组织提取物中含有多种具有生物活性的短肽,其中囊素三肽(Bursin,BS)已被证实对哺乳动物和禽类具有增强体液免疫功能,特别是对禽类法氏囊具有保护作用[1-5];李德远等分离到的法氏囊五肽(Bursopentin,BP5),不仅能够促进B 细胞分泌抗体,还能够促进细胞因子分泌和增强细胞毒性T 淋巴细胞的杀伤活性[6]。因此,对法氏囊活性肽的研究具有良好的生产应用价值。目前常用的制备囊素活性肽的方法有:从天然组织中分离提取或利用化工技术人工合成。组织提取的囊素肽纯化难度大,杂蛋白含量高;化学合成的囊素肽虽然纯度极高,但成分单一且成本较高,不适合在动物生产中推广应用[7]。王臣等利用大肠杆菌串联表达BS 及囊素样肽,经小鼠模型证实其具有较好的免疫增强作用[8],为体外大量制备囊素活性肽及其作为免疫增强剂的应用提供了新的思路。
本实验选择以BS 和BP5 的氨基酸序列为基本单元,设计了3 种不同的肽片段串联体,利用PCR技术扩增串联体编码基因,分别将其克隆至表达载体,以大肠杆菌(E.coli)为表达宿主菌,表达重组囊素肽,并通过动物实验研究其作为疫苗免疫增强剂的效果。
1 材料和方法
1.1 主要实验材料及实验动物 H9 亚型禽流感病毒(AIV)株A/Duck/Jiangsu/NJ08/05 由江苏省农业科学院郑其升博士惠赠,病毒滴度为108.3EID50/0.1 mL;H9 亚型AIV 灭活疫苗为青岛易邦生物工程有限公司产品;H9 亚型AIV 血凝抗原及阳性血清购自中国农业科学院哈尔滨兽医研究所;人工合成的BS和BP5 购自西安华辰生物科技有限公司;表达载体pET-32a、宿主菌DH5α、OrigamiTMB(E.coli OB)、兔抗鼠KLH-BS 多克隆抗体均由南京农业大学农业部动物重点免疫实验室保存。1 日龄海兰褐蛋鸡120羽购自郑州正德牧业有限公司,实验鸡父母代均为同一批次饲养的种鸡,AIV 抗体检测为阴性,按常规饲养方法饲养。
1.2 主要试剂 高保真Pyrobest DNA 聚合酶和各种限制性内切酶、质粒提取试剂盒和凝胶纯化试剂盒购自宝生物工程(大连)有限公司;DNA 低分子量Marker 购自生工生物工程(上海)有限公司;SDSPAGE 低分子量Marker 购自创瑞公司;水溶性四唑盐(WST-1)细胞增殖检测试剂盒购自上海碧云天生物技术有限公司;鸡细胞因子ELISA 检测试剂盒购自美国R&D 公司。
1.3 重组囊素肽的设计与基因扩增 根据文献[9],选择BS 和BP5 氨基酸序列KHG 和CKDVY 作为串联表达对象,设计了3 种串联模式(表1),按照E.coli 偏嗜性密码子分别设计3 种串联肽的扩增引物,基因合成采用重叠延伸PCR(SOE-OCR)进行扩增。引物均由上海Invitrongen 公司合成。

表1 3 种串联囊素肽及SOE-PCR 扩增引物Table 1 Primers of three tandem bursa peptides
1.4 重组表达质粒的构建 采用SOE-PCR 扩增获得3 段基因并经Eco RⅠ/Hin dⅢ双酶切后,分别克隆于表达载体pET-32a 中,构建重组质粒pET-BS1、pET-BS2、pET-BS3,并转化至E.coli DH5α。由于3种重组囊素肽基因片段太小,对提取的重组质粒进行双酶切鉴定时无法区分假阳性,因此采取缺失酶切位点鉴定,阳性克隆由上海博亚生物技术有限公司测序。
1.5 重组蛋白的诱导表达、鉴定及纯化 将测序正确的3 种重组质粒分别转化至E.coli OB 中。37 ℃振摇培养,至OD600nm约为0.4~0.6 时,以终浓度为1 mM 的IPTG,于22 ℃进行诱导表达。菌液离心后收集上清和沉淀,裂解处理后进行SDS-PAGE,检测表达产物表达形式。并采用兔抗鼠KLH-BS 多克隆抗体为一抗,进行western blot 鉴定。
鉴定正确的重组蛋白采用Ni 柱亲和层析进行纯化。并将其经PBS 透析浓缩,得到纯度极高的3 种重组囊素肽,分别命名为BS1、BS2、BS3。经分光光度仪检测定量后冷冻干燥备用。
1.6 动物的分组与免疫 具体免疫剂量和分组详见表2。首免时间为7 日龄,二免时间为30 日龄,两次免疫均采用颈部皮下注射。

表2 实验设计Table 2 Experimental design
1.7 血清的采集与分析 分别于两次免疫后第14 d,每组随机抽取10 只鸡,翅静脉采血,分离血清,按照OIE 血凝抑制(HI)试验标准操作方法[10],进行血清HI 效价的测定。于第二次免疫后第7 d,每组随机抽取10 只鸡,采血,分离血清,采用商品化检测试剂盒检测血清中IL-4 和IFN-γ 的含量。
1.8 外周血淋巴细胞增殖试验 于第二次免疫后第7 d,每组随机抽取10 只鸡,EDTA-肝素钠抗凝采血,参考文献[11]方法分离淋巴细胞。采用改良的淋巴细胞增殖试验WST-1 法,将淋巴细胞接种至96 孔细胞培养板内,以10 μL ConA(10 μg/mL)抗原刺激,同时设立空白对照。刺激48 h 后,每孔加入10 μL WST-1 溶液。在细胞培养箱内继续孵育4 h。采用酶标仪测定OD450nm值,以630 nm 为参考波长,分析细胞增殖情况。
1.9 数据处理 所有数据均采用SPSS15.0 软件进行统计分析,以LSD Test 进行差异显著性检验。
2 结果
2.1 串联囊素肽的PCR 扩增及序列验证 采用SOE-PCR 扩增法,利用表1 中引物对BS1、BS2、BS3基因进行扩增,经琼脂糖凝胶电泳检测,结果表明,在100 bp 处有特异的目的片段(图1)。将其回收、酶切后克隆至表达载体pET-32a 中。根据测得序列推导氨基酸序列,与设计的3 种串联囊素肽氨基酸残基完全一致,表明串联囊素肽基因正确插入至表达载体pET-32a 的多克隆位点。
2.2 重组囊素肽的表达及鉴定 将pET-BS1、pETBS2、pET-BS3分别转化E.coli OB 进行诱导表达后,分别取上清和沉淀进行SDS-PAGE,结果显示3 株阳性重组菌的表达上清约在21 ku 各有一条带,而沉淀和pET-32a/OB 诱导后上清无相应条带,表明重组囊素肽主要以可溶形式表达(图2)。Western blot结果显示,3 个重组蛋白在21 ku 均出现特异性条带,表明3 种表达产物均可以与兔抗鼠KLH-BS 多克隆抗体特异性结合,具有良好的免疫原性(图2)。
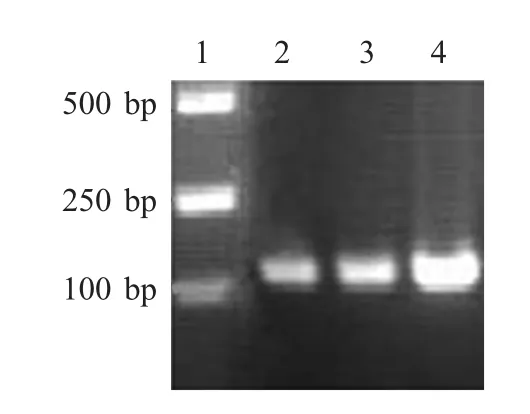
图1 3 种串联囊素肽基因的PCR 结果Fig.1 Amplifications of three tandem bursa pepties by PCR

图2 3 种重组蛋白表达的SDS-PAGE 检测(A)和western blot(B)鉴定Fig.2 Detection and identification of three recombinant proteins expression by SDS-PAGE(A)and western blot(B)
2.3 HI 抗体动态变化分析 每组实验鸡于免疫后第14 d 采血,通过HI 试验检测抗体产生的情况。结果显示,两次免疫后,与单独免疫灭活AIV 组和商品化疫苗组相比,以重组囊素肽和人工合成囊素肽为免疫增强剂组,抗体水平均显著增高(p<0.05),其中BS3促进抗体提高的水平低于其它两种重组囊素肽。加强免疫后,以重组囊素肽为免疫增强剂组的抗体水平显著低于以人工合成囊素肽为免疫佐剂组(p<0.05)(图3)。
2.4 血清中细胞因子变化分析 第二次免疫后第7 d,采血分离血清,采用细胞因子ELISA 检测试剂盒检测IL-4 和IFN-γ,结果显示,与单独免疫灭活AIV组和商品化疫苗组相比,3 种重组囊素肽和人工合成BP5 均能够明显提高鸡血清中IL-4 含量(p<0.05),其中重组囊素肽BS1和人工合成BP5 的效果基本相同;但与商品化疫苗组相比,BS2、BS3仅能够提高鸡血清中IL-4 含量的升高,对IFN-γ 的产生无明显影响(图4)。

图3 免疫后AIV 血凝抗体滴度Fig.3 Antibody titer of AIV
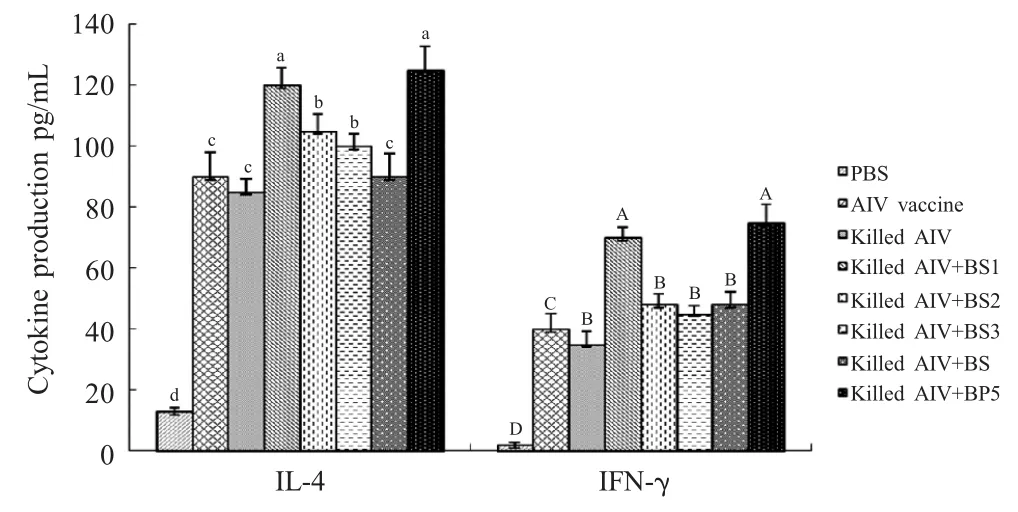
图4 免疫后血清细胞因子水平Fig.4 Cytokine response to vaccination
2.5 外周血淋巴细胞增殖情况 第二次免疫后第7 d,翅静脉抗凝采血,分离淋巴细胞,ConA 进行刺激,检测外周血淋巴细胞的增殖情况。结果显示,使用重组囊素肽BS1和人工合成BP5 作为免疫佐剂的淋巴细胞增殖活性最强,两组之间无明显差异,并且明显高于对照组和其它免疫组(p<0.05);以BS2、BS3为免疫佐剂组的淋巴细胞的增殖活性高于单独使用灭活AIV 免疫组,并且差异显著(p<0.05),但与AIV 疫苗免疫组相比差异不显著;而以人工合成的BS 作为免疫佐剂组与单独使用灭活AIV 组相比差异也不显著(图5)。
3 讨论
临床应用显示,以法氏囊组织培养制备的传染性法氏囊炎病毒疫苗的免疫保护率明显高于其它类型的疫苗[12]。另外,胸腺提取物、小牛脾提取物也被广泛地当作免疫增强剂应用。这些均表明,在动物免疫器官中存在许多未知的免疫活性分子。将一定量BS 与疫苗联合使用,能够提高疫苗的免疫保护效果,并对免疫器官有一定程度的保护作用,为法氏囊活性肽作为疫苗佐剂提供了实验依据[3-5]。研究表明,利用基因工程技术制备的重组胸腺肽与天然胸腺肽具有相同的生物学活性[13-14]。为探索体外大量获取囊素活性肽的有效方法,本实验以E.coli为宿主菌,选取能够增强体液免疫的BS 和对T、B淋巴细胞具有双重活性的BP5 为串联表达对象,分别以BP5 单体重复串联、BP5 与BS 间隔重复串联的排列方式,表达包含不同氨基酸序列的重组囊素肽。为获得高效的表达产量,选用与pET-32a 相匹配的表达菌株OrigamiTMB,可以在胞质中促进二硫键的形成,这样的组合有利于获得较高产量的可溶性、具有活性的目的蛋白。同时,采用低温22 ℃延长诱导时间,使3 种重组囊素肽均以可溶性大量表达。
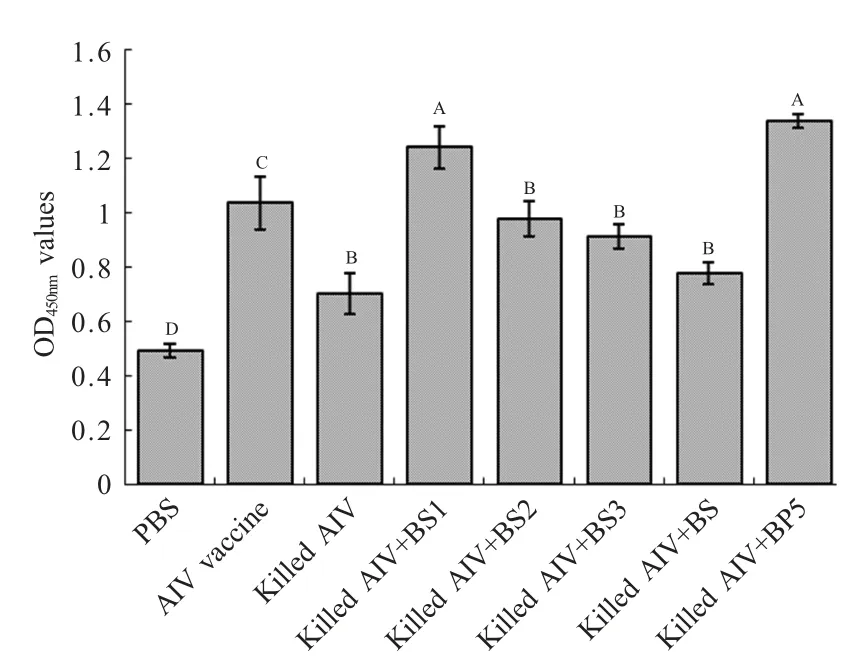
图5 免疫后各组外周血淋巴细胞增殖能力结果Fig.5 Lymphocyte proliferation response after vaccination
IL-4 和IFN-γ 分别属于Th2 型和Th1 型细胞因子,是细胞免疫和体液免疫的重要调节因子[15-16]。对3 种重组囊素肽联合灭活AIV 免疫雏鸡的免疫效果检测表明,原核表达的3 种重组囊素肽,均能够不同程度地提高鸡对灭活AIV 的免疫应答,但这种作用在加强免疫时不太明显;其中以BP5 单体重复串联的BS1对提高T 淋巴细胞免疫和抗体分泌均有明显作用,效果与人工合成囊素肽相当;而以BP5和BS 间隔串联的BS2和BS3仅表现出增强Th2 型细胞因子分泌的作用。表明重组囊素肽的免疫增强作用与文献报道的BP 和BP5 的生物学活性基本一致,实验中设计将BP5 和BS 以不同方式串联后并未产生免疫增强的叠加效应。
研究表明,具有免疫活性的小分子多肽,因其结构简单,分子量小,能够通过细胞膜的渗透以原型形式直接进入细胞内,并且对机体不具有免疫原性,能够多次重复使用仍保持良好的活性[17]。天然提取和人工合成的BS 和BP5 分别由3 个和5 个氨基酸组成,空间结构简单,而原核表达产物BS1、BS2和BS3,则是多个BS 和BP5 的多个串联体,空间结构复杂,免疫原性增强;而且3 种串联体中均含有两个或更多的半胱氨酸,是否会形成链内二硫键本实验还未验证。另外,重组多肽通过注射方式进入体内后,将如何被机体吸收还未可知,是否会影响其免疫活性还需进一步研究,本实验室将在后期的研究中探索其发生机制。本研究为重组囊素肽的制备和临床应用提供了一定的实验依据。
[1]Glick B.Bursa of Fabricius:development,growth,modulation and endocrine function[J].CRC Crit Rev Poult Biol,1988,1:107-132.
[2]Audhya T,Kroon D,Heavner G,et al.Tripeptide structure of bursin,a selective B-cell-differentiating hormone of the bursa of fabricius[J].Science,1986,231(4741):997-999.
[3]王川庆.囊素三肽免疫调节机理研究及其单克隆抗体杂交瘤细胞株的建立[D].南京:南京农业大学,1998.
[4]张秀根,蒋贻海,范根成,等.法氏囊活性肽对新城疫油乳剂灭活苗免疫效果的初步研究[J].中国兽医杂志,1998,24(11):48-49.
[5]侯艳红,钱建飞,张焕铃,等.法氏囊活性肽对鸡传染性法氏囊炎病弱毒疫苗免疫效果的影响[J].江苏农业学报,2001,(17):231-235.
[6]Li De-yuan,Geng Zi-rong,Zhu Hong-fei,et al.Immunomodulatory activities of a new pentapeptide(Bursopentin)from the chicken bursa of Fabricius[J].Amino Acids,2011,40(2):505-515.
[7]李萍,毕英佐,曹永长,等.囊素三肽的基因克隆和表达[J].中国兽医杂,2006,42(4):7-10.
[8]Wang Ceng,Wen Wen-yan,Su Chun-xia,et al.Bursin as an adjuvant is a potent enhancer of immune response in mice immunized with the JEV subunit vaccine[J].Vet Immunol Immunop,2008,122(3-4):265-274.
[9]高立,祁小乐,高小龙,等.鸡传染性法氏囊炎病毒超强毒株VP2 基因突变对细胞嗜性改变的研究[J].中国预防兽医学报,2010,32(10):747-751.
[10]Feng Xiu-li,Cao Rui-bing,Zhou Bing,et al.The potential mechanism of Bursal-dirived BPP-Ⅱon the antibody production and avian pre-B cell[J].Vaccine,2013,31(11):1535-1539.
[11]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application of proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55-63.
[12]李劲松,薛建平,郑明秋,等.鸡传染性法氏囊病组织灭活苗的免疫效力试验[J].中国畜禽传染病,1991,13(01):13-15.
[13]Aguilar J C,Rodriguez E G.Vaccine adjuvants revisited[J].Vaccine,2007,2(19):3752-3762.
[14]张巍巍.注射用人重组胸腺肽α1 免疫药效学及抗肿瘤药效学的初步研究[D].长春:吉林大学,2007.
[15]Zhou H,Buitenhuis A J,Weigend S,et al.Candiate gene promoter polymorphisms and antibody response kinetics in chickens:interferon-γ,interleukin-2,and immunoglobulin light chain[J].Poult Sci,2001,80(12):1679-1689.
[16]Zhou Huai-jun,Lamont S J.Chicken MHC class Ⅰand Ⅱgene effects on antibody response kinetics in adult chickens[J].Immunogenetics,2003,55:133-140.
[17]张从敬,张再辉,刘霞,等.复方多肽核酸溶液对雏鸡免疫增强作用的研究[J].山东农业科学,2014,46(5):115-117.
