基于重组外膜蛋白的猪流产嗜性衣原体病抗体ELISA 检测方法的建立
2015-03-09周丹娜杨克礼闫少侠刘泽文段正赢袁芳艳田永祥
周丹娜,杨克礼,闫少侠,刘泽文,段正赢,郭 锐,袁芳艳,刘 威,孟 丽,田永祥*
(1.湖北省农业科学院 畜牧兽医研究所,湖北 武汉 430064;2.动物胚胎工程及分子育种湖北省重点实验室,湖北 武汉 430064)
衣原体是一类能够引起人和多种动物患病的专性细胞内寄生的人畜共患病病原微生物,可引起结膜炎、肺炎、关节炎、肠道疾病,以及孕妇和怀孕母畜流产、死胎,给人畜健康造成严重危害[1-2]。流产嗜性衣原体(Chlamydophila abortus)在1999 年以前一直被命名为鹦鹉热衣原体血清型Ⅰ,而后Everett等根据16S rRNA 与23S rRNA 基因序列进化分析以及MOMP 基因序列中限制性酶切位点的不同,从鹦鹉热衣原体中分离出3 个新的衣原体种,即C.abortus、猫嗜性衣原体和豚鼠嗜性衣原[3]。目前,传统的衣原体病检测方法主要有细胞培养[4-5]、间接血凝试验(IHA)[6]以及竞争ELISA 试验[7]等,而这些实验方法均存在不足。如细胞培养法操作繁琐、周期长等;间接血凝试验的敏感度低;PCR 检测技术与ELISA检测方法相比,虽然灵敏度以及特异性均较好,但对设备要求较高,并且存在污染,难以适应基层工作的需要。因此,开发一种简便、高效、廉价的C.abortus 抗体检测试剂盒对于科学研究和临床检测C.abortus 的流行状况等均具有重要的意义。
本研究基于C.abortus MOMP 重组蛋白建立了检测C.abortus 抗体的ELISA 方法,为该病的防制及流行病学调查提供一种可行方法。
1 材料和方法
1.1 主要实验材料 重组MOMP 蛋白(rMOMP),C.abortus 参考阴、阳性血清,猪流行性乙型脑炎病毒(JEV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸障碍综合征病毒(PRRSV)以及猪衣原体(C.abortus)阳性血清均由湖北省农业科学院畜牧兽医研究所兽医室保存或制备;衣原体IHA 试剂盒购自兰州兽医研究所;辣根过氧化物酶标记的羊抗猪IgG(IgG-HPR)、小牛血清白蛋白组分V(BSA)购自Sigma 公司;pH 7.4 PBS 缓冲液、pH9.6 的碳酸盐缓冲液、含吐温-20 终浓度0.5 ‰的pH7.4 PBST缓冲液、含BSA 1 %的pH7.4 PBS 自配、底物缓冲液A、底物缓冲液B 购自武汉科前动物生物制品有限责任公司;临床血清样品来自湖北省内5 个不同地区的规模化猪场。
1.2 间接ELISA 抗原最佳包被浓度和最佳血清稀释度的选择将本实验室制备并纯化的rMOMP[8]用方阵法确定最佳的蛋白包被浓度和血清稀释度,具体操作如下:将rMOMP 用包被液倍比稀释包被8个浓度,第一行从1∶10 开始,100 μL/孔;4 ℃过夜,用PBST 缓冲液洗涤3 次,每次3 min;每孔加BSA 1%的pH7.4 PBS 缓冲液200 μL 进行封闭,37 ℃温育1 h,同上洗涤3 次;将参考阴、阳性血清分别从1∶12.5 稀释开始,横向倍比稀释,8 个浓度滴度,100 μL/孔,37 ℃温育1 h;同上洗涤3 次;以羊抗猪IgG-HRP(1∶5 000)为二抗,100 μL/孔,37 ℃温育1 h,同上洗涤3 次;加底物缓冲液A 和B,各1 滴,8 min 后加终止液,酶标仪测OD630nm值,根据P/N 值确定酶标二抗的最佳稀释度。
1.3 酶标二抗最佳稀释度的选择 应用已确定的最适抗原包被浓度和血清最佳稀释度来确定酶标二抗的最佳稀释度,将羊抗猪IgG-HRP 按1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶5 000 和1∶10 000 稀释,根据P/N 值确定酶标二抗的最佳稀释度。
1.4 临界值的确定 选取衣原体检测呈阴性的猪血清样品35 份,按上述实验确定的最佳反应条件进行ELISA 检测,同时设参考阴、阳性对照。根据最后的OD630nm值,计算35 份阴性血清的平均值(X)及标准偏差(SD),则阴阳性临界值为X+3SD。
1.5 间接ELISA 特异性试验 采用上述确定的反应条件,同时检测JEV、CSFV、PRV、PRRSV 以及C.abortus 阳性血清,验证所建立的ELISA 方法的特异性。
1.6 间接ELISA 敏感性试验 将C.abortus 参考阳性血清分别做1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400 稀释,按上述步骤进行间接ELISA 试验,检测该ELISA 方法的敏感性。
1.7 间接ELISA 重复性试验 采用3 块不同批次的ELISA 板同时检测6 份临床血清样品,每份血清做3 个重复,计算不同批次间的变异系数。
1.8 符合率试验 利用建立的ELISA 方法与IHA试验对来自湖北省5 个不同规模化猪场的62 份随机血清样品进行检测,比较二者的符合率。
2 结果
2.1 ELISA 反应条件的确定 采用方阵滴定法确定rMOMP 的包被浓度和待检血清稀释度,并在该基础上对各个条件进行优化,结果如表1 所示。
2.2 阴阳性临界值的判定 根据35 份衣原体抗体阴性血清检测结果的OD630nm(图1),计算其临界值其中SD=0.053,临界值=0.18+3×0.053=0.34,即 OD630nm≥0.34 者判为阳性,OD630nm<0.34 者判为阴性。

表1 ELISA 检测方法的反应条件优化结果Table 1 The optimized conditions of ELISA

图1 阴性样品结果正态分布图Fig.1 Negative samples normal distribution diagram
2.3 特异性试验结果 选择临床上引起猪流产的常见病原,如JEV、CSFV、PRV 以及PRRSV 的阳性血清,按1:50 的最佳稀释度进行ELISA 检测。结果显示,该ELISA 方法只与C.abortus 阳性血清反应,OD630nm值为0.985(表2),表明建立的ELISA 方法具有良好的特异性。

表2 特异性试验结果Table 2 The result of cross-reactivity test
2.4 敏感性试验结果 将C.abortus 参考阳性血清分别倍比稀释进行ELISA 试验,结果显示,当血清稀释800 倍时,经该ELISA 方法仍然可以检测出阳性结果(图2),表明该方法具有良好的敏感性。
2.5 重复性试验结果 采用3 块不同批次的ELISA板同时检测6 份临床血清样品,结果表明,不同批次的ELISA 板,其变异系数最大为6.70 %,最小为3.15 %,均小于10 %(表3),表明不同批次包被板具有良好的重复性。
2.6 与IHA 试验方法的比较结果 利用本研究建立的ELISA 方法和IHA 方法对来自湖北省5 个不同规模化猪场的62 份随机血清样品进行检测,结果显示ELISA 方法检测的阳性率83.87 %(52/62),IHA检测阳性率为70.97 %(44/62),两种方法的总符合率为87.09 %(54/62)(表4)。
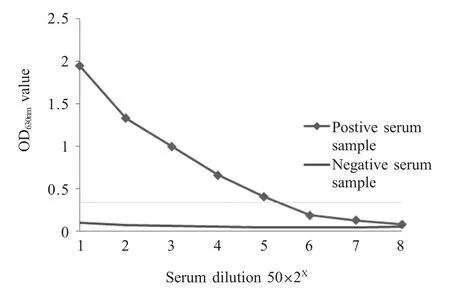
图2 阴/阳性血清敏感性试验结果Fig.2 Sensitivity assay of negtive and positive serum samples

表3 间接ELISA 3 批次诊断试剂重复性检测结果(n=6)Table 3 The repeatability test of indirect ELISA(n=6)

表4 两种方法符合性试验结果Table 4 The result of the conformance test
3 讨论
特异性检测抗原的选择是建立ELISA 抗体检测方法的关键环节。目前,C.abortus 病血清学诊断抗原主要有MOMP 和POMP。MOMP 作为一种主要外膜蛋白,其表面存在多种抗原表位,包括属、种、血清型等特异性表位。MOMP 属特异性抗原表位可能是一种三级结构抗原表位,而原核表达的rMOMP只能与同源的抗血清特异性结合[9]。因此,本研究选择rMOMP 作为诊断抗原来建立C.abortus 病ELISA 抗体检测方法。
本实验室前期研究结果显示,MOMP 全长蛋白的序列,前22 aa 为信号肽序列;第aa20~aa90 位氨基酸区域抗原性强,但不是表面抗原位点,而在100 位、240 位以及345 位氨基酸残基位点的抗原性较强,并且均为表面抗原位点[8]。蛋白的外源表达系统中,信号肽对其产量、运输及产物的加工复性等有重要影响。Hoelzle 等对衣原体MOMP 原核表达的研究也证明,全长表达不仅影响蛋白的表达量,而且对蛋白的活性也有很大的影响[10]。此外,结合对本株衣原体momp 基因限制性内切酶位点分析,该基因序列的271 bp 为Bam HⅠ,经此酶切位点切割后基因读码框不受到影响。综上,本研究从获得较高活性的重组蛋白来提高以此蛋白建立的ELISA 方法的敏感性和特异性角度考虑,选择其天然存在酶切位点的截短表达MOMP 蛋白为包被抗原建立ELISA 检测方法,实验结果显示该方法与IHA方法的符合率可达87.09 %,高于用全长rMOMP 构建的ELISA 方法[11]。并且实验表明本研究建立的ELISA 方法具有良好的特异性,敏感性,以及重复性,适用于临床及现地C.abortus 的检测。
本实验建立的ELISA 方法为C.abortus 的检测提供了一种可行方法,能够用于该病的诊断和流行病学调查,为该病的防制奠定基础。
[1]Wheelhouse N,Longbottom D.Endemic and emerging Chlamydial infections of animals and their zoonotic implications[J].Transbound Emerg Dis,2012,59(4):283-291.
[2]Schautteet K,Vanrompay D.Chlamydiaceae infections in pig[J].Vet Res,2011,42:29.
[3]Everett K D,Bush R M,Andersen A A,et al.Emended description of the order Chlamydiales,proposal of Parachlamydiaceae fam.nov.and Simkaniaceae fam.nov,each containingone monotypic genus,revised taxonomy of the family Chlamydiaceae,including a new genus and five new species,and standards for the identification of organisms[J].Int J Syst Bacteriol,1999,49:415-440.
[4]Muller-Loennies S,Gronow S,Bradea L,et al.A monoclonal antibody against a carbohydrate epitope in lipopolysaccharide differentiates Chlamydophila psittaci from Chlamydophila pecorum,Chlamydophila pneumoniae,and Chlamydia trachomatis[J].Glycobiology,2006,16(3):184-196.
[5]Petyaev I M,Zigangirova I N A,Petyaev A M,et al.Isolation of Chlamydia pneumoniae from serum samples of the patients with acute coronary syndrome[J].Int J Med Sci,2010,7(4):181-190.
[6]NY/T 562-2002.动物衣原体病诊断技术[S].
[7]Salti-Montesanto V,Tsoli E,Papavassiliou P,et al.Diagnosis of ovine enzootic abortion,using a competitive ELISA based on monoclonal antibodies against variable segments 1 and 2 of the major outer membrane protein of Chlamydia psittaci serotype 1[J].Am J Vet Res,1997,58(3):228-235.
[8]闫少侠,田永祥,刘泽文,等.猪源嗜性衣原体HB1043 株主要外膜蛋白(MOMP)基因的分析及重组表达[J].湖北农业科学,2013,52(4):949-952.
[9]Hoelzle L E,Hoelale K,Wittenbrink M M,et al.Recombinant major outer membrane protein(MOMP)of Chlamydophila abortus,Chlamydophila pecorum,and Chlamydia suis as antigens to distinguish chlamydial species-specific antibodies in animal sera[J].Vet Microbiol,2004,103(1-2):85-90.
[10]Hoelzle L E,Hoelzle K,Wittenbrink M M,et al.Expression of the major outer membrane protein(MOMP)of Chlamydophila abortus,Chlamydophila pecorum,and Chlamydia suis in Escherichia coli using an arabinose-inducible plasmid vector[J].J Vet Med B Infect Dis Vet Public Health,2003,50(8):383-389.
[11]栗绍文.猪流产嗜性衣原体抗体ELISA 检测与基因免疫研究[D].武汉:华中农业大学,2008.
