体内药物分析的HPLC柱切换平台搭建与研究进展
2015-03-09盛阳昊刘丹琦颜晓敏周伯庭中南大学湘雅医院药学部长沙410008中南大学药学院长沙410013株洲市恺德医院药学部湖南株洲412000
盛阳昊,王 萍,刘丹琦,颜晓敏,周伯庭#(1.中南大学湘雅医院药学部,长沙 410008;2.中南大学药学院,长沙 410013;3.株洲市恺德医院药学部,湖南株洲 412000)
20世纪70年代,Huber JFK等[1]开发了柱切换(Columnswitching)技术。首先在一级色谱柱完成被测组分与复杂基质的初分离,并通过阀切换来改变流动相的流向和组成,使目标组分从一级柱流向二级柱,并在二级柱上进行被测组分的测定,从而完成复杂样品的分析。随着近几十年的发展,柱切换技术在21世纪初已基本完善,被广泛应用于分析化学的各个领域,如环境分析、食品检验、体内药物分析、制剂分析等。其中,在临床药物分析和药动学中的应用最为广泛,因为通过柱切换技术可实现复杂生物基质经简单处理即可进样或直接进样,自动化操作减少了前处理过程中出错的可能,提高了整个分析过程的准确性,缩短了时间,使复杂生物基质中小分子药物分析变得简便快捷。虽然柱切换技术已基本成熟,但是还没有相应的商品上市,这需要依靠实验室的搭建,因此柱切换技术在我国医院药学部门的应用并不普及,国内关于日常治疗药物检测和药动学的相关文献报道也不多。柱切换高效液相色谱(HPLC)平台搭建的关键是如何构建切换阀与色谱柱构成的色谱网络,并根据医院的具体情况选用合适的传输技术。为此,笔者以“Column switching”“柱切换”等为关键词,检索Elsevier、Springer、中国知网等数据库,通过文献分析临床药物柱切换平台搭建的现状与研究进展,同时总结应用不同的传输技术和色谱柱来构建色谱网络的方法,为医院药学部门搭建HPLC柱切换平台、简化复杂样品的处理过程提供参考。
1 HPLC柱切换平台的仪器组成和搭建
HPLC柱切换平台主要由进样阀、切换阀、高压泵、色谱柱、检测器和控制、处理系统构成,可由普通HPLC加上若干切换阀和色谱柱等部件构成。下面具体分析色谱网络的搭建过程。
1.1 一级色谱柱的选择
复杂生物基质如血浆、血清等,其富含蛋白质,且被测药物浓度往往较低,经过蛋白沉淀、液液萃取、离线的固相萃取后,一般需要挥干浓缩、复溶等一系列样品前处理步骤。这些步骤不但耗时,而且存在操作复杂、精确性差等缺点。而柱切换平台的第一级柱将直接实现生物基质中的大分子与待测组分的分离,富集和净化待测组分。一级色谱柱的选择主要根据去蛋白的形式和药物性质来决定。
1.1.1 离线去蛋白 离线去蛋白一般采用强酸或有机溶剂,将涡旋离心后的上清液直接大体积进样。一级柱一般选用小粒径(5、10 μm)反相ODS或C8填料,可防止大体积进样的峰展宽,柱子长短皆可;且由于去蛋白后的样品较干净,可有效延长一级柱的寿命。
1.1.2 在线去蛋白 使用在线去蛋白,一般选用两种类型的柱子。第一类是粒径较大(20~50 μm)键合链烃的柱子(也叫贯流色谱柱,Turbulent flow chromatography column),比如C18、C8、C2,也可键合其他类型的基团,如氰基[2]、氨基[3]。通过以水为主的一级流动相的洗脱,大分子蛋白质和一些亲水物质被洗脱,被测组分被吸附而留在柱子中。此类柱子的优点是粒径大,可使用高流速分析,缩短分析时间。但需注意的是,柱压会随着进样次数的增多而显著升高,粒径越小越明显,这时一级柱的再生清洗和流动相的选择就非常重要。郭平等[4]用0.2 mol/L的乙酸作为清洗液,采用25~40 μm的大粒径一级柱,进样次数可达到800次以上,这可能与乙酸具有溶解蛋白并阻止在一级柱上沉积的作用有关。刘皋林等[5]发现,先用含有不同比例的水的甲醇溶液冲洗分析柱,后用纯甲醇冲洗,可避免柱内的磷酸盐析出或使柱内残余的血浆蛋白凝固粘聚于柱内,由此延长柱的使用寿命。
第二类是20世纪80年代末发展起来的RAM(Restricted access media)柱,又称为通道限制性填料柱。其分离的机制为分子排阻兼反相分离;当生物样品通过限制性填料时,亲水层对蛋白质无吸附作用,蛋白质被先洗脱;而疏水层对药物等小分子物质有保留作用,再通过选择适当的流动相,将小分子物质洗脱下来,从而实现组分的分离。RAM填料有不同的种类,在临床药物分析中应用较多的是内表面反相填料、烷基二醇硅胶和混合功能填料。张晓惠等[6]用内表面反相填料考察对盐酸贝那普利的在线富集性能,发现RAM柱对盐酸贝那普利具有良好的富集作用,能够有效提高HPLC的灵敏度。Yu Z等[7]、樊鹏程等[8]均用Lichrospher ADS作为一级柱,在分析过程中,柱切换系统预柱及分析柱柱压始终未发生较大增加,系统稳定性良好。郭志强等[9]通过自制装填的混合功能RAM柱作为一级柱,以柱切换系统实现了对血浆样品中替米沙坦的直接进样含量测定。Friedrich G等[10]用Biotrap柱实现了血浆和尿中双氢麦角隐亭的含量测定,结果回收率达99%,且精密度良好,线性范围为25~1 000 pg/ml。
1.2 传输技术及色谱网络构建
在临床治疗药物浓度监测和药动学分析中,绝大部分药物只有1~2种相应的物质需要检测,可选择中心切割技术(Heart-cut)和反冲传递技术(Back-flush)来实现快速、准确的分离。其中,中心切割技术包含直接传输和间接传输两种形式,而反冲传递技术包含反向传输形式。由于医院临床送检样品通量大,应用在线去蛋白时,可在基本传输技术的基础上使用反冲清洗技术及时清洗一级柱,延长其使用寿命。
1.2.1 直接/间接传输 直接传输(见图1)较多用于离线去蛋白。当六通阀处于OFF状态(见图1A)时,通过高压泵将样品泵入一级柱,用一级流动相(预处理流动)完成初次分离和富集样品;同时,二级柱用二级流动相(分析流动相)完成最后分离。当直接进样传输中切换阀处于ON状态(见图1B)时,通过一级流动相将富集的或初分离的组分送至二级柱;在二级柱用二级流动相分离的时候,一级柱可完成柱子的再平衡并再次进样。
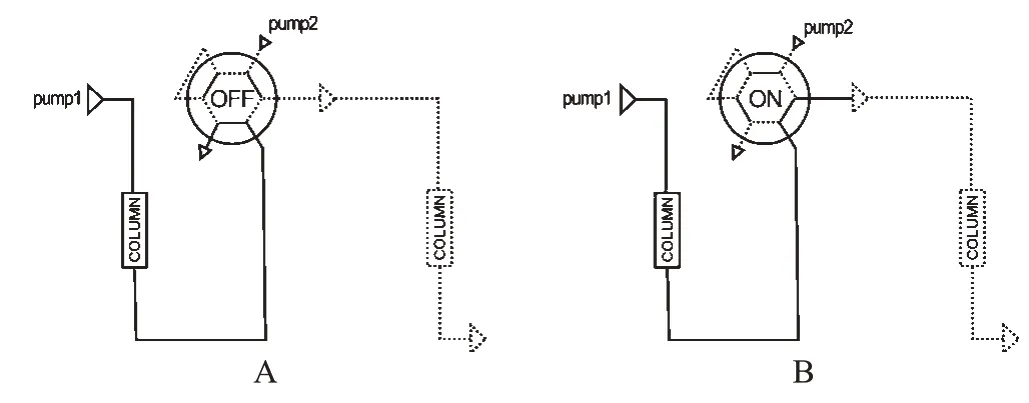
图1 直接传输
间接传输在线去蛋白(见图2B)和离线蛋白(见图2A)都可应用。间接传输流路变换和具体过程与直接传递基本一致;与直接传递不同的是,从一级柱到二级柱,用的是不同流动相来洗脱被测物。
1.2.2 反向传输形式 反相传输见图3。当六通阀处于OFF状态(见图3A)时,通过高压泵将样品泵入一级柱,一级流动相(预处理流动)将内源性基质洗脱,待测组分保留在柱端;同时,二级柱用二级流动相(分析流动相)完成最后分离。当切换阀处于ON状态(见图3B)时,通过二级流动相将富集在柱端的组分送至二级柱,同直接/间接传输不同的是,两次流动相经过一级柱中的流向相反。此种反向传输,组分保留在一级柱端,可有效减少峰展宽。

图2 间接传输
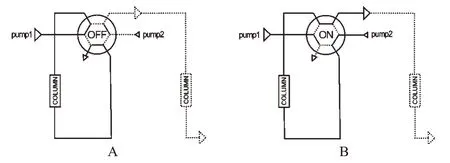
图3 反向传输
1.2.3 反冲清洗技术 反冲清洗见图4。当六通阀处于OFF状态(见图4A)时,样品通过色谱柱进入后面的检测器或色谱柱。当六通阀处于ON状态(见图4B)时,清洗流动相反冲柱子,起到净化柱子的作用,在复杂生物基质直接进样清洗一级柱中应用较多。Huber JF等[11]在反向传输形式的基本骨架上构建了应用反冲清洗技术的色谱网络,并用梯度洗脱来冲洗一级分析预柱,延长了5 μm小粒径一级柱的使用寿命。
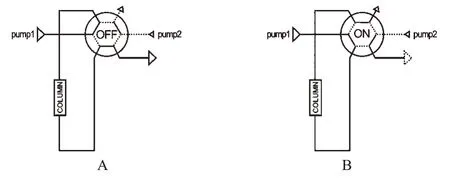
图4 反冲清洗
1.3 检测器的选择
从成本和医院开展的日常治疗药物血药浓度监测项目来考虑,紫外检测器和荧光检测器可满足大部分药物的线性范围检测要求,并可保持长期稳定,但对药动学中一些浓度很低的代谢物分析却无能为力。质谱检测灵敏度高、分析速度快、选择性高,而且经过柱切换分离的组分,成分纯度相对较高、基质效应较小,但缺点是检测器购置费和日常维护费较高。
1.4 色谱网络构建分析与讨论
医院药学部门的药物分析柱切换平台搭建与一般科研院所实验室有所不同,必须根据医院药学部门的实际情况,重点考察耐久度、经济性、时间复杂度3个重要评估要素来构建柱切换平台。下面结合前文“1.1”“1.2”项中给出的两种去蛋白形式和两种传递技术来讨论色谱网络的构建策略。
在线去蛋白因为直接、简便、准确,减少了人为干预程度,逐渐成为复杂生物基质中小分子测定技术发展的趋势;与其相适应的一级柱为大粒径反向柱(20~50 μm)和RAM柱。采用大粒径反向柱,因粒径较大,一般选择反冲模式,被测物强保留在柱端,可有效控制峰展宽。但也有少数文献采用中心切割模式[5,12],但从文献中的色谱图可看出峰展宽控制明显不佳,导致积分误差增大、准确性降低。RAM柱相对于大粒径柱则无此问题[6,13]。可根据被测物在一级柱上的保留情况,选择具体的传递技术。
虽然在线去蛋白与反冲传递技术被大部分HPLC柱切换文献所采用[14-15],但此种组合的缺点是反冲使柱头上的物质冲入分析柱,造成二级柱压力升高,降低柱耐用性;同时反冲模式去杂质能力较中心切割模式差,容易将强保留物质冲入分析柱,也会增加二级柱的分离难度以及增加二级柱的负载,减少柱使用寿命。此外,不管是RAM柱还是大粒径一级柱,随着直接进样次数增加,杂质堵塞色谱柱,会导致压力升高,色谱柱耐久性差,需经常更换。所以,结合耐久度、经济性来评估,此种组合并不适合临床大通量的日常检测;如果临床样品量较少,则可优先考虑此种组合。
离线去蛋白后进样,样品相对干净,一级柱为小粒径反向柱(5、10 μm),峰展宽控制较好,搭配上中心切割模式,二级柱负载小,寿命大大延长,可获得极好的耐久性,经济性同时也得到提高,更适合于临床大通量药物分析。
时间复杂度(指单次分析时间,时间长即复杂度高)也是进行大通量临床药物分析时一个重要的考虑因素。大粒径的反向柱粒径大,可使用高流速来载样萃取,使时间复杂度有效降低。如Ynddal L等[16]测定美沙芬及其代谢物时,使用大粒径一级柱,流速可达5 ml/min,载样及清洗只需0.5 min。在不同的传输形式中使用双泵的另外一个意义是进样“双工”,即在分析的同时使一级柱进行清洗并完成下一次进样,这样可减少时间复杂度,但这种“双工”需要手动实现,不适合医院药学部门的大通量日常检测。要实现在自动进样器的基础上全自动“双工”,必须在基本色谱骨架上并联修改。Ong VS等[17]比较了一根普通小粒径反向一级柱与两根大粒径反向一级柱并联组成的进样“双工”系统的分析速度,发现后者速度比前者快1倍左右,一次分析仅为2 min,耗费时间大幅缩短。Cass RT等[18]在反向传输形式的基本色谱骨架上,加上额外的一根二级柱和一个用于二级柱的平衡泵,实现了分析“双工”:在一根二级柱分析的同时,另一根二级柱完成平衡,被测药物的一次分析循环时间为3.3 min。如果医院药学部门每天检测样品较少,可采取单泵双柱的直接传输来构建色谱网络,这种模式比上述的双泵双柱的直接传输减少了一个泵,减少了系统复杂度,提高了经济性,但同样的会增加单次进样循环的时间。高申等[19]用单泵双柱、直接传输形式来构造色谱网络测定苯妥英和卡马西平,不需要专门控制设备,灵活、经济,相对于其他传输形式系统的复杂性较低,利于推广应用。
2 柱切换存在的问题
2.1 峰展宽
峰展宽在液相中由进样量、柱外效应和被测物在柱子中展宽引起。在柱切换HPLC中,管路长度比普通HPLC大大增加,柱外效应也随之提高。另外,在一级柱中,被测组分峰已经发生展宽;再加上被测组分需从一级柱中洗脱到二级柱中,相当于二级柱进样体积超载,从而引起了峰展宽问题,降低了灵敏度和分离度。Schill G等[20]提出了柱切换系统峰展宽体积公式:
其中,Ve为从一级柱到二级柱的有效注入体积,Vi为在一级柱上洗脱到二级柱上的被测组分体积,Ks为被测组分用一级流动相在二级柱的保留因子,Vi又可写成:

其中,x为被测组分在一级柱中的移行距离与柱子长度的比值,V0为一级柱死体积,Kp为被测组分用二级流动相在一级柱上的保留因子。将式(2)代入式(1),其中Ks远远大于1,可得:

从式(3)峰展宽表达式中可以看出,尽可能地减少分子中的x与Kp、增大分母中的Ks,即可达到减少峰展宽的目的。据此可加强二级流动相的强度,并适当加大两种流动相的强度差,或使用反向传输形式,使被测组分保留在柱端,大大减少x,从而减少峰展宽。Yu Z等[8]通过采用上述优化法则,选用高强度的二级流动相与较低强度的一级流动相,并用反向传输形式,使得Vi≤2 000 μl、lgKs>3、Ve<2 μl,可以看出取得了较好的效果。但值得注意的是,Schill G等[20]提出的峰展宽公式只考虑到进样量和在被测物在柱子中展宽两个因素,并没有涉及到柱外效应,可以通过在组装时尽量减小管路长度来进一步减少柱切换HPLC的死体积。另外,可选择更有效率的二级柱[21],以获得更好的分离度和柱效。
2.2 系统峰
系统峰是柱切换系统中一个常见的问题,指的是在不进样情况下,切换阀空切换后,大体积一级流动相进入二级柱,破坏二级柱平衡,使色谱图上有一些正峰或负峰存在,这些峰很可能干扰测定。Arvidsson T[22]指出,可调节一级流动相的pH,使其尽量与二级流动相的pH一致,也可改变一级流动相所含的盐,加入与二级流动相相同的盐类来避免系统峰。叶利民等[23]提出,当系统峰对被测组分有干扰时,可考虑通过以下方法加以避免:(1)改变流动相的组成及配比,使系统峰与被测组分峰分离;(2)在流动相中尽量减少盐和其他添加剂的加入;(3)对于某些被测组分,对检测限要求不高时,可选择用较长波长测定;(4)在某些色谱条件下,有些系统峰的保留时间很长,可在被测样品组分流出后,利用一级泵进行梯度洗脱,使高保留值的系统峰快速出峰,防止对下次分析造成干扰。
3 结语
综上所述,柱切换技术可实现对体内药物的直接分析,简化前处理过程,并使整个过程更加快速、出错的可能性减少、分离能力提高。临床上可用于药动学和体内药物分析工作,监测血药浓度,指导临床用药。随着今后不同填料的研究以及更加巧妙的色谱网络的提出,必将出现更多的组合模式,使其在临床药物分析中的应用更加广泛。
[1]Huber JFK,Van der Linden R,Ecker E,et al.Column swithching in high-pressure liquid chromatography[J].J Chromatogr A,1973,83(29):267.
[2]Heinig K,Bucheli F.Fast liquid chromatographic-tandem mass spectrometric(LC-MS-MS)determination of metformin in plasma samples[J].J Pharmaceut Biomed,2004,34(5):1 005.
[3]Chao MR,Wang CJ,Yang HH,et al.Rapid and sensitive quantification of urinary N7-methylguanine by isotope-dilution liquid chromatography/electrospray ionization tandem mass spectrometry with on-line solid-phase extraction[J].Rapid Commun Mass Sp,2005,19(17):2 427.
[4]郭平,李章万,陈朝红,等.HPLC柱切换法血浆直接进样测定糖肾平[J].药学学报,1992,27(6):452.
[5]刘皋林,沙瑞国,高申,等.HPLC柱切换法测定血浆和尿样中头孢克肟浓度[J].药学学报,1993,28(3):216.
[6]张晓惠,王荣,谢华,等.通过柱切换技术与高效液相色谱联用的限进性柱对盐酸贝那普利的在线富集性能[J].色谱,2013,31(5):451.
[7]Yu Z,Westerlund D.Ion-pair chromatography of methotrexate in a column-switching system using an alkyl-diol silica precolumn for direct injection of plasma[J].J Chromatogr A,1996,742(1):113.
[8]樊鹏程,马骏,贾正平,等.在线柱切换RP-HPLC测定人血清中卡马西平浓度[J].药物分析杂志,2008,28(12):2 033.
[9]郭志强,马俊,贾正平.柱切换高效液相色谱法测定人血浆中替米沙坦浓度[J].药物分析杂志,2006,26(8):1 071.
[10]Friedrich G,Appel K,Rose T,et al.Determination of dihydroergocryptine in human plasma and urine samples using on-line sample extraction-column-switching reversedphase liquid chromatography-mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,808(2):131.
[11]Huber JF,Lamprecht G.Assay of neopterin in serum by means of two-dimensional high-performance liquid chromatography with automated column switching using three retention mechanisms[J].J Chromatogr B Biomed APPL,1995,666(2):223.
[12]李章万,郭平.HPLC柱切换法血浆直接进样测定环丙氟哌酸[J].药物分析杂志,1994,14(2):16.
[13]武晓玉,王荣,谢华,等.柱切换-高效液相色谱法快速监测癫痫患者卡马西平血药浓度[J].药物分析杂志,2013,33(10):1 715.
[14]Eckert E,Göen T.Rapid determination of four short-chain alkyl mercapturic acids in human urine by column-switching liquid chromatography-tandem mass spectrometry[J].J Chromatog B Analyt Technol Biomed Life Sci,2014.doi:10.1016/j.jchromb.2014.06.009.
[15]Fagundes VF,Leite CP,Pianetti GA,et al.Rapid and direct analysis of statins in human plasma by columnswitching liquid chromatography with restricted-access material[J].J Chromatogr B Analyt Technol Biomed Life Sci,2014.doi:10.1016/j.jchromb.2013.12.002.
[16]Ynddal L,Hansen SH.On-line turbulent-flow chromatography-high-performance liquid chromatography-mass spectrometry for fast sample preparation and quantitation[J].J Chromatogr A,2003,1 020(1):59.
[17]Ong VS,Cook KL,Kosara CM,et al.Quantitative bioanalysis:an integrated approach for drug discovery and development[J].Int J Mass Spectrom,2004,238(2):139.
[18]Cass RT,Villa JS,Karr DE,et al.Rapid bioanalysis of vancomycin in serum and urine by high-performance liquid chromatography tandem mass spectrometry using online sample extraction and parallel analytical columns[J].Rapid Commun Mass Sp,2001,15(6):406.
[19]高申,刘皋林,王世祥,等.柱切换高效液相色谱法在体内药物分析中的应用研究[J].第二军医大学学报,1992,13(3):265.
[20]Schill G,Ehrsson H,Vessman J,et al.Separation methods for drugs and related organic compounds[M].1st ed.Stockholm:Swedish Pharmaceutical Press,1978:313-314.
[21]Gritti F,Leonardis I,Shock D,et al.Performance of columns packed with the new shell particles,Kinetex-C18[J].J Chromatogr A,2010,1 217(10):1 589.
[22]Arvidsson T.Effects of system peaks in a column-switching liquid chromatographic system for bioanalysis[J].J Chromatogr,1987,407:49.
[23]叶利民,李章万,陈聪.高效液相色谱柱切换系统中系统峰受色谱条件的影响及其干扰的避免[J].色谱,2004,22(2):1.
