青杄CYP1基因的克隆与表达1)
2015-03-07罗朝兵鞠丹刘中帅张凌云
罗朝兵 鞠丹 刘中帅 张凌云
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
责任编辑:潘 华。
亲环素是一类能与环孢霉素特异结合的蛋白家族,广泛存在于生物体中,具有肽基脯氨酸顺反异构酶活性,参与蛋白的修饰、折叠等过程[1]。早在1984年,亲环素A 就已经在生物体中发现并纯化[2],且已证明其在动物体内病毒感染进程起到重要的调节作用[3]。近年来在植物体内也发现亲环素的存在。植物体亲环素基因具有一般亲环素的功能外,还参与植物生长发育、光合作用及胁迫应答等过程。例如,有研究表明拟南芥CYP38 在光系统II(PSII)复合体的装配过程和维持其稳定性起到重要的作用,突变体植株矮小且对高光超敏,植物因PSII受损而无法正常合成光和产物,进而影响植株的生长发育[4];拟南芥CYP71 则通过与组蛋白H3 互作,且参与H3K27 的甲基化进程,cyp71 突变植株发育不正常,出现顶端分生组织发育受阻,根系生长减缓等[5];拟南芥CYP59 是具有多结构域的亲环蛋白,能与RNA 聚合酶II 最大亚基的C 端互作,进而参与转录的进程[6]。目前,Trivedi[7]等鉴定了35 个拟南芥亲环素基因,28 个水稻亲环素基因,并发现其在多种逆境条件下响应。越来越多的证据表明亲环素蛋白在植物的生长发育及形态建成、逆境生理、mRNA 进程、蛋白降解与信号转导中起到重要作用,但人们对亲环素的功能依然知之甚少,且目前研究材料仅限于模式植物和部分作物,关于木本植物中亲环素特性及功能尚未见报道。
青杄(Picea wilsonii.Mast)属于松科(Pinaceae)云杉属(Picea)植物,是一种耐寒冷、耐旱的多年生木本针叶植物,广泛分布于亚热带和温带地区,是我国重要的经济林植物[8]。本研究从青杄中克隆得到一个CYP 基因(命名为PwCYP1),通过RACE PCR 得到其全长cDNA 序列。利用qRT-PCR 等技术分析了其在不同组织及发育时期的表达量及对各种逆境的响应。本研究将对CYP 基因家族的功能研究、特别是其生殖生长的机制研究提供理论基础,也为筛选优质林木抗性基因提供依据。
1 材料与方法
1.1 试材与试剂
多年生青杄(Picea wilsonii)种子和花粉均采集于中国科学院北京植物园,组织特异性表达试验使用3a 苗龄青杄幼苗。青杄cDNA 文库由英潍捷基公司利用Gateway 技术构建完成[9-10]。激素和逆境处理试验使用8 周苗龄青杄幼苗。青杄幼苗培养于25 ℃室温,空气湿度50%,光周期为16 h 光照,8 h黑暗的温室,培养基质为V(营养土)∶ V(蛭石)=1∶1 混合,每周使用自来水充分浇灌1 次。植物材料经处理后液氮速冻于-80 ℃保存备用。
青杄cDNA 文库载体为pDONR222,由Invitrogen 公司提供。克隆载体为pEASY- T1,购买自Transgene 公司。RNA 提取试剂盒(TRI pure Reagent)购买于AidLab 公司,PCR Taq Mix、DNA Maker(DL2000,DL15000)、荧光定量PCR 试剂盒(SYBR Green SuperReal Premix)购买于天根公司,反转录试剂盒(Revert AidTM First Strand cDNA Synthesis Kit)购买于Fermentas 公司。所用激素购买于Sigma 公司。其他试剂购买于AMRESCO 公司。
1.2 试验方法
1.2.1 RACE PCR 获取目的基因PwCYP1 的全长
利用青杄cDNA 文库为模板,根据PwCYP1 的EST 序列与pDONR222 载体的序列设计引物,进行RACE PCR。使用引物5-race-F 与5-race-R扩增5’方向序列,使用3-race-F 与3-race-R扩增出3’方向的序列。PCR 产物经琼脂糖凝胶回收、连接pEASY-T1、测序后获得PwCYP1 的末端序列,与EST 序列拼接后获得PwCYP1 的全长cDNA 序列。设计引物CYP-F 与CYP-R,经过PCR后得到开放阅读框完整的核酸序列,连接到pEASY-T1 上,获得PwCYP1 单克隆。所用到的引物见表1。

表1 PwCYP1 克隆及组织表达分析所需要的引物
1.2.2 生物信息学分析
根据PwCYP1 的全长序列,利用DNAMAN 推导出PwCYP1 的编码框确定其蛋白氨基酸的序列,蛋白多序列比对运用clustalx 软件和Espript(http://espript.ibcp.fr/ESPript/ESPript/),系统树的构建利用MEGA5 软件,构树方法为邻位相连法(Neighbor-joining),bootstap 检测为1 000 次。利用Expasy(www.expasy.org)中的Compute pI/Mw 工具来计算蛋白的理论等电点与分子量;利用ProtScale 工具(http://web.expasy.org/protscale/)进行疏水性分析;利用ScanProsite(http://prosite.expasy.org/)对目的基因的结构域进行预测;利用GOR4(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)进行蛋白的二级结构预测;利用SWISS-MODLE(http://swissmodel.expasy.org/)进行蛋白的三级结构预测。
1.2.3 组织特异表达试验
用于试验的3年生青杄的根、茎、针叶及青杄种子及花粉总RNA 的提取利用AidLab 公司的植物RNA 提取试剂盒。RNA 提取后经过电泳和分光光度法检测均达到要求,运用Fermentas 公司的反转录试剂盒。均一化浓度之后在StepOnePlus Real Time RT-PCR 仪器上进行qRT-PCR 来检测基因在不同组织的相对表达量,所用特异引物为CYP-RT-F 与CYP-RT-R,内参基因为青杄延伸因子蛋白EF-1α[11],引物为EF-1α-F 与EF-1α-R(表1)。试验进行3 次重复。
1.2.4 逆境与激素响应试验
逆境与激素响应试验参考[12-13]方法,并将处理的激素处理时间和浓度加以调整。具体处理方法如下:将8 周苗龄的青杄幼苗根浸入激素溶液分别处理3、6 和12 h,以水为对照。试验中使用的激素包括ABA、吲哚-3-乙酸(indole-3-acetic acid,IAA)、GA、MeJA、水杨酸(Salicylic Acid,SA)和油菜素内酯(brassinolide,BR),浓度均为100 nmol·L-1。干旱试验中,将8 周苗龄的青杄幼苗置于温室中无水培养4周,对照组正常培养;盐胁迫试验中,实验组每天分别喷施5 mL 2%、4%、6%的NaCl 溶液,处理4 周,对照组用清水处理。将8 周苗龄的青杄幼苗放于清水中,分别放置于45、4 ℃环境中,对照组置于室温条件,分别处理0、0.5、1、3、6、12 h 后,取样后液氮速冻置于-80 ℃备用。机械损伤响应试验中,用镊子将8 周苗龄青杄幼苗的叶片损伤后,分别于0,0.5,1,2,3 h 取样,对照组正常培养。过氧化氢(H2O2)响应试验中,将8周苗龄青杄幼苗放置于5% H2O2溶液中,分别于0,1,3,6 和12 h 取样。分别提取青杄幼苗和各组织总RNA 后进行反转录、qRT-PCR 等试验检测各组织PwCYP1 的表达量变化。试验进行3 次重复。
1.2.5 种子萌发试验
种子萌发试验采用水培法[14]。将吸水滤纸铺在培养皿中,将春化1 个月的青杄种子分散放入湿润的滤纸上培养,保持滤纸湿润,在室温条件(25℃)下进行萌发试验。将培养皿置于25 ℃光照培养箱中,光周期为16 h 光照/8 h 黑暗,培养12 d,分别在培养0、2、4、6、8、10、12 d 时采样,液氮速冻后置于-80 ℃保存,用于PwCYP1 基因在种子不同萌发时期表达量分析。所有试验进行3 次重复。
1.2.6 花粉萌发试验
花粉萌发试验参照[11]方法:将保存于-80 ℃的青杄花粉取出,放在-20 ℃中24 h,再放于4 ℃中2 h 以复苏其活力后进行萌发试验。花粉的液体培养基由12%蔗糖、0.01%硼酸、0.03%硝酸钙与5 mmol·L-1柠檬酸-磷酸缓冲液组成(pH=5.8)。取花粉置于培养基中200 r/min,28 ℃摇床中培养,分别在培养0、2、6、12、18、24、30、36 h 后取样,液氮速冻置于-80 ℃保存,用于检测PwCYP1 表达量。进行3 次重复试验。
1.2.7 缺素处理试验
将正常生长条件下的3年生青杄幼苗移至不含有机物料的土壤中,正常浇水4 周,直到青杄幼苗严重枯萎,顶芽不能继续生长。对照植株正常培养。提取RNA,检测PwCYP1 表达量。进行3 次重复试验。
2 结果与分析
2.1 PwCYP1 的cDNA 克隆
利用青杄cDNA 文库为模板,根据PwCYP1(登录号为KT210442)的EST 序列与pDONR222 载体的序列设计引物,进行RACE PCR。PwCYP1 全长cDNA 为962 bp,编码框为516 bp 组成,编码一个171氨基酸的多肽,Protparam 工具预测蛋白的分子量约为17.98 kDa,理论等点为8.34。分子式为C799H1248N216O238S9,甘氨酸(Gly)量最多为15.8%,缬氨酸(Val)为11.1%,赖氨酸量为7.6%。蛋白不稳定指数为15.71,表明蛋白比较稳定。
2.2 多序列比对及系统发育树分析
运用NCBI 的BLAST 工具检索PwCYP1 的同源基因,发现绿豆(Vigna radiate)、陆地棉(Gossypium hirsutum)、火炬松(Pinus taeda)、蓖麻(Ricinus communis)和拟南芥(Arabidopsis thaliana)等物种中的同源基因,利用ClustalX 软件对PwCYP1 及其同源基因进行多序列比对,结合软件Mega5.0 构建系统发育树,结果发现:火炬松(Pinus taeda)的一个基因(登录号EF532602)与PwCYP1 高度同源,被归为一簇(图1)。多序列比对结果发现,CYP 蛋白在不同物种间有非常高的相似性(图2)。
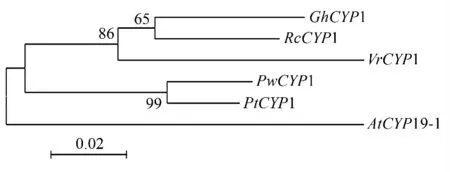
图1 青杄PwCYP1 进化树分析

图2 不同物种CYP 蛋白多序列比对
2.3 二级结构和三级结构预测
运用GOR4 工具预测PwCYP1 的二级结构,结果发现蛋白主要有α-螺旋(6.43%)、延伸链结构(33.33%)与无规则卷曲(60.23%)组成。运用SWISS-MODEL 工具预测蛋白的三级结构,结果如图3,可以预测为球状蛋白,疏水位点与亲水位点在蛋白表面均匀分布。
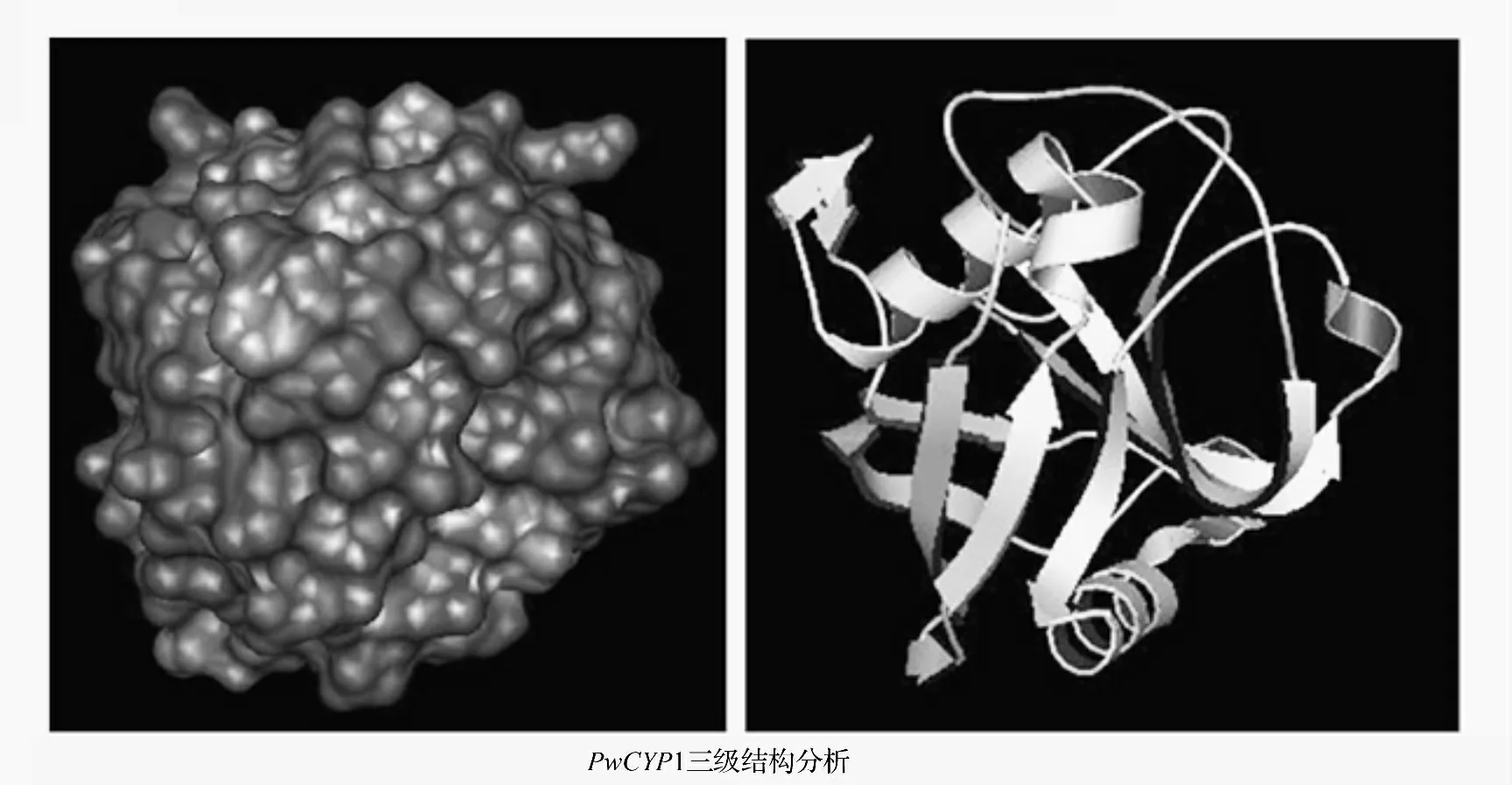
图3 PwCYP1 二级结构和三级结构
2.4 PwCYP1 的表达分析
2.4.1 PwCYP1 的组织表达特异性分析
通过半定量RT-PCR 与qRT-PCR 试验检测PwCYP1 在青杄各组织的表达模式,结果发现PwCYP1 在青杄的各组织中均有表达,但在花粉中表达量最高(表2)。
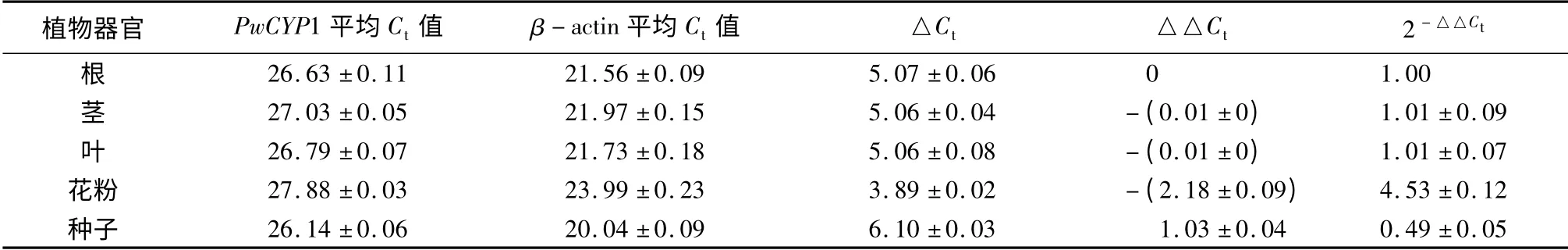
表2 PwCYP1 在青杄各组中的相对表达量
2.4.2 PwCYP1 在青杄种子萌发过程中的表达
通过qRT-PCR 检测PwCYP1 在青杄种子萌发过程中表达模式,结果发现PwCYP1 在青杄种子萌发过程中表达量呈下降趋势,在第4 天的时候降到最低值后表达量略有上升,并在第6 天之后表达量维持在相对稳定数值(表3)。
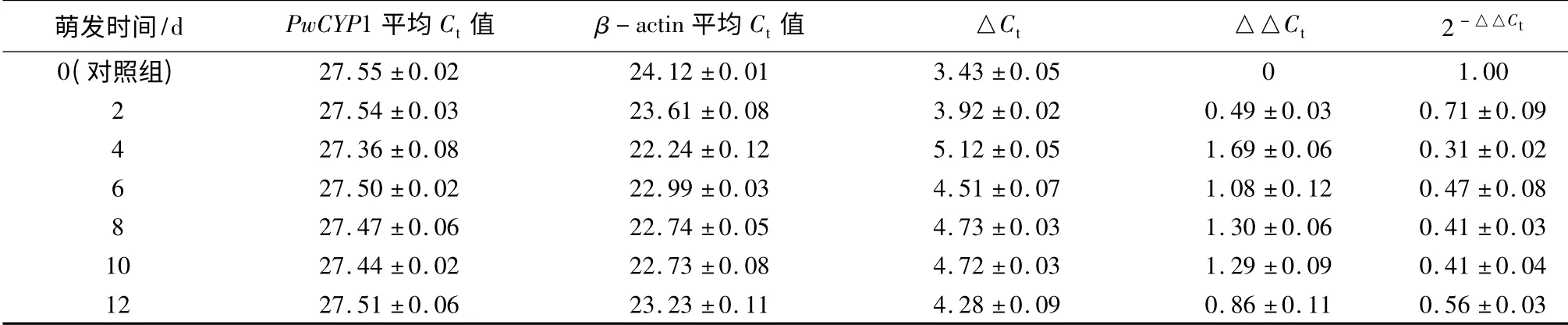
表3 PwCYP1 在种子萌发不同时期的相对表达量
2.4.3 PwCYP1 花粉不同发育时期的表达分析
在组织特异表达试验中已发现PwCYP1 在花粉中的表达量最高,因此利用qRT-PCR 方法检测在花粉萌发后不同时期的相对表达量,结果发现青杄花粉在萌发的0~24 h 阶段PwCYP1 表达量逐渐减低,在24 h 达到最低值后被上调至相对稳定值(表4)。
2.4.4 PwCYP1 对逆境的响应
分别提取干旱处理4 周后青杄幼苗的根、茎、针叶RNA 反转录成cDNA 进行qRT-PCR,结果表明,经过干旱处理后根中PwCYP1 的表达量较对照上升4 倍左右,茎中PwCYP1 的表达量上升2.5 倍,针叶中表达量变化不明显(表5);经过2% NaCl 处理后根中PwCYP1 的表达量上升70 倍左右,茎中PwCYP1 的表达量上升100 倍,针叶中表达量上升7 倍左右,但随着NaCl 浓度的上升,PwCYP1 的表达量呈下降趋势(表5);经过45 ℃处理后PwCYP1 的表达量在0.5~1 h 内先上升后下降,1~3 h 内又上升,3~12 h 呈逐渐下降的趋势(表6);机械损伤处理后PwCYP1 的表达量先上升,1 h 上升至2.5 倍达到最大值后表达量被下调至一稳定值(表7);H2O2处理后,PwCYP1 的表达量在0~1 h 内上升,1~12 h 内下降,但变化不明显(表8);冷(4 ℃)处理后3 h,PwCYP1 的表达量被抑制降低到0.4 倍,3 h 后表达量被上调(表9)。
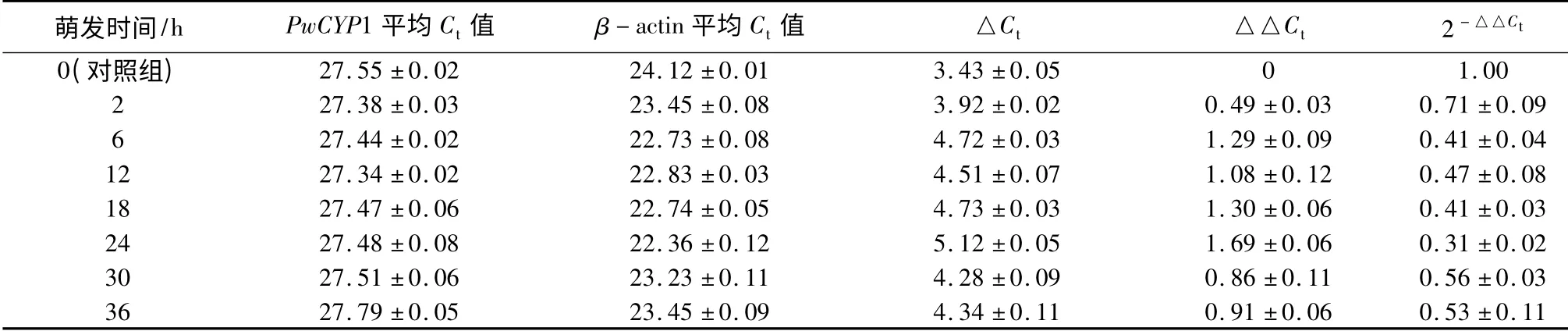
表4 PwCYP1 在花粉不同时期的相对表达量
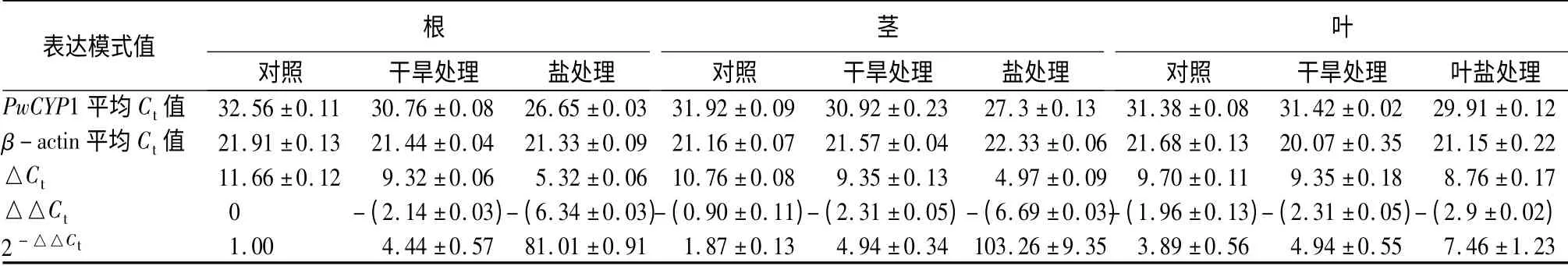
表5 PwCYP1 在盐、干旱处理下的表达模式
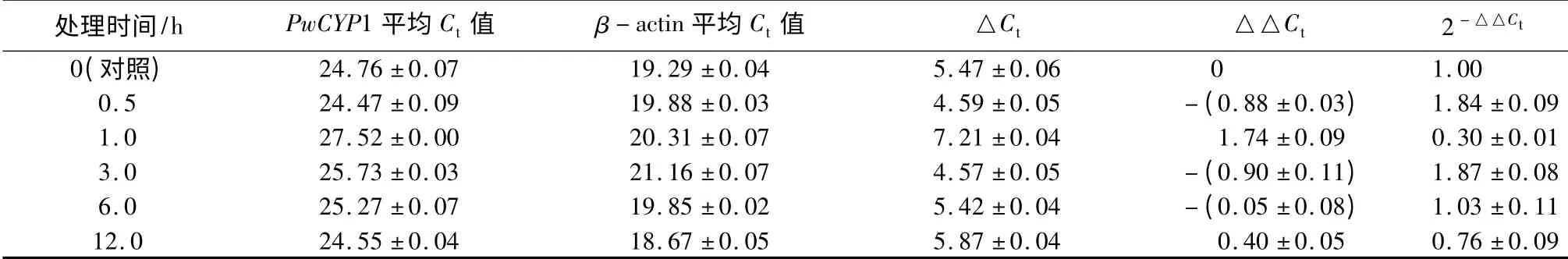
表6 PwCYP1 在热激(45 ℃)处理下的表达模式
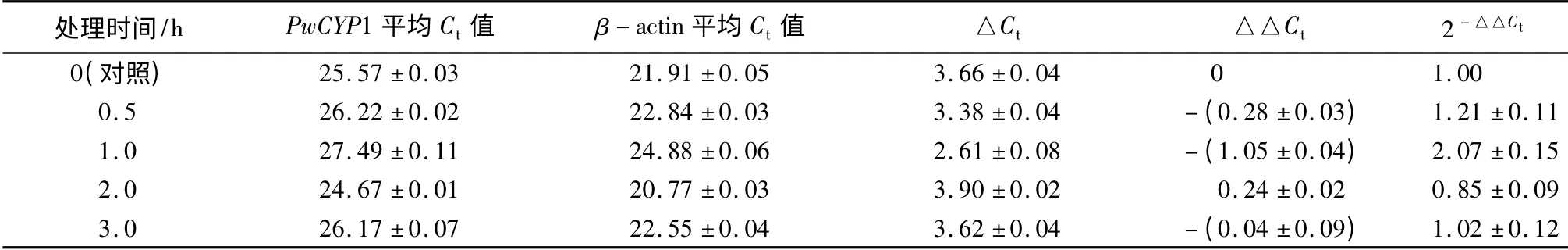
表7 PwCYP1 在机械损伤处理下的表达模式
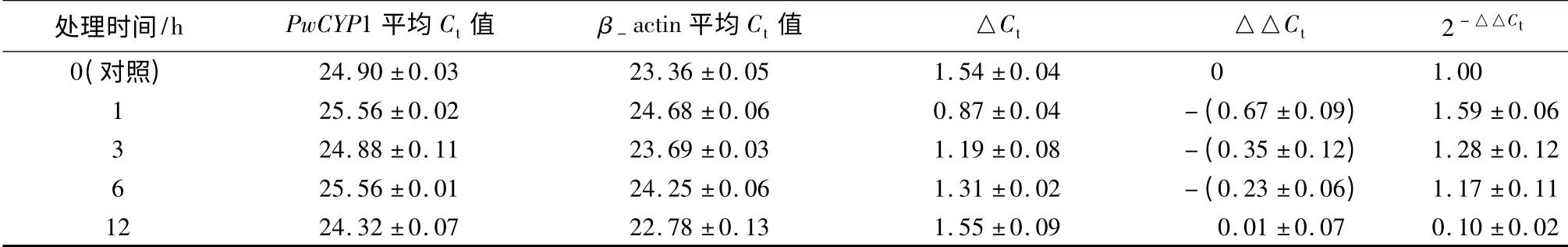
表8 PwCYP1 在H2O2 处理下的表达模式
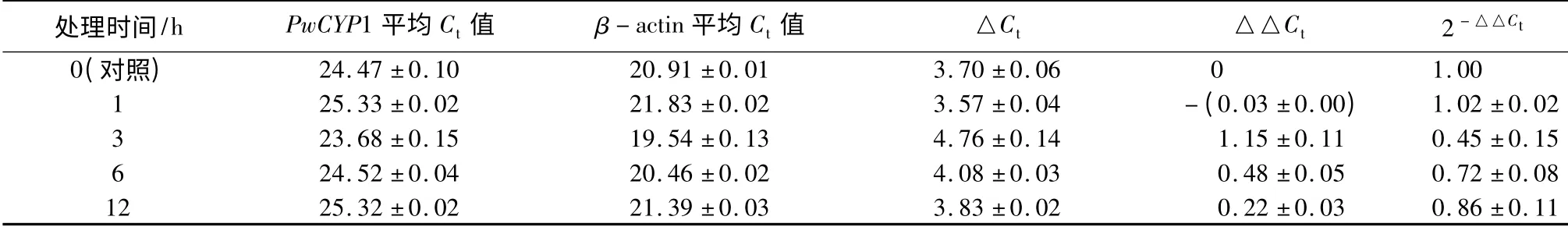
表9 PwCYP1 在冷(4 ℃)处理下的表达模式
2.4.5 PwCYP1 对缺素以及不同外源激素处理的响应
经过缺素处理4 周后的3年生青杄幼苗,分别提取根、茎、叶RNA,反转录成cDNA 进行qRT-PCR。结果表明缺素处理后PwCYP1 在根、茎、针叶中的表达量均下降,且在根中表达量下降7 倍左右,茎和针叶中均下降2 倍(表10)。不同外源激素处理结果显示,ABA,IAA,MeJA,SA 处理3 h 后PwCYP1 的表达量上升到最大值,而在3~12 h 内,PwCYP1 的表达量被抑制;GA 处理后前期PwCYP1 的表达量变化不明显,到12 h 时大幅度提高;BR 处理后6 h 后PwCYP1 的表达量升高,到12 h 时PwCYP1 的表达量重新下调(表11)。
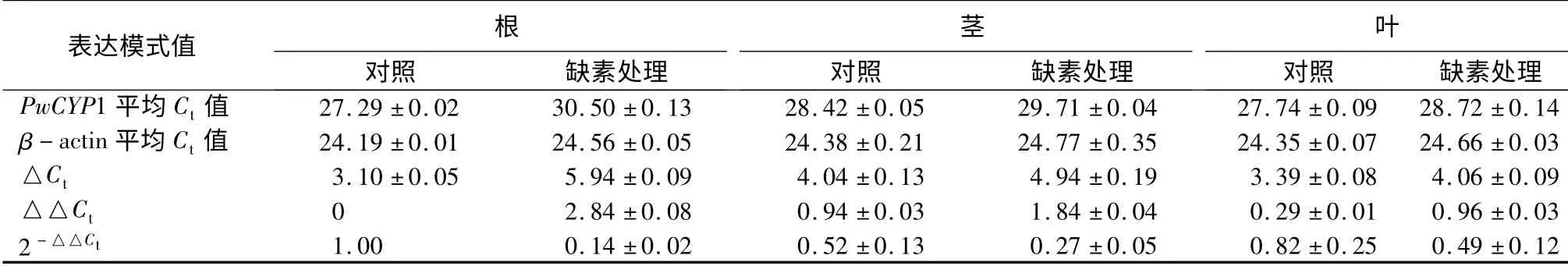
表10 PwCYP1 在缺素处理下的表达模式

表11 PwCYP1 在激素处理下的表达模式
3 结论与讨论
本研究从青杄的cDNA 文库中克隆得到亲环素基因PwCYP1,经过生物信息学分析发现PwCYP1编码了一个包含171 个氨基酸的蛋白,分子量约为17.98 KDa,包含多个α-螺旋。多序列比对以及构建系统发育树结果显示PwCYP1 和PtCYP1 聚为一簇。由于青杄(Picea wilsonii)和火炬松(Pinus taeda)都属于松科,亲缘关系相对比较近,且两者在形态学上也具有非常高的相似性,推测两物种在进化上有相同的祖先。
以为的研究中证实植物类亲环素在植物生物学、胁迫应答等过程发挥作用。例如,Sekhar[15]等在木豆中分离得到一个亲环素基因CcCYP,转基因过表达于拟南芥中发现能增强多种逆境胁迫的抵御能力;Kim[16]等研究发现过表达水稻亲环素基因OsCYP20-2 于拟南芥和烟草中增强了转基因植株抵抗非生物逆境胁迫的能力。本研究中,PwCYP1在干旱和NaCl 处理后,根和茎中表达量均大幅度升高,尤其是2%的NaCl 处理后,PwCYP1 在根和茎表达量分别上升70 倍和100 倍。显示PwCYP1 参与了青杄干旱和盐胁迫应答。不同激素处理后PwCYP1 表达量也表现出不同程度的上调。其中,ABA和MeJA 处理3 h 后PwCYP1 的表达量达到最高,机械损伤1 h 后表达量达到最大值,表明PwCYP1 能响应ABA 并参与了MeJA 诱导的机械损伤应答。Berardini 等发现拟南芥CYP40 不但对的营养生长有重要的调控作用[17],同时能与热激蛋白HSP90互作[18]。在本试验中,我们对青杄幼苗进行45 ℃处理后,PwCYP1 表达量发生明显变化,预示着Pw-CYP1 可能也参与了热激反应。
已有研究表明亲环素蛋白在植物各个器官都有表达,并发挥着重要的作用。Lippuner[20]等在拟南芥中发现ROC1 与ROC4 编码两个亲环素蛋白,其中ROC1 在拟南芥各个器官都有表达,而ROC4 只在能进行光和作用器官表达;Romano[21]等在2004年在拟南芥中已发现29 种亲环素蛋白,普遍在各个组织和器官中表达,参与了光合作用[22]、生物胁迫响应[23]、花粉萌发[24]等一系列生理过程。Saito[25]等发现AtCYP1 主要在维管束与花中表达,AtCYP2主要在幼叶中表达,显示了CYP 基因家族功能上的多样性。本研究中,在青杄组织特异表达实验中,PwCYP1 在各个组织均有表达,但在成熟花粉中表达量最高,进一步试验证实在花粉萌发过程中PwCYP1 的表达量逐步下降,在花粉管生长后期其表达量维持在一定水平。相对于花粉中,虽然种子中表达量不高,但在种子萌发过程中PwCYP1 表达量呈现同花粉萌发过程中相似的变化趋势,这些结果表明PwCYP1 参与了青杄花粉管生长和种子萌发过程,随着花粉和种子萌发其表达量下降。
综上所述,青杄PwCYP1 可能参与了青杄种子萌发、花粉萌发等多种生理过程,并参与ABA,Me-JA,IAA 等激素应答途径,是一个具有抗旱、抗盐、抗热等潜在能力的抗逆基因。今后可以将该基因转入模式植物拟南芥或其他经济植物,进一步研究其抗逆功能,并探索其在植物中的抗逆机制。本研究将为植物亲环素蛋白的进一步功能研究奠定基础,也为未来筛选优良林木基因提供理论依据。
[1] Stamnes M A,Rutherford S L,Zuker C S.Cyclophilins:a new family of proteins involved in intracellular folding[J].Trends in Cell Biology,1992,2(9):272-276.
[2] Handschumacher R E,Harding M W,Rice J,et al.Cyclophilin:a specific cytosolic binding 3 protein for cyclosporin A[J].Science,1984,226:544-547.
[3] Zhou D,Mei Q,Li J,et al.Cyclophilin A and viral infections[J].Biochemical and Biophysical Research Communications,2012,424(4):647-650.
[4] Fu A,He Z,Cho H S,et al.A chloroplast cyclophilin functions in the assembly and maintenance of photosystem II in Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(40):15947-15952.
[5] Li H,He Z,Lu G,et al.A WD40 domain cyclophilin interacts with histone H3 and functions in gene repression and organogenesis in Arabidopsis[J].The Plant Cell,2007,19(8):2403-2416.
[6] Gullerova M,Barta A,Lorkovic Z J.AtCyp59 is a multidomain cyclophilin from Arabidopsis thaliana that interacts with SR proteins and the C-terminal domain of the RNA polymerase II[J].RNA,2006,12(4):631-643.
[7] Trivedi D,Yadav S,Vaid N,et al.Genome wide analysis of Cyclophilin gene family from rice and Arabidopsis and its comparison with yeast[J].Plant Signaling and Behavior,2012,7(12):1653-1666.
[8] 魏强,凌雪,张广忠,等.甘肃兴隆山主要森林类型凋落物累积量及持水特性[J].应用生态学报,2011,22(10):2589-2598.
[9] 李长江,曹一博,张凌云.青杄PSAK 的克隆及生物信息学分析[J].生物技术,2012,22(3):4-9.
[10] 张盾,刘亚静,李长江,等.青杄均一化cDNA 文库构建及EST序列分析[J].生物技术通报,2012(6):71-76.
[11] Yu Y,Li Y,Huang G,et al.PwHAP5,a CCAAT-binding transcription factor,interacts with PwFKBP12 and plays a role in pollen tube growth orientation in Picea wilsonii[J].Journal of Experimental Botany,2011,62(14):4805-4817.
[12] Yamaguchi-Shinozaki K,Shinozaki K.Anovelcis-acting element in an Arabidopsis gene is involved in responsiveness to drought,low-temperature,or high-salt stress[J].The Plant cell,1994,6(2):251-264.
[13] Yu Y,Zhang H,Li W,et al.Genome-wide analysis and environmental response profiling of the FK506-binding protein gene family in maize(Zea mays L.)[J].Gene,2012,498(2):212-222.
[14] 李长江,孙帆,张通,等.青杄PwPSAF 的克隆与组织表达分析[J].林业科学,2013,49(10):40-47.
[15] Sekhar K,Priyanka B,Reddy V D,et al.Isolation and characterization of a pigeonpea cyclophilin(CcCYP)gene,and its overexpression in Arabidopsis confers multiple abiotic stress tolerance[J].Plant,Cell & Environment,2010,33(8):1324-1338.
[16] Kim S K,You Y N,Park J C,et al.The rice thylakoid lumenal cyclophilin OsCYP20-2 confers enhanced environmental stress tolerance in tobacco and Arabidopsis[J].Plant Cell Reports,2012,31(2):417-426.
[17] Berardini T Z,Bollman K,Sun H,et al.Regulation of vegetative phase change in Arabidopsis thaliana by cyclophilin 40[J].Science,2001,291:2405-2407.
[18] Earley K W,Poethig R S.Binding of the cyclophilin 40 ortholog SQUINT to Hsp90 protein is required for squint function in Arabidopsis[J].The Journal of Biological Chemistry,2011,286:38184-38189.
[19] Smith M R,Willmann M R,Wu G,et al.Cyclophilin 40 is required for microRNA activity in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(13):5424-5429.
[20] Lippuner V,Chou I T,Scott S V,et al.Cloning and characterization of chloroplast and cytosolic forms of cyclophilin from Arabidopsis thaliana[J].The Journal of Biological Chemistry,1994,269(11):7863-7868.
[21] Romano P G,Horton P,Gray J E.The Arabidopsis cyclophilin gene family[J].Plant Physiology,2004,134(4):1268-1282.
[22] Romano P G,Edvardsson A,Ruban A V,et al.Arabidopsis At-CYP20- 2 is a light-regulated cyclophilin-type peptidyl-prolyl cis-trans isomerase associated with the photosynthetic membranes[J].Plant Physiology,2004,134(4):1244-1247.
[23] Daniel D R,Edson L F,Leonardo P B,et al.Eucalyptus ESTs involved in mechanisms against plant pathogens and environmental stresses[J].Summa Phytopathol,2010,36(4):282-290.
[24] Wang Y,Zhang W Z,Song L F,et al.Transcriptome analyses show changes in gene expression to accompany pollen germination and tube growth in Arabidopsis[J].Plant Physiology,2008,148(3):1201-1211.
[25] Saito T,Tadakuma K,Takahashi N,et al.Two cytosolic cyclophilin genes of Arabidopsis thaliana differently regulated in temporal-and organ-specific expression[J].Bioscience,Biotechnology,and Biochemistry,1999,63(4):632-637.
