两种微藻对中华哲水蚤繁殖的影响——基于饵料生化组成分析
2015-03-07刘梦坛李超伦
刘梦坛, 金 鑫, 李超伦
(1. 山东胶州湾海洋生态系统国家野外科学观测研究站, 山东 青岛 266071; 2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071)
两种微藻对中华哲水蚤繁殖的影响
——基于饵料生化组成分析
刘梦坛1, 金 鑫2, 李超伦2
(1. 山东胶州湾海洋生态系统国家野外科学观测研究站, 山东 青岛 266071; 2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071)
在春季, 以中肋骨条藻和海洋原甲藻培养中华哲水蚤, 以饥饿培养作为对照, 测定了饵料的脂肪酸和挥发性不饱和醛类的组成和含量、雌体的产卵率和卵的孵化率, 试图探讨藻类生化组成对桡足类繁殖的影响。结果表明, 中肋骨条藻单不饱和脂肪酸、∑16脂肪酸的含量相对较高, 而海洋原甲藻则具有更高含量的总脂肪酸、多不饱和脂肪酸、∑ω3、∑ω6、∑18脂肪酸。中肋骨条藻和海洋原甲藻分别测得了6种和3种不饱和醛类, 二者醛类总含量分别为1438.95 μg/g和114.58 μg/g。在饥饿的情况下,中华哲水蚤的产卵会停止。中华哲水蚤在中肋骨条藻和海洋原甲藻培养下并没有表现出产卵率和孵化率的差异, 一方面说明并非所有的硅藻都会对桡足类的繁殖产生抑制作用, 另一方面说明藻类进入桡足类体内以后并未因其生化组成的差异对卵的孵化产生影响。中肋骨条藻培养下中华哲水蚤具有更高的死亡率, 表明硅藻在浓度较高时会对桡足类的存活产生影响。
中华哲水蚤; 产卵率; 孵化率; 脂肪酸; 不饱和醛
桡足类在自然界中以浮游植物特别是硅藻作为主要的饵料。此外, 桡足类还会摄食甲藻、原生动物、碎屑以及其他浮游动物的卵和幼体[1-2]。饵料对桡足类的繁殖活动至关重要, 在饵料缺乏的情况下桡足类的产卵行为会停滞[3]。在室内以较高浓度的硅藻培养桡足类时, 却发现其对桡足类的生长和繁殖均存在抑制作用[4-6]。目前大多数研究者认为这种抑制作用可能是因为单种硅藻饵料因缺乏某些关键营养成分而影响了桡足类的生长和产卵[4,7]。考虑到脂类物质在卵和雌性桡足类的卵巢中具有较高含量, 且在无节幼体早期发育过程中具有重要作用, 目前对这些关键营养成分研究的焦点集中在脂类物质和一些多不饱和脂肪酸上[8-10]。另外也有报道认为这种抑制作用是因为硅藻释放的次生代谢物特别是挥发性的醛类物质会抑制桡足类卵的孵化及无节幼体的发育[5,7]。但也有一些研究认为桡足类的繁殖活动不受硅藻脂类组成中某些多不饱和脂肪酸缺乏以及醛类物质释放的影响[11-12], 这种情况在野外表现的更加明显, 这可能是因为自然海区硅藻密度太低, 还达不到对桡足类生长和繁殖造成抑制作用的浓度[13]。
中华哲水蚤是黄东海浮游动物优势种和关键种之一, 在中国近海生态系统中起着至关重要的作用。室内培养实验发现, 不同种类的藻类对中华哲水蚤产卵和卵的孵化具有不同的影响效应[14]。目前对不同的藻类在中华哲水蚤繁殖过程中产生影响的具体机制尚不明确。本文以饥饿培养为对照, 以中肋骨条藻和海洋原甲藻培养中华哲水蚤, 通过分析饵料的脂肪酸和挥发性不饱和醛类的组成和含量、雌体的产卵率和卵的孵化率探讨了这两种藻类对中华哲水蚤繁殖产生影响的内在原因。
1 材料与方法
1.1 藻类培养
实验用藻种为中肋骨条藻(Skeletonema costatum) (ESD: ca. 10.1 μm)和海洋原甲藻(Prorocentrum micans) (ESD: ca.30 μm), 来自中科院海洋所海洋生态与环境科学重点实验室。海水经过砂滤后又先后经过38 μm的筛绢和0.45 μm的混合纤维滤膜过滤, 高温灭菌冷却后加入f/2培养液培养藻类至对数生长期。培养条件为: 室温18~22℃, 光暗比(L∶D)12h∶12h。
1.2 中华哲水蚤产卵和孵化实验
培养中华哲水蚤的海水过滤后再经过充分的曝气和预冷。实验用中华哲水蚤(Calanus sinicus)于2008年3月在青岛中苑码头(36.04°N; 120.29°E)(现场测定水温为 5.5℃)通过垂直拖网(浅水Ⅰ型浮游生物网: 筛绢孔径为500 μm)获得。挑选健康成熟的雌体置于自制的400 mL产卵瓶内, 实验设置海洋原甲藻(PM)、中肋骨条藻(SC)两个实验组, 以饥饿(S)培养为对照。每组6个重复, 每个重复5只雌体。根据现场水温将培养温度控制在 5.5℃±0.5℃, 培养于黑暗条件下进行。经过48 h的驯化和排空后, PM培养组和SC培养组分别加入海洋原甲藻和中肋骨条藻。将两种藻的浓度都维持在 1.0 μgC/mL(海洋原甲藻: 8.6×102个/mL; 中肋骨条藻: 3.3×104个/mL)左右, 远高于中华哲水蚤摄食阈值(约为0.2~0.3 μgC/mL)[14]。每日收集、计数产卵瓶内的卵, 并更换海水和饵料。将收集到的卵置于过滤海水中孵化 72 h, 计数孵化的无节幼体的数目。实验持续24 d。
1.3 脂肪酸和醛类测定
用以测定脂肪酸组成的藻类样品取藻液约 200~500 mL经2 400 r/min离心5 min后收集藻细胞沉淀,样品冷冻干燥48 h后保存于–20℃。向样品中加入C19∶0脂肪酸甲酯作为内标, 0.01%BHT甲醇溶液作为抗氧化剂。样品的处理参照Folch等[15]和Parrish[16]的方法, 简单来说样品经二氯甲烷: 甲醇(2∶1) 提取总脂后加入1 mL 0.5 mol/L KOH甲醇溶液于80℃水浴中皂化2 h。皂化反应结束后加入1 mL13%BF3甲醇溶液于80℃水浴中甲酯化反应1 h。脂肪酸甲酯经正己烷萃取后将样品定容至0.4 mL上机测定。甲醇、二氯甲烷和正己烷为 Merck公司生产的色谱纯。BF3甲醇溶液、脂肪酸标样、BHT均为Sigma公司生产。
脂肪酸的组成和含量用Agilent 7890A型气相色谱仪来分析。色谱条件如下:
毛细管色谱柱: DB-FFAP(30 m×0.25 mmID× 0.25 μm);
进样口温度: 220℃;
检测器温度: 280℃;
柱温: 程序升温
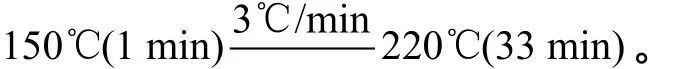
用以测定挥发性醛类的样品处理方法参照肖荣辉[17], 取一定量的藻液经2 400 r/min离心5 min后取3 mL左右的沉淀装入20 mL顶空瓶中。样品经超声破碎30s, 将顶空瓶于75℃恒温条件下进行磁力搅拌(搅拌速率为170 r/min), 平衡10 min, 然后以顶空固相微萃取法提取藻液中的挥发性醛类物质, 15 min后立即插入气相色谱汽化室230℃下解吸5 min, 进行GC/MS分析。
样品中醛类以Thermo Finnigan Trace DSQ 2003型气质联用仪进行分析, 以外标法进行定量。色谱条件如下:
毛细管色谱柱: DB-5MS(30 m×0.25 mmID×0.25 μm);
进样口温度: 230℃;
柱温: 程序升温

质谱条件如下: 传输杆温度: 230℃, 离子源温度: 230℃。
2 结果
2.1 中肋骨条藻和海洋原甲藻的脂肪酸组成
中肋骨条藻和海洋原甲藻的脂肪酸组成如表 1所示。中肋骨条藻的主要脂肪酸为14∶0、16∶0、16∶1ω7、16∶3ω4和20∶5ω3, 占总脂肪酸的77.17%。海洋原甲藻的主要脂肪酸为16∶0、18∶4ω3、18∶5ω3、20∶3ω6和22: 6ω3, 占总脂肪酸的90.49%。其中, 16∶3ω4仅在中肋骨条藻中测得, 而18∶5ω3、20∶3ω6仅在海洋原甲藻中测得。16∶0作为两种藻的主要脂肪酸, 它在中肋骨条藻和海洋原甲藻中的含量均较高。14∶0、16∶1ω7、和20∶5ω3在中肋骨条藻中的含量显著高于在海洋原甲藻中的含量(分别为P<0.005,P<0.05和P<0.001), 而18∶4ω3和22∶6ω3在海洋原甲藻中的含量则显著高于在中肋骨条藻中的含量(分别为P<0.05和P<0.001)。中肋骨条藻∑16、SFA(饱和脂肪酸)和 MUFA(单不饱和脂肪酸)的含量远高于海洋原甲藻(P<0.05), 而∑18、∑ω3、∑ω6的含量则远低于海洋原甲藻(P<0.001), 另外中肋骨条藻PUFA(多不饱和脂肪酸)的含量也远低于海洋原甲藻(P<0.05)。两种藻总脂肪酸含量分别为 23.93μg/mg± 0.47μg/mg和69.72μg/mg±3.54μg/mg, 经t检验发现中肋骨条藻总脂肪酸含量显著低于海洋原甲藻(P<0.005)。
2.2 中肋骨条藻和海洋原甲藻中不饱和醛类组成及含量
中肋骨条藻和海洋原甲藻不饱和醛类总含量分别为1438.95 μg/g和114.58 μg/g(表2), 前者远高于后者。实验中中肋骨条藻共测得6种醛类, 分别为反式-2-己烯醛、庚醛、反式-2-庚烯醛、反式-2, 4-庚二烯醛、反式-2-癸烯醛和反式-2, 4-癸二烯醛。海洋原甲藻则仅测得 3种醛类, 分别为反式-2-己烯醛、庚醛和反式-2, 4-庚二烯醛, 且测得的这三种醛的含量也远低于中肋骨条藻。
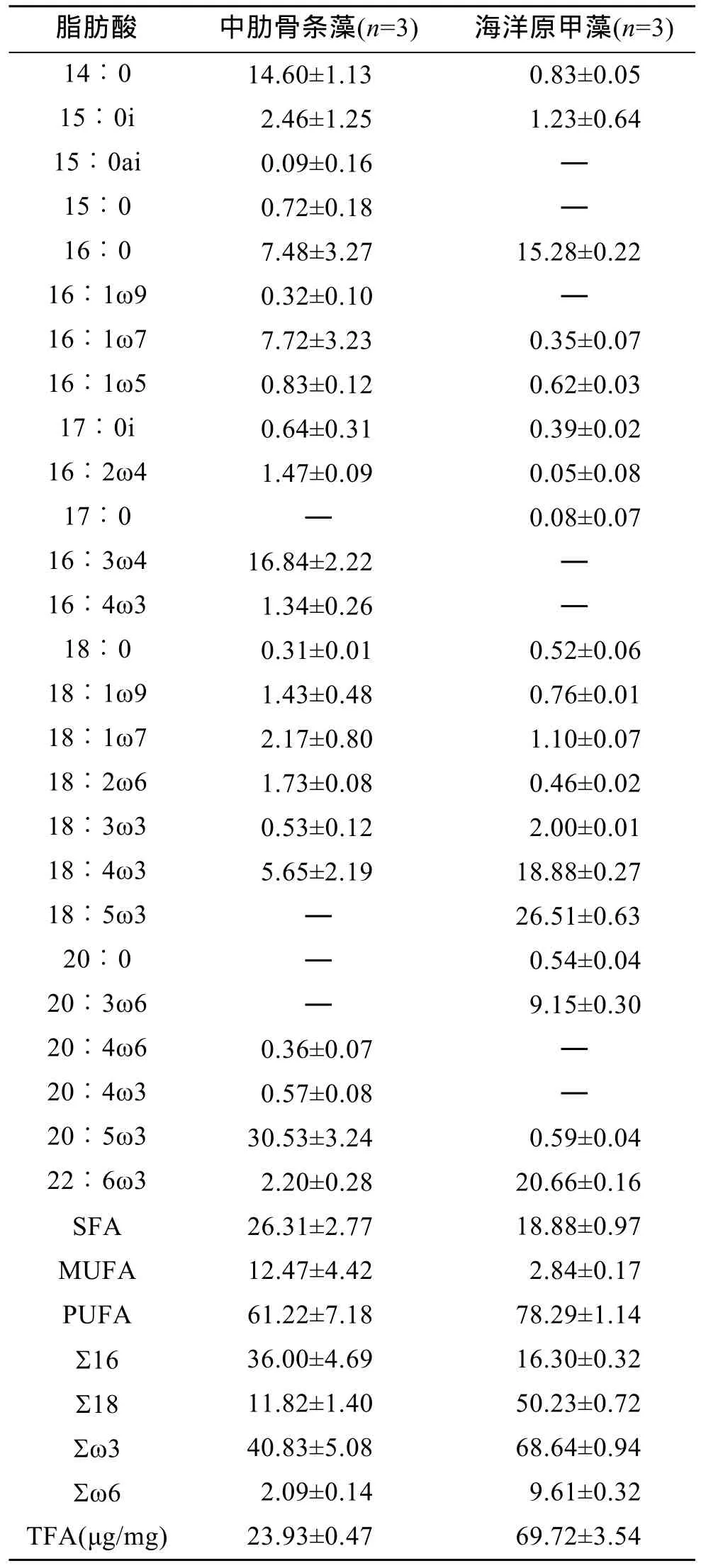
表1 中肋骨条藻和海洋原甲藻脂肪酸组成(%)Tab.1 Fatty acid composition (%) of Skeletonemacostatum and Prorocentrum micans
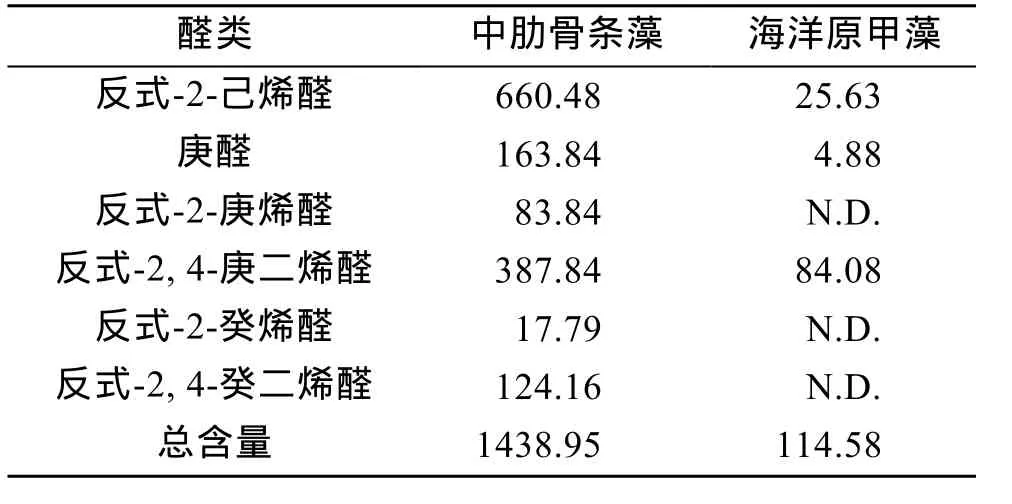
表2 中肋骨条藻和海洋原甲藻醛类组成和含量(μg/g)Tab.2 Unsaturated aldehydes contents (μg/g) of Skeletonema costatum and Prorocentrum micans
2.3 中华哲水蚤的产卵率和孵化率
不同处理下中华哲水蚤存活率的变化具有相似的特征(图1), 即在实验开始几天后出现一个下降期,实验中期存活率保持稳定, 实验结束前几天出现另一个下降期。相对来说SC培养的存活率下降的最多, PM培养的存活率下降的最少。实验结束时, SC培养、饥饿培养、PM 培养下中华哲水蚤的存活率分别为67%、81%和87%。
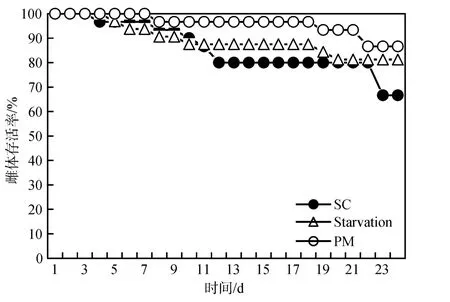
图1 不同培养条件下中华哲水蚤的存活率Fig.1 Survival (%) of Calanus sinicus on different diets
三种培养下中华哲水蚤产卵率的变化如图 2所示。饥饿培养下中华哲水蚤的产卵率逐渐下降, 5 d之后就停止了产卵, 之后仅有个别个体产少量的卵。经过48 h驯化后, SC培养和PM培养下中华哲水蚤第2天产卵率都很低, 第3天产卵率则迅速升高。随后的10 d中, 二者的产卵率均保持在一个相对较高的水平。到第 12天时, 二者的产卵率均迅速下降, 直到17 d以后开始逐渐升高。SC培养、饥饿培养、PM培养下中华哲水蚤的平均产卵率分别为: (3.84±2.80)eggs/(fem·d)、(0.21±0.37) eggs/(fem·d)、(3.76±2.37) eggs/(fem·d)。SC培养和PM培养的中华哲水蚤产卵率之间并无显著差异。
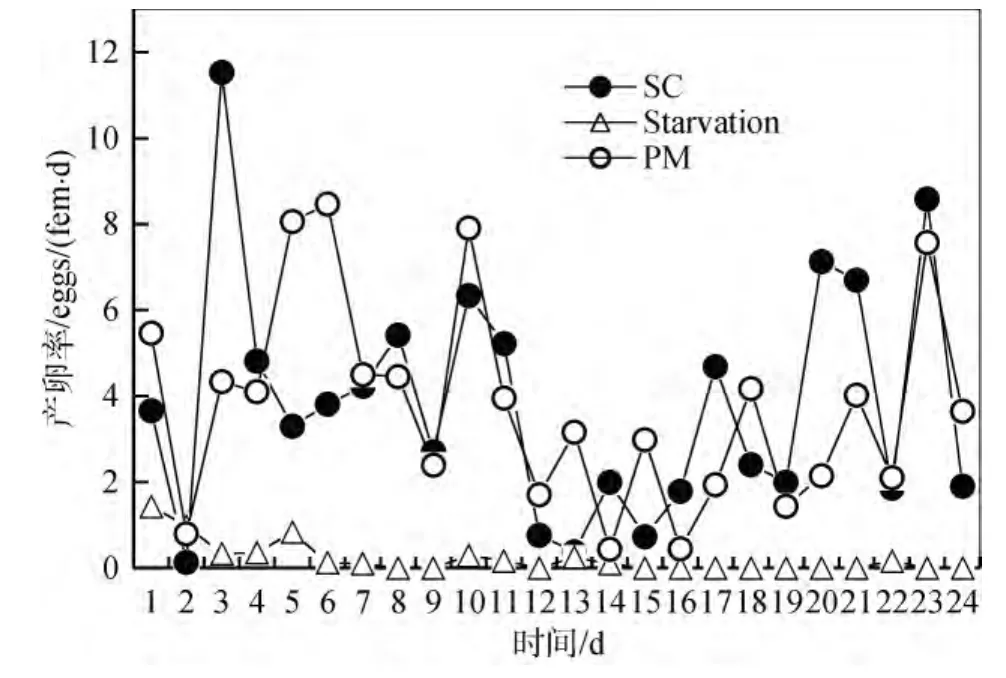
图2 不同培养条件下中华哲水蚤此雌体的产卵率eggs/(fem·d)Fig.2 Daily egg production rate (eggs/(fem·d)) of Calanussinicus on different diets
SC培养和PM培养下中华哲水蚤卵的孵化率如图3所示。SC培养的中华哲水蚤卵的孵化率在第10天和第19天时出现两个低值。SC培养和PM培养的中华哲水蚤卵的平均孵化率分别为 80.21%±11.88%和 86.24%±8.03%, 二者之间并无显著差异。相对来说, 整个实验过程中SC培养的中华哲水蚤卵的孵化率比PM培养的中华哲水蚤卵的孵化率波动要大。
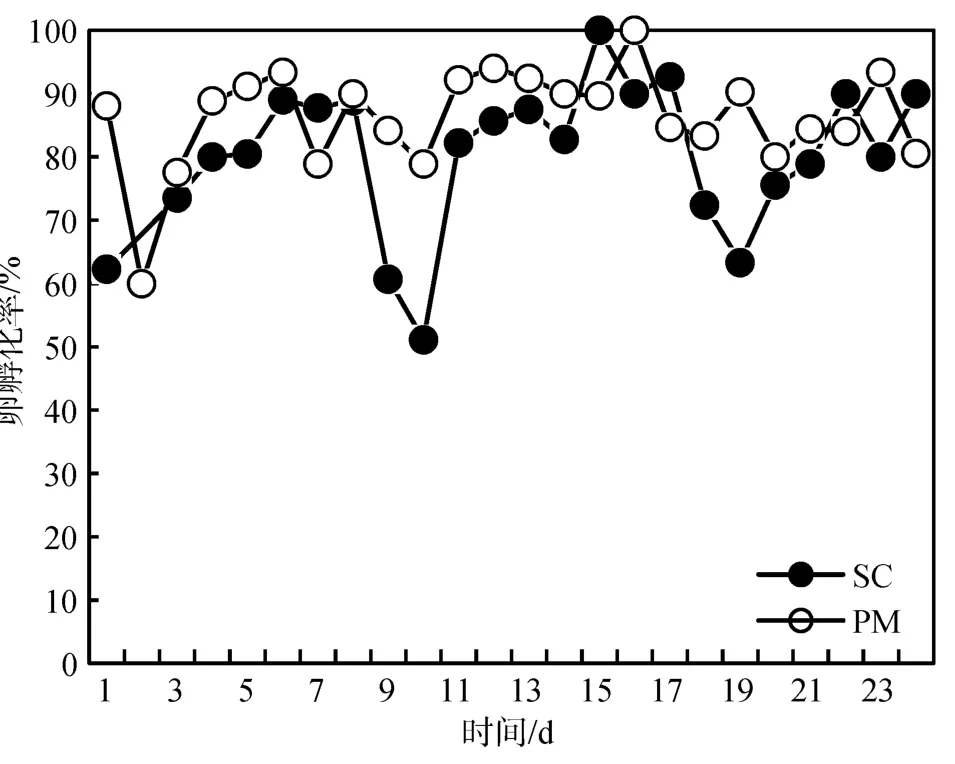
图3 不同培养条件中华哲水蚤卵的孵化率(%)Fig.3 Daily hatching success (%) of Calanus sinicus on different diets
3 讨论
3.1 中肋骨条藻和海洋原甲藻的化学组成
各个门类的海洋微藻具有不同的脂肪酸组成特征[18]。藻类的脂肪酸组成还会因为培养条件和生长期的不同而发生变化[19]。本研究中中肋骨条藻的主要脂肪酸为 14∶0、16∶0、16∶1ω7、16∶3ω4和20∶5ω3, 海洋原甲藻的主要脂肪酸为 16∶0、18∶4ω3、18∶5ω3、20∶3ω6和22∶6ω3, 表现出典型的硅藻门和甲藻门的脂肪酸组成特征[18]。按脂肪酸分类来看, 二者脂肪酸组成的差异还表现在中肋骨条藻具有较高含量的∑16、SFA和MUFA, 而海洋原甲藻具有较高含量的∑18、∑ω3、∑ω6和PUFA。其中, 20∶5ω3、22∶6ω3等脂肪酸不能由捕食者自身合成而必须从食物中获得, 是动物体内的必需脂肪酸[20]。不同的饵料因脂肪酸组成的不同提供给捕食者的脂肪酸的种类和含量也不同, 如果饵料中缺乏一些必需脂肪酸,则会对捕食者的一些生理活动产生影响[21]。在相同的培养条件下, 海洋原甲藻总脂肪酸含量大约是中肋骨条藻的 3倍左右。因此相同质量的海洋原甲藻能够比中肋骨条藻提供给捕食者更多的脂肪酸, 特别是那些对捕食者生长发育很重要的必需脂肪酸。
研究表明, 一些硅藻在细胞破裂时(捕食者捕食等原因造成)会产生应激反应释放不饱和醛的混合物[22-23], 这些源于不饱和脂肪酸的醛类会对植食性的甲壳类产生毒性效应[24-25]。目前关于醛类测定的方法较多, 测得的结果也有差别。Miralto等[7]通过高分辨率质谱测定了中肋骨条藻等三种硅藻中的三种醛类的含量, Wichard 等[25]以气质联用仪分析了五种硅藻中的四种醛类的含量。由于培养条件、生长阶段和生长状态的不同, 硅藻释放的醛类也会有差别[26]。本研究中中肋骨条藻的醛类总含量要远高于海洋原甲藻, 中肋骨条藻体内的多不饱和醛类共测得 6种,而海洋原甲藻体内的醛类仅测得 3种。可见除了硅藻, 其他种类的一些海洋微藻也会释放醛类, 在相同的条件下, 中肋骨条藻能够比海洋原甲藻释放更多种类和更高含量的醛类。本研究中仅选择了单种硅藻和单种甲藻进行了研究, 是否所有的硅藻都能比甲藻释放更多种类和更高含量的醛类还需要选择更多的硅藻和甲藻进行进一步的研究。
3.2 饵料对中华哲水蚤产卵和孵化的影响
饵料对桡足类的繁殖活动至关重要。本研究中在饥饿的情况下, 中华哲水蚤的产卵活动在5d后才几乎完全停止。而Huggett[3]、林元烧和李松等[27]的研究中桡足类在饥饿 2~3 d以后就基本停止了产卵活动, 在投饵恢复之后几天之内桡足类就逐步恢复了产卵。这说明桡足类的繁殖活动主要依赖于外部的食物条件。从种群的角度来看, 春季水华期浮游植物的大量增殖为桡足类的繁殖和种群补充提供了充足的饵料。
除了食物数量, 食物的质量也是影响桡足类繁殖的一个重要因素[8]。食物质量包括饵料大小、适口性、化学组成等多方面的内容。近年来对桡足类室内培养的结果发现高浓度的硅藻会抑制桡足类的产卵并对卵的孵化产生不利影响[4,7,28]。一些科学家将原因归结于不同的藻类具有不同的化学组成: 一方面单种藻类营养成分不全面难以为捕食者提供足够的营养成分, 另一方面一些硅藻会释放多不饱和醛类物质, 从而影响桡足类卵的孵化[5,7]。但近年来的一些研究认为, 硅藻对桡足类繁殖活动存在负面影响主要存在于室内培养硅藻浓度较高时, 野外的一些研究结果发现, 春季硅藻水华对桡足类产卵具有促进作用[29]。本研究中虽然中肋骨条藻和海洋原甲藻的化学组成存在较大差异, 但中华哲水蚤在两种饵料培养下的产卵率并无明显差异。Li等[14]的研究中虽然也报道了中华哲水蚤在用中肋骨条藻和混合饵料(硅藻、甲藻)培养时并没有发现产卵率的显著下降, 但在用三角褐指藻和牟氏角毛藻培养时其产卵率均显著下降。这说明并不是所有的硅藻都会对桡足类的产卵产生抑制作用。目前较多的观点认为那些硅藻对桡足类产卵产生抑制作用是因为其体内缺乏一些重要的脂肪酸类物质[8], 但Wichard等[11]则认为桡足类的繁殖活动与饵料的多不饱和脂肪酸和醛类的组成和含量无关。
Irigoien等[13]认为在自然界中硅藻的浓度很难对桡足类卵的孵化率产生抑制效应。但在室内, 桡足类的卵在硅藻、甲藻、混和饵料溶出液中的孵化率均低于在过滤海水中的孵化率[14]。说明除了硅藻, 其他的藻类可能也会释放一些次级代谢物抑制桡足类卵的孵化。前期的研究中, 通过研究卵在不同藻类溶出液中的孵化过程, 认为硅藻释放的有害物质会影响受精卵的分裂过程, 从而产生畸形幼体和未孵化的卵[30-31]。本研究由于没有足够的卵, 仅做了两种处理下中华哲水蚤卵在过滤海水中的孵化率实验。结果发现两种藻培养的中华哲水蚤卵的孵化率并无明显差异。这说明藻类进入桡足类体内以后并未因其生化组成的差异对卵的孵化产生影响, 其他报道中藻类对桡足类卵孵化的抑制作用主要是通过排出的胞外分泌物作用于受精卵的分裂过程导致的[30-31]。需要注意的是虽然本文中中华哲水蚤在两种微藻培养下产卵率和卵的孵化率无显著差异, 但中肋骨条藻培养下的中华哲水蚤, 在实验中表现出了更高的死亡率, 说明高浓度的硅藻会影响桡足类的存活[8]。导致这一现象的原因是否是因为硅藻类更低的必需脂肪酸含量和更高的不饱和醛类含量尚需要选择更多的藻种进行进一步研究。
4 结论
硅藻对桡足类繁殖活动的影响并不是一个简单的问题。本研究中中肋骨条藻会明显降低中华哲水蚤的存活率, 但却没有表现出对桡足类产卵的抑制作用。而在许多其他的室内研究中, 硅藻对桡足类产卵的抑制作用也表现出了种的差异性, 有的种在不同的培养条件下还表现出对桡足类产卵的不同影响效应。在野外, 桡足类的食物选择更多, 硅藻的浓度可能远达不到对桡足类产卵产生抑制作用的浓度。因此, 我们认为硅藻对桡足类产卵是否产生抑制作用不仅取决于藻的种类, 还取决于藻类的浓度。硅藻对桡足类卵孵化的抑制作用目前已经研究的比较清楚, 目前普遍认为藻类特别是硅藻产生的不饱和醛类会影响桡足类受精卵的有丝分裂过程, 从而降低桡足类卵的孵化率。而在一些现场试验中虽然没有观察到孵化率的下降, 却发现了硅藻水华过后大量畸形无节幼体的产生。
[1] Sell A F, Keuren D V, Madin L P. Predation by omnivorous copepods on early developmental stages ofCalanus finmarchicusandPseudocalanusspp. [J].Limnology and Oceanography, 2001, 46(4): 953-959.
[2] Zhang G T, Li C L, Sun S, et al. Feeding habit ofCalanus sinicus(Crustacea: Copepoda) during spring and autumn in the Bohai Sea studied with herbivore index [J].Scientia Marina, 2006, 70(3): 381-388.
[3] Huggett J A. Reproductive response of the copepodsCalanoides carinatusandCalanus agulhensisto varying periods of starvation in the southern Benguela upwelling region [J].Journal of Plankton Research, 2001, 23(10): 1061-1071.
[4] Ban S, Burns C, Castel J, et al. The paradox of diatom-copepod interactions [J].Marine Ecology-progress Series, 1997, 157: 287-293.
[5] Miralto A, Guglielmo L, Zagami G, et al. Inhibition of population growth in the copepodsAcartia clausiandCalanus helgolandicusduring diatom blooms [J].Marine Ecology Progress Series, 2003, 254: 253-268.
[6] Chen M R, Liu H B, Chen B Z. Effects of dietary essential fatty acids on reproduction rates of a subtropical calanoid copepod,Acartia erythraea[J].Marine Ecol-ogy Progress Series, 2012, 455: 95-110.
[7] Miralto A, Barone G, Romano G, et al. The insidious effect of diatoms on copepod reproduction [J].Nature, 1999, 402: 173-175.
[8] Shin K, Jang M C, Jang P K, et al. Influence of food quality on egg production and viability of the marine planktonic copepodAcartia omorii[J].Progress in Oceanography, 2003, 57(3-4): 265-277.
[9] Jónasdóttir S H. Effects of food quality on the reproductive success ofAcartia tonsaandAcartia hudsonica: laboratory observations [J].Marine Biology, 1994, 121(1): 67-81.
[10] Jónasdóttir S H, Kiørboe T. Copepod recruitment and food composition: do diatoms affect hatching success? [J].Marine Biology, 1996, 125(4): 743-750.
[11] Wichard T, Poulet S A, Boulesteix A L, et al. Influence of diatoms on copepod reproduction. II. Uncorrelated effects of diatom-derived alpha, beta, gamma, delta-unsaturated aldehydes and polyunsaturated fatty acids onCalanus helgolandicusin the field [J].Progress in Oceanography, 2008, 77(1): 30-44.
[12] Dutz J, Koski M, Jonasdottir S H. Copepod reproduction is unaffected by diatom aldehydes or lipid composition [J].Limnology and Oceanography, 2008, 53(1): 225-235.
[13] Irigoien X, Harris R P, Verheye H M, et al. Copepod hatching success in marine ecosystems with high diatom concentrations [J].Nature, 2002, 419: 387-389.
[14] Li J, Sun S, Li C L, et al. Effects of single and mixed diatom diets on the reproduction of copepodCalanus sinicus[J].Acta Hydrochimica et Hydrobiologica, 2006, 34(1-2): 117-125.
[15] Folch J, Lees M, Sloane Stanley G H. A simple method for the isolation and purification of total lipides from animal tissues [J].Journal of Biology and Chemistry, 1957, 226(1): 497-509.
[16] Parrish C C. Determination of total lipid, lipid classes and fatty acids in aquatic samples[C]// Arts M T, Wainman B C.Lipids in Freshwater Ecosystem. Newyork: Springer-Verlag, 1999: 4-20.
[17] 肖荣辉. GC/MS在环境污染物分析及海洋生态领域中的应用研究[D]. 青岛: 青岛理工大学, 2010.
[18] Dalsgaard J, St John M, Kattner G, et al. Fatty acid trophic markers in the pelagic marine environment [J].Advances in Marine Biology, 2003, 46: 225-340.
[19] Volkman J K, Jeffrey S W, Nichols P D, et al. Fatty-Acid and Lipid-Composition of 10 Species of Microalgae Used in Mariculture [J].Journal of Experimental Marine Biology and Ecology, 1989, 128(3): 219-240.
[20] Spector A A. Essentiality of fatty acids [J].Lipids, 1999, 34: S1-S3.
[21] Arts M T, Ackman R G, Holub B J. “Essential fatty acids” in aquatic ecosystems: a crucial link between diet and human health and evolution [J].Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(1): 122-137.
[22] Pohnert G. Wound-activated chemical defense in unicellular planktonic algae [J].Angewandte Chemie-International Edition, 2000, 39(23): 4352-4354.
[23] Pohnert G, Lumineau O, Cueff A, et al. Are volatile unsaturated aldehydes from diatoms the main line of chemical defence against copepods? [J].Marine Ecology Progress Series, 2002, 245: 33-45.
[24] Ianora A, Miralto A, Poulet S A, et al. Aldehyde suppression of copepod recruitment in blooms of a ubiquitous planktonic diatom [J].Nature, 2004, 429(6990): 403-407.
[25] Wichard T, Poulet S A, Pohnert G. Determination and quantification of alpha, beta, gamma, delta-unsaturated aldehydes as pentafluorobenzyl-oxime derivates in diatom cultures and natural phytoplankton populations: application in marine field studies [J].Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2005, 814(1): 155-161.
[26] Ribalet F, Wichard T, Pohnert G, et al. Age and nutrient limitation enhance polyunsaturated aldehyde production in marine diatoms [J].Phytochemistry, 2007, 68(15): 2059-2067.
[27] 林元烧, 李松. 厦门港中华哲水蚤产卵量的初步研究[J].厦门大学学报(自然科学版), 1986, 25(1): 107-112.
[28] Poulet S A, Escribano R, Hidalgo P, et al. Collapse ofCalanus chilensisreproduction in a marine environment with high diatom concentration [J].Journal of Experimental Marine Biology and Ecology, 2007, 352(1): 187-199.
[29] Koski M. High reproduction ofCalanus finmarchicusduring a diatom-dominated spring bloom [J].Marine Biology, 2007, 151(5): 1785-1798.
[30] Poulet S A, Laabir M, Ianora A, et al. Reproductive response ofCalanus helgolandicus. I. Abnormal embryonic and naupliar development [J].Marine Ecology Progress Series, 1995, 129(1-3): 85-95.
[31] Ianora A, Poulet S A, Miralto A, et al. The diatomThalassiosira rotulaaffects reproductive success in the copepodAcartia clausi[J].Marine Biology, 1996, 125(2): 279-286.
(本文编辑: 康亦兼)
Influence of two algal diets on the reproduction of the copepodCalanus sinicusbased on a biochemical analysis of diets
LIU Meng-tan1, JIN Xin2, LI Chao-lun2
(1. Jiaozhou Bay Ecosystem Research Station, Qingdao 266071, China; 2. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
Feb., 12, 2015
Calanus sinicus; egg production rate; hatching success; fatty acid; unsaturated aldehydes
In a laboratory experiment with a duration of 24 days, the influence of two algal diets on egg production and hatching success of the copepodCalanus sinicuswas studied. During the experiment,Skeletonema costatumandProrocentrum micanswere offered as diets at the same concentration and with starvation as the control. The diets were analyzed for their fatty acid and unsaturated aldehydes compositions. Comparatively,P. micanswas rich in ∑18, ∑ω3, ∑ω6, polyunsaturated fatty acid, and total fatty acid, andS. costatumwas rich in ∑16 and monounsaturated fatty acid. The total unsaturated aldehydes ofS. costatumandP. micanswere 1438.95 μg/g and 114.58 μg/g, respectively.C. sinicusterminated egg production after being placed in filtered sea water for a period of time. The egg production rate and hatching success ofC. sinicusdid not show significant differences based on a diet ofS. costatumorP. micans, indicating that not all diatom diets have a negative effect on copepod reproduction. At the end of the experiment,C. sinicussurvival rates were 61%, 81%, and 87% with diets ofS. costatum,P. micans, or starvation, respectively. We considered that the nutritional imbalances of fatty acid composition and the production of unsaturated aldehydes inS. costatummight reduce the survival ofC. sinicus.
Q143.1
A
1000-3096(2015)12-0001-07
10.11759/hykx20150212001
2015-02-12;
2015-06-25
国家重点基础研究发展计划(973)项目(2015CB452903, 2011CB403604); 国家自然科学基金资助项目 (41476139, 41406159)
刘梦坛(1983-), 男 , 重庆人, 博士, 从事海洋浮游动物生态学研究, E-mail: liumengtan@qdio.ac.cn, 电话: 0532-82898545; 李超伦, 通信作者, E-mail: lcl@qdio.ac.cn
