Ⅰ型鸭肝炎病毒基因C型株的分离与鉴定
2015-03-06龚文孝金梅林
张 雪,龚文孝,胡 勇,邹 忠,李 冉,金梅林,*
(1.华中农业大学动物医学院,湖北武汉 430070;2.武汉科前动物生物制品有限责任公司,湖北武汉 430070)
Ⅰ型鸭肝炎病毒基因C型株的分离与鉴定
张 雪1,龚文孝2,胡 勇1,邹 忠1,李 冉2,金梅林1,2*
(1.华中农业大学动物医学院,湖北武汉 430070;2.武汉科前动物生物制品有限责任公司,湖北武汉 430070)
在湖北某养殖场的雏鸭群中,出现以角弓反张和肝脏树枝状出血为特征的传染性疾病,根据临床病症初步判断疑似鸭肝炎病毒感染。使用本实验室建立的RT-PCR方法对鸭胚分离毒株进行鉴定,扩增出与预期大小相符的929 bp的目的片段。该片段序列与GenBank上公布的Ⅰ型鸭肝炎病毒基因C型株序列同源性达98%,由此可以确定该雏鸭群感染了新型Ⅰ型鸭肝炎病毒。雏鸭回归试验结果表明,尿囊液接种非免疫7日龄雏鸭,48 h后试验组出现症状,60 h出现雏鸭死亡,出现角弓反张等症状,病理剖检及组织病理学切片都能观察到特征性病理变化,对照组不出现任何临床症状及病理变化。
Ⅰ型鸭肝炎病毒;变异;逆转录-聚合酶链反应;分离;鉴定
血清Ⅰ型鸭肝炎病毒是造成鸭病毒性肝炎的主要病原,主要感染2周龄内雏鸭,其传播速度和致死率,每年给养鸭业造成巨大的损失。鸭病毒性肝炎又被称为“背脖病”,病死雏鸭主要表现为角弓反张,病理剖检发现其肝脏肿大,表面呈点状出血或者树枝状出血[1]。
近年来,由于免疫压力等因素,血清Ⅰ型鸭肝炎病毒呈现出新的流行态势。2007年,韩国首次报道分离到一种变异的Ⅰ型鸭肝炎病毒,其病毒基因组结构、致病症状等与经典流行的Ⅰ型鸭肝炎病毒非常相似,但二者之间免疫交叉保护较差,经基因组测序鉴定其发生了较大的遗传变异[2]。后来中国大陆及台湾等地区都报道了Ⅰ型鸭肝炎病毒的遗传变异株[3-4],其中大陆地区分离株与韩国分离的变异株之间存在免疫交叉反应,经国际病毒分类委员会确定命名为Ⅰ型鸭肝炎病毒基因C型,台湾地区分离毒株命名为Ⅰ型鸭肝炎病毒基因B型,经典流行的Ⅰ型鸭肝炎病毒命名为Ⅰ型鸭肝炎病毒基因A型[5]。
2013年夏天,湖北某鸭场9日龄雏鸭发病,主要表现为精神沉郁,食欲减退,转圈,扭头死亡,死亡雏鸭呈现角弓反张等症状。主要剖检病理变化为肝脏肿大,表面呈现树枝状出血。经RT-PCR方法检测及序列比对分析,显示引起此次疫病的为新型鸭肝炎病毒感染。
1 材料与方法
1.1 材料
1.1.1 试验用动物及主要试剂 10日龄非免疫鸭胚、13日龄非免疫雏鸭为武汉春江禽业有限公司产品;Trizol为Invitrogen公司产品;Trans Tag DNA聚合酶、DNA Marker DL 5 000为全式金公司产品;AMV反转录酶、RNA酶抑制剂为宝生物工程(大连)有限公司产品。三氯甲烷、乙醇和异丙醇等为国药试剂(分析纯)。
1.1.2 引物合成 参考GenBank中已经发表的Ⅰ型鸭肝炎病毒基因A型和基因C型全基因组序列,选取保守区域设计鉴定引物,其序列如下p1:5′-ACTGTGAATTCATCAGCCCC-3′,p2:5′-CACTGCACACCATAATGGCGG-3′; p1:5′-TTAACTCAACATCTCCATCC-3′,p2:5′-TTTTGCCAGATCCTGATTTACC-3′。引物p1/p2能特异性的鉴定血清Ⅰ型鸭肝炎病毒基因A(DHAV-A)型毒株,扩增出1 432 bp的DNA片段,引物p3/p4能特异性的鉴定血清Ⅰ型鸭肝炎病毒基因C(DHAV-C)型毒株,扩增出929 bp的DNA片段。
1.2 方法
1.2.1 病毒的分离与增殖 临床采集的疑似鸭肝炎感染雏鸭的肝脏病料,剪取病变的肝脏组织,每2 g组织约加入500 μL灭菌的PBS缓冲液(10 g/L的青链霉素)进行匀浆处理,置于-80 ℃保存。
将处理好的病料上清接种10日龄非免疫鸭胚,每枚鸭胚尿囊腔接种病料研磨上清原液200 μL。每天照胚2次,丢弃24 h内死亡鸭胚,4 d后收获尿囊液进行RT-PCR鉴定。
1.2.2 病毒的RT-PCR鉴定 按照Trizol法提取病料研磨上清中病毒RNA,20 μL无RNA酶水溶解后取10.5 μL抽提的RNA样品进行反转录,加人20 μmol/L的随机引物2 μL,10 μmol/L的dNTP 2 μL,AMV酶1 μL,5×AMV buffer 4 μL,RNA酶抑制剂0.5 μL。混匀后按照以下程序进行反转录:42 ℃ 60 min,72 ℃ 15 min,16 ℃ 10 min。
取4 μL反转录完成的cDNA样本加入干净的PCR管中,然后依次加入20 μmol/L的上/下游引物各1.5 μL,TransTagDNA聚合酶0.5 μL,10×TransTagbuffer 2.5 μL,10 μmol/L的dNTP 2 μL,然后加水补充体积至25 μL。混匀后按照以下程序进行PCR反应:95 ℃预变性10 min ;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;最后整体延伸10 min。PCR产物于8 g/L的琼脂糖凝胶中电泳检测。
1.2.3 雏鸭回归试验 选择无鸭肝炎母源抗体的7日龄雏鸭30只,随机分成3组,第1组用收获的尿囊液作10倍稀释,经腿部肌肉注射,0.2 mL/只;第2组将收获的尿囊液经100倍稀释,经腿部肌肉注射,0.2 mL/只;第3组腿部肌肉注射灭菌的PBS。3组试验动物均隔离饲养,保证充足的饮水及饲料,每12 h观察1次。
1.2.4 病理组织学观察 剖检病死鸭及正常对照组的鸭子,观察肝脏大体病理变化,并取病死雏鸭及正常对照组的雏鸭肝脏,按照常规方法制作石蜡切片,在光学显微镜下观察肝脏的病理组织学变化。
2 结果
2.1 鸭胚尿囊液的RT-PCR检测及遗传进化分析
临床观察发病雏鸭,表现为典型的“背脖病”特征,初步判断鸭肝炎。如图1所示,分别从接种病料上清的鸭胚尿囊液和正常鸭胚尿囊中提取RNA,经RT-PCR检测显示,从正常的鸭胚尿囊液中没有检测到特异性的条带,接种疑似鸭肝炎组织研磨上清的鸭胚尿囊液中只能扩增出929 bp的特异性条带,可以初步判断该样品为DHAV-C阳性。将该特异性的条带回收,连接T载体后,送上海生工生物工程技术服务有限公司测序,获取其序列信息。

图1 尿囊液的RT-PCR鉴定Fig.1 Identification of the allantoic fluid by RT-PCR
将测序所得的片段序列在GenBank中进行比对,发现其与DHAV-C型SD1101毒株序列同源性达98%。提取GenBank中具有代表性血清Ⅰ型鸭肝炎病毒的VP1蛋白编码基因序列进行遗传进化分析。分析结果表明,该分离毒株的VP1基因序列与中国大陆分离的新型鸭肝炎毒株的序列同源性最高,属同一分支;与其他的经典鸭肝炎分离毒株及台湾地区分离毒株的遗传进化距离较远(图2)。
2.2 雏鸭回归试验
将病料上清接种鸭胚后收获的尿囊液经10倍和100倍稀释,经大腿外侧肌肉注射感染7日龄雏鸭,每12 h观察鸭子的临床症状。观察发现,在第48 h,试验组雏鸭出现精神萎靡,采食饮水减少;第72 h出现死亡,死亡雏鸭表现为角弓反张等症状(图3A)。病理剖检观察发现,试验组鸭的肝脏明显肿大,表面出现点状出血或者树枝状出血,经对照组不出现任何临床症状及临床病理变化(图3B)。

图2 分离毒株VP1基因的遗传进化分析Fig.2 Phylogenetic analysis of VP1 gene of the isolated virus
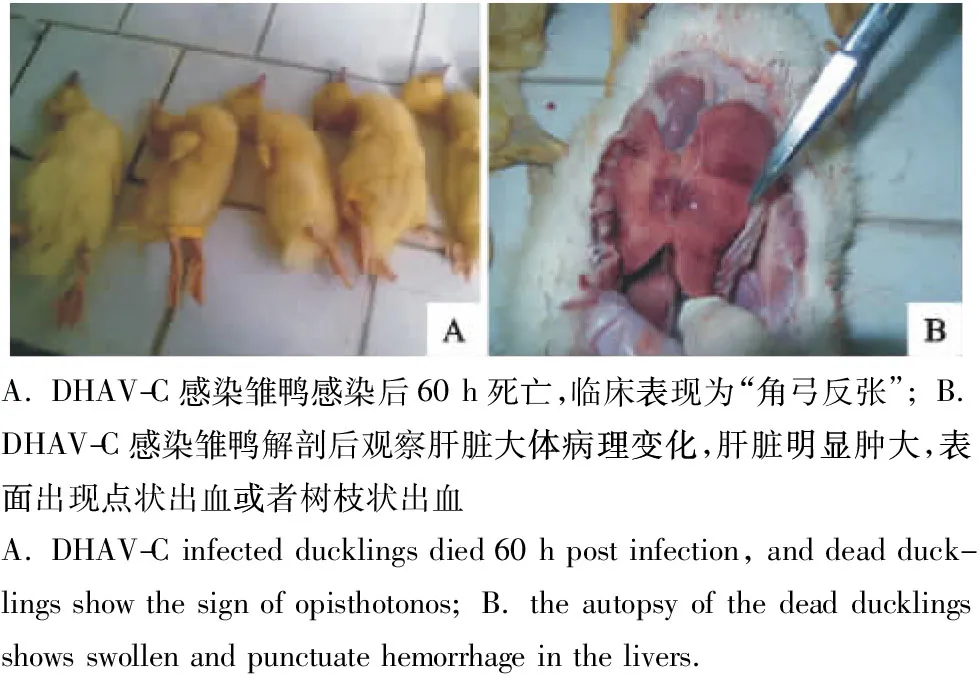
图3 病死鸭的临床病理学观察Fig.3 Clinicopathological observation of dead ducks
将临床剖检的雏鸭肝脏按照常规方法制作石蜡切片,光学显微镜下观察肝脏组织的病理学变化,与对照组(图4A、图4C)相比,试验组(图4B、图4D)雏鸭肝脏表面表现为肝板结构紊乱,中央静脉及细胞间充满大量红细胞;大量肝细胞肿胀变圆,细胞质内出现大小不等的空泡,细胞核淡染;肝细胞间及汇管区有散在的炎性细胞浸润,以淋巴细胞和嗜酸粒细胞为主。
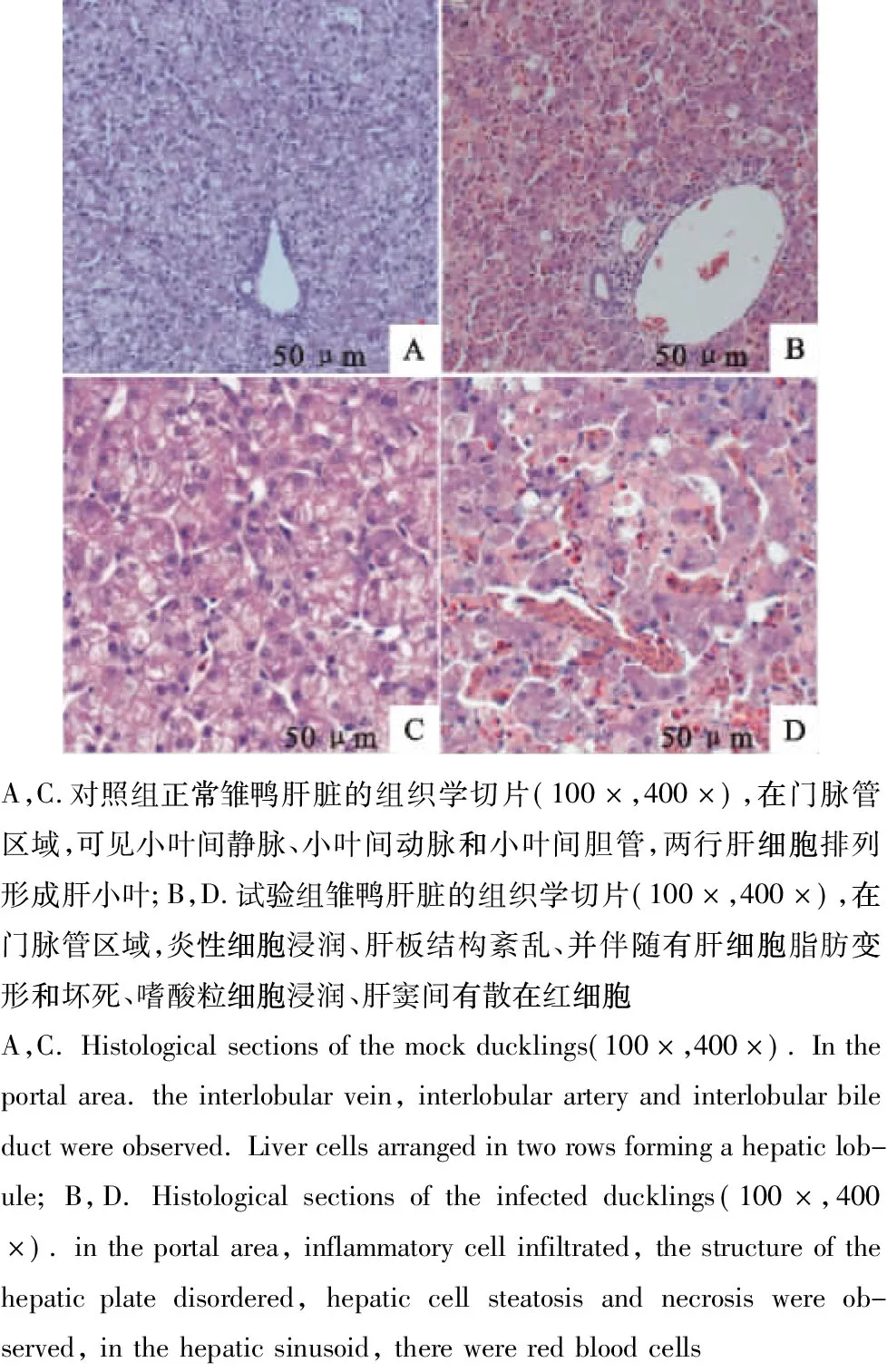
图4 病死鸭肝脏的组织病理学观察Fig.4 Histopathological observation of dead duck liver
3 讨论
本研究中采用鸭胚分离和RT-PCR鉴定,获得了一株血清Ⅰ型鸭肝炎基因C型病毒。DHV-Ⅰ属小RNA病毒科,基因组为单股正链RNA[6]。在本研究中,提取尿囊液中病毒RNA,随机引物反转,采用本实验室建立的RT-PCR方法鉴定,确定为血清Ⅰ型鸭肝炎基因C型病毒感染。在检测该病例时,我们首先采用RT-PCR方法直接检测病死鸭肝脏中鸭肝炎病毒粒子基因组,常常有组织基因组RNA的干扰,检测效果不稳定,灵敏性也不高。便将病料匀浆上清接种鸭胚,收获尿囊液后进行RT-PCR鉴定,具有较好灵敏性。但是接种鸭胚增殖病毒周期较长,不利于临床疫病的控制。因此,建立一种能稳定、快速鉴定Ⅰ型鸭肝炎病毒的方法等迫在眉睫[7-8]。
雏鸭的病毒性肝炎是危害养鸭业比较严重的疫病之一,具有传播快,发病率和死亡率高等特点,给养殖户带来了巨大的经济损失。近2年来,临床上鸭肝炎的流行病学出现了一些新的特点。在中国大陆大部分省区等都有新型鸭肝炎病毒出现的报道[9-10]。新型鸭肝炎病毒后来经国际分类委员会命名为Ⅰ型鸭肝炎病毒基因C型(DHAV-C),与经典流行的Ⅰ型鸭肝炎病毒(DHAV-A)具有同的基因组结构及病毒粒子结构,感染雏鸭后引起类似的临床症状和病理变化,但是两种病毒粒子之间几乎不存在交叉保护,针对DHAV-A流行毒株的疫苗及卵黄抗体等对DHAV-C不产生保护作用[11],因此,在新型鸭肝炎病毒流行的早期经常发生免疫失败,使得疫病得不到很好的控制[12]。
在本研究中,采用本试验建立的RT-PCR方法,从病料接种鸭胚尿囊液中特异性的扩增出了预期929 bp的核酸片段,通过对扩增片段进行测序及Blast比对及遗传进化分析等,确定了该临床分离病毒为DHAV-C流行毒株,对控制该病原引起的疾病有一定意义。
[1] Saif Y M.禽病学[M].高 福,苏敬良,索 勋,译. 11版.北京:中国农业出版社,2005.
[2] Kim M C, Kwon Y K, Joh S J, et al. Recent Korean isolates of duck hepatitis virus revealed the presence of a new geno- and serotype when compared to duck hepatitis virus type 1 type strains[J].Arch Virol,2007,152:2059-2072.
[3] Tseng C H, Tsai H J.Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Res,2007,126:19-31.
[4] 马秀丽,赵立娜,夏雪梅,等.一株韩国新型DHV的分离及RT-PCR鉴定[J].浙江农业学报,2010,22:596-598.
[5] Wang L, Pan M, Fu Y, et al. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J].Virus Genes,2008,37:52-59.
[6] 黄秋雪,汤 承,岳 华,等.基因C型鸭甲型肝炎病毒分子生物学研究进展[J].动物医学进展,2013,34(2):92-95.
[7] 李 娇,王文秀,祖立闯,等.新型鸭病毒性肝炎病毒巢式RT-PCR检测方法的建立及应用[J].中国兽医学报,2013,33(3):341-344.
[8] 何冉娅, 罗玉均,孙 伟,等.Ⅰ型鸭病毒性肝炎病毒和新型鸭肝炎病毒鉴别RT-PCR检测方法的建立[J].黑龙江畜牧兽医,2009(5):14-16.
[9] 提金凤,李志杰,李 舫,等.山东地区Ⅰ型鸭肝炎病毒分离鉴定及单克隆抗体的研制[J].动物医学进展,2012,33(2):63-66.
[10] 李海金,费后俊.一起樱桃谷肉鸭病毒性肝炎的诊治及体会[J].养殖与饲料,2014(3):37-39.
[11] 周 欣,董丽君,张 丽,等.鸭肝炎病毒的分离鉴定及免疫防治试验[J].黑龙江畜牧兽医,2013(3):109-111.
[12] 刘 建,苏敬良,张克新,等.新型鸭肝炎病毒流行病学调查及免疫防治试验[J].中国兽医杂志,2006(2):3-6.
Isolation and Identification of A Serotype Ⅰ Duck Hepatitis Genotype C Virus
ZHANG Xue1,GONG Wen-xiao2,HU Yong1,ZOU Zhong1,LI Ran2,JIN Mei-lin1,2
(1.CollegeofVeterinaryMedicine,HuazhongAgriculturalUniversity,Wuhan,Hubei,430070,China;2.WuhankeqianAnimalBiologicalProductsCo.,Ltd,Wuhan,Hubei,430070,China)
In a farm in Hubei province, an infectious disease emerged in the ducklings. Dead ducklings showed the sign of opisthotonos, with swollen and punctuate hemorrhage in the livers. We primarily determined suspected duck hepatitis virus infection. RT-PCR detection of the samples showed that a 929 bp segment was amplified as expected. We aligned the sequences in the GenBank,and the identity was 98% with known new serotype DHV-Ⅰ. The infection study showed that, the infected 7-day-old ducklings died 60 h after infection, the characteristic pathological and histopathological lesions appeared, but ducklings from the control group were normal.
Duck hepatitis virus type Ⅰ;variation;RT-PCR;isolation;identification
2014-06-17
张 雪(1989-),女,安徽阜阳人,硕士,主要从事动物病原分子生物学与基因工程研究。*
S852.659.6;S858.32
:A
:1007-5038(2015)01-0023-04
