乳酸恩诺沙星对温和气单胞菌的体外抗菌后效应
2015-03-06曹延超谢旭阳戴文婷孔祥会
李 莉,曹延超,谢旭阳,陈 颖,戴文婷,孔祥会
(河南师范大学水产学院,河南新乡 453007)
乳酸恩诺沙星对温和气单胞菌的体外抗菌后效应
李 莉,曹延超,谢旭阳,陈 颖,戴文婷,孔祥会
(河南师范大学水产学院,河南新乡 453007)
为研究乳酸恩诺沙星对温和气单胞菌(A.sobria)的体外药效学,采用二倍稀释法测定了乳酸恩诺沙星对温和气单胞菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC),在此基础上探究在温和气单胞菌的不同生长时期加入乳酸恩诺沙星后对其生长的影响,研究乳酸恩诺沙星不同药物浓度(2×MIC、4×MIC、8×MIC)作用对温和气单胞菌的杀菌动力学和抗菌后效应(PAE)。结果显示,乳酸恩诺沙星对温和气单胞菌的MIC和MBC分别为0.39 μg/mL和1.56 μg/mL,乳酸恩诺沙星对温和气单胞菌有较强的杀菌作用,其PAE与药物浓度呈正相关。
温和气单胞菌;乳酸恩诺沙星;生长曲线;杀菌曲线;抗菌后效应
温和气单胞菌(A.sobria)是我国淡水和海水水产品的一种常见致病菌,可以引起多种水产养殖动物感染发病,可单独引发感染或与嗜水气单胞菌(A.hydrophila)、豚鼠气单胞菌(A.caviae)及其他病原菌混合感染,具有发病率高、传染性强、死亡快的特点。有报道该菌可导致罗非鱼(Tilapia)的出血性败血病,中华鳖(Trionyxsinensis)的肝水肿病,鲤((Cyprinuscarpio)的体表溃烂病, 幼鳖的白点病[1]等。另外,此菌可以通过病鱼经消化道感染人类,导致人类食物中毒,造成腹泻、败血症等疾病[2],属于人兽鱼共染的病原细菌。
恩诺沙星(enrofloxacin)是第一个畜禽专用的氟喹诺酮类广谱抗菌药物[3]。广泛应用于包括水生动物在内的各种动物细菌性疾病的预防和治疗,几乎对水生动物所有病原菌均具有较强的抗菌活性,对赤鳍病、烂尾病、烂鳃病、肠炎病等水产类动物疾病具有良好的疗效[4]。乳酸恩诺沙星为恩诺沙星的乳酸盐,其水溶性好于盐酸恩诺沙星,口服吸收快,体内分布广,对革兰阴性菌有很强的杀灭作用,对革兰阳性菌也有良好的抗菌作用。为了解乳酸恩诺沙星的体外抗菌活性,达到有效的控制鱼类细菌性疾病,本研究选择鱼类病原菌A.sobria,测定了乳酸恩诺沙星对A.sobria的最小抑菌浓度(minimal inhibitory concentration,MIC)、最小杀菌浓度(minimum bactericidal concentration,MBC)和抗菌后效应(post antibiotic effect,PAE),以期为指导生产上科学使用氟喹诺酮类药物提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株 供试A.sobria由河南师范大学水产学院水产动物医学研究室提供,分离自患病斑点叉尾鮰(Ictaluruspunctatus)。
1.1.2 试验药品 供试药品乳酸恩诺沙星(含量98%)为浙江朗博药业有限公司产品;试验所用胰蛋白胨、大豆蛋白胨、氯化钠、琼脂粉等为北京奥博星公司产品。
1.2 方法
1.2.1 乳酸恩诺沙星母液的制备 精密称取20.0 mg乳酸恩诺沙星,加入少量0.1 mol/L NaOH溶液,待完全溶解后,加水定容至10 mL,即为2 000 μg/mL的母液,经0.22 μm的微孔滤膜过滤除菌后分装,使用前配制。
1.2.2 培养基的配制 TSB培养基的配制方法: 称取胰蛋白胨15.0 g,大豆蛋白胨5.0 g,氯化钠5.0 g,加适量水后,调节pH至7.2,加水定容至1 000 mL,121 ℃高压灭菌20 min;TSA培养基则是在TSB培养基中加入15 g/L的琼脂粉配制而成。1.2.3 细菌培养 将保存的A.sobria菌种进行活化,取10 μL菌液接种到1 000 μL的TSB培养基中,28 ℃摇床培养过夜后,划线接种于TSA培养基,28 ℃培养24 h。挑取典型的单菌落接种于1 000 μL TSB培养基,28 ℃培养12 h后转接到100 mL TSB培养基扩大培养,调整菌液浓度使活菌数达到108CFU/mL作为后续试验用菌悬液。
1.2.4 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定 使用杭州天和微生物试剂有限公司生产的恩诺沙星药敏纸片,采用K-B纸片琼脂扩散法,以大肠埃希菌ATCC 25922为质控,按照CLSI标准方法进行药敏试验及结果判定[5]。在药物敏感定性检测的基础上,参考戴自英等试管二倍稀释法[6-8]进行MIC的测定。将乳酸恩诺沙星药物母液稀释2倍(1 000 μg/mL)之后加入到第1支试管,再进行2倍稀释加入到第2支试管,以此类推直至稀释到1 000 μg/mL~0.25 μg/mL的13个浓度梯度。
取15支无菌带塞试管分别编号1号~15号,每支试管装有TSB培养基4.0 mL,1号~13号试管加入不同浓度的药液0.5 mL, 14号试管加0.5 mL无菌水,15号试管加1 mL的TSB培养基,将1号~14号试管各加入0.5 mL浓度为108CFU/mL的菌液,使细菌的终浓度约为107CFU/mL,而培养基中的药液浓度达到100 μg/mL~0.025 μg/mL,28 ℃恒温培养24 h,观察无明显细菌生长的试管对应的最低药物浓度即为MIC。培养48 h,取MIC上无明显细菌生长的各个药液浓度的菌液0.1 mL均匀涂布于TSA培养基,28 ℃恒温培养24 h,菌落数小于5个的作为该药物的最小杀菌浓度(MBC)[6],测定重复5次。
1.2.5 乳酸恩诺沙星对A.sobria生长的影响 取处于对数生长期的菌悬液进行接种,按照5%的接种量将菌悬液接种于100 mL液体培养基中,28 ℃、150 r/min恒温摇床培养。分别于0 h~13 h期间每间隔1 h取样1次,分光光度计测定OD600 nm值。以时间为横坐标,OD值为纵坐标绘制A.sobria的生长曲线。
在检测A.sobria生长曲线的基础上,研究乳酸恩诺沙星对A.sobria生长的影响。设置3个试验组和1个对照组,每组按5%的接种量接种A.sobria,其中对照组于0 h加入1 mL无菌水,试验组分别在接种后培养的第0、1、5 h加入乳酸恩诺沙星药液,使乳酸恩诺沙星的最终浓度达到MIC值[3,7]。28 ℃、150 r/min恒温摇床培养,分别于0 h~13 h每间隔1 h取样,分光光度计测定OD600 nm值,以时间为横坐标,OD600 nm值为纵坐标绘制生长曲线。
1.2.6 乳酸恩诺沙星对A.sobria的杀菌动力学①配制乳酸诺氟沙星20×MIC、40×MIC、80×MIC的药物浓度。取盛有4 mL无菌TSB的试管4支,编号为A、B、C、D,其中A、B、C中分别加入浓度为20×MIC、40×MIC、80×MIC乳酸恩诺沙星药液0.5 mL,D组为4.5 mL无菌TSB的对照组,然后,向4支试管中分别加入0.5 mL处于对数生长期的菌悬液,使得药物终浓度分别达到2×MIC、4×MIC、8×MIC ,每个浓度设3个平行。28 ℃、150 r/min恒温摇床培养,分别在0、3、6、9、12 h取0.1 mL的培养液,用无菌生理盐水对菌悬液进行10倍系列稀释,取稀释度104~106的稀释液各0.1 mL置于TSA平板均匀涂布,每个稀释度3个平板,28 ℃恒温培养24 h后,对细菌数在30~300间的平板进行计数,取其平均值,计算活菌数(CFU/mL)。以时间为横坐标,每毫升菌液中活菌数(CFU/mL)的对数(lg)为纵坐标,建立乳酸恩诺沙星对A.sobria的杀菌动力学曲线[9]。
1.2.7 乳酸恩诺沙星对A.sobria的体外抗菌后效应(PAE) 参考苏振霞等[9]的方法稍加改进,设置试验管T和对照管C。取5只无菌的试管分别编号为T1、T2、T3、C1、C2,其中T1、T2、T3为试验组,C1、C2为对照组。试验组每支试管加入4 mL无菌TSB,分别加入0.5 mL的20×MIC、40×MIC、80×MIC乳酸恩诺沙星药液,对照组为4.5 mL无菌TSB,再向各试管中加0.5 mL 浓度为108CFU/mL的菌悬液,使T1、T2、T3试管中药物的终浓度分别为2×MIC、4×MIC、8×MIC。置于28 ℃、150 r/min条件下恒温振荡培养。
培养2 h后,采用100倍稀释除药法,取上述各试验管及对照管中的菌液0.1 mL分别加入到5支装有9.9 mL、28 ℃预温的TSB试管中,C2中加入适量的乳酸恩诺沙星药液,使药物终浓度为0.08×MIC,作为残留药物造成PAE的对照组。以上各管混匀后立即进行28 ℃、150 r/min恒温振荡培养,此时计作0h,分别在0、2、4和6 h取0.1 mL菌液适当稀释后,涂布TSA平板,进行细菌计数,重复 3 次,取平均值。将各时间点的细菌浓度值(CFU/mL)取对数(lg CFU/mL)后作为为纵坐标,以时间(h)为横坐标作图,建立对照管及试验管细菌重建后恢复生长的动力学曲线。
由细菌生长动力学曲线计算T、C,其中,T和C分别为试验管和对照管细菌浓度CFU/mL高于重建后零时10倍所需时间(h),按照PAE=T-C的公式计算PAE值[10-11]。
2 结果
2.1 乳酸恩诺沙星对A. sobria的MIC和MBC
使用K-B纸片琼脂扩散法检测结果显示,恩诺沙星对A.sobria敏感(抑菌圈直径40 mm),采用二倍稀释法测得乳酸恩诺沙星对A.sobria的MIC为0.39 μg/mL,MBC为1.56 μg/mL,计算出MBC/MIC为4。
2.2 乳酸恩诺沙星对A. sobria生长的影响
在28 ℃、150 r/min恒温摇床培养条件下,A.sobria的生长曲线如图1所示,1 h之前是短暂的延滞期,1 h后进入对数生长期,大约11 h后进入稳定期。
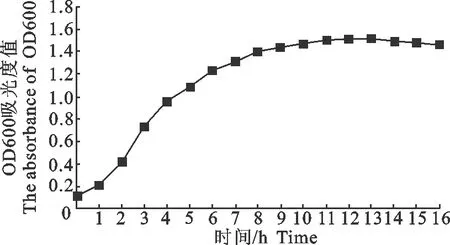
图1 A. sobria的生长曲线Fig.1 The growth curve of A. sobria
在接种A.sobria培养后0、1、5 h 3个不同的时间点分别向试验组加入乳酸恩诺沙星药液,使培养液中最终药物浓度为1×MIC,药物处理后A.sobria的生长曲线如图2所示。结果表明,在不同生长时期进行药物处理具有不同的影响,在0 h接种同时加入乳酸恩诺沙星,药物对A.sobria的生长有明显的抑制作用,对照组在11 h后进入稳定期,而0 h药物处理组在培养4 h左右进入稳定期;培养1 h后的药物处理组,细菌增长速率低于对照组,在加入药液2 h后生长减慢,进入稳定期;培养5 h后加入恩诺沙星的处理组,在加入药物1 h之后,细菌增长速率较对照组降低,在添加药物4 h后进入稳定期。图2显示,在A.sobria生长的延滞期加入乳酸恩诺沙星,药物对该菌的生长有强抑制作用。而在对数生长期加入药物,其抑制作用较延滞期低。
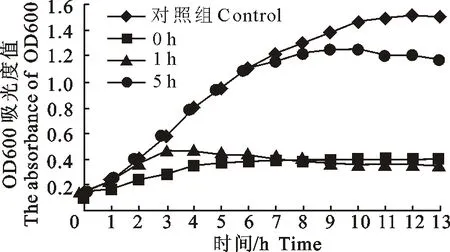
图2 不同时间加入乳酸恩诺沙星后A. sobria的生长曲线Fig.2 The growth curve of A. sobria with addition of enrofloxacin at different time
2.3 乳酸恩诺沙星对A. sobria的体外杀菌作用
乳酸恩诺沙星以2×MIC、4×MIC、8×MIC作用后,对A.sobria的体外杀菌作用如图3所示。从图3可以看出,细菌与药物接触后,数量开始减少,在3 h~12 h内显示出随药物浓度的增加,杀菌效果增强的浓度依赖性规律。
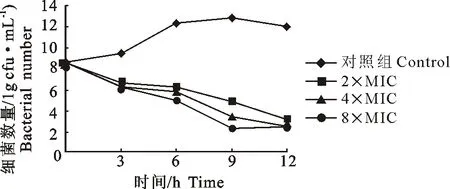
图3 乳酸恩诺沙星对A. sobria的杀菌动力曲线Fig.3 The killing curve of enrofloxacin against A. sobria in different concentration
2.4 乳酸恩诺沙星对A. sobria的抗菌后效应
乳酸恩诺沙星以2×MIC、4×MIC、8×MIC的药物浓度对A.sobria接触2 h后,体外抗菌后效应结果见表1,除去药物后细菌的恢复生长情况见图4。
由表1可知,随着药物浓度的升高,PAE值增大,呈现浓度依赖性。由图4可以看出药物残留对照C2与空白对照C1的生长曲线几乎相同,而C1和C2的活菌数高于2×MIC、4×MIC和8×MIC实验组,试验组细菌数随着药物浓度的的增加而减少。在相同试验条件下,高浓度药物组对A.sobria的抑制效果高于低浓度组。

表1 恩诺沙星对A. sobria的体外抗菌后效应值Table 1 Postantibiotic effects value of enrofloxacin against A. sobria at different concentrations

图4 恩诺沙星作用于A. sobria后抗菌后效应期的细菌生长曲线Fig.4 The growth curve of A. sobria in the postantibiotic effect phase of enrofloxacin
3 讨论
3.1 乳酸恩诺沙星对A. sobria的敏感性
乳酸恩诺沙星对A.sobria的MIC、MBC的相关报道较少。王志强等[3]研究氟喹诺酮类药物对A.sobria的体外药效时的结果显示,盐酸恩诺沙星对A.sobria的MIC为0.025 mg/L,MBC/MIC为2。樊海平等[10]研究盐酸恩诺沙星的药物效应时,得出其对A.sobria的MIC、MBC均为0.048 8 mg/L。樊海平等总结了国内外关于恩诺沙星对水产致病菌的体外抑菌试验,认为恩诺沙星对敏感病原微生物如气单胞菌等的MIC小于0.1 mg/L 。而本试验结果乳酸恩诺沙星对A.sobria的MIC和MBC与上述文献报道相比数值偏大,可能由于试验所用菌株为临床分离株,在生产中长期使用抗菌药物控制疾病,导致病原菌对抗菌药物的敏感性下降而使MIC 和 MBC 值升高。此外,不同研究者得到的研究结果的差别,也可能与所使用的药物来源、菌株来源、培养基成分差异,试验中菌液的使用浓度不同等因素有关[11]。
乳酸恩诺沙星对A.sobria有较好的抑菌杀菌效果,作用效果在细菌生长的不同时期有差异。在延滞期加入乳酸恩诺沙星,对A.sobria的生长具有较强抑制作用,而在对数生长期加入药物,其抑制作用较延滞期相对较弱。因此在防治由A.sobria引发的疾病时,及早用药对疾病的控制和治疗非常重要。
本研究结果显示乳酸诺氟沙星的杀菌效果随药物浓度的增加而增强,表现较强的浓度依赖性,结果与马寅等[12]、徐丽娟等[13]等研究的药物对细菌杀菌曲线的规律是一致的。过低浓度的药物对病原菌没有抑菌或杀菌作用,长期使用还会引起细菌产生耐药性[14]。因此,生产中应注意乳酸恩诺沙星的使用浓度,避免长期低剂量使用抗菌药物进行鱼病防治。
3.2 乳酸恩诺沙星的体外PAE
PAE又称抗菌后效应,是指细菌和抗菌药物短暂接触,当抗菌药物被清除或下降至MIC以下时,在一定时间内细菌生长仍受到持续抑制的效应[9]。PAE已成为评价抗菌药物药效学的重要参数。本研究中乳酸恩诺沙星对A.sobria的PAE,显示出随药物浓度增加PAE值增大的浓度依赖性的规律,和徐丽娟等[13]研究恩诺沙星对A.hydrophila的PAE的结果相一致。兽医临床对氟喹诺酮类药物的研究结果也显示,氟喹诺酮类药物抑、杀菌作用在很大范围内呈剂量依赖关系[13]。药物体外PAE的试验结果可能与多种因素有关:①菌种及其接种量:同一种药物在体外的PAE因菌种的不同而不同,而在一定的药物浓度下,接种量越大,残存的细菌越多,恢复生长就相对较快,PAE缩短;②药物浓度:PAE值随药物浓度增加而增大;③药物与细菌的接触时间:接触时间越长,PAE越大;④其他因素:药物的联合作用、pH、温度、培养基等也会对药物的体外PAE产生影响。
按照传统观念,抗菌药物需维持1×MIC以上浓度,方能发挥疗效,当血药浓度低于1×MIC 时应再次给药[15]。本研究中乳酸恩诺沙星的PAE结果显示,乳酸恩诺沙星和A.sobria同培养2 h后除去药物,其抑菌作用并没有消失。由于PAE的存在,即使乳酸恩诺沙星浓度低于MIC,仍可以持续发挥抗菌作用。目前,恩诺沙星在水产上的应用越来越广,为防止药物滥用所造成的药物残留,减少药物对养殖水环境的污染以及耐药菌的出现,在制定给药方案时,可考虑以血药浓度高于1×MIC 的时间与 PAE 的时间之和作为给药间隔,或者减少给药次数,在满足疗效的基础上,降低临床上可能出现的毒副作用,达到高效、安全的治疗目的。
[1] 董传甫,林天龙,俞伏松,等.鱼源气单胞菌的分离鉴定及血清学调查[J].水利渔业,2004,24(6):78-81.
[2] 韩玉坤,魏振满,庄英杰,等.危重肝炎患者气单胞菌败血症临床研究[J].中华医院感染学杂志,2002,12(7):491-493.
[3] 王志强,朱 琳.动物专用氟喹诺酮类药物对嗜水气单胞菌与温和气单胞菌的抗菌活性[J].中兽医医药杂志,2005,24(2):34-36.
[4] 杨先乐,陆承平,战文斌.新编渔药手册[M].北京:中国农业出版社,2005:183-184.
[5] Clinical and Laboratory Standards Institute.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria;Approved guideline-second edition. CLSI document M45-A2[M].USA:Clinical and Laboratory Standards Institute,2010:12-13.
[6] 戴自英,刘裕昆,汪 复.临床抗菌药物学[M].北京:人民卫生出版社,1985:6-9.
[7] 潘任桃,卢素云,刘兆颖,等.茶皂素与四种抗菌药物的体外联合抗菌效果研究[J].动物医学进展,2013,34(8):119-122.
[8] 张 利,李玉平,黎晓敏,等.牛支原体药物敏感性试验[J].动物医学进展,2012,33(2):110-113.
[9] 苏振霞,肖 辉,陈列欢,等.6种水产常用抗生素对鳗弧菌的抗菌后效应研究[J].中国预防兽医学报,2012,34(10):793-796.
[10] 樊海平,曾占壮,林 煜.盐酸恩诺沙星与其他四种抗茵药物对水产致病菌的体外抗菌作用[J].福建水产,2005,25(1):34-37.
[11] Xu L J, Wang H, Yang X L, et al. Integrated pharmacokinetics/pharmacodynamics parameters-based dosing guidelines of enrofloxacin in grass carpCtenopharyngodonidellato minimize selection of drug resistance[J]. BMC Vet Res,2013,9:126.
[12] 马 寅,金 珊,余 开,等.恩诺沙星对4种水产致病弧菌的抑杀菌效应[J].微生物学通报,2011,38(8):1216-1221.
[13] 徐丽娟,权可艳,王 浩,等.恩诺沙星控制嗜水气单胞菌性鲫败血症的防耐药用药方案[J].中国水产科学,2013,20(3):635-643.
[14] Chen D Q, Yang L, Luo Y T, et al.Prevalence and characterization of quinolone resistance in Laribacter hongkongensis from grass carp and Chinese tiger frog[J].J Med Microbiol,2013,62(10):1559-1564.
[15] Fang X, Liu X, Liu W, et al. Pharmacokinetics of enrofloxacin in allogynogenetic silver crucian carp,CarassiusauratusGibelio[J].J Vet Pharmacol Therap,2012,35(4):397-401.
Postantibiotic Effects of EnrofloxacininVitroAgainstAeromonassobria
LI Li,CAO Yan-chao,XIE Xu-yang,CHEN Ying,DAI Wen-ting,KONG Xiang-hui
(CollegeofFisheries,HenanNormalUniversity,Xinxiang,Henan,453007,China)
In order to research the pharmacodynamics of enrofloxacin onAeromonassobriainvitro. The minimal inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of enrofloxacin againstA.sobriawere determined by two-fold broth macrodilution method. Then the effect of enrofloxacin on growth curves ofA.sobriain different periods,and the kinetics of sterilization and postantibiotic effects(PAE) of enrofloxacin in different concentrations (2×MIC,4×MIC,8×MIC) onA.sobriawas studied. Results showed that the MIC and MBC of enrofloxacin againstA.sobriawere 0.39 μg/mL and 1.56 μg/mL, respectively. The enrofloxacin has a strong bactericidal effect againstA.sobria, the PAE and drug concentration of it were positively correlated.
A.sobria;enrofloxacin;growth curve;bactericidal curve;PAE
2014-05-13
河南省重点科技攻关项目(092102110030,122102110216,132102110045)
李 莉(1969-),女,河南巩义人,副教授,博士,主要从事水产动物医学相关研究。
S948;S859.796
:A
:1007-5038(2015)01-0057-05
