石榴花中α-葡萄糖苷酶抑制剂的筛选研究
2015-03-06康保珊赵文恩刘杰超张春岭
刘 慧,康保珊,赵文恩,刘杰超,张春岭
(中国农业科学院郑州果树研究所,郑州 450009)
餐后高血糖是2 型糖尿病的表现症状和主要危害因素。α-葡萄糖苷酶抑制剂能够与小肠刷状缘α-葡萄糖苷酶活性中心部位结合[1],阻抑酶活性的发挥,阻止双糖水解,从而有效控制餐后血糖的升高和糖尿病的加重[2]。此类药物对1、2 型糖尿病均适用,也可以与其他口服降糖药或胰岛素联合应用[3]。近年来,从天然产物中筛选α-葡萄糖酶抑制剂日益受到重视。
石榴花在印度传统草药中一直被用作抗糖尿病药物[4,5],前人的研究为明确石榴花的抗糖尿病机制建立了良好的基础,但报道多集中在研究某一特定物质或提取物的降糖活性,并未对石榴花中α-葡萄糖苷酶抑制剂进行系统全面地筛选,其真正的活性部位很有可能被遗漏或排除,阻碍了石榴花作为抗糖尿病药物的应用。本研究目的在于利用α-葡萄糖苷酶的体外生物学活性检测技术,筛选、确定石榴花中抑制α-葡萄糖苷酶的有效活性部位,为开发新型的天然抗糖尿病保健品提供一定的理论及技术支持。
1 材料与方法
1.1 材料与仪器
石榴花于2014 年6 月采摘于中国农业科学院郑州果树研究所,采后阴干,粉碎备用。4-硝基苯-α-D 吡喃葡萄糖苷(pNPG) (BIO Basic INC.),α-葡萄糖苷酶(EC3.2.1.20,100U,日本和光纯药工业株式会社);AB-8 大孔树脂(安徽三星树脂科技有限公司)。其余试剂为分析纯。
电热恒温水浴锅(DK-98-ⅡA,天津市泰斯特仪器有限公司);旋转蒸发仪(RE-52AA,上海亚荣生化仪器厂);高速冷冻离心机(J-25,Backman CoulterTM);分光光度计(722S,上海精密科学仪器有限公司分析仪器总厂)。
1.2 试验方法
1.2.1 α-葡萄糖苷酶活性抑制率体外检测模型
参考Maria D.P.T.Gunawan-Puteri 等的方法[6],采用2 mL 反应体系如表1 所示。将5 mmol/L 的pNPG(pH 6.8,0.1 mol/L 磷酸缓冲液配制)、0.1 mol/L pH 6.8 的磷酸缓冲液、样品提取液依次加入到试管中,于37 ℃水浴保温15 min。然后加入浓度为5 U/mL 的α-葡萄糖苷酶溶液(用pH 6.8 的0.1 mol/L 磷酸缓冲液配制)启动反应,37 ℃水浴反应1 h。反应结束时,加入4% 的Na2CO3溶液以终止反应,分别测定400 nm 波长下的吸光值A,以(1)式计算酶抑制率y (%)。
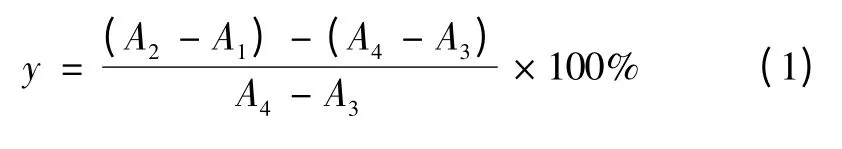
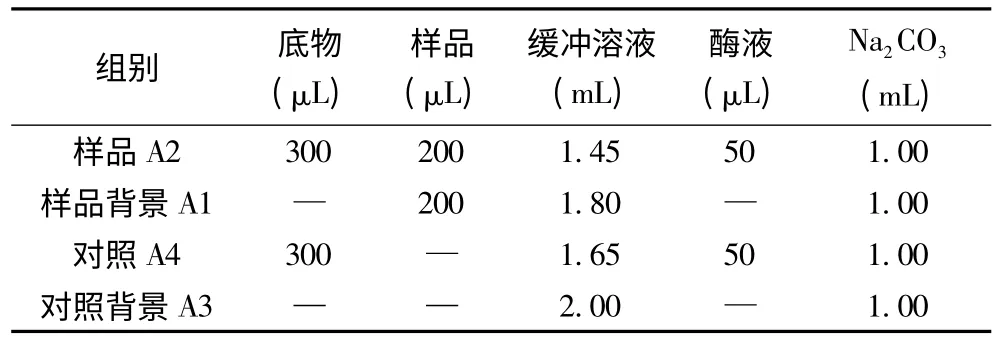
表1 α-葡萄糖苷酶抑制率测定反应体系
1.2.2 石榴花中α-葡萄糖苷酶抑制剂提取溶剂的筛选
准确称取2.0g 干燥石榴花瓣粉末,分别加入40mL水、乙醇、甲醇、丙酮、氯仿、石油醚30℃超声提取30min,过滤,重复2 次,合并滤液,浓缩定容至100mL,分别取200μL 提取液依据1.2.1 方法测定其对α-葡萄糖苷酶活性的抑制率。同时,考察不同pH 值的水溶液体系对α-葡萄糖苷酶活性的抑制率。
1.2.3 石榴花水提取液的分离及α-葡萄糖苷酶抑制活
性追踪 在石榴花水提液(pH 8.0)分离的各个阶段(图1),实时追踪各分离部位的α-葡萄糖苷酶的抑制活性,逐步筛选高抑制率的活性部位。
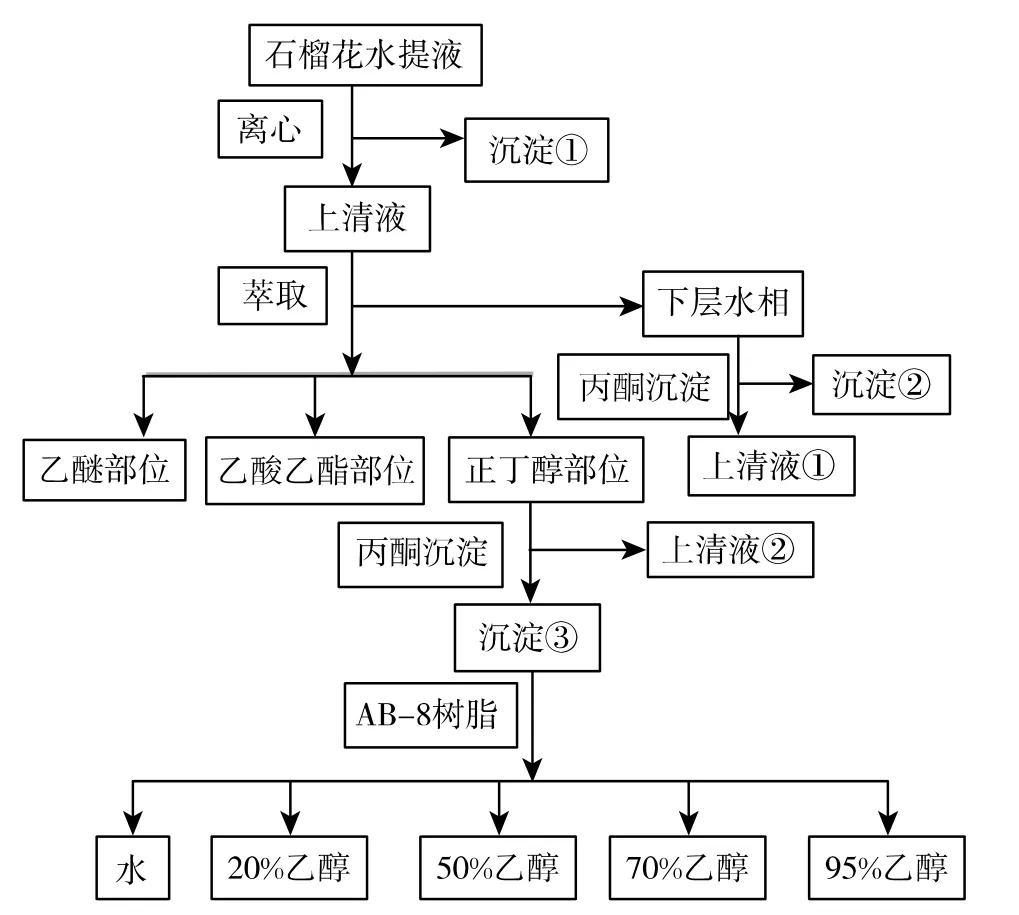
图1 石榴花水提液分离流程
1.2.4 石榴花中活性物质对α-葡萄糖苷酶的抑制效果
取等量石榴花干燥粉末,分别采用何毓敏[7]、高英[8]、萨提瓦尔地[9]、热依木古丽·阿布都拉[10]、周本宏[11]等的方法提取石榴花中皂甙、多糖、类黄酮、多酚、鞣质,将提取液浓缩、干燥成粉后,将对应粗提物配制成一定的浓度溶液,测定其对α-葡萄糖苷酶的活性抑制率。
2 结果与分析
2.1 不同溶剂提取液的α-葡萄糖苷酶活性抑制率
从图2 可以看出,对于不同极性的提取溶剂,水提取物的总抑制率最高,达到55.82%。同时,考察不同pH 值水溶液体系的α-葡萄糖苷酶抑制活性,结果表明,弱碱性提取液的抑制活性高于酸性提取液,抑制率最高的提前溶剂为pH 8.0 的水溶液。结果表明石榴花中对α-葡萄糖苷酶活性抑制效果较好的成分应该为极性较大的水溶性物质,可能包括糖类、鞣质、氨基酸、蛋白质、有机酸盐、生物碱盐及甙类等。碱性环境可增加有机酸、黄酮、蒽醌、内酯、香豆素以及酚类成分的溶出。
2.2 石榴花水提取液不同溶剂萃取部位的α-葡萄糖苷酶抑制活性
石榴花水提取液先后经乙醚、乙酸乙酯、水饱和正丁醇萃取,各萃取部分的总抑制率及半抑制浓度(IC50)。从图3 可以看出,水溶液不同极性萃取部分抑制率最高的为正丁醇萃取相,总抑制率高达94.83%,半抑制浓度为3.57 mg/mL,正丁醇相对α-葡萄糖苷酶的活性抑制作用明显高于乙醚相和乙酸乙酯相,表明活性因子为极性较大的物质。
水提取液离心得沉淀①,经分步萃取后的水相加丙酮分离为上清液①和沉淀②,正丁醇相萃取后加丙酮的上清液②以及得到的沉淀③,分别经旋蒸、冷冻干燥等方式制成干燥粉末,加水溶解配制成不同浓度,以粗样品的质量浓度(mg/mL)为横坐标,酶抑制率(%)为纵坐标作图,在浓度/抑制率曲线的线性范围内计算相应的IC50,结果如图4 及表2 所示。表2 结果表明,沉淀②的IC50最小,表明该部分的α-葡萄糖苷酶活性抑制能力最高。水提取物经正丁醇萃取结果表明,沉淀②的IC50最小,表明该部分的α-葡萄糖苷酶活性抑制能力最高。水提取物经正丁醇萃取后,加入丙酮产生的沉淀主要成分为皂甙类[7]。皂甙是一类具有多种生理功效的生物活性物质,具有调节血脂、血压,降低血糖,抗氧化,抑制血栓形成等活性作用。近年来皂甙的降血糖作用的研究进展迅速,多种中草药皂甙[12]、苦瓜皂甙[13]、大豆皂甙[14]、玉米须皂甙[15]、癞葡萄皂甙[16]等都已证实具有显著的α-葡萄糖苷酶抑制效果和降血糖的功效,但石榴花中皂甙类物质抗糖尿病活性的研究未见报道。
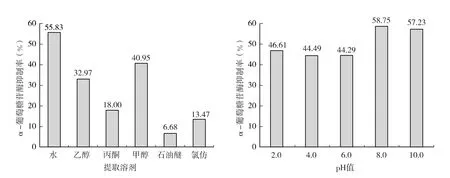
图2 不同溶剂提取液的α-葡萄糖苷酶活性抑制率
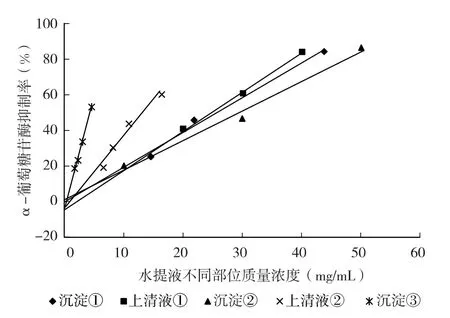
图4 石榴花水提液分离不同部位的浓度/抑制率曲线

表2 石榴花水提液分离不同部位的浓度/抑制率线性方程及IC50结果
2.3 正丁醇相上清液②及沉淀③经大孔树脂分离各部位的酶抑制活性
将活性较高的正丁醇相浓缩后加等体积丙酮,静置沉淀,离心后分离得到上清液②及沉淀部分③,分别干燥后,用水溶解至适当的浓度,用AB-8 大孔树脂吸附,经不同浓度乙醇洗脱,得到4 个部分,洗脱液旋蒸定容至相同体积,不同洗脱部位的α-葡萄糖苷酶活性抑制率如表3 所示。其中上清液②的70%、95%乙醇部分,沉淀③的95%乙醇部分经测定没有活性。从结果可以看出,活性部位集中在50%和70%乙醇洗脱部分。
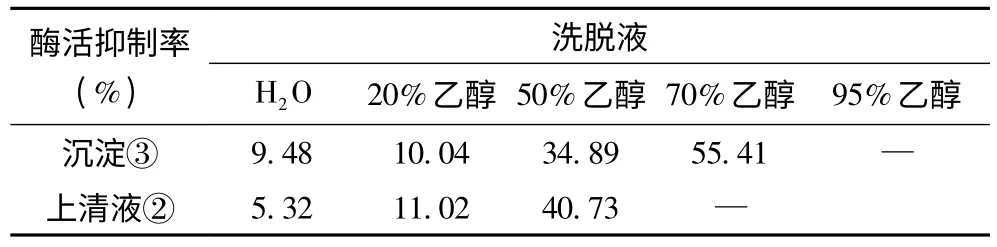
表3 上清液②及沉淀③经大孔树脂洗脱的各部位对α-葡萄糖苷酶的抑制率
大孔树脂AB-8 已经被广泛应用于生物活性物质的分离和纯化,是分离植物中活性成分的一种有效手段。大量的研究表明,利用AB-8 大孔树脂进行皂甙纯化,有效部位多集中在40%~80%的乙醇部位[17-19]。从表3结果可以看出,沉淀③经大孔树脂吸附纯化后,70%乙醇洗脱的部位活性最高,其次为50%乙醇部位,这一结果在一定程度上符合前人在皂甙类大孔树脂吸附纯化的研究内容,更进一步加强了石榴花中皂甙类是关键的α-葡萄糖苷酶活性抑制因子的可能性。
2.4 石榴花中几种活性成分对α-葡萄糖苷酶的抑制作用
石榴花中抗糖尿病活性物质主要有多酚类、黄酮类、三萜类[20]。结合本试验2.1-2.3 结论,同时参考有关文献,选择石榴花中几种主要的水溶性活性成分,考察对α-葡萄糖苷酶活性的抑制作用。以抑制剂粗提物浓度为横坐标,抑制率为纵坐标作图,在线性浓度范围内作抑制率曲线并计算IC50,结果如图5 所示。
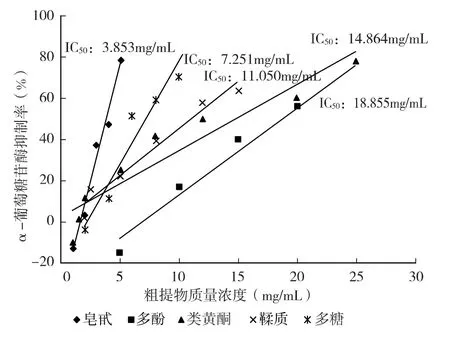
图5 不同活性物质对α-葡萄糖苷酶活性的抑制率曲线及IC50
从图5 可以看出,石榴花皂甙、多糖、生物碱、类黄酮、多酚的粗提液对α-葡萄糖苷酶均有一定抑制作用,在一定的浓度范围之内呈线性关系。IC50从小到大依次为皂甙<多糖<鞣质<类黄酮<多酚。其中,多酚和类黄酮粗提物对α-葡萄糖苷酶的活性抑制作用最弱,IC50分别为18.855、14.864 mg/mL,当粗提物质量浓度达到25.0 mg/mL 时,抑制率为70.59% 和77.87%。而皂甙的抑制作用最强,皂甙粗提物的IC50为3.853 mg/mL,粗提物的质量浓度为5.0 mg/mL 时,对α-葡萄糖苷酶活性的抑制率达到78.39%。这一结果可能与各种活性成分提取方法以及粗提物中的有效成分含量有关,皂甙类物质提取后经过了初步纯化,而多酚和类黄酮物质均为溶剂提取的混合物质,有效成分含量较低。
3 结论
石榴花一直被用作治疗糖尿病的传统中药,本研究筛选出石榴花中抑制α-葡萄糖苷酶活性的高效提取溶剂为pH 8.0 的水提取液。在此基础上对石榴花水提取液进一步的分离,以体外α-葡萄糖苷酶活性抑制率为跟踪目标,找出活性最高的部位为正丁醇萃取相经丙酮沉淀部位。该部位经AB-8 大孔树脂吸附,50%和70%乙醇洗脱部位的酶抑制活性较高。初步推断石榴花中抑制α-葡萄糖苷酶活性的物质为皂甙类。至于其活性成分的具体化学成分与结构,尚待深入研究。
[1]Bays H,Stein EA.Pharmacotherapy for dyslipidaemia current therapies and future agents [J].Expert Opin Pharmacother,2003,4:1901-1938.
[2]Gao H,Huang Y N,Gao B,et al.α-glucosidase inhibitory effect by the flower buds of Tussilago farfara L [J].Food Chemistry,2008,106:1195-1201.
[3]Sauerberg P,Pettersson I,Jeppesen L,et al.Novel tricyclicalpha-alkyloxyphenylporpionic acids:dual PPAR alpha/gamma agonists with hypolipidemic and antidiabetic activity [J].Journal of Medicinal Chemistry,2002,45(4):789–804.
[4]Huang T H W,Peng G,Kota B P,et al.Pomegranate flower improves cardiac lipid metabolism in a diabetic rat model:role of lowering circulating lipids [J].British Journal of Pharmacology,2005,145:767-774.
[5]Li Y H,et al.Pomegranate flower:a unique traditional antidiabetic medicine with dual PPAR-α/-γ activator properties[J].Diabetes,Obesity and Metabolism,2008,10:10-17.
[6]Maria D.P.T.Gunawan-Puteri,Jun K.Novel α-glucosidase inhibitors from Macaranga tanarius leaves [J].Food Chemistry,2010,123:384-389.
[7]何毓敏,等.竹节参总皂苷的制备工艺及含量测定[J].中国中药杂志,2008,33(22):2607-2611.
[8]高英,等.黄精多糖的提取及其对α-葡萄糖苷酶抑制作用[J].中成药,2010,32(12):2133-2137.
[9]萨提瓦尔地,艾克白尔,艾来提,等.新疆石榴花中总黄酮提取工艺研究[J].食品科学,2007,28(3):110-112.
[10]热依木古丽·阿布都拉,刘力,阿吉艾克拜尔·艾萨.新疆石榴花多酚的提取工艺[J].食品科学,2011,32(2):1-4.
[11]周本宏,郭志磊,范捷,等.石榴皮鞣质对阿霉素肾病大鼠的保护作用[J].中国医院药学杂志,2010,30(20):1722-1725.
[12]奚苗苗.中药皂甙的抗糖尿病活性筛选和药效学研究[D].西安:第四军医大学.2005.
[13]田力东,张名位,郭祀远,等.不同苦瓜品种的皂苷含量及对α-葡萄糖苷酶活性抑制作用的比较[J].中国农业科学,2008,41(10):3415-3421.
[14]全吉淑,尹学哲,金明,等.大豆皂苷对α-葡萄糖苷酶抑制作用的研究[J].中药材,2003,26(9):654-656.
[15]苗明三,苗艳艳,纪晓宁,等.玉米须总皂苷对地塞米松所致小鼠糖耐量降低模型和α-葡萄糖苷酶活力的影响[J].中华中医药杂志,2009,24(8):1071-1073.
[16]赵海雯.癞葡萄皂甙的分离纯化及降血糖功效研究[M].2005.无锡:江南大学.
[17]石忠峰,陈蔚文,李卫民,等.大孔吸附树脂纯化黄芪总皂苷的研究[J].中草药,2005,36(9):1322-1324.
[18]石召华,熊富良,李崇明,等.大孔树脂分离纯化三七总皂苷工艺研究[J].中成药,2004,26:10-11.
[19]雷建飞,贾莉萍.大孔吸附树脂分离纯化皂苷工艺研究进展[J].中国现代中药,2006,8(11):22-24.
[20]刘慧,赵文恩,康保珊.石榴抗糖尿病生物活性的研究进展[J].食品工业科技,2012,33(23):370-373.
