兔实验性骨关节炎中6种血清生物标志物的检测
2015-03-05曹媛媛佘秋凤李玉洁
曹媛媛,高 戈,佘秋凤,李玉洁,宋 欢
(中南大学湘雅医学院医学检验系,湖南长沙 410013)
骨关节炎(osteoarthritis,OA)是一种发病率逐年增高的慢性关节疾病,已成为人类致残的第一大疾病,称为“不死的癌症”。现有的OA诊断方法以临床体征结合影像学检查为基础,不能在关节软骨的组织结构发生不可逆损伤前进行诊断,如能运用有效、廉价和微创的检查手段在有临床症状而未出现影像学改变的人群中筛选出OA早期患者,做到早发现早治疗,就可以延缓甚至逆转疾病的发展,这也是防治OA的重要方法[1]。回顾近年来国内外文献发现IL-1β/COX-2/PGE2/MMP-1/CTX-Ⅱ和 IL-1β/NO/MMP-1/CTX-Ⅱ两调控轴在OA的发生发展中有重要作用。本研究通过检测血清中相关因子水平,探讨其在早期OA中的作用。
1 材料与方法
1.1 实验动物:清洁级成年新西兰大白兔40只,雌雄不拘,体质量2.5~3.0 kg,6月龄。[中南大学湘雅医学院动物实验中心,合格证号:SCXK(湘)2008-003]
1.2 实验方法
1.2.1 实验分组:将兔分为对照组和实验组各20只。关节腔内注射胶原蛋白酶制备骨关节炎动物模型[2],于注射后第30、60和90天,行膝关节X线、常规组织病理学检查,检测造模是否成功,并按Wakitani法[3]进行组织学评分比较。
1.2.2 外周血各细胞因子的检测:在第2、4、6、8、10、12 周抽取外周血,分离血清,采用ELISA试剂盒检测血清中IL-1β、COX-2、PGE2、NO、MMP-1和 CTX-Ⅱ水平。每份标本双空对照,操作严格按试剂盒说明书进行。最后用酶标仪在450 nm波长测量各孔吸光度(A)值并计算浓度。
1.3 统计学分析:所有数据均输入Excel表,采用SPSS20.0统计学软件分析。计量资料用均数±标准差(±s)表示,偏态分布的变量经对数转换后呈正态分布再进行分析,组间均数差异比较采用One-Way ANOVA,组间均数两两比较采用最小显著差(least significance difference,LSD)检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔膝关节X线观察:第90天时X线结果:实验组关节面不规则,关节间隙变窄,软骨下骨硬化以及边缘唇样改变,骨赘形成,关节周围有囊状改变,证明造模成功(图1)。

图1 免膝关节X线图Fig 1 X-ray change of rabbit knee joint
2.2 兔膝关节软骨组织病理学观察:HE染色光镜下结果,造模后第90天对照组:形态正常(图2A)。
实验组:软骨基质染色较淡,软骨表面粗糙不平整,可见裂隙及纤维化,软骨细胞排列紊乱,簇集生长明显,软骨下骨板增厚,可明显观察到软骨细胞变形、凋亡(图2B)。
Wakitani法对对照组和实验组的软骨缺损组织学评分结果分别为0.00±0.00和11.67±0.52。
2.3 血清6种生物学标志物检测结果:各细胞因子浓度实验组比对照组显著升高(P<0.05)。实验组中,IL-1β和CTX-Ⅱ浓度在术后2与4、4与6周均比对照组显著升高(P<0.05);COX-2浓度在术后2与4、8与10周均比对照组显著升高(P<0.05),且整体呈上升趋势;PGE2和NO浓度在术后2与4、4与6周均比对照组显著升高(P<0.05);MMP-1浓度在实验组组内两两比较均有明显差异(P<0.05)(表1)。

图2 关节软骨在HE染色光镜下结果图Fig 2 Articular cartilage is observed under light microscope(×400)
表1 对照组和实验组血清中IL-1β、COX-2、PGE2、NO、MMP-1和CTX-ⅡI随时间变化关系比较Table 1 The variation of L-1β,COX-2,PGE2,NO,MMP-1 and CTX-Ⅱ in rabbit serum with time in control and experimental groups(±s,n=20)
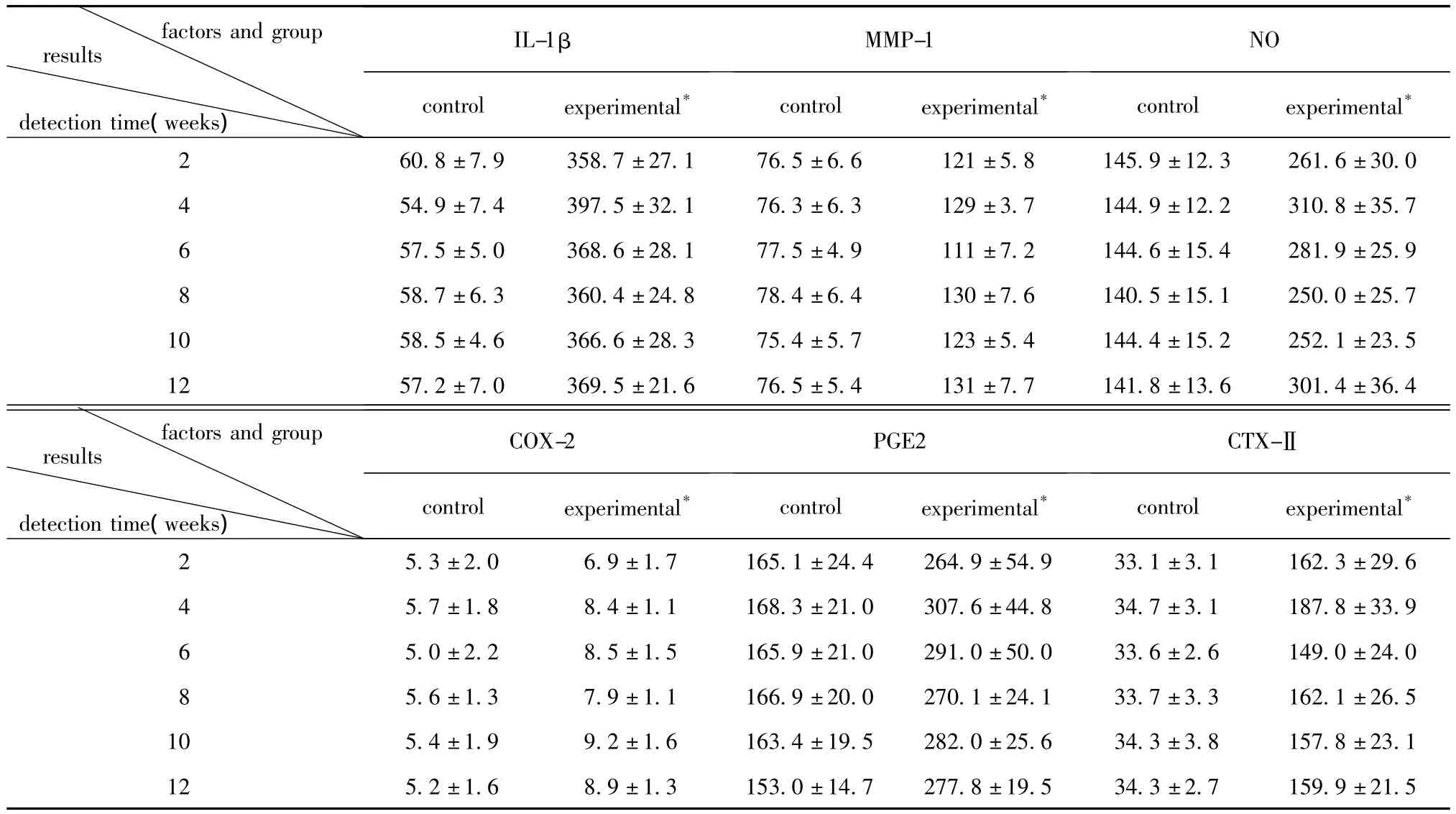
表1 对照组和实验组血清中IL-1β、COX-2、PGE2、NO、MMP-1和CTX-ⅡI随时间变化关系比较Table 1 The variation of L-1β,COX-2,PGE2,NO,MMP-1 and CTX-Ⅱ in rabbit serum with time in control and experimental groups(±s,n=20)
*indicates difference between the experimental group and the control group was statistically significant,P <0.05.
factors and group detection time(weeks)results IL-1βMMP-1 NO control experimental* control experimental* control experimental *2 60.8±7.9 358.7±27.1 76.5±6.6 121±5.8 145.9±12.3 261.6±30.0 4 54.9±7.4 397.5±32.1 76.3±6.3 129±3.7 144.9±12.2 310.8±35.7 6 57.5±5.0 368.6±28.1 77.5±4.9 111±7.2 144.6±15.4 281.9±25.9 8 58.7±6.3 360.4±24.8 78.4±6.4 130±7.6 140.5±15.1 250.0±25.7 10 58.5±4.6 366.6±28.3 75.4±5.7 123±5.4 144.4±15.2 252.1±23.5 12 57.2±7.0 369.5±21.6 76.5±5.4 131±7.7 141.8±13.6 301.4±36.4 factors and group detection time(weeks)results COX-2 PGE2 CTX-Ⅱcontrol experimental* control experimental* control experimental *2 5.3±2.0 6.9±1.7 165.1±24.4 264.9±54.9 33.1±3.1 162.3±29.6 4 5.7±1.8 8.4±1.1 168.3±21.0 307.6±44.8 34.7±3.1 187.8±33.9 6 5.0±2.2 8.5±1.5 165.9±21.0 291.0±50.0 33.6±2.6 149.0±24.0 8 5.6±1.3 7.9±1.1 166.9±20.0 270.1±24.1 33.7±3.3 162.1±26.5 10 5.4±1.9 9.2±1.6 163.4±19.5 282.0±25.6 34.3±3.8 157.8±23.1 12 5.2±1.6 8.9±1.3 153.0±14.7 277.8±19.5 34.3±2.7 159.9±21.5
3 讨论
研究证明IL-1β在软骨细胞外基质和滑膜炎性反应中处于中心地位。IL-1β作为炎性反应的始动因素和重要调节剂,可诱导COX-2产生、上调MMPs的基因表达。COX-2的过量表达,使滑膜细胞、软骨细胞合成并释放PGE2增加,PGE2通过细胞间环腺苷酸积累,直接诱导软骨细胞凋亡,增加破骨细胞形成,引起滑膜炎性反应并参与软骨下骨重塑。此外,PGE2又可进一步加强IL-1β对软骨的分解作用,如此循环造成关节软骨生存的恶劣微环境,促进OA的进展。MMP-1是降解软骨细胞外基质Ⅱ型胶原的主要蛋白酶,高表达的MMP-1对细胞外基质的过度降解导致了Ⅱ型胶原结构破坏及蛋白多糖过度降解,导致Ⅱ型胶原C端肽(CTX-Ⅱ)水平升高。
OA发生时,IL-1可通过在软骨细胞中上调细胞因子基因,编码出诱导型一氧化氮合酶(iNOS)。iNOS可持续表达使NO水平升髙,NO可作用于胞膜下细胞骨架复合物部分,干扰其组装,抑制软骨细胞与细胞外基质结合和细胞迁移,从而抑制Ⅱ型胶原和蛋白多糖的合成及损伤区的修复[4]。此外,NO作为活性氧(ROS)的一种,能激活多种信号途径诱导MMP-1的合成[4],进而增强MMP-1对Ⅱ型胶原的降解。
实验结果显示见表1,实验组各因子的浓度相比对照组均有统计学意义(P<0.05),除COX-2外其余5个指标均在第4周有最显著差异,可能说明第4周是这5个指标检测OA灵敏度最高的时期。与X线检查相比,实验的第2、4和6周均处于OA早期,证明检测的6种血清因子可间接反映OA早期的软骨病理变化,在早期OA的检测和诊断中有一定的适用性。
综上所述,骨关节炎机制十分复杂,IL-1β、COX-2、PGE2、MMP-1、CTX-Ⅱ和NO联合诊断早期 OA,相对于目前临床诊断手段可能更有效,但也有其局限性。对OA的早期诊断仍需进一步探索,寻找更具特异性和灵敏性的生物标志物。
[1]Gross KD,Hillstrom H.Knee osteoarthritis:primary care using noninvasive devices and biomechanical principles[J].Med Clin,2009,93:179-200.
[2]Kikuchi T,Sakuta T,Yamaguchi T.Intraarticular injection of collagenase induces experimental osteoarthritis in mature rabbits[J].Osteoarthritis Cartilage,1998,6:177-186.
[3]Ashikawa K,Majumdar S,Banerjee S,et al.Piceatannol inhabits TNF-α induced NF-kappaβactivation and NF-kappaβ mediated gene expression through suppression of IkappaBalphakinased p65 phosphorylation[J].J Immunol,2002,169:6490-6497.
[4]张林,陆军,李永刚,等.骨关节炎中介导软骨细胞代谢失衡的相关信号通路研究进展[J].东南大学学报(医学版),2013,32:465-472.
