IL-1β诱导内质网应激增加人软骨细胞凋亡
2015-03-05赵聪喆柴惠斌韩为华孙银娣
史 达,赵聪喆,柴惠斌,李 喆,韩为华,孙银娣
(西安交通大学医学院附属红会医院中医骨科,陕西西安 710054)
骨性关节炎(osteoarthritis,OA)又称退行性关节炎,是指以滑膜、软骨等关节组织退变、破坏为主要病变特征的慢性疾病,其中,关节软骨细胞凋亡是导致关节组织发生退行性变化的起始病症之一。在OA患者的骨关节细胞内,白细胞介素1β(IL-1β)、肿瘤坏死因子(TNF-α)等炎性反应相关因子的正常表达调控会发生变化[1],并被高水平积累,进而反作用于细胞,激活相关信号通路,使关节细胞代谢失去平衡,发生细胞老化、凋亡,导致关节炎症的进一步加剧[2]。
内质网应激(endoplasmic reticulum stress,ERS)是机体细胞应对环境变化,启动自我反应、自我修复以及调节细胞凋亡的重要途径,与包括OA在内多种疾病的发生存在密切联系[3]。然而,ERS是否与炎性反应因子的存在具有相关性以及二者在OA发生过程中的具体发病机制尚不清楚。该研究分析了骨关节软骨中炎性反应因子IL-1β、TNF-α与ERS标志分子糖调节蛋白78(glucoseregulatedproteins78,GRP78)和增强子结合蛋白同源蛋白(C/EBP homologous protein,CHOP)及相关信号通路的联系,探讨炎性反应因子与ERS对骨关节软骨细胞凋亡的影响及其作用机制。
1 材料与方法
1.1 病例
OA组(因膝OA行全膝关节置换术,ACR1986膝OA诊断标准)与对照组(因股骨颈骨折行全膝关节置换术)膝关节软骨均取自陕西省博爱医院消化内科就诊患者,每组各取样20例,取样前2周,患者均未使用过激素类或免疫抑制剂类药物。该研究已获得西安市红会医院伦理委员会批准授权,所有患者均签署知情同意书。
1.2 试剂
DMEM培养基、胎牛血清(Gibco公司);GRP78、CHOP、ATF4、caspase-3 和 β-actin 抗体(北京博奥森生物技术有限公司);总RNA提取试剂盒(Tiangen公司);RT-PCR MasterMix kit(Toyobo公司);IL-1β、TNF-α、GRP78、CHOP、ATF4 和 GAPDH 引物(Takara公司);TUNEL细胞凋亡检测试剂盒(碧云天生物技术研究所);4-苯基丁酸(4-PBA)(Sigma公司)。
1.3 方法
1.3.1 软骨细胞分离与培养:骨关节软骨细胞的分离培养按照Ⅱ型胶原酶顺序消化联合胰蛋白酶法进行[4]。培养良好的细胞,传代至6孔板,不同浓度IL-1β和TNF-α作用于细胞,24 h后进行相关因子表达水平检测,72 h后进行凋亡水平检测。
1.3.2 RT-PCR检测:冻存的骨关节软骨组织(或培养的软骨细胞)置于离心管中,按试剂盒说明书提取总RNA并反转录成cDNA,进行实时定量PCR检测,反应程序:94℃,50 s;54℃,50 s;72℃,50 s;72℃,10 min,30个循环,以 β-actin为内参,依据2-ΔΔCT法计算各组mRNA的相对表达量。
1.3.3 Western blot检测:用预冷的SDS裂解缓冲液裂解骨关节软骨组织(或软骨细胞)提取总蛋白,BCA法测定蛋白浓度,煮沸5 min变性,SDS-PAGE电泳,上样60 μg。150 mA 3 h转PVDF膜,3%脱脂奶粉封闭1 h,加入一抗(1∶1 000稀释),4℃过夜,TBST洗膜,每次5 min,共3次。加入二抗HRP-IgG(1∶2 000稀释),室温孵育 1 h,TBST洗膜,每次5 min,共3次,加入ECL显色液曝光显影。
1.3.4 细胞凋亡检测:细胞凋亡按照TUNEL细胞凋亡检测试剂盒进行。显色后常规封片,镜下观察,随机选取5个高倍视野,计算凋亡细胞率[(凋亡细胞数/计数细胞总数)×100%]。
1.4 统计学分析
2 结果
2.1 OA患者骨关节软骨中炎性因子与ERS标志蛋白的水平
与对照组相比,OA组骨关节软骨组织中IL-1β、TNF-α的mRNA表达水平均显著增高(P<0.01)(图1A),GRP78、CHOP的 mRNA表达水平也显著上调(P<0.01)(图1B)。
2.2 OA患者骨关节软骨中炎性因子与内质网应激的相关性分析
相关性分析表明IL-1β与GRP78(r=0.849)和CHOP(r=0.854)的表达上调均呈正相关性(P<0.05);TNF-α与GRP78和CHOP的表达不具有相关性。
2.3 炎性因子对于软骨细胞内质网应激的影响
与对照组相比,不同浓度IL-1β作用下(图2A,B),GRP78的 mRNA和蛋白表达量均显著增加;CHOP的表达量呈IL-1β浓度依赖性,IL-1β浓度增加至2 ng/L以上时,CHOP的表达量显著增加(P<0.01)。不同浓度 TNF-α 作用时(图2C,D),GRP78的表达水平均显著增高(P<0.01)。
2.4 炎性因子对于软骨细胞凋亡的影响
与对照组相比,IL-1β浓度增加至2 ng/L以上时,软骨细胞的凋亡数量显著增加(P<0.01);不同浓度TNF-α均能引起细胞凋亡(P<0.01)(图3)。

图1 软骨组织中炎症因子与ERS标志蛋白的mRNA水平Fig 1 mRNA levels of inflammatory factors and ERS markers in OA and controls

图2 不同浓度IL-1β、TNF-α作用下GRP78、CHOP的表达水平Fig 2 The expression of GRP78 and CHOP in treatment of different concentration of IL-1β and TNF-α

图3 不同浓度IL-1β、TNF-α作用下凋亡细胞百分数Fig 3 The percentage of cell apoptosis in treatment of different concentration of IL-1β and TNF-α
2.5 炎性因子与软骨细胞内质网应激介导的凋亡通路的关系
与对照组相比,IL-1β单独作用时,CHOP、ATF4的mRNA和蛋白表达水平显著增高(P<0.01);IL-1β与ERS抑制剂4-苯基丁酸(4-PBA)共同作用时,CHOP、ATF4的表达水平较对照组并无显著差异(图4A,B),caspase-3的表达水平较对照组均显著上调(P <0.01)(图4C,D)。
3 讨论
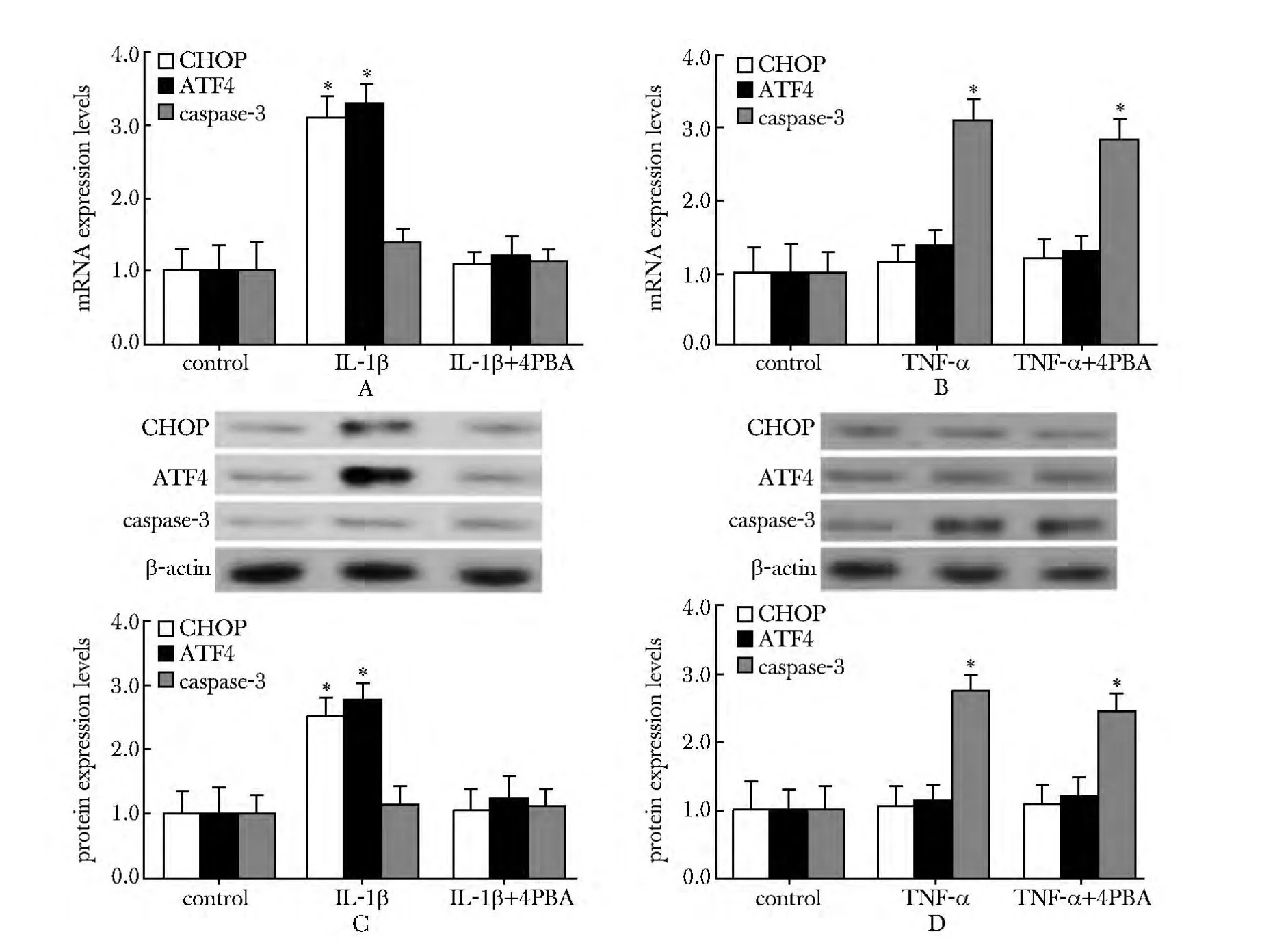
图4 IL-1β、TNF-α作用下 CHOP、ATF4、caspase-3 的表达水平Fig 4 The expression level of CHOP,ATF4,caspase-3 treatedwith IL-1β and TNF-α
炎性因子IL-1β是炎性反应发生的始动因素,在类风湿性关节炎和骨性关节炎患者的骨关节滑膜液中均存在着高水平的积累,对于骨关节炎的发生和治疗具有重要作用[1]。GRP78和 CHOP是 ERS的两种标志性分子[5]。GRP78参与蛋白质的折叠修饰,适度的ERS使GRP78表达增加、活化,启动未折叠蛋白反应信号传导通路(unfoldedproteinresponse,UPR),使内质网进行自我恢复[6]。CHOP 是ERS下游凋亡相关调控因子[7],过度 ERS诱导CHOP高表达,导致细胞对ERS凋亡信号产生响应,发生细胞凋亡。相关研究发现,炎性因子IL-1β和ERS均与软骨细胞凋亡及OA的发生存在密切联系[8],然而ERS与炎性因子在OA发生过程中的相互关系尚不清楚。本研究发现,临床OA患者骨关节软骨组织中炎性因子 IL-1β、TNF-α 及 ERS相关因子 GRP78、CHOP的表达水平均显著增高,并且 IL-1β与 GRP78、CHOP的高表达存在正相关性。且不同浓度IL-1β均能引起GRP78的高水平表达,而CHOP的表达量只有在较高浓度IL-1β作用下才出现显著性增高,也只有在较高浓度IL-1β刺激下,才能诱导软骨细胞大量凋亡。相反,TNF-α虽能引起GRP78的高水平表达和细胞凋亡的发生,但并不导致CHOP的显著增高。推测,炎性因子IL-1β与ERS及细胞凋亡存在联系,而TNF-α的促细胞凋亡作用并不是通过ERS途径实现的。
PERK、IRE-1和ATF6是ERS发生时的3个主要信号通路,已有研究表明三者既能介导促细胞生存信号,也能在持续或严重的ERS发生时,介导促细胞凋亡信号,其中PERK-eIF2α-ATF4信号途径是CHOP高表达所必需的[7,9]。本实验也证实了IL-1β处理后,CHOP与ATF4因子二者表达水平的上调和抑制具有同步性,表明高浓度IL-1β对细胞凋亡的诱导,可能通过ERS介导的PERK-eIF2α-ATF4通路得以实现。实验也发现TNF-α对于细胞凋亡的作用与ERS并没有显著相关性,而主要与caspases等其他途径有关。
因此,可以推测,骨关节组织内IL-1β的大量积累诱发ERS,刺激下游GRP78等促生存信号分子的活化表达,引导内质网进行自我恢复,同时也调节CHOP等促凋亡信号分子的表达,在ERS持续时间过长或程度严重时,引导细胞发生凋亡,去除受损伤的软骨细胞。这一发现对于完整揭示OA发病机制及合理化用药具有重要的参考价值。
[1]郑柏生,李锋生.骨关节炎患者骨桥蛋白、IL-1β表达水平及意义[J].临床合理用药,2014,7:1-3.
[2]Loeser RF.Molecular mechanisms of cartilage destruction in osteoarthritis[J].J Musculoskelet Neuronal Interact,2008,8:303-306.
[3]Takada K,Hirose J,Yamabe S,et al.Endoplasmic reticulum stress mediates nitric oxide-induced chondrocyte apoptosis[J]Biomed Rep,2013,1:315-319.
[4]刘军,戴刚,杨柳.骨关节炎软骨细胞的体外分离培养[J].中国组织工程研究与临床康复,2008,12:9045-9048.
[5]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11:381-389.
[6]胡深,张洪义,赵刚,等.不同+Gz重复持续暴露对大鼠肝脏组织损伤及GRP78的表达影响[J].基础医学与临床,2015,35:17-21.
[7]关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡[J].生物化学与生物物理进展,2007,34:1136-1141.
[8]郑洁,王瑞辉,寇久社.炎性反应在骨关节炎软骨退变中的作用[J].基础医学与临床,2014,34:1146-1149.
[9]Oliver BL,Cronin CG,Zhang-Benoit Y,et al.Divergent stress responses to IL-1β,nitric oxide,and tunicamycin by chondrocytes[J].J Cell Physiol,2005,204:45-50.
