HPLC-RID测定甘蔗茎节蔗糖、葡萄糖和果糖含量
2015-03-02林月绪陈如凯
林月绪,张 华,陈如凯
(1.福建农林大学生命科学学院;2.福建农林大学国家甘蔗产业技术研发中心,福建福州 350002)
HPLC-RID测定甘蔗茎节蔗糖、葡萄糖和果糖含量
林月绪1,张 华2,陈如凯2
(1.福建农林大学生命科学学院;2.福建农林大学国家甘蔗产业技术研发中心,福建福州 350002)
研究高效液相色谱示差折光检测法(HPLC-RID)测定甘蔗茎节3种主要糖分蔗糖、葡萄糖和果糖的含量,摒弃有毒流动相乙腈,建立一种无毒、快捷、准确的检测方法.该法通过乙醇浸提,采用Waters SugarPakⅠ色谱柱(6.5 mm×300 mm,10 μm),流动相为超纯水,流速0.4 mL·min-1,柱温90℃,检测器温度35℃.检测方法线性关系好、灵敏度高,RSD为2.77%-4.5%(n=5),方法重复性良好;加标回收率高,达95.4%-101.8%;能满足甘蔗及相似作物中3种糖的准确分析.
HPLC-RID;甘蔗茎节;蔗糖;葡萄糖;果糖
甘蔗是我国最重要的糖料作物之一,甘蔗茎节含有蔗糖、葡萄糖、果糖等糖类,甘蔗糖类检测对甘蔗品质鉴定、品种开发和种植有重要意义[1,2].目前,蔗糖、葡萄糖、果糖的检测方法有气相色谱法[3,4]、离子色谱法[5,6]及高效液相色谱法等.气相色谱法由于糖为非挥发性物质需要进行衍生化处理、检测过程较复杂;离子色谱法因糖易在电极上发生氧化还原反应而影响检测灵敏度、重现性;高效液相色谱检测主要用碳水化合物柱、氨基柱为分离色谱柱,以乙腈和水混合溶剂为流动相,用示差折光检测器(RID)[1,7,8]、质谱检测器(MS)[9,10]、蒸发光散射检测器(ELSD)[11-13].乙腈是一种有毒致癌物质,易挥发,以乙腈为流动相不仅给测试人员身体带来伤害,还对环境造成污染;氨基柱固定相上的氨基易与还原糖(葡萄糖、果糖)发生反应,影响柱子寿命;质谱、蒸发光散射检测器价格昂贵、专用性强,不利于检测方法推广普及.本研究拟建立一种安全无毒、快捷准确检测甘蔗茎节糖类含量的高效液相色谱法,该法用Waters SugarPakⅠ(钙基糖分离柱)为HPLC色谱柱,以超纯水为流动相,适当流速、柱温下用示差折光检测器实现蔗糖、葡萄糖、果糖的分离检测.
1 材料与方法
1.1 甘蔗茎节样品
甘蔗茎节样品取自福建农林大学甘蔗研究所甘蔗种植园区,选取新台糖22号(ROC22)蔗株中部茎节,取样时间为2014年1月6日.
1.2 仪器试剂
蔗糖、葡萄糖、果糖标准样为国产色谱纯(纯度≥99.5%);Milli-Q Academic超纯水机;Waters2695高效液相色谱仪(具有120位自动进样器)配Waters2414示差折光检测,色谱工作站为Empower;Mettler Toledo XS205 分析天平(0.01 mg).
1.3 色谱条件
Waters SugarPakⅠ柱(6.5 mm×300 mm,10μm),带配套预保护柱;流动相为超纯水;柱温90℃;流速为 0.4 mL·min-1;进样量 10 uL.
1.4 糖品标准溶液配制
准确称取蔗糖1.0 g(准确至0.01 mg)用10mL容量瓶溶解定容,制得100 g·L-1混合标准溶液,稀释得 50、40、30、20、10 g·L-1标准工作溶液;葡萄糖、果糖各0.1 g(准确至0.01 mg),分别用10 mL 容量瓶溶解定容制得 10 g·L-1标准溶液,稀释得 1.2、0.9、0.6、0.3、0.1 g·L-1标准工作溶液;为考察标样分离情况,另准确称取3种糖各0.25 g于同一50mL容量瓶溶解定容制得5 g·L-1混合标准溶液.所有样品进样前经0.45μm有机滤膜过滤.
1.5 甘蔗茎节样品处理方法
甘蔗等作物中糖类提取常采用乙醇水溶液水浴浸提[1,8,14].简述如下:甘蔗茎节样品去皮切碎于液氮中研磨成粉,准确称取1.0 g(加标样品于此时加入),5 mL 80%乙醇于80℃下浸提30 min,离心取上清液,残渣再次提取后合并上清液,水浴蒸至近干后用超纯水溶解定容至5 mL.
2 结果与分析
2.1 检测器的选择
蔗糖、葡萄糖、果糖这些单糖、二糖在结构上没有紫外吸收基团,因此不能选择紫外分光光度检测器检测.示差折光检测器是根据样品流路与参比流路之间折射率的变化以测定样品浓度的通用检测器,适用于糖类检测;但对温度变化敏感,要求高于室温5-10℃[15].本试验采用示差检测器检测,RID检测器温度设定为35℃[16],灵敏度可满足需要.
2.2 流动相与柱温选择
Waters SugarPakⅠ色谱柱由钙基树脂填装而成,流动相中允许有机相最大含量为5%,过多有机相进入系统可能引起填料的膨胀而永久损坏色谱柱.实验过程中还发现,少量有机相(小于5%乙腈、甲醇)的加入对甘蔗茎节糖类分析没有显著影响,并引起基线漂移(如图1,a所示);因此直接选择0.45μm滤膜过滤后超纯水为流动相,使用Waters2695在线脱气系统脱气.
水在低温时高的粘度会带来很高的反压,为避免损坏色谱柱,分析时至少要选择70℃以上的柱温.实验过程考察0.4 mL·min-1流速时,柱温分别为80℃、85℃、90℃、95℃时某代表性甘蔗茎节样品的分离效果(如图1,b,c,d,e 所示),发现柱温升高各组分峰形对称性有所改善,蔗糖与葡萄糖分离度有所增加,并能很好地减少果糖峰形宽展;但95℃柱温下3种糖的分离效果与90℃条件下无明显区别,考虑到柱温过高可能影响色谱柱寿命,本试验采用色谱柱柱温为90℃.

图1 流动相及柱温选择Fig.1 HPLC chromatogram of differentmobile phase and column temperature
2.3 流动相流速选择
由于色谱柱工作条件要求流动相流速低于0.6 mL·min-1,故实验设计考察了0.2、0.4、0.6 mL·min-1条件下3种糖的分离效果.实验结果发现0.6 mL·min-1流速条件下,3种糖混合标样(5 g·L-1)能较好分离且分析时间短,但柱压力显著升高;实际测定甘蔗茎节样品时有杂质与蔗糖峰不能分离,干扰在0.4 mL·min-1流速条件下能很好消除;0.2 mL·min-1流速下3种糖分离效果很好,但峰形变宽且分析时间延长至25 min以上.因此,选择0.4 mL·min-1为流动相流速条件,该流速条件能同时满足有效分离和快速测定的需求(如图2所示,样品浓度均为5 g·L-1),蔗糖、葡萄糖、果糖保留值分别为10.07、12.43和14.86 min.
2.4 回归方程、相关系数及检测限
以上述混标初步测定某代表性甘蔗茎节样品中果糖、葡萄糖、蔗糖含量,约为0.5、1.1、25.0 g·L-1(如图3所示);故分别设计1.4中所述3种糖类各级标准溶液.以标样峰面积y为纵坐标、标样质量浓度x为横坐标,由工作站Empower绘制标准溶液曲线得线性回归方程并给出判定系数;按信噪比S/N=3计算出各组分检测限,结果表明方法线性关系良好、检测限优于课题组前期氨基柱分析结果[1],能满足甘蔗茎节样品中糖的分析(表1).

图2 糖标样及混合标样的色谱图Fig.2 HPLC chromatogram of three saccharides standards and mixture
2.5 精密度与回收率
取某代表性甘蔗茎节样品,按1.5中所述液氮研磨、浸提、定容等步骤平行处理5份,峰面积RSD值分别为蔗糖2.77%、葡萄糖 3.23%、果糖 4.50%;某代表性样品加标结果如下表2所示(n=5).结果表明,测定方法重复性好、回收率高,实验中成功应用该方法检测基地多批次甘蔗茎节样品.
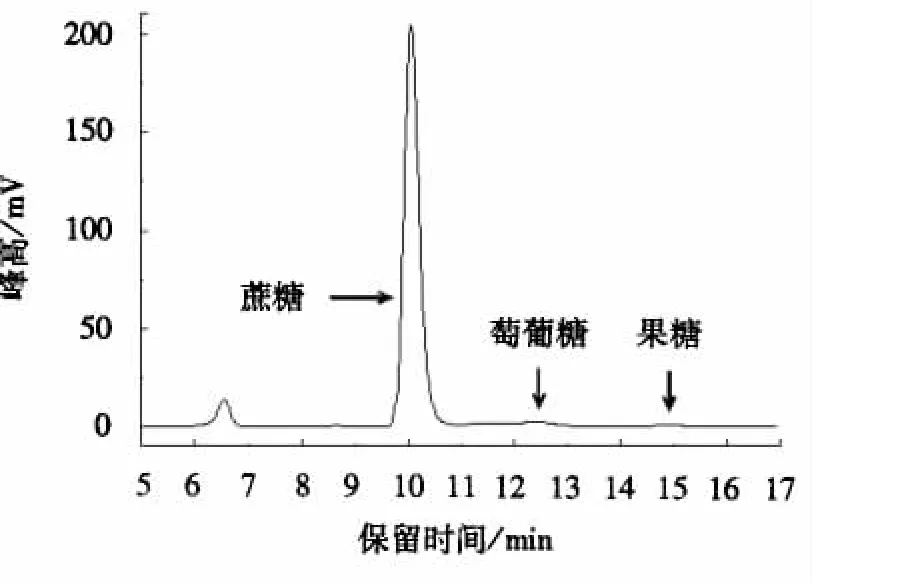
图3 代表性样品谱图Fig.3 HPLC chromatogram of the representing samples

表1 标准曲线回归方程、判定系数及检测限Table1 Linearity assays of the analyticalmethod

表2 方法加标及回收率Table 2 Recovery assay of the analyticalmethod
3 结论
本方法HPLC以钙基阳离子交换柱Sugar-PakⅠ为分析柱,以RID检测器对甘蔗茎节提取液进行分析,对甘蔗中含量较多的3种糖实现有效分离和定量检测.研究表明,该方法用超纯水取代常用有毒溶剂乙腈作为流动相,简便快捷、安全,结果准确可靠;检测方法线性关系好、灵敏度高,判定系数均大于0.9995;方法重复性良好,RSD小于5%、加标回收率高;能满足甘蔗及相似作物或水果中3种糖的准确分析.
[1]逯平杰,代容春,叶冰莹,等.高效液相色谱法测定甘蔗节间果糖,葡萄糖和蔗糖的含量[J].食品科学,2011,32(2):198-200.
[2]霍汉镇.现代制糖化学与工艺学[M].化学工业出版社,2008:1-5.
[3]周欣,王庆彪,刘锡钧,等.气相色谱法检测葡萄糖、麦芽糖、果糖和蔗糖[J].海峡药学,2001,13(4):48-49.
[4]张峻松,宣晓泉,唐纲岭,等.毛细管气相色谱法测定烟草中葡萄糖、果糖、蔗糖的含量[J].中国烟草学报,2007,13(2):17-20.
[5]崔鹤,李戈,纪雷,等.离子色谱脉冲安培法测定蜂蜜中的葡萄糖、果糖、蔗糖[J].化学分析计量,2001,10(1):25-26.
[6]CASEIRO A,MARR IL,CLAEYSM,et al.Determination of saccharides in atmospheric aerosol using anion-exchange highperformance liquid chromatography and pulsed-amperometric detection[J].Journal of Chromatography A,2007,1171(1-2):37-45.
[7]DE CORTESSÁNCHEZ-MATA M,CÁMARA-HURTADOM,DÍEZ-MARQUÉSC.Identification and quantification of soluble sugars in green beans by HPLC[J].European Food Research and Technology,2002,214(3):254-258.
[8]胡志群,王惠聪,胡桂兵.高效液相色谱测定荔枝果肉中的糖、酸和维生素C[J].果树学报,2006,22(5):582-585.
[9]王浩,刘艳琴,杨红梅,等.液相色谱——质谱联用技术测定无糖食品中果糖、葡萄糖、蔗糖、麦芽糖和乳糖[J].分析化学,2010,38(6):873-876.
[10]CHANDRAJU S,THEJOVATHIC,KUMAR C.Extraction,isolation and identification of sugars from banana peels(Musa Sapientum)by HPLC coupled LC/MS instrument and TLC analysis[J].Journal of Chemical and Pharmaceutical Research,2011,3(3):312-321.
[11]杨俊,刘江生,蔡继宝,等.高效液相色谱-蒸发光散射检测法测定烟草中的水溶性糖[J].分析化学,2006,33(11):1596-1598.
[12]张媛媛,聂少平,万成,等.高效液相色谱—蒸发光散射检测法同时测定单糖双糖及低聚果糖[J].食品科学,2009,30(18):237-239.
[13]宋晓晖,谢凯,李艳丽,等.HPLC-ELSD法测定梨果实中不同种类可溶性糖含量[J].南京农业大学学报,2012,35(2):87-91.
[14]陈思,曾磊,陈尚武,等.蔗糖转运蛋白基因VvSUC12和VvSUC27在葡萄胚性和非胚性愈伤组织中的差异表达[J].生物工程学报,2010,26(4):530-537.
[15]龚时琼.高效液相色谱仪常用检测器的使用与维护[J].现代仪器,2009,16(1):55-55.
[16]查圣华,王泽凤,姜水红,等.HPLC法测定益生元冲剂中水苏糖含量的方法学研究[J].食品科技,2011,36(7):278-282.
(责任编辑:吴显达)
HPLC-RID determ ination of sucrose,glucose and fructose in sugarcane internodes
LIN Yue-xu1,ZHANG Hua2,CHEN Ru-kai2
(1.College of Life Sciences,Fujian Agriculture and Forestry University;2.National Research and Development Center for Sugarcane Industry Technology,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China)
Sucrose,glucose and fructose in sugarcane internodes were determined by high performance liquid chromatography with refractive index detector(HPLC-RID).The chromatographic separation was achieved on an Waters Sugar Pak I column(6.5 mm ×300 mm,10μm),which was held at a constant temperature of90℃,using amobile phase composed of pure water at a flow rate of0.4 mL·min-1.RID temperature was set as 35 ℃.Average spike recoveries for 6 replicate determinations of three saccharides were found in range of 94.2%-101.5% ,with a relative standard deviation(RSD)between 2.77%and 4.5% .
HPLC-RID;sugarcane internode;sucrose;glucose;fructose
O657.7
A
1671-5470(2015)03-0232-04
10.13323/j.cnki.j.fafu(nat.sci.).2015.03.002
2014-05-30
2014-12-17
公益性行业科研专项(201003009).
林月绪(1979-),男,助理实验师,硕士.研究方向:无机化学.Email:linyuexu@163.com.
