聚乙二醇(PEG)胁迫诱导水稻DNA甲基化变异与脯氨酸代谢相关性研究
2015-03-02张春玉
张春玉
(1.长春职业技术学院食品与生物技术分院,吉林 长春130033;2.东北师范大学生命科学学院,吉林 长春130024)
作物产量经常受到干旱等非生物胁迫因素的影响,而植物在响应渗透胁迫的过程中常会出现脯氨酸的积累;已有的研究表明,脯氨酸在植物应对胁迫的过程中发挥了重要的抗逆作用[1-3].植物体内脯氨酸的合成主要有两条途径:一条是以谷氨酸为底物合成脯氨酸,催化此途径的酶是Δ1-吡咯啉-5-羧酸合成酶(P5CS)和Δ1-吡咯啉-5-羧酸还原酶(P5CR);另一条途径是以鸟氨酸为底物合成脯氨酸,催化此途径的酶是鸟氨酸转氨酶(δ-OAT)和Δ1-吡咯啉-5-羧酸合成酶(P5CR).脯氨酸的降解则由脯氨酸脱氢酶(Prodh)催化和Δ1-吡咯琳-5-羧酸脱氢酶(P5CDH)调控[4-5].研究表明,脯氨酸合成过程中相关基因表达的上调有利于叶片中游离脯氨酸的积累,如Roosens等将鸟氨酸转氨酶(δ-OAT)基因用于烟草植株的转化,结果证明与非转化植株相比,叶片脯氨酸含量明显升高,即鸟氨酸转氨酶(δ-OAT)基因转化植株的后代对脯氨酸的积累能力显著增强.
虽然脯氨酸的积累是逆境条件下最常见的生理反应,常被作为衡量抗逆性强弱的指标.但是其确切机理仍不清楚[4].最新的研究表明,逆境胁迫(如干旱、冷害和盐碱)能够改变植物基因组DNA 甲基化水平,这表明DNA 甲基化与植物的抗逆性有关[6].为了研究逆境胁迫下DNA 甲基化是否参与了脯氨酸的累积,本文首次从表观遗传学角度探讨了聚乙二醇(PEG)胁迫下DNA 甲基化与脯氨酸代谢之间可能存在的相关性,对于深入研究逆境条件下脯氨酸代谢的表观遗传学机制具有重要意义.
1 实验方法
1.1 材料与试剂
1.1.1 植物材料
水稻(Oryza sativa L.)粳稻品种——松前.
1.1.2 材料的处理
随机选取松前S0代和S1代(S0的自交后代)种子各30粒进行培养.待苗长到三叶一心时,将S0代和S1代植株分别分成两组:一组为对照组,不进行PEG 胁迫;另一组为处理组.选取15%的PEG 模拟干旱胁迫处理,在处理期间每天更换新的处理液以保证处理浓度的均一性的,胁迫处理4d后,分别取处理组和对照组的叶片,在液氮中冷冻后置于-70℃冰箱中保存待用.
1.1.2 营养液
1.44 mmol/L (NH4)2SO4,0.32 mmol/L NaH2PO4,0.6 mmol/L K2SO4,1.0 mmol/L CaCl2,1.6mmol/L MgSO4,0.072mmol/L EDTA,0.2mmol/L Na2SiO3,9.1mmol/L MnCl2,0.154μmol/L ZnSO4,0.156μmol/L CuSO4,18.5μmol/L H3BO3,0.526μmol/L H2MoO4.pH=5.2.
1.2 技术路线
1.2.1 松前基因组总DNA 提取
采用改良的十六烷基三甲基溴化铵(CTAB)法[7].
1.2.2 松前的DNA 甲基化敏感扩增多态性(MSAP)检测
参照Xiong等报道的方法[8],以上述提取的松前DNA 为模板,对S0代进行DNA 甲基化敏感扩增多态性检测,双酶切组合为EcoRⅠ/MspⅠ和EcoRⅠ/HpaⅡ,接头、预扩增及选扩增引物序列如表1所示.
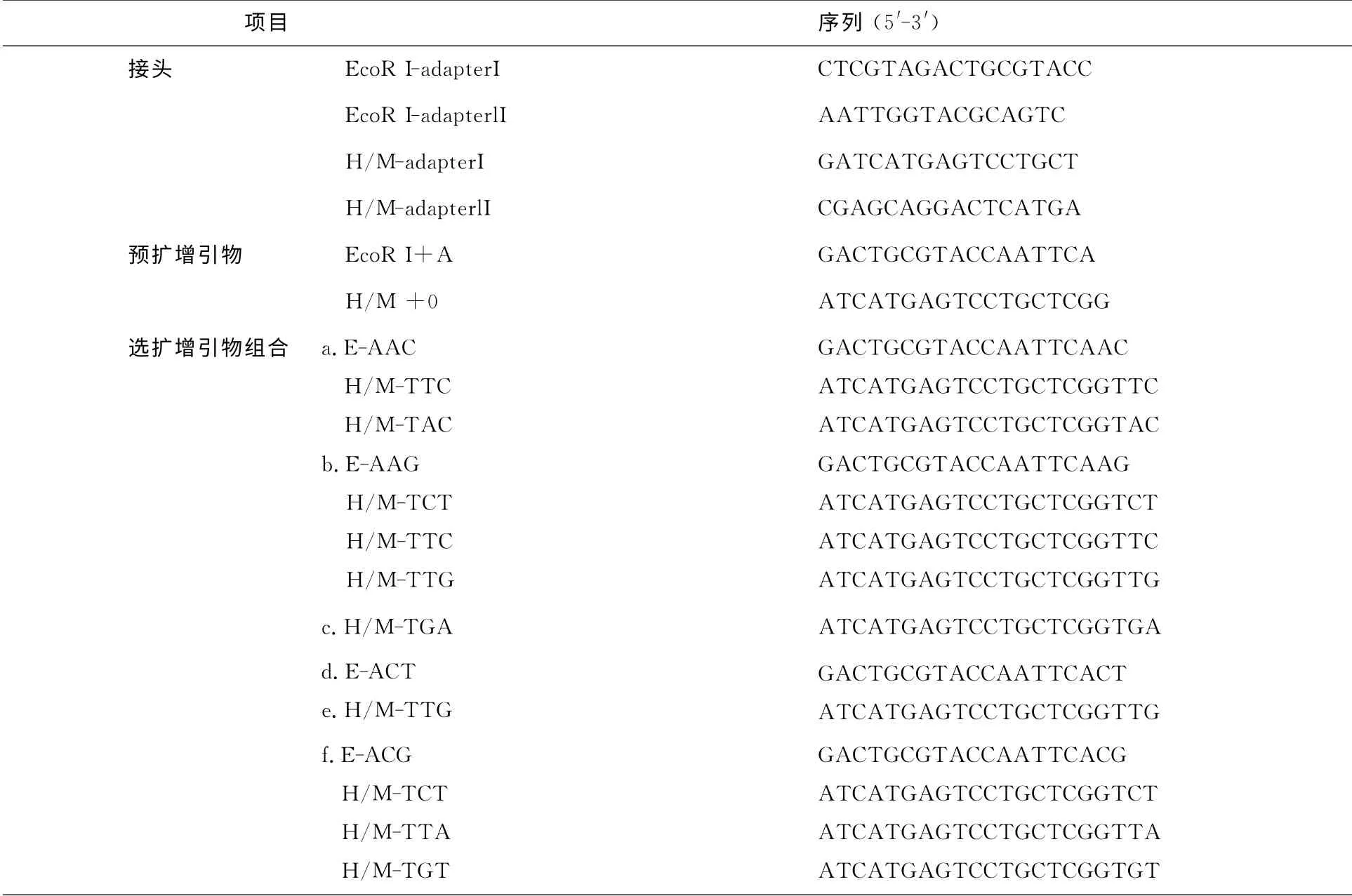
表1 松前扩增MSAP中接头序列、预扩增引物和选择性扩增引物组合

续表1
1.2.3 松前总RNA 的提取
参照Lepz等方法提取松前总RNA[9].
1.2.2 松前总RNA 反转录
以上述提取的松前总RNA 为模板进行反转录,反转录反应体系如表2所示.反应程序为:30℃,10min;42℃,30min;99℃,5min.

表2 10μL反转录反应体系
1.2.3 脯氨酸代谢相关基因的Southern印迹杂交检测
用限制性内切酶消化水稻当代变异最大的单株S0及其后代S1代单株叶片的基因组DNA,进行脯氨酸代谢相关基因的Southern印迹杂交检测.
1.2.4 脯氨酸代谢相关基因的实时荧光定量聚合酶链式反应(Realtime-PCR)
以上述反转录获得的水稻样品的cDNA 为模板,按照表3提供的引物,采用荧光染料(SYBR Green)三步法进行实时荧光定量聚合酶链式反应(Realtime-PCR)扩增.反应体系如表4所示.反应程序为:95℃,1min;95℃,5s;58℃~60℃,10s;72℃,30s.40个循环.

表3 用于扩增松前的转座子和基因的探针的引物
1.2.5 游离脯氨酸含量的测定
按照Bates等方法测定样品叶片中游离脯氨酸的含量[10].
2 结果与分析
2.1 松前S0 代甲基化变异最大的单株
对随机选取的S0代的14个单株进行DNA 甲基化敏感扩增多态性检测,采用EcoRⅠ+MspⅠ选择性扩增引物组合(19对)扩增出了956条清晰可辨的条带.结果表明,S0代的14个单株的CHG 甲基化水平和模式均发生了变异,但是CG 甲基化却没有发生变异.CHG 总甲基化变异范围为0.2%~8%,结果如图1所示.根据以上的检测结果,筛选出甲基化变异最明显的第4株(变异率为8%)进行后续的研究,记作S0,S0的自交后代记为S1.

表4 松前的Realtime-PCR反应体系(10μL)

图1 PEG 胁迫S0 代DNA甲基化模式变异
2.2 S0 和S1 代脯氨酸代谢相关基因的Southern印迹杂交的检测
为了进一步明确脯氨酸代谢相关基因P5CS、δ-OAT、P5CR 以 及P5CDH 在S0和S1代所发生的DNA 甲基化变异特征,利用Southern印迹杂交技术检测S0代和S1代的14个单株的DNA 甲基化水平,结果见图2.结果表明:这些基因在S0代,CHG、CG 甲基化均未发生变异.S1代Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因甲基化变异率为100%(全部发生去甲基化变异);鸟氨酸转氨酶(δ-OAT)基因甲基化变异率约为21%(3个单株发生去甲基化变异,11个单株没有变化);脯氨酸合成途径Δ1-吡咯啉-5-羧酸合成酶(P5CR)基因和脯氨酸降解途径基因Δ1-吡咯啉-5-羧酸脱氢酶(P5CDH)基因的甲基化变异率为0(S1代没有发生甲基化变化).
2.3 S0 代和S1 代叶片的脯氨酸代谢基因的
DNA甲基化变异与基因表达的相关性
(1)Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因的表达.与对照相比,S0代P5CS基因表达上调得不明显,S1代所有单株P5CS基因的表达均上调,尤其是S1-8,S1-9和S1-10这3个单株的表达明显上调(P<0.05),P5CS基因在S1后代中表达上调的比率为100%(见图3A).
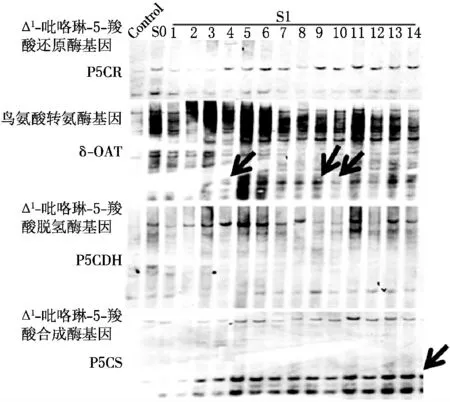
图2 S0 代和S1 代的Southern杂交结果
(2)鸟氨酸转氨酶(δ-OAT)基因的表达.与对照相比,除S1-5,S0代和S1代其他13 个单株中δ-OAT 基因的表达均上调,上调的比率为71.4%.Southern印迹杂交的结果显示S1-4,S1-9和S1-10这3个单株δ-OAT 基因发生了去甲基化变异;Realtime-PCR 结果显示这3个单株对应的基因表达结果为上调,说明二者基本可以吻合.但是该基因的Southern 印迹杂交结果表明,S1代其他的11 个单株δ-OAT 基因没有发生去甲基化变异,但是对应的基因表达却有上调,这进一步证明了仅是部分单株甲基化变异与基因的表达可能呈现相关性(见图3B).
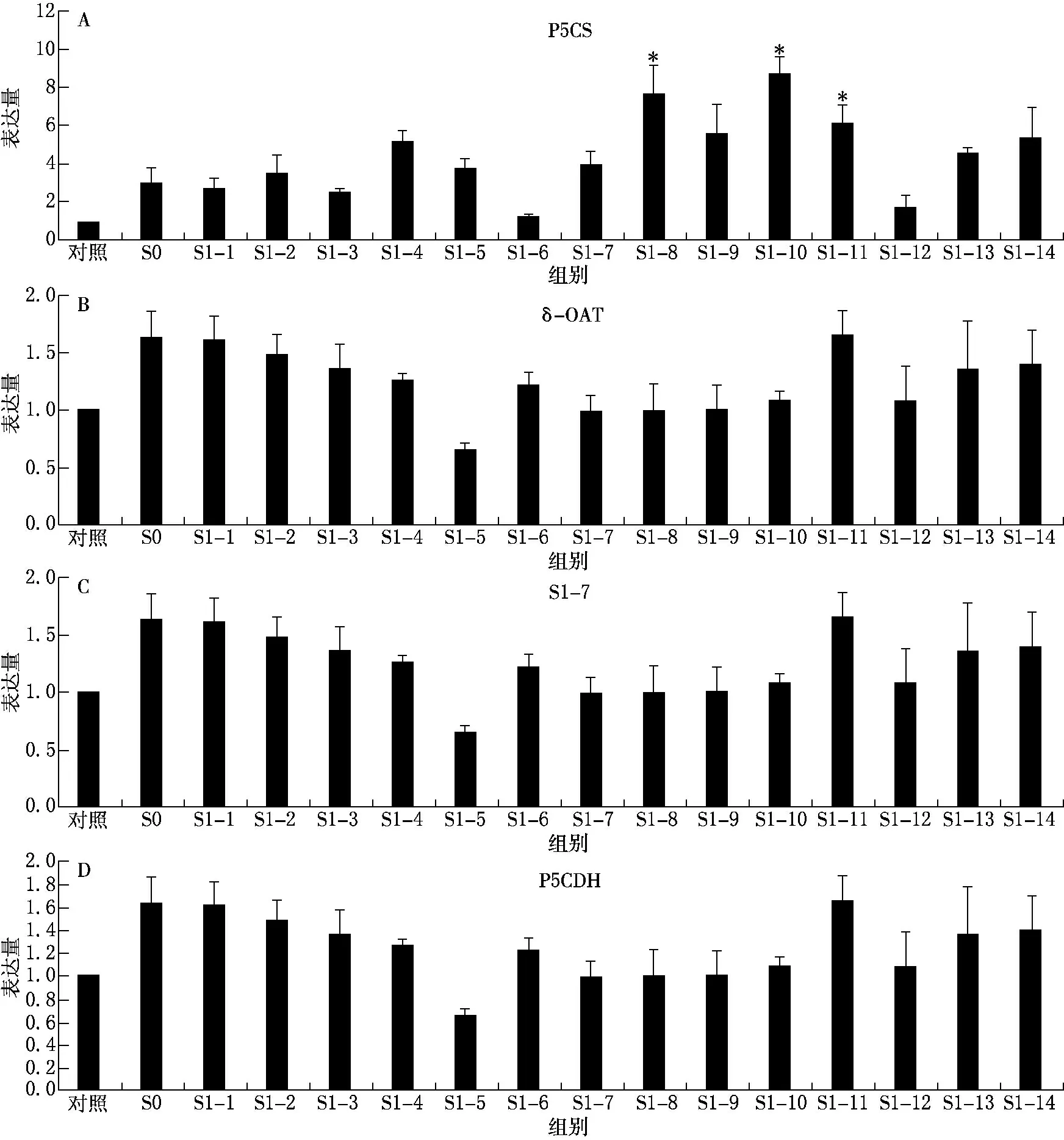
图3 S0 代和S1 代的Realtime-PCR检测
(3)Δ1-吡咯啉-5-羧酸还原酶(P5CR)基因的表达.与对照相比,S0代P5CR 基因表达上调,S1代P5CR基因表达上调率为71.4%,这与Southern印迹杂交的去甲基化变异率(0)不相符,表明P5CR 基因在S1代单株中的DNA 去甲基变异与该基因在S1代的表达不直接相关(见图3C).
(4)Δ1-吡咯啉-5-羧酸脱氢酶(P5CDH)基因的表达.与对照相比,S0代P5CDH 基因表达上调,S1代P5CDH 基因表达下调率为7.1%,这与Southern印迹杂交0的去甲基化变异率之间存在一定的差距,表明P5CDH 基因的甲基化变异与基因表达也不存在直接相关(见图3D).
2.4 干旱胁迫对后代(S1 代)叶片游离脯氨酸含量的影响
前述的基因表达结果已经表明,S1代所有植株的控制脯氨酸合成的关键基因Δ1-吡咯啉-5-羧酸合成酶(P5CS)表达均上调.为了验证这个基因的DNA 甲基化变异及其基因表达的变化是否对脯氨酸的累积产生影响,分别对S0代和S1代叶片中游离脯氨酸含量进行测定.结果(见图4)表明,与对照相比,无论是否经过再次胁迫处理,在胁迫6h和4d时S1代叶片中的脯氨酸含量均高于对照;并且S1代在经过再次胁迫处理时,叶片中脯氨酸含量明显高于未胁迫状态,而对照在经过处理后脯氨酸含量没有明显的增强.很多研究表明脯氨酸可以作为植物抗逆的指标之一[3,13],因此,这也表明经过胁迫处理的后代植株S1代的抗旱性有所增强.

图4 S0 代和S1 代的脯氨酸含量
3 讨论与结论
植物的生长发育是在遗传和环境因素以及二者的相互作用下,通过极其复杂的生理和生化过程完成的.逆境尤其是干旱可以引起植物体内游离脯氨酸含量的增加,而脯氨酸含量是否可以作为植物抗旱适应性和育种的指标一直存在争议.但是很多研究表明,水稻受到干旱胁迫后脯氨酸的累积有利于水稻抗逆性的提高.引起脯氨酸累积的可能原因主要是脯氨酸合成途径被激活、氧化降解途径受到抑制或合成途径的原料供应受阻[11-13].
本研究发现:(1)S1代脯氨酸合成途径部分基因的DNA 甲基化变异与基因表达可能存在一定的相关性,但是否就是由于Δ1-吡咯啉-5-羧酸合成酶(P5CS)和鸟氨酸转氨酶(δ-OAT)基因的去甲基化变异激活了基因的表达而导致表达量上调还不能明确定论,因为酶的活性受到转录和翻译的共同调控,因此还有待于在蛋白质水平上进行进一步的验证.但是我们获得的信息表明,S1代中14个单株的Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因甲基化的变化与基因表达呈现了一致性,3 个单株的鸟氨酸转氨酶(δ-OAT)基因的甲基化变异与基因的表达呈现了一致性,因而我们猜测DNA 甲基化极有可能参与了对Δ1-吡咯啉-5-羧酸合成酶(P5CS)和鸟氨酸转氨酶(δ-OAT)基因表达的调控,进而影响了脯氨酸的累积.(2)Δ1-吡咯啉-5-羧酸还原酶(P5CR)基因和Δ1-吡咯啉-5-羧酸脱氢酶(P5CDH)基因的表达可能并不受DNA 甲基化的调控.(3)DNA 甲基化变异可能只对脯氨酸部分特定基因的表达产生一定的影响.
本文的研究结果表明:表观遗传修饰如DNA 甲基化极有可能在植物响应干旱胁迫时参与脯氨酸代谢的调节,并且这种代谢特性(基因表达水平和脯氨酸含量的变化)可按照一定的频率遗传给后代,因而可能在植物适应干旱以及胁迫抗性获得中发挥重要作用.本研究为DNA甲基化在脯氨酸代谢中的作用提供了一个可靠的证据,胁迫生物学的研究应该更多地关注执行抗性的生物活性的分子表观遗传学调节.
[1]RAZIN A,CEDAR H.DNA methylation-biochemistry and biological significance[J].Chromatogr,1992,581(1):31-40.
[2]ADAMS R L P,BURDON R H.Molecular biology of DNA methylation[M].New York,Berlin,Herddberg,Tokyo:SpringerVerlag,1985:1.
[3]SANTI D V,GARRETT C E,Barr P J.On the mechanism of inhibition of DNA-cytosine methyltransferases by cytosine analogs[J].Cell,1983,33:9-10.
[4]PAUL E VERSLUES1,SANDEEP SHARMA.Proline metabolism and its implications for plant-environment interaction[J].The Arabidopsis Book,2010,11(3):1-23.
[5]SAVOURE A,JAOUA S,HUA X J,et al.Isolation,characterization,and chromosomal location ofa gene encoding theΔ1-pyrroline-5-carboxylate synthetase in Arabidopsis thaliana[J].FEBS Lett,1995,372:13.
[6]FINNEGAN E J,GENGER R K,PEACOCK W J,et al.DNA methylation in plants[J].Annu Rev Plant Physiol Plant Mol Biol,1998,49(1):223-247.
[7]KIDWELL K K.Simple plant DNA isolation procedures,in plant genomes:methods for genetic and physical mapping Amsterdam[M].The Netherlands,Kluwer:Academic Publishers,1992:1-13.
[8]XIONG L Z,XU C G,MAROOF S,et al.Patterns of cytosine methylation pattern in an elite rice hybrid and its parental lines detected by a methylation sensitive amplification polymorphism technique[J].Molecular and General Genetics,1999,261:439-446.
[9]LEPZ GMEZ R,LIM M A.A method for extracting RNA with modified Gomez method[J].Hortscience,1992,27:440-442.
[10]BATES L S,WALDREN R P,TEARE I D.Rapid determination of free proline for water-stress studies[J].Plant and Soil 1973,39:205-207.
[11]ZHANG C S,LU Q,VERMA D P S.Removal of feedback inhibition ofΔ1-pyrroline-5-carboxylate synthetase,a bifunctional enzyme catalyzing the first two steps of proline biosynthesis in plants[J].J Biol Chem,1995,270:20491-20496.
[12]VERBRUGGEN N,HUA X J,MAY M,et al.Nvironmental and developmental signals modulate proline homeostasis:evidence for a negative transcriptional regulator[J].Proc Natl Acad Sci USA,1996,93:8787-8791.
[13]IYER S,CAPLAN A.Products of proline catabolism can induce osmotically regulated genes in rice[J].Plant Hysiology,1998,116:203-21.
