NO供体型吉西他滨衍生物的设计、合成及其抗肿瘤活性*
2015-03-02李祥华王学敏徐辰俊黄俊凯何黎琴
李祥华,王学敏,徐辰俊,黄俊凯,何黎琴**,凌 勇**
1安徽中医药大学,安徽省现代中药重点实验室,合肥 230031;2南通大学药学院,南通 226001
NO供体型吉西他滨衍生物的设计、合成及其抗肿瘤活性*
李祥华1,王学敏2,徐辰俊2,黄俊凯1,何黎琴1**,凌 勇2**
1安徽中医药大学,安徽省现代中药重点实验室,合肥 230031;2南通大学药学院,南通 226001
在吉西他滨(gemcitabine)的N4位偶联上不同的二醇取代的苯磺酰基呋咱氮氧化物,设计合成了10个新型NO供体型吉西他滨衍生物9a~9e和10a~10e。体外抗肿瘤活性结果表明,化合物9b~9d和10b~10d显示较强的抗肿瘤活性,尤其化合物10c不仅对HepG2、HCT116和SW620抗增殖活性(IC50=2.44~3.57 μmol·L-1)强于吉西他滨(IC50=3.87~7.52 μmol· L-1),而且释放出高浓度的NO。然而,加入NO清除剂后10c的抗肿瘤活性降低了近50%,提示NO供体型衍生物的抗肿瘤作用与NO释放有关。
一氧化氮;苯磺酰基呋咱;吉西他滨;抗肿瘤活性
恶性肿瘤是当今危害人类健康最重要的疾病之一,近年来现有的抗肿瘤药物在肿瘤治疗方面仍然存在着局限性[1]。临床上各种核苷类药物广泛地应用于癌症的治疗,其中吉西他滨是一种周期特异性抗代谢核苷类药物[2],主要用于胰腺癌、膀胱癌、乳腺癌及其他实体肿瘤的治疗[3-7]。然而,在临床使用过程中存在如下缺点:脂溶性差、跨膜能力差;容易被脱氨酶降解失活,从而导致半衰期短,生物利用度低等[8]。因此,本课题组基于吉西他滨在临床使用过程中存在的不足,设计及合成新型吉西他滨衍生物具有重要意义。
文献报道[9-10],吉西他滨的修饰主要是针对吉西他滨嘧啶环上的N4氨基进行修饰,使其形成酰胺键。例如,口服N4位丙戊酸修饰的吉西他滨(LY2334737,见图1-1)已经进入临床Ⅰ期试验,LY2334737可以避免吉西他滨进入体内后的快速降解,并且可以耐受胃肠道不同的酸碱环境[11-12]。吉西他滨N4氨基引入十八烷基的C18dFdC(见图1-2),不仅可以避免被体内的脱氨酶降解,而且可以改善吉西他滨在体内代谢的生物利用度[13]。
NO作为重要的信使物质和效应分子在生理和病理过程扮演一个关键的角色[14]。文献报道,高浓度的NO不仅可以诱导细胞凋亡,抑制肿瘤细胞转移,而且对化疗、免疫治疗、放疗的肿瘤细胞更加敏感[15-16]。在NO供体型衍生物中,选择能够产生高浓度NO的苯磺酰基呋咱氮氧化物作为NO供体,不仅具有较好的亲脂性,而且能抑制肿瘤细胞的生长[17-19]。基于上述的研究,将苯磺酰基呋咱和吉西他滨通过丁二酸偶联获得目标化合物9a~9e和10a~10e,期望能释放高浓度的NO,进一步提高吉西他滨衍生物的抗肿瘤效果。
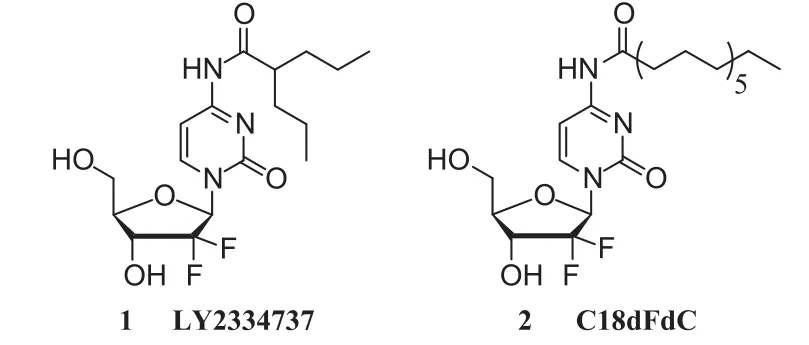
图1 吉西他滨衍生物化学结构式
1 合成路线
目标化合物9a~9e和10a~10e具体合成路线如图2所示。首先5a~5e参照文献合成方法[17,20],以苯硫酚1为原料,在氢氧化钠作用下,加入碳酸钠和氯乙酸的混合溶液,得到白色棒状晶体化合物2;化合物2与30%的过氧化氢反应,以冰醋酸作为溶剂得到化合物3;然后化合物3与95%的发烟硝酸反应,得到白色针状晶体化合物4。化合物4与不同取代基的二醇在氢氧化钠作用下,反应得到化合物5a~5e;化合物5a~5e与丁二酸酐在缩合剂4-二甲氨基吡啶(DMAP)作用下,反应生成化合物6a~6e;7与二碳酸二叔丁酯(Boc2O)以氢氧化钾作为缚酸剂,反应得到化合物8;化合物6a~6e与8在N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、4-二甲氨基吡啶(DMAP)作用下得到目标化合物9a~9e;化合物9a~9e在三氟乙酸(TFA)作用下,脱保护得到目标化合物10a~10e。
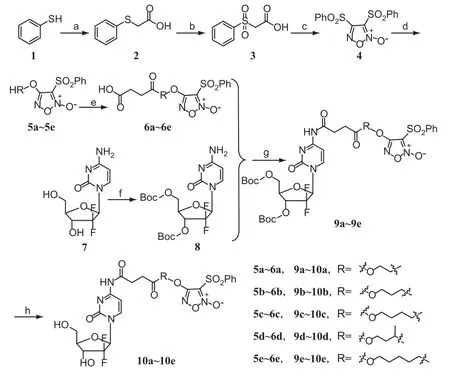
图2 目标化合物9a~9e和10a~10e具体合成路线图
2 实验部分
2.1 化学实验
XT4A型熔点仪(北京科仪电光仪器厂);Nicolet Avatar 370 DTGS型红外光谱仪 (美国 Thermo Electron公司);Brucker AV-300型核磁共振仪(瑞士Brucker公司);HP 1100LC/MSD质谱仪(美国Agi-lent公司);Elementar Vario ELⅢ型元素分析仪(德国Elementar公司);GF254色谱硅胶 (青岛海洋化工厂);试剂均为市售化学纯或分析纯产品。吉西他滨(连云港金康医药科技有限公司,纯度大于98%)。
4-(2-((3-羧基丙基)氧基)乙氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(6a)
将5a(0.29g,1.00mmol)、DMAP(0.06g,0.50mmol)及1,4-丁二酸酐(0.12 g,1.20 mmol)加入50 mL圆底烧瓶,以二氯甲烷为溶剂,加毕,油浴回流反应。反应5 h后薄层色谱(TLC)检测(乙酸乙酯-石油醚,4∶1)反应完全。停止搅拌,室温冷却后将反应液倾入50 mL水中,二氯甲烷(3×30 mL)萃取,合并有机层并用饱和氯化钠水洗一次,无水硫酸钠干燥。过滤、滤液减压浓缩至干,得到淡黄色固体,产率90.0%。MS(ESI)m/z 387[M+H]+。
4-(2-((3-羧基丙基)氧基)丙氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(6b)
参照6a的合成方法,5b代替5a与1,4-丁二酸酐、DMAP反应最终得到淡黄色固体,产率92.0%。MS(ESI)m/z 401[M+H]+。
4-(2-((3-羧基丙基)氧基)丁氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(6c)
参照6a的合成方法,5c代替5a与1,4-丁二酸酐、DMAP反应最终得到淡黄色固体,产率88.0%。MS(ESI)m/z 415[M+H]+。
4-((4-((3-羧基丙)氧基)丁-2-基)氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(6d)
参照6a的合成方法,5d代替5a与1,4-丁二酸酐、DMAP反应最终得到淡黄色固体,产率85.0%。MS(ESI)m/z 415[M+H]+。
4-(2-((3-羧基丙基)氧基)戊氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(6e)
参照6a的合成方法,5e代替5a与1,4-丁二酸酐、DMAP反应最终得到淡黄色固体,产率91.5%。MS(ESI)m/z 429[M+H]+。
4-氨基-1-((2R,4R,5R)-4-((叔丁氧基羰基)氧基)-5-(((叔丁氧基羰基)氧基)甲基)-3,3-二氟-四氢呋喃-2-基)嘧啶-2-(1H)-酮(8)
将7(2.63 g,10.00 mmol)溶于2 mol·L-1KOH(80 mL)中,冰浴条件下进行搅拌,将 Boc2O(10.90 g,50.00 mmol)溶于四氢呋喃(80 mL)中,N2保护下将其缓慢滴加至7的混合溶液中,滴加完毕,撤除冰浴恢复室温反应2 h,减压蒸出四氢呋喃,并将其倾入200 mL水中,乙酸乙酯(3×50 mL)萃取,合并有机层制砂过柱纯化(二氯甲烷-甲醇,50∶1~20∶1),得到白色固体,产率88.6%。MS(ESI)m/z 464[M+H]+。
4-(2-((4-((1-((2R,4R,5R)-4-((叔丁氧基羰基)氧基)-5-(((叔丁氧基羰基)氧基)甲基)-3,3-二氟-四氢呋喃-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)乙氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(9a)
将 6a(0.19 g,0.50 mmol)、NHS(0.07 g,0.60 mmol)、EDCI(0.12 g,0.60 mmol)、DMAP(0.01 g,0.10 mmol)加入50 mL圆底烧瓶,以无水CH2Cl2为溶剂加毕,常温条件下N2保护进行反应。反应2 h后TLC检测(石油醚-乙酸乙酯,1∶4)反应完全。将8(0.25 g,0.50 mmol)在N2保护下缓慢加入反应液中,常温条件下进行反应18 h后,TLC检测 (石油醚-乙酸乙酯,1∶1)反应完全。停止搅拌,后将反应液倾入50 mL水中,二氯甲烷(3×30 mL)萃取,合并有机层制砂过柱纯化(石油醚-乙酸乙酯,5∶1~1∶1),得淡黄色固体,产率52.0%。IR(KBr,cm-1):3460,2929,2848,1663,1619,1552,1447,1162;mp:142~145℃;1H-NMR(DMSO-d6,300 MHz)δ:11.18(s,1H,NH),8.20(d,2H,J=7.5 Hz,Ar-H),8.00(d,1H,J=7.5 Hz,CH=CHN),7.73(t,1H,J=7.5 Hz,Ar-H),7.21(d,2H,J=7.5 Hz,Ar-H),6.22(d,1H,J=7.5 Hz,CH=CHN),5.76(m,1H,NCH),5.31(m,1H,OCH),4.59(m,2H,OCH2),4.40(m,2H,OCH2),3.98(m,1H,OCH),3.80(m,1H,CH2O),3.65(m,1H,CH2O),2.74(m,2H,OCCH2),2.63(m,2H,OCCH2),1.26(s,18H,6×CH3);MS(ESI)m/z 832[M+H]+;C33H39F2N5O16S元素分析,理论值:C,47.65;H,4.73;N,8.42;实测值:C,47.50;H,4.87;N,8.30。
4-(2-((4-((1-((2R,4R,5R)-4-((叔丁氧基羰基)氧基)-5-(((叔丁氧基羰基)氧基)甲基)-3,3-二氟-四氢呋喃-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)丙氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(9b)
参照 9a的合成方法,6b代替 6a与 NHS、DMAP、EDCI及8反应,最终得到淡黄色固体,产率57.0%。IR(KBr,cm-1):3487,2925,2833,1661,1618,1562,1448,1160;mp:158~160℃;1H-NMR(DMSO-d6,300 MHz)δ:11.16(s,1H,NH),8.24(d,2H,J=7.5 Hz,Ar-H),8.09(d,1H,J=7.5 Hz,CH=CHN),7.82(t,1H,J=7.5 Hz,Ar-H),7.26(d,2H,J=7.5 Hz,Ar-H),6.36(d,1H,J=7.5 Hz,CH=CHN),6.18(m,1H,NCH),5.37(m,1H,OCH),4.42(m,2H,OCH2),4.09(m,2H,OCH2),3.89(m,1H,OCH),3.83(m,1H,CH2O),3.60(m,1H,CH2O),2.67(m,2H,OCCH2),2.58(m,2H,OCCH2),2.16(m,2H,CH2),1.26(s,18H,6×CH3);MS(ESI)m/z 846[M+H]+;C34H41F2N5O16S元素分析,理论值:C,48.28;H,4.89;N,8.28;实测值:C,48.39;H,5.02;N,8.12。
4-(2-((4-((1-((2R,4R,5R)-4-((叔丁氧基羰基)氧基)-5-(((叔丁氧基羰基)氧基)甲基)-3,3-二氟-四氢呋喃-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)丁氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(9c)
参照 9a的合成方法,6c代替 6a与 NHS、DMAP、EDCI及8反应,最终得到淡黄色固体,产率51.0%。IR(KBr,cm-1):3400,2939,2874,1698,1622, 1557,1453,1161;mp:165~166℃;1H-NMR(DMSO-d6,300 MHz)δ:11.17(s,1H,NH),8.26(d,2H,J=7.5 Hz,Ar-H),8.06(d,J=7.5 Hz,1H,CH=CHN),7.88(t,1H,J=7.5 Hz,Ar-H),7.27(d,2H,J=7.5 Hz,Ar-H),6.35(d,1H,J=7.5 Hz,CH=CHN),6.19(m,1H,NCH),5.36(m,1H,OCH),4.47(m,2H,OCH2),4.06(m,2H,OCH2),3.88(m,1H,OCH),3.82(m,1H,CH2O),3.64(m,1H,CH2O),2.74(m,2H,OCCH2),2.61(m,2H,OCCH2),1.82(m,2H,CH2),1.67(m,2H,CH2),1.28(s,18H,6× CH3);MS(ESI)m/z 860[M+H]+;C35H43F2N5O16S元素分析,理论值:C,48.89;H,5.04;N,8.15;实测值:C,48.72;H,5.19;N,8.03。
4-((4-((4-((1-((2R,4R,5R)-4-((叔丁氧基羰基)氧基)-5-(((叔丁氧基羰基)氧基)甲基)-3,3-二氟四氢呋喃-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)丁-2-基)氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(9d)
参照9a的合成方法,6d代替6a与NHS、DMAP、EDCI及8反应,最终得到淡黄色固体,产率53.0%。IR(KBr,cm-1):3450,2928,2852,1664,1613,1496,1448,1150;mp:144~146℃;1H-NMR(DMSO-d6,300 MHz)δ:11.12(s,1H,NH),8.29(d,2H,J=7.5 Hz,Ar-H),8.02(d,J=7.5Hz,1H,CH=CHN),7.87(t,1H,J=7.5Hz,Ar-H),7.29(d,2H,J=7.5 Hz,Ar-H),6.34(d,1H,J=7.5 Hz,CH=CHN),6.16(m,1H,NCH),5.39(m,1H,OCH),4.37(m,2H,OCH2),4.02(m,1H,OCH),3.87(m,1H,OCH),3.79(m,1H,CH2O),3.62(m,1H,CH2O),2.79(m,2H,OCCH2),2.59(m,2H,OCCH2),1.87(m,2H,CH2),1.29(s,18H,6×CH3),1.22(m,3H,CH3);MS(ESI)m/z 860 [M+H]+;C35H43F2N5O16S元素分析,理论值:C,48.89;H,5.04;N,8.15;实测值:C,48.72;H,5.22;N,8.01。
4-(2-((4-((1-((2R,4R,5R)-4-((叔丁基二甲基甲硅烷基)氧基)-5-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3,3-二氟-四氢呋喃-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)戊氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(9e)
参照 9a的合成方法,6f代替 6a与 NHS、DMAP、EDCI及8反应,最终得到淡黄色固体,产率59.0%。IR(KBr,cm-1):3469,2922,2853,1677,1615,1551,1447,1165;mp:172~174℃;1H-NMR(DMSO-d6,300 MHz)δ:11.12(s,1H,NH),8.26(d,2H,J=7.5 Hz,Ar-H),8.02(d,1H,J=7.5 Hz,CH=CHN),7.88(t,1H,J=7.5 Hz,Ar-H),7.24(d,2H,J=7.5 Hz,Ar-H),6.36(d,1H,J=7.5 Hz,CH=CHN),6.18(m,1H,NCH),5.34(m,1H,OCH),4.49(m,2H,OCH2),4.12(m,2H,OCH2),3.87(m,1H,OCH),3.82(m,1H,CH2O),3.68(m,1H,CH2O),2.79(m,2H,OCCH2),2.56(m,2H,OCCH2),1.82(m,2H,CH2),1.64(m,2H,CH2),1.53(m,2H,CH2),1.26(s,18H,6×CH3);MS(ESI)m/z 874[M+H]+;C26H29F2N5O12S元素分析,理论值:C,49.48;H,5.19;N,8.01;实测值:C,49.26;H,5.38;N,7.90。
4-(2-((4-((1-((2R,4R,5R)-3,3-二氟-4-羟基-5-(羟甲基)四氢呋喃-吡啶-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)乙氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(10a)
将9a(0.20 g,0.23 mmol)溶于5 mL无水二氯甲烷溶液中,缓慢滴加0.5 mL TFA,冰浴条件下反应0.5 h,TLC检测原料点反应完全,减压蒸出反应液溶剂,粗品通过柱层析纯化(二氯甲烷-甲醇,50∶1~20∶1)得到淡黄色固体,产率86.7%。IR(KBr,cm-1):3465,2927,2844,1662,1617,1558,1445,1160;mp:172~175℃;1H-NMR(DMSO-d6,300 MHz)δ:11.10(s,1H,NH),8.24(d,2H,J=7.5Hz,Ar-H),8.02(d,1H,J=7.5 Hz,CH=CHN),7.90(t,1H,Ar-H),7.24(d,2H,J=7.5 Hz,Ar-H),6.34(d,1H,J=7.5 Hz,CH=CHN),6.13(m,1H,NCH),5.33(m,1H,HOCH),4.48(m,2H,OCH2),4.42(m,2H,OCH2),3.89(m,1H,OCH),3.80(m,1H,CH2OH),3.65(m,1H,CH2OH),2.78(m,2H,OCCH2),2.58(m,2H,OCCH2);MS(ESI)m/z 632[M+H]+;C23H23F2N5O12S元素分析,理论值:C,43.74;H,3.67;N,11.09;实测值:C,43.53;H,3.77;N,11.21。
4-(2-((4-((1-((2R,4R,5R)-3,3-二氟-4-羟基-5-(羟甲基)四氢呋喃-吡啶-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)丙氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(10b)
参照10a的合成方法,9b代替9a与TFA的二氯甲烷溶液反应,最终得到淡黄色固体,产率82.8%。IR(KBr,cm-1):3481,2927,2830,1663,1616,1560,1444,1160;mp:182~185℃;1H-NMR(DMSO-d6,300 MHz)δ:11.18(s,1H,NH),8.26(d,2H,J=7.5 Hz,Ar-H),8.07(d,1H,J=7.5 Hz,CH=CHN),7.88(t,1H,J=7.5Hz,Ar-H),7.29(d,2H,J=7.5Hz,Ar-H),6.32(d,1H,J=7.5 Hz,CH=CHN),6.16(m,1H,NCH),5.30(m,1H,HOCH),4.43(m,2H,OCH2),4.06(m,2H,OCH2),3.88(m,1H,OCH),3.82(m,1H,CH2OH),3.61(m,1H,CH2OH),2.68(m,2H,OCCH2),2.56(m,2H,OCCH2),2.11 (m,2H,CH2);MS (ESI)m/z 646[M+H]+;C24H25F2N5O12S元素分析,理论值:C,44.65;H,3.90;N,10.85;实测值:C,44.38;H,4.08;N,11.00。
4-(2-((4-((1-((2R,4R,5R)-3,3-二氟-4-羟基-5-(羟甲基)四氢呋喃-吡啶-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)丁氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(10c)
参照10a的合成方法,9c代替9a与TFA的二氯甲烷溶液反应,最终得到淡黄色固体,产率81.6%。IR(KBr,cm-1):3407,2934,2876,1696,1624,1559,1454,1165;mp:205~208℃;1H-NMR(DMSO-d6,300 MHz)δ:11.12(s,1H,NH),8.23(d,2H,J=7.5 Hz,Ar-H),8.02(d,1H,J=7.5 Hz,CH=CHN),7.89(t,1H,J=7.5 Hz,Ar-H),7.23(d,2H,J=7.5 Hz,Ar-H),6.33(d,1H,J=7.5 Hz,CH=CHN),6.17(m,1H,NCH),5.31(m,1H,HOCH),4.41(m,2H,OCH2),4.08(m,2H,OCH2),3.89(m,1H,OCH),3.80(m,1H,CH2OH),3.65(m,1H,CH2OH),2.72(m,2H,OCCH2),2.60(m,2H,OCCH2),1.80(m,2H,CH2),1.68(m,2H,CH2);MS(ESI)m/z 660[M+H]+;C25H27F2N5O12S元素分析,理论值:C,45.52;H,4.13;N,10.62;实测值:C,45.29;H,4.28;N,10.80。
4-((4-((4-((1-((2R,4R,5R)-3,3-二氟-4-羟基-5-(羟甲基)四氢呋喃-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)丁-2-基)氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(10d)
参照10a的合成方法,9d代替9a与TFA的二氯甲烷溶液反应,最终得到淡黄色固体,产率86.3%。IR(KBr,cm-1):3455,2927,2856,1668,1614,1499,1444,1152;mp:195~197℃;1H NMR(DMSO-d6,300 MHz)δ:11.16(s,1H,NH),8.27(d,2H,J=7.5 Hz,Ar-H),8.04(d,1H,J=7.5 Hz,CH=CHN),7.86(t,1H,J=7.5 Hz,Ar-H),7.28(d,2H,J=7.5 Hz,Ar-H),6.39(d,1H,J=7.5 Hz,CH=CHN),6.12(m,1H,NCH),5.36(m,1H,HOCH),4.38(m,2H,OCH2),4.00(m,1H,OCH),3.83(m,1H,OCH),3.80(m,1H,CH2OH),3.67(m,1H,CH2OH),2.77(m,2H,OCCH2),2.57(m,2H,OCCH2),1.89(m,2H,CH2),1.21(m,3H,CH3);MS(ESI)m/z 660[M+H]+;C25H27F2N5O12S元素分析,理论值:C,45.52;H,4.13;N,10.62;实测值:C,45.79;H,4.27;N,10.82。
4-(2-((4-((1-((2R,4R,5R)-3,3-二氟-4-羟基-5-(羟甲基)四氢呋喃-吡啶-2-基)-2-氧代-1,2-二氢嘧啶-4-基)氨基)-4-氧代丁酰基)氧基)戊氧基)-3-(苯基磺酰基)-1,2,5-噁二唑-2-氧化物(10e)
参照10a的合成方法,9e代替9a与TFA的二氯甲烷溶液反应,最终得到淡黄色固体,产率77.8%。IR(KBr,cm-1):3466,2929,2858,1672,1618,1552,1447,1162;mp:218~220℃;1H-NMR(DMSO-d6,300 MHz)δ:11.11(s,1H,NH),8.25(d,2H,J=7.5 Hz,Ar-H),8.03(d,1H,J=7.5 Hz,CH=CHN),7.87(t,1H,J=7.5 Hz,Ar-H),7.26(d,2H,J=7.5 Hz,Ar-H),6.34(d,1H,J=7.5 Hz,CH=CHN),6.19(m,1H,NCH),5.32(m,1H,HOCH),4.47(m,2H,OCH2),4.11(m,2H,OCH2),3.89(m,1H,OCH),3.82(m,1H,CH2OH),3.66(m,1H,CH2OH),2.78(m,2H,OCCH2),2.55(m,2H,OCCH2),1.83(m,2H,CH2),1.62(m,2H,CH2),1.52(m,2H,CH2);MS(ESI)m/z 674[M+H]+;C26H29F2N5O12S元素分析,理论值:C,46.36;H,4.34;N,10.40; 实测值:C,46.11;H,4.42;N,10.58。
2.2 药理活性实验
2.2.1 MTT法 参照ATCC(American Type Cul-true Collection)相关说明,将含每孔2×104~4×104个人源肿瘤细胞株包括人肝癌细胞(HepG2),人结肠癌细胞(HCT116,SW620),人胃癌细胞(SGC7901),所有细胞均培养于含10%热灭活胎牛血清,青霉素100 U·mL-1和链霉素100 U·mL-1的RPMI1640培养基或DMEM细胞培养基的96孔板中,过夜。加入含有不同浓度的受试化合物,吉西他滨作为阳性对照药,37℃、5%CO2培养48 h。加入5 mg·mL-1噻唑蓝(MTT)溶液于96孔板中的细胞孔中,每孔30 μL,培养箱中孵育4 h。弃上清液,加150 μL/孔二甲亚砜(DMSO),平板摇床上振摇10 min。用酶联免疫监测仪在波长为570 nm处测定每孔的吸光度,分别计算各浓度下的细胞抑制率。用LOGIT法(Graph Pad Prism Version 4.03软件)计算受试化合物IC50。
2.2.2 体外NO释放实验 参照NO试剂盒相关说明,采用Griess重氮化反应法测试了目标化合物NO的释放量[21]。HepG2和HCT116细胞培养过程参照“2.2.1”的实验方法。受试化合物用DMSO溶解后用PBS稀释,受试物浓度为10-4mol·L-1。按50 μL/孔,在96孔板中加入样品。于300 min时间点离心沉淀取上清液,在各孔中加入Griess试剂,室温放置10 min,在540 nm处测吸收值,根据标准曲线计算NO浓度。NO的释放量以其相当于硝酸盐(NO3-)/亚硝酸盐(NO2-)的量表示。
2.2.3 NO清除剂阻滞实验 HepG2细胞培养过程参照“2.2.1”的实验方法,受试化合物所选浓度为5、10 μmol·L-1。Hemoglobin相对于受试化合物提前1 h加入培养基中,且分别采用 0、1、5、10 μmol·L-1Hemoglobin未见显著的细胞毒性。受试化合物处理48 h后,检测并计算细胞抑制率。
3 结果与讨论
3.1 化合物9a~9e和10a~10e体外细胞增殖抑制活性
通过MTT法测试化合物9a~9e和10a~10e对4种人癌细胞 系 HepG2、HCT116、SGC7901和SW620抑制活性,以吉西他滨作为阳性对照。如表1所示,化合物9b~9d和10b~10d显示较强的抗肿瘤活性,尤其目标物10c对HepG2、HCT116和SW620抗肿瘤活性(IC50=2.44~3.57 μmol·L-1)强于吉西他滨(IC50=3.87~7.52 μmol·L-1)。
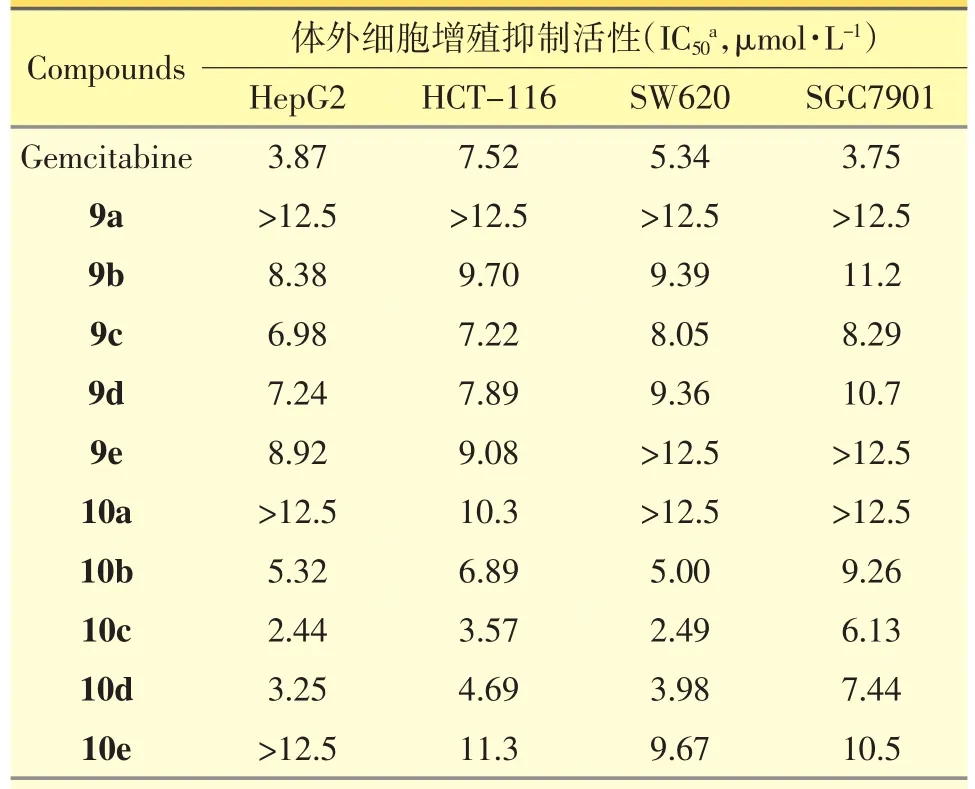
表1 化合物9a~e和10a~e体外细胞增殖抑制活性
3.2 化合物9b~9d和10b~10e体外NO释放检测
为考察NO供体型衍生物的NO释放与其抗肿瘤活性之间的关联,选择9b~9d、10b~10e和吉西他滨测定了它们的体外NO释放,如图3所示。发现细胞毒性最强化合物10c的NO释放量最大,在300 min时达到最大值28.6 μmol·L-1;而细胞毒性相对较弱的化合物9b~9d、10e的NO释放量较低。此结果与文献报道[22]的高浓度NO对肿瘤细胞具有较强细胞毒作用的结论是一致的。
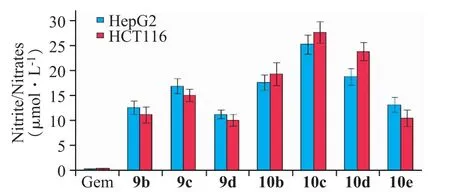
图3 NO供体型衍生物9b~9d和10a~10e体外NO释放检测
3.3 NO清除剂对NO供体型吉西他滨衍生物10c活性的阻滞作用
为了进一步阐明化合物10c细胞毒性与NO释放的相关性,考察了NO释放较高的10c其NO释放水平与抑制HepG2细胞之间的关系。如图4所示,选取5、10 μmol·L-1的10c在细胞培液中加入不同浓度 0、1、5、10 μmol·L-1的 NO清除剂 Ho-moglobin。结果发现,Homoglobin能剂量依赖性地促使目标物10c的细胞抑制率下降,在Homoglobin最大剂量下能够使得10c的抗肿瘤活性降低50%,提示NO供体型衍生物的抗肿瘤作用与NO释放有关。
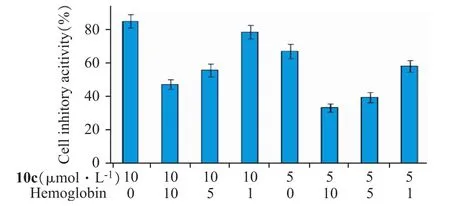
图4 Homoglobin对NO供体型吉西他滨衍生物10c活性抑制
3.4 构效关系研究
根据 NO供体型吉西他滨衍生物 9a~9e和10a~10e抗肿瘤活性发现,连接链的长短和Boc基团对偶联物的抗肿瘤活性有较大影响。例如,在不同链长的二醇化合物中,发现链长为3~4个碳链较其它长度的连接片段具有更强的体外抗肿瘤活性;此外,发现脱保护的化合物10a~e的体外抗肿瘤活性明显强于未脱保护的化合物9a~9e。
4 小 结
本研究设计合成了一系列NO供体型吉西他滨衍生物9a~9e和10a~10e,体外抗肿瘤实验表明,大部分化合物具有较强的抗肿瘤活性,尤其是化合物10c不仅展现抗增殖活性强于吉西他滨,而且能释放高浓度的NO。NO清除剂hemoglobin能够明显降低了10c对HepG2细胞近50%的抑制率,表明NO供体型衍生物发挥体外抗肿瘤活性与高浓度的NO释放密切相关。
[1] Jordheim LP,Durantel D,Zoulim F,et al.Advances in the development of nucleoside and nucleotide analogues for cancer and viral diseases[J].Nat Rev Drug Discov, 2013,12(6):447-64.
[2] Hertel LW,Kroin JS,Misner JW,et al.Synthesis of 2-Deoxy-2,2-difluoro-D-ribose and 2-Deoxy-2,2-diflu-oro-D-ribofuranosyl Nucleosides[J].J Org Chem,1988, 53(11):2406-9.
[3] Manegold C.Gemcitabine (Gemzar)in non-small cell lung cancer[J].Expert Rev Anticancer Ther,2004,4(3): 345-60.
[4] Heinemann V.Gemcitabine in metastatic breast cancer [J].Expert Rev Anticancer Ther,2005,5(3):429-43.
[5] Carmichael J,Fink U,Russell RC,et al.PhaseⅡ study of gemcitabine in patients with advanced pancre-atic cancer[J].Br J Cancer,1996,73(1):101-5.
[6] Ozols RF.Gemcitabine and carboplatin in second-line ovarian cancer[J].Semin Oncol,2005,32(1):S4-8.
[7] Khaled HM,Shafik HE,Zabhloul MS,et al.Gemc-itabine and cisplatin as neoadjuvant chemotherapy for invasive transitional and squamous cell carcinoma of the bladder:effect on survival and bladder preservation [J].Clin Genitourin Cancer,2014,12(1):e233-40.
[8] Moysan E,Basttiat G,Benoit JP.Gemcitabine versus Modified Gemcitabine:a review of several promising chemical modifications[J].Mol Pharm,2013,10(1): 430-44.
[9] Han HK,Amidon GL.Targeted prodrug design to opti-mize drug delivery[J].AAPS Pharm Sci,2000,2(1):E6.
[10] Stella VJ.Prodrugs:Some thoughts and current issues [J].J Pharm Sci,2010,99(12):4755-5.
[11] Pratt SE,Durland-Busbice S,Shepard RL,et al.Hu-man carboxylesterase-2 hydrolyzes the prodrug of gemcitabine (LY2334737)and confers prodrug sensi-tivity to cancer cells[J].Clin Cancer Res,2013,19 (12):1159-68.
[12] Wickremsinhe E,Bao J,Smith R,et al.Preclinical absorption,distribution,metabolism,and excretion of an oral amide prodrug of gemcitabine designed to de-liver prolonged systemic exposure[J].Pharmaceutics, 2013,5(2):261-76.
[13] Gupta A,Asthana S,Konwar R,et al.An insight into potentialofnanoparticles-assisted chemotherapy of cancer using gemcitabine and its fatty acid prodrug:a comparative study[J].J Biomed Nanotechnol,2013,9 (5):915-25.
[14] Fukumura D,Kashiwagi S,Jain RK.The role of nitric oxide in tumour progression[J].Nat Rev Cancer,2006, 6(7):521-34.
[15] Bonavida B,Baritaki S,Huerta-Yepez S,et al.Novel therapeutic applications of nitric oxide donors in can-cer:roles in chemo- and immunosensitization to apoptosis and inhibition of metastases[J].Nitric Oxide, 2008,19(7):152-7.
[16] Hirst D,Robson T.Targeting nitric oxide for cancer therapy[J].J Pharm Pharmacol,2007,59(1):3-13.
[17] Ling Y,Ye X,Zhang Z,et al.Novel nitric oxide-re-leasing derivatives of farnesylthiosalicylic acid:synthe-sis and evaluation of antihepatocellular carcinoma ac-tivity[J].J Med Chem,2011,54(1):3251-9.
[18] Maksimovic-Ivanic D,Mijatovic S,Harhaji L,et al. Anticancer properties of the novel nitric oxide-donat-ing compound(S,R)-3-phenyl-4,5-dihydro-5-isoxazoleacetic acid-nitric oxide in vitro and in vivo[J].Mol Cancer Ther,2008,7(3):510-20.
[19] Huang Z,Zhang Y,Zhao L,et al.Synthesis and an-ti-human hepatocellular carcinoma activity of new ni-tric oxide-releasing glycosyl derivatives of oleanolic acid[J].Org Biomol Chem,2010,8(3):632-9.
[20] Chen L,Zhang Y,Kong X,et al.Design,synthesis, and antihepatocellular carcinoma activity of nitric ox-ide releasing derivatives of oleanolic acid[J].J Med Chem,2008,51(15):4834-8.
[21] Tarpey MM,Fridovich I.Methods of detection of vas-cular reactive species nitric oxide,superoxide,hydro-gen peroxide,and peroxynitrite[J].Circ Res,2001,89 (3):224-36.
[22] Megson IL,Webb DJ.Nitric oxide donor drugs:cur-rent status and future trends[J].Expert Opin Investig Drugs,2002,11(5):587-601.
·资讯概览·
2015年3月美国FDA公布的药品安全信息
1 FDA要求限制睾酮药物的使用,警惕其心血管风险
FDA认为,睾酮治疗对于年龄相关的低睾酮水平男性并不合适,因为它可能与心血管事件风险增加相关。
FDA当局要求修改所有睾酮类产品的药品标签,明确它们的合理使用范围。FDA同时警告称“任何使用这种激素的患者都存在心脏病发作和中风风险增加的可能性”。睾酮仅被批准用于特殊疾病状况的男性,但现在这类疗法被超标签地用于年龄相关的低睾酮水平男性患者中已是一种普遍情况。
低睾酮(low testosterone)即“Low T”处方量在过去10年来猛涨,这主要是由于与年龄增长相关的低睾酮水平中年男性对这类处方药使用量的增加所致。随着年龄增长,睾丸功能减退,导致男性睾酮水平逐渐下降。低睾酮的症状包括性欲减退、肌肉质量下降、疲劳及抑郁。
根据FDA公布的数据,从2009至2013年,处方睾酮药物的男性患者数量激增75%至230万例,其中70%患者年龄在40~64岁之间。FDA此次发布的条令,将禁止制药商在年龄相关性低睾酮群体中营销或推广其产品。
根据从研究和FDA顾问委员会所获得的证据,FDA认为使用睾酮类产品可能会增加心血管风险。这些研究包括了老年男性使用睾酮治疗。有些研究认为使用睾酮治疗会增加心脏病、中风或死亡的风险,但也有些研究报告不这样认为。具体细节可查阅《FDA安全通告》的资料汇总。
FDA仅批准睾酮类药品用于替代治疗因睾丸、脑垂体或脑部疾病引起性腺机能减退而导致的睾酮水平低下。但该药品的实际使用范围被扩大为缓解因年龄因素导致睾酮水平降低而产生的症状——而这种用法的效益和安全性还有待研究。
FDA建议医疗专业人员仅对由于疾病因素导致的、并且经过实验室检查确定的睾酮水平低下的男性患者使用睾酮类产品。在决定开始或继续使用睾酮类产品时,应让患者知道可能会增加心血管风险。患者在使用该类产品后出现心脏病或中风的症状时应立即就医,如:胸痛、呼吸急促或呼吸困难、身体部分或一侧无力,或口齿不清。
2 戒必适(瓦伦尼克林,Chantix)或与癫痫和降低酒精耐受性相关
FDA发出警示,凭处方销售的戒烟药戒必适(瓦伦尼克林)可能会改变使用者对酒精的耐受性。戒必适与酒精的相互作用会导致一些人醉酒加重,有时会伴有攻击性行为和(或)健忘。另外,有报道称极少数患者在使用戒必适治疗时出现癫痫。FDA已要求戒必适修改标签,加入上述风险的警告内容。
戒必适是FDA批准用于帮助成人戒烟的处方药。该药由美国辉瑞公司生产,于2006年被FDA批准上市。此前,FDA已要求厂家更新过标签说明,并附带了一份黑框警告说明,突出说明了该药物对神经、精神方面的潜在副作用,包括自杀念头、攻击性和焦虑。
医疗专业人员在给患者使用戒必适之前,应权衡癫痫的风险和潜在的收益,尤其对有癫痫史或其他因素可能降低癫痫发作阈的患者。应告知患者在使用戒必适期间感觉烦乱、产生敌意、有攻击性行为,情绪低落、行为或想法与往常不同、有自杀的想法或行为时需立即停药。
除非清楚戒必适对其酒精耐受的影响程度,患者都应该减少酒精的摄入量。当患者使用戒必适期间发生癫痫,应立即停药并进行治疗。
(由江苏省药品不良反应监测中心提供)
Synthesis and Biological Evaluation of Nitric Oxide-releasing Hybrids of Gemcitabine and Phenylsulfonyl Furoxans as Anti-tumor Agents*
LI Xiang-hua1,WANG Xue-min2,XU Chen-jun2, HUANG Jun-kai1,HE Li-qin1**,LING Yong2*
1Anhui Key Laboratory of Traditional Chinese Medicine,Anhui University of Chinese Medicine, Hefei 230031,China;2School of Pharmacy,Nan-tong University,Nantong,226001,PR China
A series of novel gemcitabine derivatives 9a-9e and 10a-10e were designed and synthesized by coupling phenylsulfonyl furoxans with gemcitabine through various diol linkers,and their biological activities were evaluated in vitro. Compounds 9b-9d and 10b-10d exhibited more potentanticanceractivities.Especially,compound 10c showed excellentanti-proliferative activities (IC50=2.44-3.57 μmol·L-1)which were better than gemcitabine(IC50=3.87-7.52 μmol·L-1).However,the inhibitory rates of 10c partially reduced by pretreatment with hemoglobin,demonstrating that their anticancer activities were associated with their NO release.
Nitric oxide;Phenylsulfonyl furox-ans;Gemcitabine;Anti-tumor activity
R914.5;R979.1
A
1673-7806(2015)02-097-07
国家自然科学基金(No.81302628);安徽省教育厅自然科学重点科研项目(No.KJ2013A168);江苏省自然科学基金(No.BK2011389)
李祥华,男,硕士生 E-mail:lixianghua28@yeah.net
**通讯作者何黎琴,女,教授 E-mail:Hlq661125@126.com凌勇,男,副教授 E-mail:lyyy111@sina.com
2015-03-02
2015-03-20
