改良的苯酚-硫酸法测定蛹虫草多糖含量
2015-03-01阴婉婷
阴婉婷, 李 彤, 马 辰
(中国医学科学院北京协和医学院药物研究所,北京 100050)
改良的苯酚-硫酸法测定蛹虫草多糖含量
阴婉婷, 李 彤*, 马 辰
(中国医学科学院北京协和医学院药物研究所,北京 100050)
[目的]改良苯酚-硫酸法测定蛹虫草多糖含量。[方法]采用水提醇沉法制备多糖沉淀并溶解成供试品溶液。精密量取供试品溶液和葡萄糖对照溶液各1.0 ml,分别置10 ml具塞试管中,加1.0 ml水,缓慢加入7.0 ml浓硫酸,摇匀,恒温放置1 h,加入1.0 ml 4%苯酚溶液,摇匀,40 ℃水浴35 min后冰水浴5 min,取出放置20 min,在487 nm处测定吸光度,计算多糖含量。[结果]该方法在10.26~102.55 μg葡萄糖的回归方程为Y=0.013 9X+0.007(r=0.999 9);平均回收率为97.7%(RSD=2.3%),精密度试验和重复性试验的RSD分别为1.4%和2.7%。不同来源蛹虫草多糖含量在1.21%~4.70%。[结论]该方法显色稳定、准确可靠、重复性好、灵敏度高,可测定蛹虫草多糖含量并为蛹虫草质量研究提供依据。
蛹虫草;多糖;苯酚-硫酸法;含量测定
蛹虫草(CordycepsmilitarisLink),别名北冬虫夏草、北虫草。蛹虫草化学成分与冬虫夏草相似,含有虫草素、虫草酸、多糖等有效成分,以及多种对人体有益的物质,如氨基酸、维生素、无机元素和超氧化物歧化酶(SOD)等,其中,虫草素和SOD在蛹虫草中的含量高于冬虫夏草,无机元素种类与冬虫夏草基本一致且含量丰富。蛹虫草能够降低血脂,保护心、脑组织,同时,具有调节免疫、抗氧化、抗衰老、抗肿瘤的作用,且安全无毒,可以作为冬虫夏草的代用品[1]。蛹虫草在新药研究和保健品开发方面有重大价值,且人工栽培已获成功,其质量控制是必不可少的内容。由于虫草多糖有广泛的生物活性[2],如抗肿瘤、降血糖、抗氧化,且蛹虫草的免疫调节作用也主要与虫草多糖有关,因此,测定虫草多糖含量可以为蛹虫草质量控制提供依据。苯酚-硫酸法是测定多糖含量的经典方法之一[3-4],但对显色条件的要求较为严格[4],操作难度较大,笔者通过改变显色剂苯酚与浓硫酸的加入顺序,显著提高了蛹虫草多糖含量测定方法的稳定性、可操作性和检测灵敏度。
1 材料与方法
1.1 材料
1.1.1仪器。He λ ios α紫外-可见分光光度计(Thermo Spectronic);RE-52AA水浴锅(上海振捷实验设备有限公司);XMTD-6000水浴锅(北京市长风仪器仪表公司);XP205型电子天平(瑞士梅特勒-托利多公司);CP224S型电子天平(德国赛多利斯公司);DT5-2型低速台式离心机(北京时代北利离心机有限公司);KH-500B型超声波清洗器(昆山禾创超声仪器有限公司);DZF-6020型真空干燥箱(上海一恒科技有限公司,上海益恒实验仪器有限公司)。
1.1.2试剂。硫酸(北京化工厂),苯酚(北京化学试剂二厂),葡萄糖(北京化学试剂公司),无水乙醇(北京化工厂),以上试剂均为分析纯;娃哈哈纯净水。
1.1.3蛹虫草样品。由不同生产厂家提供,分别编号为样品1、样品2、样品3、样品4、样品5、样品6、样品7和样品8。
1.2 方法
1.2.1对照品溶液的制备。取葡萄糖适量,精密称定,加水溶解并稀释制成每1 ml含0.2 mg的溶液,作为对照品储备液。精密量取5 ml对照品储备液置25 ml量瓶,加水稀释制成每1 ml含40 μg葡萄糖的对照品溶液。
1.2.2供试品溶液的制备。蛹虫草样品在60 ℃下干燥12 h,粉碎,过60目筛。取样品约0.5 g,精密称定,加入纯净水50 ml,称重。90 ℃水浴回流提取2 h,冷却后补重。4 000 r/min离心10 min,取上清液2.0 ml,加入无水乙醇8 ml,冰箱冷藏48 h,沉淀多糖。4 000 r/min离心90 min,倾出上清液,其沉淀用水溶解,定量转移至5 ml容量瓶中,定容至刻度,摇匀,作为样品储备溶液。测定其吸光度后,将其稀释制成适当浓度的样品溶液以备测定,或将同法制得的沉淀定量转移至适当容积的量瓶中,制成浓度合适的供试品溶液。
1.2.3测定波长的选择。精密量取葡萄糖对照溶液1.0 ml置10 ml具塞试管中,加1.0 ml水,缓慢加入7.0 ml浓硫酸,摇匀,恒温放置1 h,加入4%苯酚溶液1.0 ml,摇匀,40 ℃水浴35 min后冰水浴5 min,取出放置20 min。另取2.0 ml水,置10 ml具塞试管中,自“缓慢加入7.0 ml浓硫酸”起,同上平行操作,作为空白对照。于200~700 nm扫描,以最大吸收波长为测定波长。
1.2.4显色条件的优化。按照“1.2.3”项的显色及测定条件,进行单因素试验,分别优化各显色条件。①加入不同体积苯酚溶液0.4、0.6、0.8、1.0、1.2 ml;②分别加入浓硫酸4.0、5.0、6.0、7.0、8.0 ml;③加入浓硫酸后放置不同时间10、20、30、45、60、120、180 min;④加入浓硫酸后,反应温度分别为10、20、25、30 ℃;⑤加入苯酚后,分别在20、40、60、80 ℃温度下显色35 min;⑥加入苯酚后,于40 ℃分别显色15、20、25、30、35、40、45 min。测定各显色条件下的吸光度,确定最佳显色条件。
1.2.5方法学考察。
1.2.5.1标准曲线的绘制。精密量取对照品储备液适量,加水分别稀释成10、20、40、60、80、100 mg/L葡萄糖溶液,精密量取上述葡萄糖溶液各1.0 ml,置10 ml具塞试管中,在最佳条件下显色并测定吸光度。以葡萄糖质量(μg)为横坐标、吸光度为纵坐标,绘制标准曲线。
1.2.5.2精密度试验。将样品1多糖沉淀定量转移至25 ml量瓶,加水溶解并定容、摇匀,制得供试品溶液。精密量取供试品溶液1.0 ml,在最佳条件下显色并测定吸光度,平行测定6次。
1.2.5.3稳定性试验。精密量取“1.2.5.2”项供试品溶液1.0 ml,在最佳条件下显色并测定吸光度,每5 min测定一次,连续测定2 h。
1.2.5.4回收率试验。精密量取“1.2.5.2”项供试品溶液0.5 ml置10 ml具塞试管中,低、中、高浓度组分别精密加入葡萄糖对照品溶液适量,每组平行3份,加水至2 ml。在最佳条件下显色并测定吸光度,计算回收率。
1.2.5.5重复性试验。取6份样品1各0.5 g,精密称定,按照“1.2.2”项方法制备供试品溶液,在最佳条件下显色并测定吸光度,计算多糖含量及RSD。
1.2.6蛹虫草样品多糖含量测定。按照“1.2.2”项方法分别制备蛹虫草样品1、样品2、样品3、样品4、样品5、样品6、样品7和样品8的供试品溶液(n=3),在最佳条件下显色并测定吸光度,计算多糖含量。
2 结果与分析
2.1 测定波长的选择按照“1.2.3”项方法显色并扫描200~700 nm的吸光度,在487 nm处有最大吸收,确定487 nm为测定波长。
2.2 显色条件的优化
2.2.1苯酚用量的选择。加入苯酚溶液0.4、0.6、0.8、1.0、1.2 ml时的吸光度分别为0.433、0.504、0.530、0.541、0.543。吸光度随苯酚用量增加而增加,用量1.0 ml与1.2 ml的吸光度变化不大,确定1.0 ml为苯酚用量。
2.2.2浓硫酸用量的选择。加入浓硫酸4.0、5.0、6.0、7.0、8.0 ml时的吸光度分别为0.190、0.346、0.474、0.588、0.525。加入7.0 ml浓硫酸时吸光度最大,确定7.0 ml为浓硫酸用量。
2.2.3加入硫酸后放置时间的考察。加入浓硫酸后分别放置10、20、30、45、60、120、180 min,吸光度分别为0.468、0.512、0.525、0.538、0.546、0.551、0.560。吸光度在60 min后基本不变,确定放置60 min。
2.2.4加入硫酸后放置温度的考察。加入浓硫酸后于10、20、25、30 ℃放置,吸光度分别为0.567、0.531、0.524、0.488。可见吸光度随放置温度的升高而降低,故应保持放置中温度的恒定。
2.2.5显色温度的选择。加入苯酚后,分别在20、40、60、80 ℃温度下显色35 min,测得吸光度分别为0.537、0.589、0.546、0.481。在40 ℃时吸光度最高且稳定,确定40 ℃为显色温度。
2.2.6显色时间的选择。加入苯酚后,分别考察40 ℃显色15、20、25、30、35、40、45 min的吸光度,结果表明,35 min后,吸光度稳定,确定显色时间为35 min。
2.3 方法学考察以葡萄糖质量(μg)为横坐标、吸光度为纵坐标,绘制标准曲线,回归方程为Y=0.013 9X+0.007(r=0.999 9),表明葡萄糖在10.26~102.55 μg线性关系良好。供试品溶液平行测定6次,RSD=1.4%,表明精密度良好。显色后溶液在2 h内吸光度稳定,平均回收率为97.7%,RSD为2.3%(表1),表明回收率满足要求。样品1多糖含量RSD为2.7%(n=6),表明重复性良好。
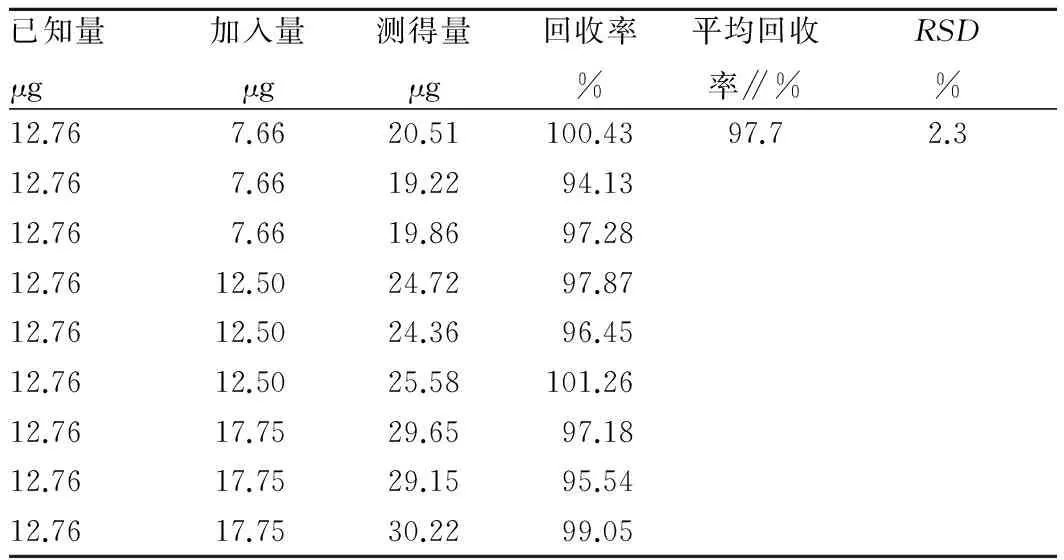
表1 回收率试验结果
2.4 蛹虫草样品多糖含量经测定,蛹虫草样品1、样品2、样品3、样品4、样品5、样品6、样品7和样品8的多糖含量分别是3.21%、3.68%、2.03%、2.59%、1.96%、1.21%、1.23%和4.70%。
3 讨论
按照标准的多糖含量测定方法[3],精密量取40 mg/L葡萄糖对照溶液1.0 ml,先加入适量苯酚溶液(0.2、0.6、1.0、1.4、1.8 ml),后加入浓硫酸混匀,分别测定吸光度。吸光度随苯酚用量增加而增加,且变化较大,表明苯酚溶液量的较小变化会对吸光度产生较大影响。苯酚-硫酸法测定多糖含量的机制是多糖在浓硫酸作用下水解成单糖并迅速脱水,生成糠醛衍生物,进而与苯酚缩合成有色化合物。由于苯酚含有强致活基团酚羟基,很容易与浓硫酸发生磺化反应[5],推测浓硫酸与糠醛衍生物竞争苯酚。该试验改变显色剂浓硫酸和苯酚的加入顺序:先向糖溶液中加入浓硫酸,充分生成糠醛衍生物,再加入苯酚溶液,产物稳定。结果表明,改良后的方法灵敏度显著提高,测定方法重现性好。
该试验研究过程中发现经典的苯酚-硫酸法对各个显色条件要求均较为严格,若达不到要求,会影响结果的重复性,所以,该方法操作难度较大,与纪宝玉等报道[4]一致。改良后的方法,使每一步反应完全,吸光度较为稳定,易于得到良好的精密度和重复性,因此,改良后的方法对放置时间和显色时间的要求较为宽松,这使方法的可操作性大大提高。
改良后的苯酚-硫酸法显色稳定,精密、准确,重现性好,且灵敏度显著提高,这有利于低浓度供试品溶液的分析,扩大了可分析的样品范围。该方法可用于蛹虫草多糖含量的测定。
[1] 王建芳,杨春清.蛹虫草有效成分及药理作用研究进展[J].中医药信息,2005,22(5):30-32.
[2] 王普,郑明,何军邀,等.虫草多糖的化学结构及药理活性研究进展[J].浙江工业大学学报,2010,38(2):129-133,172.
[3] 中华人民共和国农业部.中华人民共和国农业行业标准 食用菌中粗多糖含量的测定 NY/T 1676-2008[S].北京:中国农业出版社,2008.
[4] 纪宝玉,裴莉昕,陈随清,等.葛根不同生长期多糖含量的动态积累研究[J].中国实验方剂学杂志,2013,19(16):63-65.
[5] 邢其毅,裴伟伟,徐瑞秋,等.基础有机化学,下册[M].3版.北京:高等教育出版社,2005:837.
Determination of Polysaccharides inCordycepsmilitarisLink by Improved Phenol-sulfuric Acid Method
YIN Wan-ting, LI Tong*, MA Chen
(Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050)
[Objective] To determine polysaccharides inCordycepsmilitarisLink by improved phenol-sulfuric acid method. [Method] Prepare polysaccharides by water-extraction and alcohol-precipitation method and dissolve the polysaccharides in water to obtain the sample solution. Transfer accurately measured 1.0 ml of sample solution and glucose reference solution to 10 ml volumetric test tubes, respectively. To each tube, add 1.0 ml of water and slowly add 7.0 ml of sulfuric acid with the stream of acid being directed against the tube wall and shake each tube immediately upside down, then allow it to stand for 1 h at constant temperature. Add 1.0 ml of 4% phenol aqueous solution and shake and keep every tube in water bath at 40 ℃ for 35 min, then cool it in ice-water bath for 5 min. About 20 min after ice-water bath, measure the absorbance at the wavelength of 487 nm and calculate the content of polysaccharides inCordycepsmilitarisLink. [Result] The regression equation of absorbance(Y) and glucose mass(X) wasY=0.013 9X+0.007 (r=0.999 9) in the range of 10.26-102.55 μg of glucose; the average recovery was 97.7%(RSD=2.3%); the RSDs obtained in precision and repeatability experiments were 1.4% and 2.7%, respectively. The polysaccharides content inCordycepsmilitarisLink from different sources ranged from 1.21% to 4.70%. [Conclusion] The improved phenol-sulfuric acid method had higher sensitivity than before and stable color and good accuracy and repeatability, and therefore could be applied to determine polysaccharides inCordycepsmilitarisLink and provided reference for quality control ofCordycepsmilitarisLink.
CordycepsmilitarisLink; Polysaccharides; Phenol-sulfuric acid method; Content determination
“重大新药创制”科技重大专项(2012ZX09301002-001)。
阴婉婷(1990- ),女,山西运城人,硕士研究生,研究方向:药物分析。*通讯作者,主管技师,从事药物分析研究。
2014-12-17
S 567
A
0517-6611(2015)04-117-02
