猪细小病毒河南分离株全基因组克隆及序列分析
2015-03-01陈龙彪高晓云吴宇阳冯亚琼陈红英崔保安马世杰郭官鹏
陈龙彪, 高晓云, 吴宇阳, 冯亚琼, 陈红英, 崔保安, 马世杰, 郭官鹏
(河南农业大学牧医工程学院,河南郑州 450002)
猪细小病毒河南分离株全基因组克隆及序列分析
陈龙彪, 高晓云, 吴宇阳, 冯亚琼, 陈红英, 崔保安*, 马世杰, 郭官鹏
(河南农业大学牧医工程学院,河南郑州 450002)
[目的]进一步了解河南地区猪细小病毒(PPV)的变异特点。[方法]利用PCR方法,对河南郑州、周口、济源等地采集的疑似PPV感染的病料进行检测。PCR检测为阳性的病料经处理后,同步接种猪睾丸细胞盲传6代,对4株PPV全基因组进行分段克隆及测序,并与GenBank登录的国内外PPV流行株全基因组进行比较。[结果]获得的4株PPV全基因组序列全长均为4 679 bp。4个毒株之间的核苷酸同源性介于99.6%~99.8%,与其他毒株间核苷酸同源性为98%~100%,遗传进化较为稳定。[结论]为PPV在河南地区分子流行病学调查及遗传变异分析奠定了基础。
猪细小病毒;全基因组;克隆;序列分析
猪细小病毒(Porcine parvovirus,PPV)是引起母猪繁殖障碍的主要病原体之一,主要表现为胎儿和胚胎的感染和死亡。受感染母猪会产出死胎、畸形胎、木乃伊胎及病弱仔猪,而受感染母猪本身通常并不表现临床症状。仔猪会出现生长受阻,同时伴有仔猪的皮炎和腹泻症状。感染公猪则表现为精液品质下降。PPV 又常同猪圆环病毒2型(PCV2)、猪瘟(CSFV)、猪繁殖与呼吸障碍综合征病毒(PRRSV)等混合感染而加重其危害[1]。同时,PPV对热极其稳定,对很多常用消毒剂都具有很强的抵抗力,因此污染的猪舍常是PPV的主要储藏所,导致该病的流行,给养猪业造成了巨大经济损失。
自1967年Cartwright等[2]首次从猪流产胎儿脏器中分离到PPV以来,各国猪群血清学调查阳性检出率都较高,我国血清学调查的阳性率为80%[3-5],其中有些猪场经产母猪和5日龄内仔猪PPV的HI阳性率高达99%~100%。我国先后在北京、上海、吉林、四川、浙江等地分离到多株PPV,这些PPV毒株虽然分离自不同地区,但都属于同一血清型。
近年来,因PPV感染而造成的危害呈上升趋势。为了解河南地区PPV的变异特点,笔者从河南郑州、周口、济源、焦作等地采集疑似感染PPV的病料中分离出4株PPV,测序4毒株的全基因组序列,并与GenBank登录的PPV参考毒株进行遗传进化分析,旨在为进一步分析PPV基因组的结构、功能以及PPV防控奠定基础。
1 材料与方法
1.1 组织病料及细胞株将2010~2012年从河南郑州、周口、济源、焦作等疑似PPV感染发病的猪中采集死胎胎衣及肝脏、脾脏、肺脏、淋巴结等组织,-80 ℃保存备用。猪睾丸(ST)细胞购自中国兽药监察所。
1.2 主要试剂TaqTM酶、蛋白酶 K、pMD-18载体等购自宝生物工程(大连)有限公司;琼脂糖购自Promega公司;DMEM培养液、胎牛血清和胰蛋白酶购自Solarbio公司;十二烷基硫酸钠(SDS)购自上海生物工程有限公司,其余试剂均为国产或进口分析纯。
1.3 引物的设计与合成参考GenBank已发表的PPV序列[6],设计并合成4对相互重叠的特异引物(表1)。引物由上海生工生物工程有限公司合成。
1.4 组织病料中PPV DNA的PCR检测将采集的死胎胎衣及肝脏、脾脏、肺脏、淋巴结等组织混合,剪碎后研磨成匀浆,按1∶5(W/V)加入灭菌PBS液,制成悬液,反复冻融3次后,融化,8 000 r/min离心10 min。取上清液200 μl,按常规的酚氯仿抽提法提取病毒DNA。利用PPV检测引物[7],PCR检测PPV DNA。取5 μl PCR产物用10 g/L琼脂糖凝胶(含0.5 μg/ml EB)进行电泳检测PCR的结果。
1.5 病毒的分离与培养将PCR检测为阳性的病料,剪成小块并研碎冻融3次,加入少量DMEM培养液稀释,5 000 r/min 离心10 min,在上清液中加入青霉素1 000 U/ml和链霉素1 000 U/ml,37 ℃作用2 h,经0.22 μm的细菌滤器过滤除菌。将处理后的病料按培养液量的10%同步接种到ST细胞中,置于5%CO237 ℃恒温培养箱中培养72 h。收获接毒细胞,反复冻融3次收集病毒,8 000 r/min离心30 min去除细胞碎片,此为第一代毒。盲传至ST细胞出现较稳定的细胞病变(CPE)时,按2%进行接毒[8],连续盲传至第6代。传代过程中,观察细胞病变,直至收获病毒,并用PPV检测引物,PCR检测PPV[8-9]。
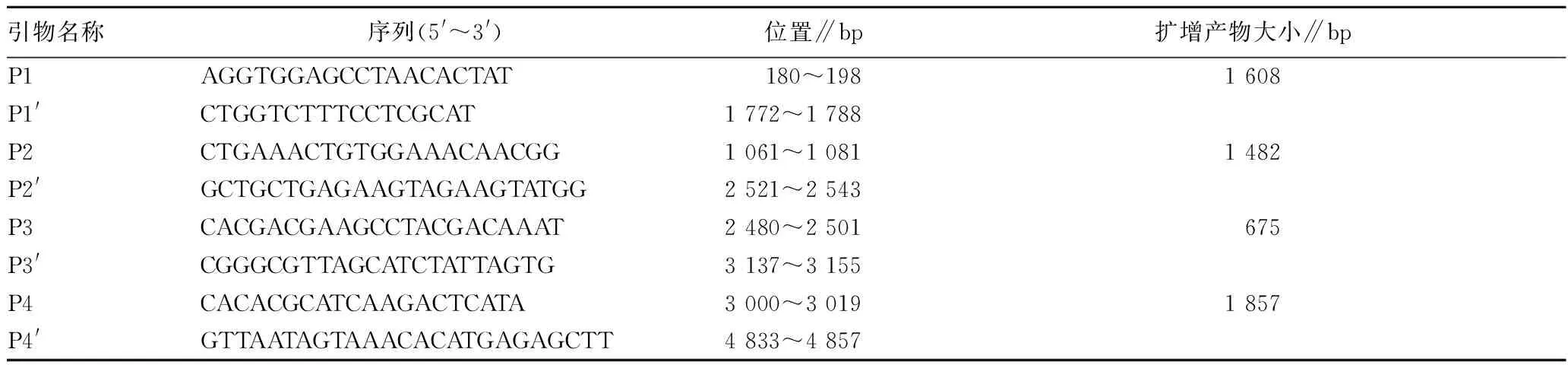
表1 所用引物
1.6 DNA片段的克隆、鉴定和测序将PPV分离株感染的ST细胞毒,冻融3次,12 000 r/min离心4 min。取上清,按“1.4”方法抽提细胞毒DNA。利用表1中PPV特异引物进行PCR扩增,将回收纯化的DNA片段克隆于pMD18-T载体中,转化至大肠杆菌DH5α感受态细胞。挑取单菌落接种到LB液体培养基中培养12~16 h。PCR和酶切鉴定为阳性的重组菌,送上海生工生物工程有限公司进行测序[10-12]。
1.7 PPV全基因组序列分析利用DNAstar软件包进行PPV全基因组序列拼接,并对PPV分离株全基因组序列及由ORF所推导的氨基酸序列与GenBank上读取的PPV参考毒株(表2)序列进行分析,分析它们之间的同源性及变异程度。

表2 PPV参考毒株的国家、采样时间、全基因组长度及登录号
2 结果与分析
2.1 PPV的细胞培养将PCR检测为PPV阳性的郑州、周口、济源、焦作等地组织匀浆液接种ST细胞,盲传6代,分离到4株PPV。从各代次中均检测出PPV特异性的目的片段,而正常ST细胞核酸为模板进行PCR扩增,结果为阴性。表明病毒已适应ST细胞。将分离出的4株PPV分别命名为G、H、I和K。
2.2 PPV基因组的克隆与序列测定用所设计的4对引物P1/P2、P3/P4、P5/P6和P7/P8进行PCR扩增,电泳结果显示,分别扩增出约1 600、1 500、700和1 900 bp的条带(图1),与预期扩增产物大小相符。每个分离株4个基因片段大小分别为1 608、1 482、675和1 857 bp,与预期产物大小一致。经拼接获得的4个分离株全基因组序列均为4 679 bp。所测序列已上传NCBI,获得序列登录号分别为KF429252、KF429253、KF429254、KF429255。
2.3 PPV全基因组序列分析利用DNAstar软件,将4株PPV与GenBank收录的具有代表性的PPV全序列进行序列分析。4个分离株之间的核苷酸同源性为99.6%~99.8%,所有PPV株基因组间核苷酸同源性在98%~100%。由图2可知, I和K株与NADL-2(M38367.1、NC_001718.1)株、中国分离株JT(JN968975.1)的亲缘关系较近,而G株和H株与广西分离株N(HM989009.1)亲缘关系较近(图2)。
2.4 PPV NS1基因及推导的氨基酸分析利用DNAstar软件将PPV NS1基因及所推导的氨基酸序列进行比对,并绘制进化树。所有PPV株NS1基因核苷酸序列同源性位于98.1%~100%。4株分离株处于同一分支,与NADL-2株的亲缘关系较近(图3)。其推导的氨基酸序列同源性在98.2%~100%,仅存在个别氨基酸差异:G、I、K株在59位N→D,K株在155位S→G,I株在173位K→E,G、H、I株在513位N→H。
2.5 PPV VP1基因及推导的氨基酸分析利用DNAstar软件将PPV各毒株的VP1基因及所推导的氨基酸序列进行比对。结果发现,所有PPV株VP1基因核苷酸序列同源性位于98.6%~100%,推导的氨基酸序列同源性在98.%~100%。与参考毒株NADL-2相比,4株PPV与一些PPV毒株相同,在219、318、539、730和739位点发生氨基酸置换(219-→Y,318R→S,539-→L,730L→I和739K→E),而分离株在37、352和388等位点出现了独特的突变(表3中斜体下划线标示),但无一定规律性。

表3 PPV各毒株VP1蛋白的氨基酸差异
接下表
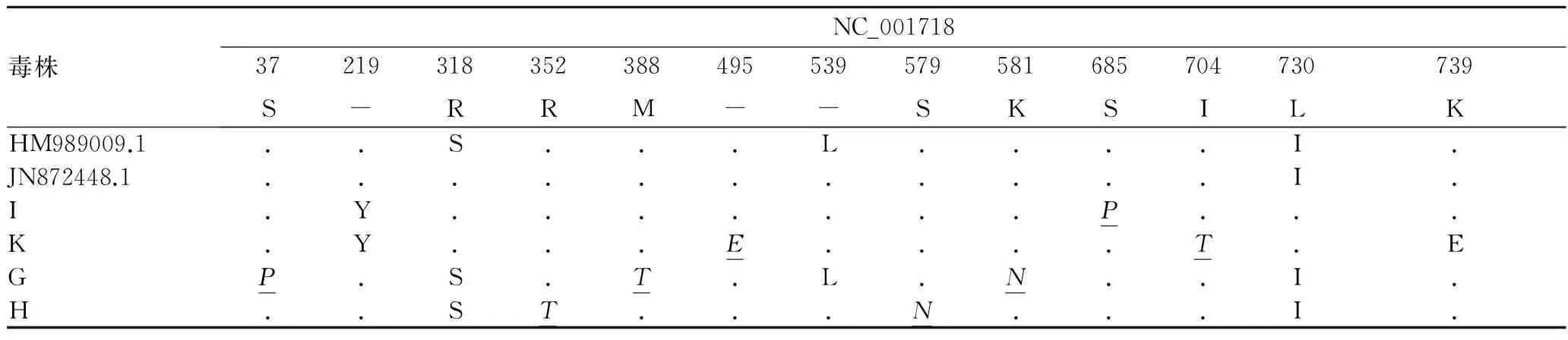
续表3
注:与参考毒株NADL-2 (NC_001718)的氨基酸序列相比,相同的用“.”做标记,不编码氨基酸的位点用“-”表示。
2.6 VP2基因及推导的氨基酸分析利用DNAstar软件将各分离株的VP2基因及所推导的氨基酸序列进行比对。结果发现,所有PPV株VP2基因核苷酸同源性位于98.3%~100%,变异较小,没有发生插入或移位突变,仅存在点突变。其推导的氨基酸序列同源性在97.1%~100%,突变位点在45S→T,144E→A,378G→D,555N→K,565K→R较为一致。而分离株在其他位点,如178、214、320等位点出现了独特的突变(表4中斜体下划线标示),但无一定规律性。
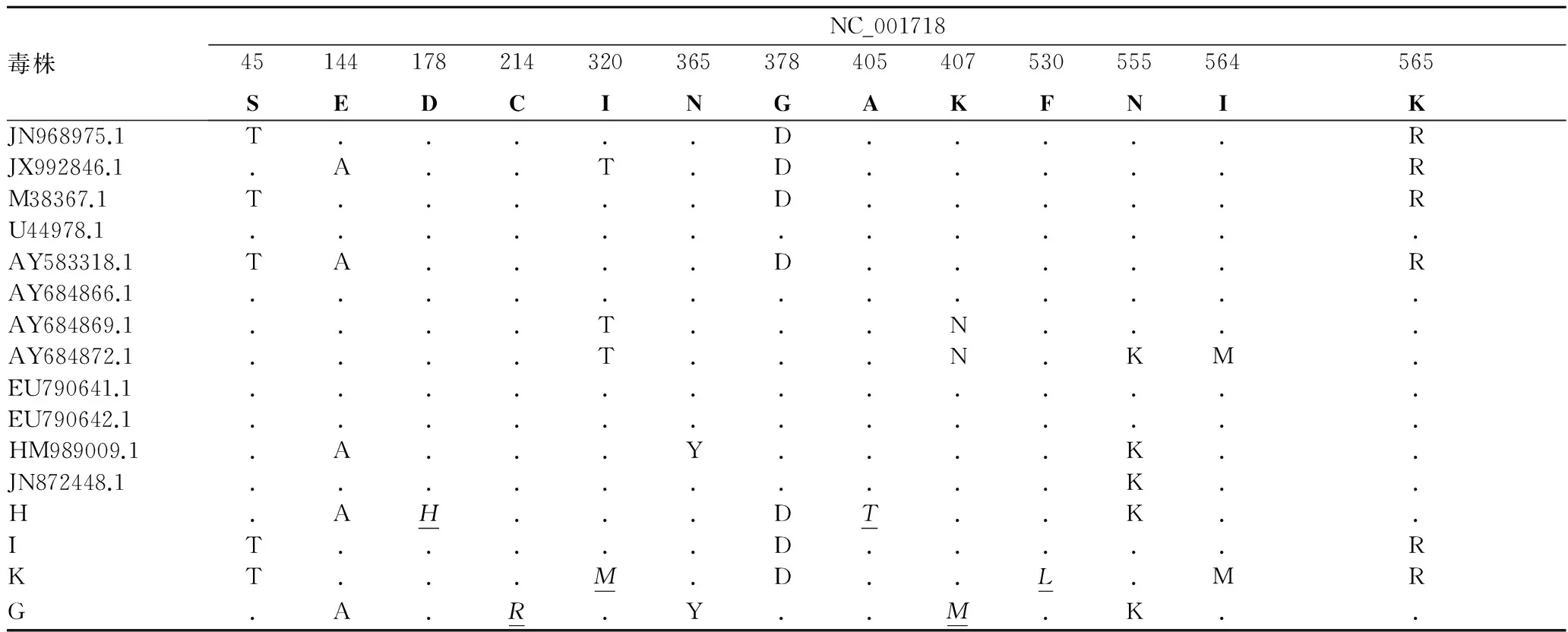
表4 PPV各毒株VP2蛋白的氨基酸差异
注:与参考毒株NADL-2 (NC_001718)的氨基酸序列相比,相同的用“.”做标记,不编码氨基酸的位点用“-”表示。
3 讨论
猪细小病毒全长约5 000 bp,成熟的粒子只含有负链DNA。PPV与其他自主性细小病毒相似,两端均有发夹结构,3′端的102nt的回文序列被其中的2个10nt的短回文序列中断,折叠形成Y型结构;5′端有一个127nt的回文序列,中间被一个24nt的短回文序列中断,折叠形成U型结构[13]。这种复杂的末端结构导致PCR方法只能对PPV的编码基因进行扩增。一般认为细小病毒都较保守,而按照实验室建立的PPV检测和分离鉴定方法得到的这4个分离株在核苷酸序列上同其他毒株差别不大,该研究结果证实了这一点。但基于遗传和变异的特性,即使很细微的点突变长期积累下来也会造成较大的变化。
近年来对于PPV的研究主要集中于结构蛋白VP2和非结构蛋白NS1上,对于其他基因的研究很少,而研究表明其他部分基因在PPV的复制、传播过程中同样起着至关重要作用。其中非结构蛋白NS1在病毒DNA的复制中起着重要作用,是病毒基因组本身编码的反式激活蛋白,对病毒的早期和晚期转录都发挥着重要的调节作用,起始病毒DNA的复制,与细小病毒的组装密切相关。从NS1蛋白的核苷酸序列进化树可以看出,这4株PPV的NS1蛋白在一个分支上,相似性非常高,符合其应具有的高度保守性。而对NS2和NS32这2个非结构蛋白的报道较少,因此其功能尚不清楚。
结构蛋白VP1、VP2和VP3共同构成了病毒的核衣壳,其中VP1可能在病毒从细胞外转移到细胞内起作用,据报道抗VP1血清抗体保护率(100%)比VP2、VP3血清抗体(保护率50%~70%)具有更强的中和病毒能力[14]。而VP2蛋白是主要结构蛋白,也是主要的保护性抗原,在体外表达后不仅有良好的免疫原性而且可以自我装配成病毒样颗粒,将该颗粒接种动物后能诱导产生强烈的免疫应答反应[15]。VP3通常认为是VP2翻译后切割加工的产物。通过对VP1和VP2基因序列以及氨基酸序列的分析可以发现,该次获得的4株PPV基因变异不大,没有出现一定规律的突变点,符合PPV病毒的保守性特点,而VP1蛋白和VP2蛋白核苷酸序列进化树形态较为相似:I、K株同NADL-2 (美国,M38367.1、NC_001718.1)弱毒侏关系较近,而G、H株同N(中国广西,HM989009.1)关系较近。同时4株分离株都具有VP1/VP2终止子处的两段完整127 bp重复单元,符合PPV弱毒的特征[13]。但从2种蛋白的推导氨基酸进化树上可以看出,尽管核苷酸序列的相似度较高,但氨基酸序列的差异较大。由此可见,PPV的变异应属于基因漂移而发生的改变,与地域及药物选择没有直接的相关性,而对于PPV基因漂移对抗原性的影响还有待进一步研究[16]。
[1] STRAW B W.猪病学[M].9版.北京:中国农业大学出版社,2008.
[2] CARTWRIGHT S F,LUCAS M,HUCK R A.A small haemagglutinating porcine DNA virus.I.Isolation and properties [J].J Comp Pathol,1969,79(3):371-377.
[3] 杨作丰.猪细小病毒研究现状及综合防控[J].现代畜牧兽医,2013(3):40-41.
[4] 张朝阳.猪细小病毒感染及其防制[J].中国畜牧兽医,2006,33(12):86-89.
[5] 赵光伟,杜桂娇,张超,等.川渝地区患病猪群中细小病毒感染情况的调查与分析[J].中国动物检疫, 2010, 27(2):42,48.
[6] 张宇.猪细小病毒SR-1株全基因测序研究[D].雅安:四川农业大学,2006.
[7] 吴宇阳,陈龙彪,王林青,等.猪圆环病毒2型和猪细小病毒混合感染的PCR检测[J].安徽农学通报, 2013,19(4):129,147.
[8] 谢巧,李春华.猪细小病毒分子生物学诊断技术及基因工程疫苗的研究进展[J].畜牧与兽医,2010,42(2):92-96.
[9] 赵俊龙,陈焕春,吕建强,等.猪细小病毒PCR检测方法的建立与应用[J].中国预防兽医学报,2003,23(2):142-144.
[10] 时乐,黄勇,许信刚,等.猪细小病毒YL株序列分析及其VP2基因原核表达[J].西北农业学报,2012,21(6):6-12.
[11] 郭东辉,王超群,王建辉,等.猪细小病毒HNZM-01株NS1基因的克隆及序列分析[J].河南农业科学,2012,41(3):137-141.
[12] 苏乾莲,李斌,赵武,等.猪细小病毒自然弱毒N株非结构蛋白NS1基因原核表达[J].广西农业科学,2010,41(7):710-713.
[13] 崔尚金,戚亭.猪细小病毒的分子生物学研究[J].猪业科学,2008,25(2):22-24.
[14] MOLITOR T W,JOO H S,COLLETT M S.Porcine parvovirus:virus purification and structural and antigenic properties of virion polypeptides [J].J Virol,1983,45(2):842-854.
[15] 李斌,梁家幸,赵武,等.猪细小病毒自然弱毒N株VP2基因的克隆、测序及生物信息学分析[J].基因组学与应用生物学, 2010, 29(5):849-856.
[16] MARTINS SOARES R,CORTEZ A,HEINEMANN M B, et al.Genetic variability of porcine parvovirus isolates revealed by analysis of partial sequences of the structural coding gene VP2 [J].J Gen Virol, 2003,84(6):1505-1515.
Cloning and Sequence Analysis of the Complete Genome of Porcine Parvovirus from Henan Province
CHEN Long-biao,GAO Xiao-yun,WU Yu-yang, CUI Bao-an*et al
(College of Animal Husbandry and Veterinary Medicine, Henan Agricultural University, Zhengzhou, Henan 450002)
[Objective] Sample suspiciously infected with porcine parvovirus(PPV)were collected from several regions in Henan Province and detected by PCR. [Method]Positive cases were treated and inoculated in swine testicular (ST) cells, 4 isolates were isolated and passaged blindly in ST cell for 6 generations. According to the published complete genome sequences of PPV in GenBank, a pair of specific primers was designed and synthesized.The complete genomes of the PPV isolates were cloned,sequenced and analyzed.[Result] The results showed that the genomes homologies among the 4 isolates were 99.6%-99.8%,and they shared 98%-100% homologies with other PPV strains.Phylogenetic tree showed that the 4 PPV isolates were closely related.[Conclusion]The study provided some basis for studying the molecular epidemiology,variation and prevention of PPV in Henan.
Porcine parvovirus; Complete genome;Cloning; Sequence analysis
河南省重大科技专项(111100110300)。
陈龙彪(1989- ),男,河南洛阳人,硕士研究生,研究方向:分子病原学。*通讯作者。
2014-12-17
S 852.65+1
A
0517-6611(2015)04-026-04
