“幽门螺杆菌胃炎京都全球共识”解读
2015-02-23刘文忠
刘文忠
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
“幽门螺杆菌胃炎京都全球共识”解读
刘文忠
上海交通大学医学院附属仁济医院消化内科上海市消化疾病研究所(200001)

Stomach Neoplasms;Consensus
2014年1月31日-2月1日,由全球40余位相关领域专家参加的“幽门螺杆菌(Helicobacterpylori, Hp)胃炎全球共识”会议在日本京都召开。经过会前准备后,会议上采用Delphi法、无记名电子投票系统,对预先准备的4部分内容[与国际疾病分类(International Classification of Diseases, ICD)-11相关的胃炎分类;Hp感染相关消化不良;胃炎的诊断;胃炎的处理]的23个临床问题和相关陈述进行表决,就其中22个问题和相关陈述达成了共识。为方便解读、避免内容重复、增强可读性和便于理解,本文未根据共识原文中的4部分内容和临床问题以及相关陈述按序解读。22个临床问题和相关陈述参见附件。
一、Hp胃炎是一种感染性疾病
Hp感染是人类最常见的慢性感染之一,感染后一般难以自发清除而导致终身感染,除非进行根除治疗,或胃黏膜发生严重肠化生时细菌难以定植(Hp只能定植于胃型上皮),才会自动消失。
1. 即使患者没有症状,也不论有无消化性溃疡、胃癌等并发症,Hp胃炎应被定义为一种感染性疾病【陈述6】
组织学上,慢性胃炎的定义是胃黏膜有淋巴细胞、浆细胞浸润,“活动性”则是指胃黏膜有中性粒细胞浸润。目前已清楚,几乎所有Hp感染者在组织学上均存在慢性活动性胃炎(chronic active gastritis)[1-3]。Hp感染诱发的慢性活动性胃炎, 即Hp胃炎(Hp gastritis),是Hp感染的基础病变,在此基础上,部分患者可发生消化性溃疡(十二指肠溃疡、胃溃疡)、胃癌以及胃黏膜相关淋巴样组织(MALT)淋巴瘤等严重疾病,部分患者可有消化不良症状[4-5]。总体上,约70%的Hp感染者既无消化不良症状,也无严重病变。但重要的事实是,Hp胃炎,不论有无症状或有无并发症,几乎均存在活动性胃炎,即存在胃黏膜病理变化。因此,将Hp胃炎定义为感染性疾病(Hp感染后至少诱发慢性活动性胃炎),即使患者没有症状,也不论有无消化性溃疡、胃癌等并发症,是客观、合理的。
2. 将Hp胃炎定义为一种感染性疾病是迟到的共识
Hp研究诺贝尔医学奖得主之一病理科医师Warren在1979年就注意到胃黏膜中细菌的存在与慢性胃炎活动性相关。随后有不少观察研究证实,几乎所有Hp感染者均在组织学上存在慢性活动性胃炎。但Hp感染与慢性活动性胃炎之间存在正相关,并不能说明两者之间存在因果关系。要证明是Hp感染引起慢性活动性胃炎,必需符合柯赫法则(Koch’s postulates),即符合确定病原体为疾病病因的4项条件:①该病原体存在于所有该病患者中; ②该病原体分布与体内病变分布一致; ③清除病原体后疾病可好转; ④在动物模型中,该病原体可诱发与人类相似的疾病。大量研究表明: ①80%~95%的慢性活动性胃炎患者胃黏膜中有Hp感染,5%~20%的阴性率反映了慢性胃炎病因的多样性;②Hp分布以胃窦为主,与胃内炎症分布一致;③根除Hp可使胃黏膜炎症消退;④已在志愿者和动物模型中证实Hp感染可引起胃炎。上述4项条件在1985年Hp研究诺贝尔医学奖得主之一Marshall医师本人作为志愿者吞服培养的Hp,证实可以诱发胃炎后就已得到满足[6]。Harrison内科学早就在其感染性疾病栏目中加入了Hp感染。
3. Hp胃炎实际上是一种传染病
Hp可以在人-人之间传播[7]。感染者和可能包括被污染水源是最主要的传染源。口-口和粪-口是其主要传播途径,以口-口传播为主。前者主要通过唾液在母亲至儿童和夫妻之间传播,后者主要通过感染者粪便污染水源传播。儿童和成人均为易感人群。感染性疾病分为传染性和非传染性,因此Hp胃炎定义为传染病更为确切(infectious disease既可译为“感染性疾病”,也可译为“传染病”)。
4. 世界卫生组织(WHO)ICD中的胃炎分类应调整【陈述1】【陈述2】
Hp感染是慢性胃炎最主要的病因。WHO的ICD-10版(1989年制订)胃炎和十二指肠炎(K29)分类中未提及Hp,这一版本显然已经过时。ICD-11版目前仍处于草拟阶段。Hp胃炎京都全球共识(简称“京都全球共识”)提议,根据病因进行胃炎分类,将Hp诱发的胃炎(Hp-induced gastritis)置于感染性胃炎头条。毫无疑问,这样的分类更为客观、合理。
二、Hp感染与消化不良
消化不良(dyspepsia)主要指上腹部疼痛或不适,后者包括餐后饱胀、早饱、上腹烧灼感、上腹胀气、嗳气、恶心和呕吐,是一组临床上很常见的症候群,人群中约10%~20%的个体存在消化不良[8],我国因消化不良就诊的患者占普通内科门诊就诊者的10%,占消化科门诊就诊者的50%。为此,消化不良的处理耗费了大量医疗资源,合理的处理对于节约医疗资源具有重要作用。消化不良经相关检查后,可分为器质性和功能性两类,后一类消化不良占大多数。传统的消化不良原因归类中,一般不将慢性胃炎(包括Hp相关慢性活动性胃炎)作为器质性消化不良的原因[9],因为多数慢性胃炎患者无症状,有症状者其症状与慢性胃炎严重程度的相关度亦较低。
1. Hp胃炎是部分消化不良患者症状的原因【陈述7】
Hp胃炎可以在部分患者中产生消化不良症状,这一结论的证据来自三方面:①志愿者研究:曾有3名志愿者吞服Hp,证实可以诱发胃炎和消化不良症状[6,10]。②根除治疗对消化不良症状的影响:不少安慰剂对照研究发现,根除Hp对Hp胃炎患者消化不良症状的疗效较安慰剂高约10%[11],部分患者症状可获得长期缓解。需要指出的是,在消化不良处理的各种策略中,目前有安慰剂对照大样本研究证实疗效的仅仅是根除Hp和质子泵抑制剂(PPI)治疗。③相关机制研究:Hp胃炎患者存在胃肠激素(胃泌素、ghrelin)水平改变,影响胃酸分泌;炎症可导致胃十二指肠高敏感和运动功能改变。这些改变可以解释消化不良症状的产生[11]。
可以类比的是,感染可诱发肠易激综合征,即感染后肠易激综合征(post-infectious irritable bowel syndrome)和感染可诱发消化不良,即感染后消化不良(post-infectious dyspepsia),两者均已成为共识,Hp胃炎可导致消化不良也应该成为共识。为什么不是所有Hp胃炎患者均产生消化不良症状呢?这一情况类似于Hp感染诱发的消化性溃疡,感染者中也仅有15%~20%的个体发生溃疡。这是由于Hp胃炎患者产生消化不良症状或消化性溃疡,除Hp感染外,尚需其他因素(遗传因素、环境因素、精神/心理因素等)参与。
2. Hp相关消化不良是一种独特实体(distinct entity)【陈述8A】【陈述8B】
Hp胃炎伴消化不良症状患者根除Hp后基于症状变化情况可分为3类:①消化不良症状得到长期缓解; ②症状无改善;③症状短时间改善后又复发。目前认为第一类患者属于Hp相关消化不良(Hp-associated dyspepsia),这部分患者的Hp胃炎可以解释其消化不良症状,因此不应再属于罗马Ⅲ标准定义(无可以解释症状的器质性、系统性和代谢性疾病)的功能性消化不良[12]。后两类患者虽然有Hp感染,但根除后症状无改善或仅有短时间改善(后者不排除根除方案中PPI的作用),因此仍可视为功能性消化不良(图1)。所以,Hp相关消化不良是一种独特的疾病实体,即与根除Hp后症状无改善或仅短时间改善的患者不同,应归于器质性消化不良范畴,这一归类方法不同于传统归类方法,显得更为科学、客观。
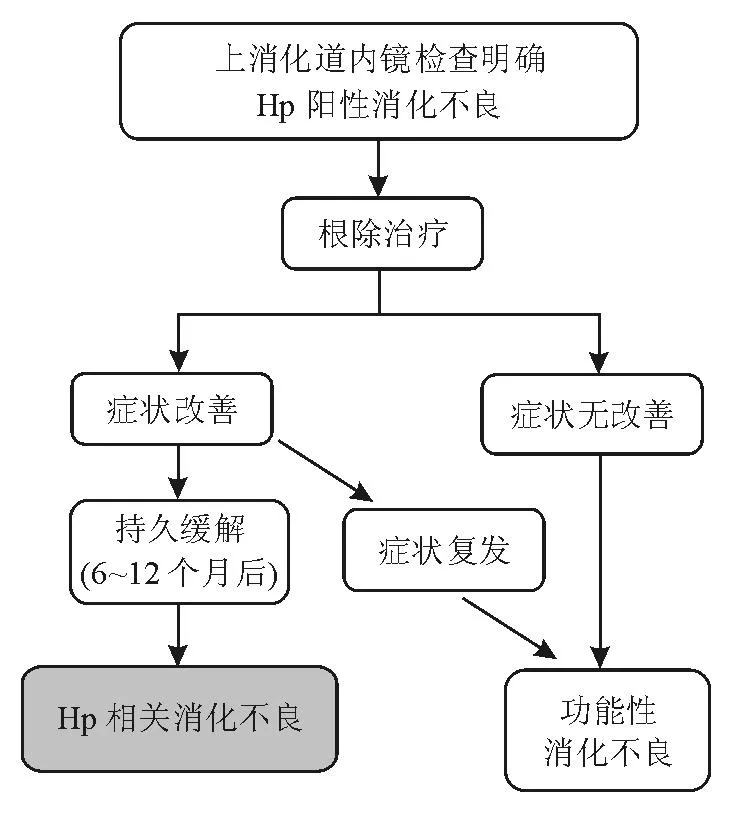
图1 Hp相关消化不良不同于功能性消化不良
3. 根除Hp应作为消化不良处理的一线治疗【陈述9】【陈述10】【陈述11】
早在2005年,美国胃肠病学会关于消化不良处理方案的全面评估报告中就指出:总体而言,在功能性消化不良治疗中已确立疗效(与安慰剂治疗相比)的方案仅仅是根除Hp和PPI治疗;对于Hp阳性患者,根除治疗是最经济有效的方法,因为一次治疗可获得长期效果[13]。 “京都全球共识” 仅仅是重申了根除Hp对消化不良症状的疗效高于安慰剂这一事实和推荐其作为一线治疗的观点。事实上,不仅美国,欧洲、亚洲以及一些已制订相关指南的国家均强烈推荐根除Hp作为消化不良的一线治疗,有高级别证据支持[11]。 “一线治疗” 体现在:①未经调查消化不良(uninvestigated dyspepsia)的处理采用Hp“检测和治疗”策略(test & treat strategy);②因消化不良症状行内镜检查,诊断为慢性胃炎(即明确为功能性消化不良)者检测Hp,阳性者首先行根除治疗,根除后仍有症状者再采取相应治疗。
根除Hp作为消化不良处理的一线治疗不仅疗效相对较高,而且可以预防消化性溃疡和胃癌,减少传染源。我国 “Hp感染处理共识”(2007、2012年)[14]和 “慢性胃炎共识意见”(2006、2012年)[15]中均推荐对Hp阳性慢性胃炎伴消化不良(相当于Hp阳性的功能性消化不良)者行根除治疗。鉴于我国内镜检查普及率高、检查费用低且上消化道肿瘤发病率高,未推荐“检测和治疗” 策略。我国“消化不良诊治指南”(2007年)处理流程图中未提及Hp[16],显然不妥。我国学者撰文“重视根除Hp处理在消化不良处理中的应用”[17],详细阐述了根除Hp应作为消化不良处理的一线治疗的观点,惜未引起国内学者重视(极少被引用;不少消化科医师在消化不良患者的处理中不检测Hp)。
综上所述,推荐根除Hp作为消化不良处理一线治疗的理由充分,而且显而易见:疗效确实(安慰剂对照研究证实),一次治疗可获得长期效果。当然实施这一策略时也需要注意个体化,在高龄、伴存严重疾病等患者中,根除Hp不适合作为一线治疗。
三、胃炎的诊断评估
Hp胃炎的发展与胃炎、萎缩和肠化生分布部位及其严重程度密切相关。胃体为主的萎缩性胃炎,尤其是程度严重时,胃癌发生风险显著增加;而胃窦为主的胃炎患者中十二指肠溃疡的风险增加。ICD中的胃炎分类仅是粗略分类,需要细化。
1. 基于悉尼分类评估【陈述3】【陈述4】【陈述5】
胃炎分类的悉尼系统(Sydney System)(1991年)[18]将慢性胃炎分为全胃炎、胃窦炎和胃体炎。事实上,多数胃炎并不仅局限于胃窦或胃体,因此,此后全胃炎衍生出胃窦为主胃炎(antrum-predomi-nant gastritis)和胃体为主胃炎(corpus-predominant gastritis)。胃炎分类的新悉尼系统(Updated Sydney System)(1994年)[19]强调了胃黏膜活检部位和活检块数(胃窦大、小弯各1块,胃角1块,胃体大、小弯各1块),对炎症、活动性、萎缩、化生和Hp感染的严重程度分级(0、1、2、3)提出了直观模拟评分(visual analogue scales),便于评估,减少了观察者之间的评分差异。我国“慢性胃炎共识意见”(2006、2012年)[15]采纳了这些国际分类精要。
慢性胃炎分类中,国内慢性胃炎共识意见将糜烂与胃炎分开描述[15],糜烂在Hp胃炎中的意义尚不明确。
2. 胃黏膜萎缩程度和范围评估【陈述12】【陈述13】
胃黏膜萎缩分为单纯性萎缩和化生性萎缩,即肠化生也属于萎缩[19]。
(1)内镜观察:常规内镜下观察无法准确诊断胃黏膜萎缩和化生[15],必须进行组织活检,并依据悉尼分类标准对胃黏膜行组织形态学评估。然而,影像增强内镜检查(image-enhanced endoscopy)在诊断胃黏膜萎缩/肠化生方面具有较高的准确性和可重复性[20-22]。影像增强内镜包括色素内镜、高分辨率放大内镜和结合放大技术的影像增强内镜。如用影像增强内镜检查指导黏膜活检,可进一步提高萎缩黏膜和肠化生检查的准确率。但目前除日本外,尚未普遍开展这类检查。
(2)OLGA和OLGIM胃癌风险分期方法【陈述14A】【陈述14B】:OLGA(operative link for gastritis assessment,意译为 “可操作的与胃癌风险联系的胃炎评估”)和OLGIM (operative link for gastric intes-tinal metaplasia assessment,意译为 “可操作的与胃癌风险联系的肠化生评估” )是由慢性胃炎分类新悉尼系统发展而来的胃癌风险分期方法[23-24]。按照慢性胃炎新悉尼系统要求活检,每块活检标本观察10个腺体,根据观察腺体中的萎缩(OLGA)或肠化生(OLGIM)腺体个数,计算萎缩(包括肠化生)或肠化生区域(仅肠化生)。OLGA或OLGIM分期Ⅲ或Ⅳ者,属于胃癌高风险患者[4]。OLGIM评估的重复性和与胃癌发生风险的关联性优于OLGA(萎缩判定有主观性,肠化生易于识别)[25]。这是目前评估胃黏膜萎缩/肠化生准确性相对较高的方法。OLGA分期见图2。
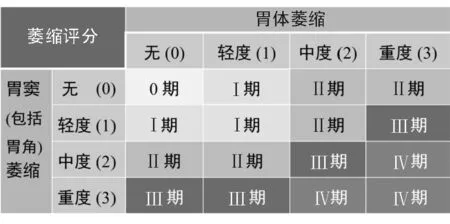
图2 慢性胃炎OLGA分期
(3)非侵入性ABC法【陈述15】:这是一种非侵入性筛查方法,通过测定血Hp抗体和血胃蛋白酶原(PG)Ⅰ、PGⅡ水平将受检者分成A、B、C、D 四组。血PG Ⅰ和PG Ⅰ/Ⅱ水平降低的异常改变提示存在胃黏膜萎缩。分组方法和各组胃癌发生风险见表1。如果能以经过当地验证的临界值(cut-off value)作为标准,可以发现胃癌发生风险增加的个体,主要用于筛查[26]。

表1 ABCD胃癌风险分层
四、Hp胃炎的处理
1. Hp感染者应给予根除治疗,除非有抗衡方面考虑【陈述17】
上文已述,Hp感染几乎均会发生慢性活动性胃炎,即Hp胃炎;Hp胃炎是一种感染性疾病,更确切地说是一种传染病。虽然多数Hp胃炎患者既无消化不良症状,最终也不发生消化性溃疡、胃癌、胃MALT淋巴瘤等严重疾病,但究竟谁最终会在Hp胃炎的基础上发生严重疾病难以预测,这种情况类似于无症状的结核或梅毒感染。而且早期胃癌症状隐匿,发现时多已属中、晚期,预后不良。根除Hp可有效预防和治疗Hp相关消化不良、消化性溃疡,在较大程度上预防胃癌发生。此外,Hp感染始终具有传染性,根除Hp可减少传染源。30余年来全球范围内大量患者的根除治疗结果证明,根除Hp后的负面影响(可能会增加胃食管反流病、肥胖、哮喘等疾病发病率以及造成人体菌群紊乱等,但这些尚有争议)远远低于上述正面作用[4]。为此,Hp感染者应给予根除治疗,除非有抗衡方面考虑。抗衡因素包括患者伴存疾病、社区中高再感染率、卫生资源优先度安排等。
2. 根除Hp可降低胃癌发生风险【陈述18】【陈述20】【陈述22】
根除Hp预防胃癌的对照研究和meta分析结果显示,根除Hp可降低胃癌发生风险,风险降低程度取决于根除治疗时的胃黏膜萎缩严重程度和范围[27-28]。根除治疗时未发生胃黏膜萎缩者,根除Hp后几乎可以完全预防肠型胃癌的发生;对已有胃黏膜萎缩者则预防效果降低或显著降低。无症状个体在胃黏膜仍处于非萎缩阶段时根除Hp获益最大,因为此阶段根除治疗可有效预防Hp相关消化不良、消化性溃疡和胃癌。随访研究显示,根除Hp后胃黏膜炎症消退,萎缩/肠化生发展可以停止或减缓; 部分萎缩可以逆转,但肠化生不能逆转[29]。也就是说,根除Hp作为降低胃癌发生风险的一级预防措施并不能消除已有胃黏膜萎缩/肠化生者的胃癌发生风险,这些患者需要进行二级预防,即随访和处理[26]。
3. 根除Hp方案应根据各地不同情况选择【陈述19】
随着Hp耐药率的上升,标准三联疗法的根除率已显著下降。不同国家或地区的Hp耐药率、药物可获得性、经济条件等存在差异,因此根除方案的选择应根据各地不同情况,基于药敏试验结果治疗和经验治疗是抗感染治疗的两种基本策略。定期监测人群抗菌药物耐药率,可为经验治疗抗菌药物的选择提供依据;是否实施基于药敏试验结果的个体化治疗,很大程度上取决于经验治疗的成功率。目前推荐的经验性铋剂四联方案[14]和在无铋剂条件下推荐的非铋剂四联方案(尤其是伴同疗法)仍可在很大程度上克服克拉霉素、甲硝唑和左氧氟沙星耐药;而阿莫西林、四环素、呋喃唑酮耐药率仍极低,应用前不需要行药敏试验。Maastricht Ⅳ共识[5]和我国最新共识[14]均推荐在二次治疗失败后进行药敏试验,但实际作用可能有限。
4. Hp是否根除成功需要评估【陈述21】
鉴于Hp根除率在下降中且未根除者仍存在严重疾病发生风险,推荐所有患者均应在根除治疗后进行复查。复查最好采用非侵入方法,包括尿素呼气试验和粪便Hp抗原试验,常用前者。Hp根除治疗后复查收集的资料也可用于根除方案疗效评估。
5. 胃癌高风险患者根除Hp后仍需随访
根除Hp时已有胃黏膜萎缩/肠化生,尤其是程度较重、范围较广的患者,根除Hp后仍属胃癌高风险患者,需要定期内镜检查随访。这些患者包括胃癌风险评估指标OLGA Ⅲ或Ⅳ期,或PG≤70 ng/mL和PGⅠ∶PGⅡ ≤3[4](参见上文“胃黏膜萎缩程度和范围评估”)。此外,早期胃癌内镜下切除术后或有异型增生(上皮内瘤变)者亦需密切随访。ABC法与OLGA法结合筛查和随访的相关流程见图3。
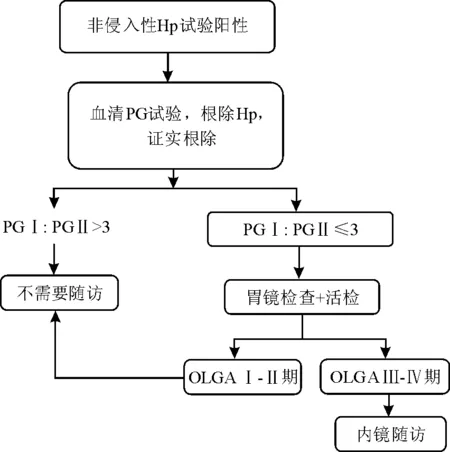
图3 Hp胃炎筛查和随访流程[4]
6. 搜寻(search)和筛查(screen)Hp胃炎何时合适?【陈述16】
搜寻可能仅指发现Hp胃炎患者,筛查包含了发现胃癌高风险患者。搜寻和筛查Hp胃炎的合适时间为萎缩和肠化生发生前,人群中Hp胃炎患者发生胃黏膜萎缩/肠化生的年龄需要通过流行病学调查确定。Hp感染多数发生在儿童时期,12岁以后较少发生感染,多数感染通过家庭内传播。日本是世界上胃癌发病率最高的国家,流行病学调查显示,Hp感染者20岁以后就有部分患者发生萎缩/肠化生[30]。因此他们提出,出于预防胃癌目的,合适的搜寻Hp胃炎年龄为12~20岁。我国胃癌发病率存在显著的地区差异,Hp感染率总体上仍很高,感染后发生胃黏膜萎缩/肠化生的年龄尚不清楚,根除后再感染率也可能较高,因此合适的搜寻和筛查Hp胃炎年龄有待确定。
参考文献
1 Dooley CP, Cohen H, Fitzgibbons PL, et al. Prevalence ofHelicobacterpyloriinfection and histologic gastritis in asymptomatic persons[J]. N Engl J Med, 1989, 321 (23): 1562-1566.
2 Warren JR. Helicobacter: the ease and difficulty of a new discovery (Nobel lecture)[J]. ChemMedChem, 2006, 1 (7): 672-685.
3 Wei Z, Ying L, Wen G, et al. Rome Ⅲ criteria cannot distinguish patients with chronic gastritis from those functional dyspepsia patients[J]. Helicobacter, 2014, 19 (2): 124-128.
4 Graham DY.Helicobacterpyloriupdate: gastric cancer, reliable therapy, and possible benefits[J]. Gastroenterology, 2015, 148 (4): 719-731.e3.
5 Malfertheiner P, Megraud F, O’Morain CA, et al; European Helicobacter Study Group. Management ofHelicobacterpyloriinfection -- the Maastricht Ⅳ/Florence Consensus Report[J]. Gut, 2012, 61 (5): 646-664.
6 Marshall BJ, Armstrong JA, McGechie DB, et al. Attempt to fulfil Koch’s postulates for pyloric Campylobacter[J]. Med J Aust, 1985, 142 (8): 436-439.
7 Eusebi LH, Zagari RM, Bazzoli F. Epidemiology ofHelicobacterpyloriinfection[J]. Helicobacter, 2014, 19 Suppl 1: 1-5.
8 Ford AC, Marwaha A, Sood R, et al. Global prevalence of, and risk factors for, uninvestigated dyspepsia: a meta-analysis[J]. Gut, 2015, 64 (7): 1049-1057.
9 Oustamanolakis P, Tack J. Dyspepsia: organic versus functional[J]. J Clin Gastroenterol, 2012, 46 (3): 175-190.
10Morris A, Nicholson G. Ingestion ofCampylobacterpyloridiscauses gastritis and raised fasting gastric pH[J]. Am J Gastroenterol, 1987, 82 (3): 192-199.
11Suzuki H, Moayyedi P.Helicobacterpyloriinfection in functional dyspepsia[J]. Nat Rev Gastroenterol Hepatol, 2013, 10 (3): 168-174.
12Tack J, Talley NJ, Camilleri M, et al. Functional gastroduodenal disorders[J]. Gastroenterology, 2006, 130 (5): 1466-1479.
13Talley NJ, Vakil NB, Moayyedi P. American gastroenterological association technical review on the evaluation of dyspepsia[J]. Gastroenterology, 2005, 129 (5): 1756-1780.
14中华医学会消化病学分会幽门螺杆菌学组; 刘文忠,谢勇,成虹,等. 第四次全国幽门螺杆菌感染处理共识报告[J]. 中华内科杂志, 2012, 51 (10): 618-625.
15中华医学会消化病学分会;房静远,刘文忠,李兆申,等. 中国慢性胃炎共识意见(2012年,上海)[J]. 中华消化杂志, 2013, 33 (1): 5-16.
16中华医学会消化病学分会胃肠动力学组;柯美云,侯晓华,罗金燕,等. 中国消化不良的诊治指南(2007,大连)[J]. 中华消化杂志, 2007, 27 (12): 832-834.
17刘文忠,萧树东. 重视根除幽门螺杆菌在消化不良处理中的应用[J]. 中华内科杂志, 2008, 47 (1): 5-6.
18Price AB. The Sydney System: histological division[J]. J Gastroenterol Hepatol, 1991, 6 (3): 209-222.
19Dixon MF, Genta RM, Yardley JH, et al. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994[J]. Am J Surg Pathol, 1996, 20 (10): 1161-1181.
20Uedo N, Ishihara R, Iishi H, et al. A new method of diagnosing gastric intestinal metaplasia: narrow-band imaging with magnifying endoscopy[J]. Endoscopy, 2006, 38 (8): 819-824.
21Capelle LG, Haringsma J, de Vries AC, et al. Narrow band imaging for the detection of gastric intestinal metaplasia and dysplasia during surveillance endoscopy[J]. Dig Dis Sci, 2010, 55 (12): 3442-3448.
22Pimentel-Nunes P, Dinis-Ribeiro M, Soares JB, et al. A multicenter validation of an endoscopic classification with narrow band imaging for gastric precancerous and cancerous lesions[J]. Endoscopy, 2012, 44 (3): 236-246.
23Rugge M, Correa P, Di Mario F, et al. OLGA staging for gastritis: a tutorial[J]. Dig Liver Dis, 2008, 40 (8): 650-658.
24Isajevs S, Liepniece-Karele I, Janciauskas D, et al. Gastritis staging: interobserver agreement by applying OLGA and OLGIM systems[J]. Virchows Arch, 2014, 464 (4): 403-407.
25Capelle LG, de Vries AC, Haringsma J, et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis[J]. Gastrointest Endosc, 2010, 71 (7): 1150-1158.
26Shiotani A, Cen P, Graham DY. Eradication of gastric cancer is now both possible and practical[J]. Semin Cancer Biol, 2013, 23 (6 Pt B): 492-501.
27Wong BC, Lam SK, Wong WM, et al; China Gastric Cancer Study Group.Helicobacterpylorieradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial[J]. JAMA, 2004, 291 (2): 187-194.
28Ford AC, Forman D, Hunt RH, et al.Helicobacterpylorieradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomised controlled trials[J]. BMJ, 2014, 348: g3174.
29Wang J, Xu L, Shi R, et al. Gastric atrophy and intestinal metaplasia before and afterHelicobacterpylorieradication: a meta-analysis[J]. Digestion, 2011, 83 (4): 253-260.
30Kamada T, Haruma K, Ito M, et al. Time Trends inHelicobacterpyloriInfection and Atrophic Gastritis Over 40 Years in Japan[J]. Helicobacter, 2015, 20 (3): 192-198.
(2015-07-01收稿)
附件:
幽门螺杆菌(Hp)胃炎京都全球共识相关“临床问题”和“陈述”
第一部分:与ICD-11相关的胃炎分类(1-6)
【临床问题1】目前的ICD-10胃炎分类合适吗?
【陈述1】鉴于Hp的发现,目前ICD-10胃炎分类已经过时。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题2】提议的ICD-11胃炎分类合适吗?
【陈述2】在ICD-11β版中新提出的胃炎分类是一种改进,因为它是基于病因的分类。
推荐等级:强;证据级别:中等;共识水平:100%
【临床问题3】有必要根据胃部位进行胃炎分类吗?
【陈述3】由于消化性溃疡和胃癌发生风险受胃炎类型影响,因此将Hp诱发的胃炎基于部位分类是有用的。
推荐等级:强;证据级别:高;共识水平:97.4%
【临床问题4】是否有必要根据组织学(严重程度)和(或)内镜检查进行胃炎分类。
【陈述4】建议根据组织学检查进行胃炎分类,因为在Hp胃炎中,胃癌发生风险根据炎症和萎缩的范围和严重程度而改变。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题5】在慢性胃炎中,我们应该如何进行胃黏膜糜烂分类?
【陈述5】胃黏膜糜烂应与胃炎分开报告。胃十二指肠黏膜糜烂的自然史和临床意义取决于病因学,尚需要进一步澄清。
推荐等级:强;证据级别:低;共识水平:100%
【临床问题6】不论症状和并发症,Hp胃炎是否是一种感染性疾病?
【陈述6】Hp胃炎无论有无症状、伴或不伴有消化性溃疡和胃癌,均应定义为一种感染性疾病。
推荐等级:强;证据级别:高;共识水平:100%
第二部分:Hp感染相关消化不良(7-11)
【临床问题7】Hp胃炎会引起消化不良吗?
【陈述7】Hp胃炎是部分患者消化不良的原因。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题8】我们是否应将Hp相关消化不良作为一种特殊(疾病)实体?
【陈述8A】Hp感染消化不良患者如果成功根除治疗后有显著的症状缓解,其症状可归因于Hp胃炎。
推荐等级:强;证据级别:高;共识水平:97.4%
【陈述8B】Hp相关消化不良(如陈述8A)是一种特殊(疾病)实体。
推荐等级:强;证据级别:中等;共识水平:92.1%
【临床问题9】根除Hp感染是改善消化不良症状的一线治疗吗?
【陈述9】根除Hp是Hp感染消化不良患者的一线治疗。
推荐等级:强;证据级别:高;共识水平:94.7%
【临床问题10】根除Hp对消化不良症状的疗效如何: 短期和长期疗效,以及与其他治疗(如PPI)对比?
【陈述10】在Hp感染的消化不良患者,根除治疗对消化不良症状的疗效优于安慰剂,是优选选择。
推荐等级:强;证据级别:高;共识水平:97.4%
【临床问题11】成功根除Hp后仍有消化不良的患者是否应被认为有功能性消化不良?
【陈述11】成功根除Hp后仍有消化不良的患者应被认为有功能性消化不良。
推荐等级:强;证据级别:中等;共识水平:97.4%
第三部分: 胃炎的诊断(12-15)
【临床问题12】是否有可能用内镜检查诊断萎缩和(或)肠化生?
【陈述12】 经过适当培训后,影像增强内镜检查可准确检测萎缩黏膜和肠化生。
推荐等级:强;证据级别:高;共识水平:84.2%
【临床问题13】新悉尼系统是否适合胃炎组织学诊断?
【陈述13】胃炎准确的组织学评估胃窦和胃体均需要取活检。
推荐等级:强;证据级别:高;共识水平:92.1%
【临床问题14】分级系统,如OLGA和OLGIM,对危险分层有用吗?
【陈述14A】胃癌发生的风险与萎缩性胃炎的严重程度和范围相关。
推荐等级:强;证据级别:高;共识水平:94.7%
【陈述14B】组织学分级系统,如OLGA和OLGIM对危险分层有用。
推荐等级:强;证据级别:低;共识水平:97.3%
【临床问题15】血清学试验(PGⅠ、PGⅡ、PGⅠ/Ⅱ,Hp抗体)进行危险分层有用吗?
【陈述15】血清学试验(PGⅠ、PGⅡ和Hp抗体)对识别胃癌发生风险增加的个体有用。
推荐等级:强;证据级别:高;共识水平:91.9%
第四部分: 胃炎的处理(16-22)
【临床问题16】搜寻和筛查Hp胃炎何时合适?
【陈述16】应根据流行病学资料,合适的搜寻和筛查Hp胃炎的年龄为萎缩性胃炎和肠化生发生之前。
推荐等级:强;证据级别:中等;共识水平:97.3%
【临床问题17】Hp阳性者都应该接受根除治疗吗?
【陈述17】Hp感染者应给予根除治疗,除非有抗衡方面考虑。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题18】何时是无症状者根除Hp的最佳时机?
【陈述18】在胃黏膜仍处于非萎缩阶段时,根除Hp可最大获益。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题19】我们是否需要根据地区采取(不同)根除治疗方案?
【陈述19】根除方案最好应基于当地有效方案,理想的是根据个体药敏试验或社区抗菌药物敏感性、或抗菌药物消费数据和临床结果数据。可获得的药物在不同地区间有差异,这部分决定了什么方案是可能的。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题20】根除Hp能预防胃癌吗?
【陈述20】根除Hp能减少胃癌发生风险。降低风险的程度取决于根除治疗时胃黏膜萎缩的严重程度和范围。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题21】根除治疗的结果(是否根除)始终需要评估吗?
【陈述21】根除治疗的结果始终需要评估,首选非侵入方法。
推荐等级:强;证据级别:高;共识水平:100%
【临床问题22】哪些患者根除Hp后需要长期随访?
【陈述22】根除Hp可能不会完全消除胃癌风险。基于萎缩范围和严重程度定义仍有风险的患者,应进行内镜和组织学监控。
推荐等级:强;证据级别:高;共识水平:97.3%
·特约文稿·
摘要2014年1月31日-2月1日,“幽门螺杆菌(Hp)胃炎全球共识”会议在日本京都召开, 制订了下述内容共识:①Hp胃炎是一种感染性疾病;②临床上如何区别Hp引起的消化不良与功能性消化不良;③胃炎适当的诊断评估;④何时、何人、如何治疗Hp胃炎。所有22个临床问题的24个陈述均达到>80%的共识水平。本文对这些内容进行详细解读。
关键词幽门螺杆菌;胃炎;传染性疾病;根除;消化不良;胃肿瘤;共识
Interpretation of Kyoto Global Consensus onHelicobacterpyloriGastritisLIUWenzhong.DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001)
AbstractA global consensus meeting on Helicobacter pylori (H. pylori) gastritis was held in Kyoto, Japan from January 31stto February 1st, 2014, which was convened to develop consensus on: (1) H. pylori gastritis is an infectious disease, (2) clinical distinction of dyspepsia caused by H. pylori from functional dyspepsia, (3) appropriate diagnostic assessment of gastritis and (4) when, whom and how to treat H. pylori gastritis. All 24 statements for 22 clinical questions achieved a consensus level of >80%. In this paper, the statements were interpreted in detail.
Key wordsHelicobacter pylori;Gastritis;Infectious Diseases;Eradication;Dyspepsia;
DOI:10.3969/j.issn.1008-7125.2015.08.001
