针对20S蛋白酶体的抗肿瘤药物研究进展
2015-02-23邢志佳张叶叶马宇衡
邢志佳,张叶叶,马宇衡,杨 慧
(内蒙古医科大学药物化学教研室,呼和浩特 010010)
针对20S蛋白酶体的抗肿瘤药物研究进展
邢志佳,张叶叶,马宇衡,杨 慧*
(内蒙古医科大学药物化学教研室,呼和浩特 010010)
20S蛋白酶体在生物体内的功能主要是水解蛋白,其与许多疾病如阿尔斯海默症、癌症等有密切的相关性,已经成为抗肿瘤药物研发的新靶点。本文对已经上市的硼替佐米、卡非佐米及正在临床研究阶段的Marizomib的结构及应用特点进行综述。
20S蛋白酶体,抑制剂,硼替佐米,卡非佐米,Marizomib
泛素-蛋白酶体途径(ubiquitin-proteasome pathway, UPP)是生物体内除溶酶体途径之外,另一个重要的细胞内蛋白质水解通路[1]。水解过程由蛋白泛素化和蛋白质水解两部分组成。水解蛋白主要发生在26S蛋白酶体,由两个19S复合体(Regulatory particle, RP)和一个20S蛋白酶体(Core particle, CP)组成(见图1)[2,3]。前者主要起调控作用,后者是水解的主要场所。20S蛋白酶体由14个不同的蛋白亚基组成,每7个亚单位组成一个环形,整齐排列为4层,两个α亚基环在外侧,两个β亚基环在内侧,活性亚基为β1、β2和β5[4]。研究证实,蛋白酶体与阿尔斯海默症以及癌症等多种疾病有非常密切的相关性,这主要是由于其可以通过水解调控细胞内短寿命蛋白如NF-κB、p53、c-Moc以及cyclin A等,间接调控细胞有丝分裂周期、细胞凋亡、信号转导,以及蛋白跨膜定位等过程造成的[5]。目前,蛋白酶体已经成为抗肿瘤药物研发的新热点。

图1 26S蛋白酶体结构(A)β亚基环状结构(B)
目前,20S蛋白酶体抑制剂按结构通常被分为肽与非肽类两大类,肽类抑制剂按药效团不同可分为:醛类(1)[6]、硼酸类(2)[7]、环氧酮类(3)[8]、不饱和砜(烯基砜)类(4)[9]等(见图2),其中肽硼酸类的Bonezomib (2)由于其具有良好的活性、选择性以及代谢稳定性等特点,2003年经FDA批准成为了首个蛋白酶体类新型抗肿瘤药物[10]。非肽类抑制剂以含有β-内酯类结构的抑制剂为代表,其中NPI-0052 (5)已经进入了临床研究阶段[11]。本文对已经上市的硼酸类药物硼替佐米(2),环氧酮类药物卡非佐米(3)以及正在临床研究阶段的β-内酯类药物Marizomib(NPI-0052)特点进行综述。
1 硼替佐米
自UPP通路被发现,硼替佐米(2)是首个被FDA批准的20S蛋白酶体抑制药物[12],其主要用于治疗多发性骨髓瘤以及复发性或难治性淋巴瘤[13]。目前,硼替佐米正在进行器官移植后排斥反应的临床研究[13]。硼替佐米对20S蛋白酶体β5亚基的选择抑制活性IC50值为7 nmol/L,而对β1亚基的抑制活性IC50值为74 nmol/L[14]。有研究表明,硼替佐米与地塞米松联合使用可使治疗初发型骨髓瘤的缓解率由原来单独使用硼替佐米的40%提升至70~85%[15]。
尽管目前硼替佐米已经投入市场,但其在治疗疾病过程中还是有一些不足之处。首先,静脉给药途径给患者用药带来不便;其次,在治疗过程中会引起血小板减少[16]、中性粒细胞减少以及胃肠疾病等严重的副作用[17]。在使用硼替佐米治疗的患者中,有超过30%的人会产生可逆的神经退行性病症,包括神经毒性、颤动和神经传导速度减弱等[18]。
2 卡非佐米和ONX 0912
硼替佐米在使用中存在的副作用促使学术界和制药行业必须开发新的低毒且等效的蛋白酶体抑制剂。卡非佐米(3)是天然产物epoxomicin(6)的一个四肽衍生物[8,19],该化合物对蛋白酶体的β5亚基具有靶向作用,不可逆的与20S蛋白酶体N-末端苏氨酸活性位点相结合[20]。卡非佐米与β5亚基结合的蛋白晶体结构显示,其P1片段可以与S1口袋的亮氨酸侧链作用,因此该化合物较硼替佐米有更好的β亚基选择性[21]。
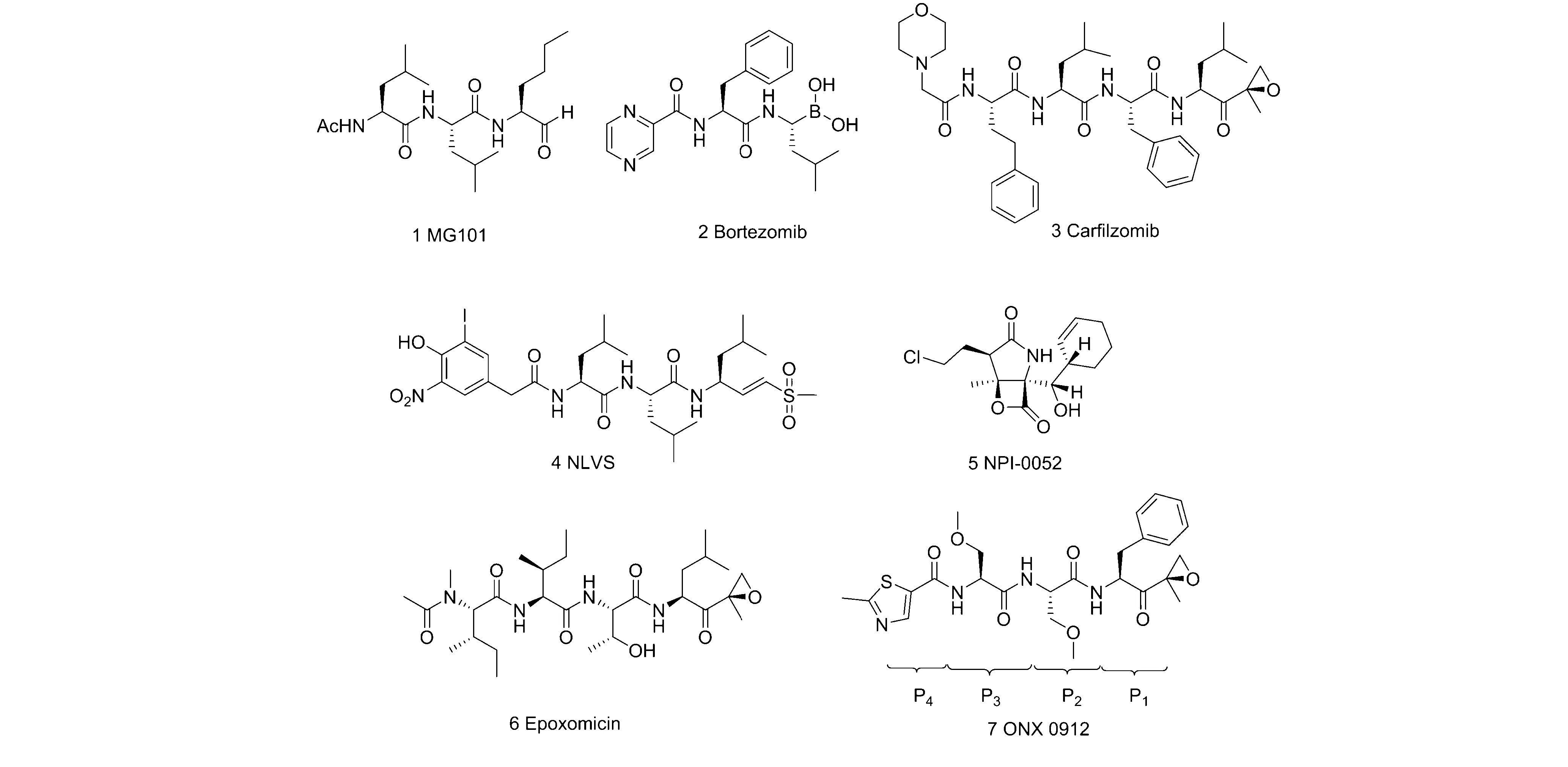
图2 20S蛋白酶体抑制剂
多项研究显示卡非佐米在针对复发、难治性、多发型骨髓瘤患者的治疗过程中具有持久的抗瘤活性[22],在大量的肿瘤细胞株中有诱导细胞凋亡的能力,目前已经顺利通过治疗多发性骨髓瘤的临床试验成功上市,近期该药物正在进行实体瘤Ⅰ期临床试验[23]。与硼替佐米相比,该药在治疗过程中也会出现中性粒细胞减少症和血小板减少的情况,此外,还会产生疲劳、呼吸困难、腹泻及发热等不良反应[24],因此使用药剂量受到限制,但卡非佐米没有诱导外周神经毒性的情况[25]。
由于α',β'-环氧酮的存在,其与β亚基作用时通过共价结合,并且形成一个吗啉环,可以提高抑制活性减少脱靶效应[26],有效避免硼替佐米引起神经病变的副作用。
为了改进卡非佐米不可口服的缺点,研究人员设计了一个可以口服的三肽环氧酮类抑制剂ONX 0912(7)[27],其具有与卡非佐米相当的诱导多发性骨髓瘤细胞凋亡的能力。ONX 0912与β5亚基结合的晶体结构显示,在P1位残基处带有体积较大的苯基侧链,这一片段可使ONX 0912与β5亚基结合能力增强。化合物ONX 0912对不同的β5亚型,如β5c和β5i亚基的IC50值分别是36 nmol/L和82 nmol/L。这主要是因为β5i底物结合的S3口袋较β5c的口袋小,ONX 0912的 P3位Ser(OMe)基团产生立体障碍。
3 Marizomib(NPI-0052)
Marizomib(NPI-0052)[28]是由Nereus制药公司开发的具有β-内酯并γ-内酰胺环结构的20S蛋白酶体抑制剂。Marizomib为海洋放线菌Salinisporatropica的次级代谢产物,与其他肽类蛋白酶体抑制剂相比,Marizomib独特的化学结构可以产生更加持续的抑制活性(主要是与β2和β5亚基作用),更有利于促进细胞凋亡。另外,Marizomib非肽结构对水解酶稳定,与硼替佐米相比药代动力学稳定性好,体外实验结果显示对硼替佐米耐药的肿瘤株中表现出强的抑制活性[29]。虽然Marizomib可以通过口服和静脉注射给药,没有出现周围神经疾病或血栓[30],但其较短的半衰期(<5 min)和可穿过血脑屏障的缺点限制其应用[31]。
自上世纪80年代被发现,经过30余年的研究,人们对蛋白酶体的结构、功能和生物学作用有了深刻的认识,从该通路开发新的抗肿瘤药物已经成为其抑制剂开发的主要目的。
1 Coux O, Tanaka K, Goldberg A L.Structure and functions of the 20S and 26S proteasomes[J]. Annu Rev Biochem, 1996,65:801-847
2 Kim H M, Yu Y, Cheng Y. Structure characterization of the 26S proteasome [J]. Biochim Biophys Acta, 2011,1809(2):67-79
3 Bedford L, Paine S, Sheppard P W,etal. Assembly structure and function of the 26S proteasome [J]. Trends Cel Biol,2010,20(7):391-401
4 Verdoes M, Florea B I, Marel G,etal. Chemical tools to study the proteasome [J]. Eur J Org Chem, 2009,20:3301-3313
5 Tsvetkov P, Reuven N, Shaul Y. Ubiquitin-independert p53 proteasomal degradation [J]. Cell Death Differ, 2009,17(1):103-108
6 Loidl G, Groll M, Musiol H J,etal. Bifunctional inhibitors of the trypsin-like activity of eukaryotic proteasomes [J]. Chem Biol,1999,6(4):197-204
7 Groll M, Berkers C R, Ploegh H L,etal. Crystal structure of the boronic acid-based proteasome inhibitor bortezomib in complex with the yeast 20S proteasome [J]. Structure, 2006,14(3):451-456
8 Meng L, Mohan R, Kwok B H,etal. Epoxomicin, a potent and selective proteasome inhibitor, exhibits in vivo anti-inflammatory activity [J]. Proc Natl Acad Sci USA, 1999,96(18):10403-10408
9 Palmer J T, Rasnick D, Klaus J L,etal. Vinyl sulfones as mechanism-based cysteine protease inhbibitors [J]. J Med Chem, 1995,38(17):3193-3196
10 李景,张大永,吴晓明.泛素-蛋白酶体及其抑制剂的分类与合成[J].药学学报,2009,44(12):1313-1319
11 Potts B C, Albitar M X, Anderson K C,etal. Marizomib, a proteasome inhibitor for all seasons: prelinical profile and a framework for clinical trials [J]. Curr Cancer Drug Targets,2011,11:254-284
12 O'Connor O A, Wright J, Moskowitz C,etal. Phase II clinical experience with the novel proteasome inhibitor bortezomib in patients with indolent non-Hodgkin's lymphoma and mantle cell lymphoma[J].J Clin Oncol,2005, 23(4):676-684
13 侯健,周帆,张永贞,等.硼替佐米治疗复发、难治性多发性骨髓瘤[J].中国新药与临床杂志,2005,24(27):579-581
14 May L J, Yeh J, Maeda K,etal. HLA desensitization with bortezomib in a highly sensitized pediatric padiatric patient [J]. Pediatric Blood Cancer,2014, 18(8): 280-282
15 张冬华,孙建群. 硼替佐米联合吡柔比星、地塞米松治疗初治多发性骨髓瘤14例临床分析[J]. 中国药业, 2015,24(1): 78-80
16 Jackson G, Einsele H, Moreau P,etal. Bortezomib, a novel proteasome inhibitor, in the treatment of hematologic malignancies[J].Cancer Treat Rev,2005, 31(8):591-602
17 Arastu K S,Anderl J L,Kraus M,etal. Nonproteasomal targets of the proteasome inhibitors bortezomib and carfilzomib: a link to clinical adverse events[J].Clin Cancer Res, 2011,17(9):2734-2743
18 Kuhn D J,Orlowski R Z,Bjorklund C C. Second generation proteasome inhibitors: carfilzomib and immunoproteasome-specific inhibitors (IPSIs) [J].Curr Cancer Drug Targets,2011, 11(1):285-295
19 Franke N E,Niewerth D,Assaraf Y G,etal. Impaired bortezomib binding to mutant β5 subunit of the proteasome is the underlying basis for bortezomib resistance in leukemia cells[J].Leukemia, 2012,26(4):757-768
20 霍秀颖,封宇飞.蛋白酶体抑制剂卡非佐米的药理作用与临床评价[J].新药评述,2013,22(13):1479-1482
21 Huber E M, Basler M, Schwab R,etal. Immuno- and constitutive proteasome crystal structures reveal differences in substrate and inhibitor specificity[J]. Cell,2012,148(4):727-738
22 朱晓峰,汪安友,蔡晓燕.复发难治性多发性骨髓瘤的治疗进展[J].临床医学,2014,34(7):115-117
23 Sara B, Francesca G, Francesca D,etal. Current Phase II investigational proteasome inhibitors for the treatment of multiple myeloma [J]. Expert Opinion on Investigational Drugs,2014,23(9):1193-1209
24 方罗,吴盈盈,张翀,等.近五年全球抗肿瘤药物研发现状(Ⅱ)[J].中国肿瘤,2013,22(8):644-655
25 Ruschak A M, Slassi M,Kay L E,etal.Novel proteasome inhibitors to overcome bortezomib resistance[J].J Natl Cancer Inst,2011,103(13):1007-1017
26 易文渊,徐波,李敏.蛋白酶体抑制剂逆转肿瘤多药耐药的研究进展[J].国外医学·药学分册,2007,34(2):87-92
27 Zhou H J, Aujay M A, Bennett M K,etal.Design and synthesis of an orally bioavailable and selective peptide epoxyketone proteasome inhibitor (PR-047) [J]. J Med Chem, 2009, 52(9):3028-3038
28 Potts B C, Albitar M X, Anderson K C,etal. Marizomib, a proteasome inhibitor for all seasons: Preclinical profile and a framework for clinical trials[J]. Curr Cancer Drug Targets, 2011,11(3):254-284
29 王一,方美云.多发性骨髓瘤药物治疗新进展[J].实用癌症杂志,2011,26(4):437-440
30 刘念,陈文明.复发难治多发性骨髓瘤的新药治疗[J].白血病·淋巴瘤,2013,22(1):35-37
31 Molineaux S M. Molecular Pathways:Targeting Proteasomal Protein Degradation in Cancer[J].Clin Cancer Res, 2012, 18(1): 15-20
2014-10-23
R979.1
A
1006-5687(2015)01-0055-03
*通讯作者:杨慧,E-mail:yanghui1962@126.com。
