中国早期结直肠癌筛查及内镜诊治指南(2014年,北京)
2015-02-22中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜学专业委员会
中国早期结直肠癌筛查及内镜诊治指南(2014年,北京)
中华医学会消化内镜学分会中国抗癌协会肿瘤内镜学专业委员会*

一、引言
结直肠癌(colorectal cancer, CRC)是起源于结直肠黏膜上皮的恶性肿瘤,是临床最常见的恶性肿瘤之一。我国每年结直肠癌新发病例超过25万,死亡病例约14万,新发和死亡病例均占全世界同期结直肠癌病例的20%[1]。因此,降低我国结直肠癌的发病率和死亡率是刻不容缓的重大临床科学问题。
结直肠癌的转归和预后与病变分期紧密相关。局部进展期结直肠癌5年癌症相关生存率为70%,而发生远处转移的晚期结直肠癌5年生存率仅为12%[2],且生活质量低。大部分早期结直肠癌则可获得良好预后,5年生存率超过90%[2],部分可行内镜微创治疗获得根治。但目前我国结直肠癌的早期诊断率较低,明显低于欧美国家。因此,逐步普及结直肠癌筛查和推广内镜下早诊早治,是提高我国结直肠癌早期诊断率、降低结直肠癌相关死亡率的有效途径。
为规范我国结直肠癌诊疗方案,我国卫生部先后颁布了《结直肠癌诊疗规范(2010年版)》[3]和《结直肠癌诊疗质量控制指标(试行)》[4],中华医学会消化内镜学分会肠道学组[5]和中华医学会消化病学分会[6]也相继发布了相关指南。但目前我国尚缺乏侧重于结直肠癌内镜早期诊治且兼顾筛查等方面内容的综合性共识意见。因此,由中华医学会消化内镜学分会和中国抗癌协会肿瘤内镜学专业委员会组织我国消化、内镜、外科、肿瘤、病理等多学科专家,并邀请澳大利亚谭达恩教授和新加坡霍光明教授参与,共同制订本指南。
二、定义和术语
1. 早期结直肠癌:根据1975年日本结直肠癌研讨会意见,目前我国普遍将局限于结直肠黏膜层和黏膜下层的癌定义为早期结直肠癌,其中局限于黏膜层的为黏膜内癌,浸润至黏膜下层但未侵犯固有肌层者为黏膜下癌。而2000年版世界卫生组织(WHO)肿瘤分类则规定结直肠发生的上皮恶性肿瘤,只有穿透黏膜肌层、浸润至黏膜下层时才被认为是恶性的。鉴于我国实际情况,推荐使用WHO推荐术语[6],但也可暂时沿用原位癌、黏膜内癌等术语。
2. 上皮内瘤变:低级别上皮内瘤变(low-grade intraepithelial neoplasia, LGIN)相当于原来的轻、中度异型增生, 高级别上皮内瘤变(high-grade intra-epithelial neoplasia, HGIN)则包括重度异型增生、原位癌、原位癌可疑浸润以及黏膜内癌。
3. 结直肠癌癌前病变:指与结直肠癌发生密切相关的病理变化,包括结直肠腺瘤、腺瘤病和炎症性肠病(IBD)相关异型增生等[5],新近命名的传统锯齿状腺瘤(traditional serrated adenoma, TSA)和广基 锯齿状腺瘤/息肉(sessile serrated adenoma/polyps, SSA/P)等锯齿状病变也属于癌前病变的范畴[7]。
(1)结直肠腺瘤:可分为管状腺瘤、管状绒毛状腺瘤和绒毛状腺瘤,以绒毛状腺瘤癌变率最高,管状腺瘤最低。大多数结直肠癌经由腺瘤-腺癌途径形成。
(2)进展期腺瘤:指满足以下一项或多项标准的腺瘤: a) 直径>10 mm; b) 含有绒毛成分; c) 有重度异型增生或高级别上皮内瘤变。
(3)锯齿状病变:指一组以上皮锯齿状结构为特征的病变,包括增生性息肉、SSA/P和TSA[8]。一般认为增生性息肉不具有恶变潜能,而SSA/P和TSA可通过锯齿状途径癌变[9]。SSA/P根据细胞异型性分为不伴和伴有细胞异型增生型。
4. 侧向发育肿瘤(laterally spreading tumor, LST):指直径≥10 mm,沿肠壁侧向扩展而非垂直生长的一类表浅性结直肠病变,依据其表面形态可分为颗粒型(颗粒均一型和结节混合型)和非颗粒型(扁平隆起型和假凹陷型)[10]。LST并非组织学分类,其病理可能为腺瘤或锯齿状病变等,有黏膜下浸润风险。
5. 整块切除(en bloc resection):病灶在内镜下被整块切除并获得单块标本。
6. 水平/垂直切缘阳性:内镜下切除的标本固定后每隔2 mm垂直切片,标本侧切缘有肿瘤细胞浸润为水平切缘阳性,基底切缘有肿瘤细胞浸润则称为垂直切缘阳性。
7. 完全切除(complete resection/R0 resection):整块切除标本的水平和垂直切缘均为阴性称为完全切除。
8. 治愈性切除(curative resection):切除标本水平和垂直切缘均为阴性且无淋巴结转移风险。
9. 局部复发/残留(local recurrence/residual):结肠镜表现:①原内镜切除部位存在肿瘤病灶;②伴有黏膜聚集的肿瘤病灶;③不伴黏膜聚集但紧邻部位有明确内镜切除术后瘢痕的肿瘤病灶[11]。早期局部复发/残留指内镜治疗6个月后第一次结肠镜随访发现上述病灶;晚期局部复发则定义为至少1次结肠镜随访阴性后发现上述病变[11]。
10. 间期结直肠癌(interval colorectal cancer):也称为结肠镜后结直肠癌(post-colonoscopy colorectal cancer, PCCRC),指结肠镜筛查或监测未被发现,而在推荐的下一次检查日期前发生的结直肠癌[12]。
三、流行病学
“中国肿瘤登记年报”数据显示,结直肠癌是我国肿瘤登记地区2009年第二常见的消化道肿瘤,仅次于胃癌,发病率为29.44/10万,同期死亡率为14.23/10万,居恶性肿瘤死亡率的第五位[13](图1~4)。我国结直肠癌分布地区差异明显,沿海(东部)地区较内陆(西北)地区高发,江苏、浙江、上海、福建和东北以及华北部分地区发病率上升较快,长江中下游地区的发病率和死亡率最高。男性发病率和死亡率约为女性的1.2~1.3倍,且增长趋势更为显著;年龄标化后城市人口的发病率和死亡率均较农村人口高65%以上,增幅为农村人口的2倍以上。近二十年来我国结直肠癌发病率呈持续上升趋势,结肠癌发病率增高明显,直肠癌基本稳定;死亡率从40岁开始持续快速上升,85岁组达峰值且未见下降。第三次死因调查显示,我国结直肠癌死亡率与第二次死因调查相比上升了40.0%,与第一次死因调查相比上升了77.9%[14]。目前,我国结直肠癌发病数和死亡数均占世界同期的18%~20%[1]。
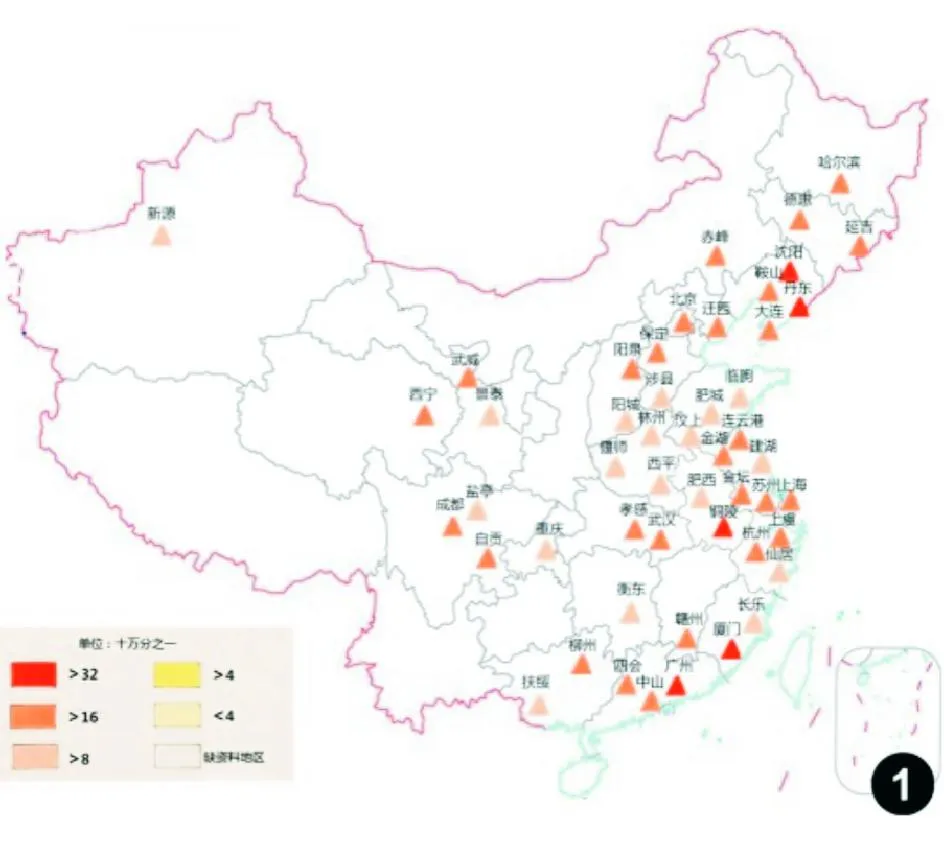
图1中国部分省市和地区男性结直肠癌发病率分布图(2009年)
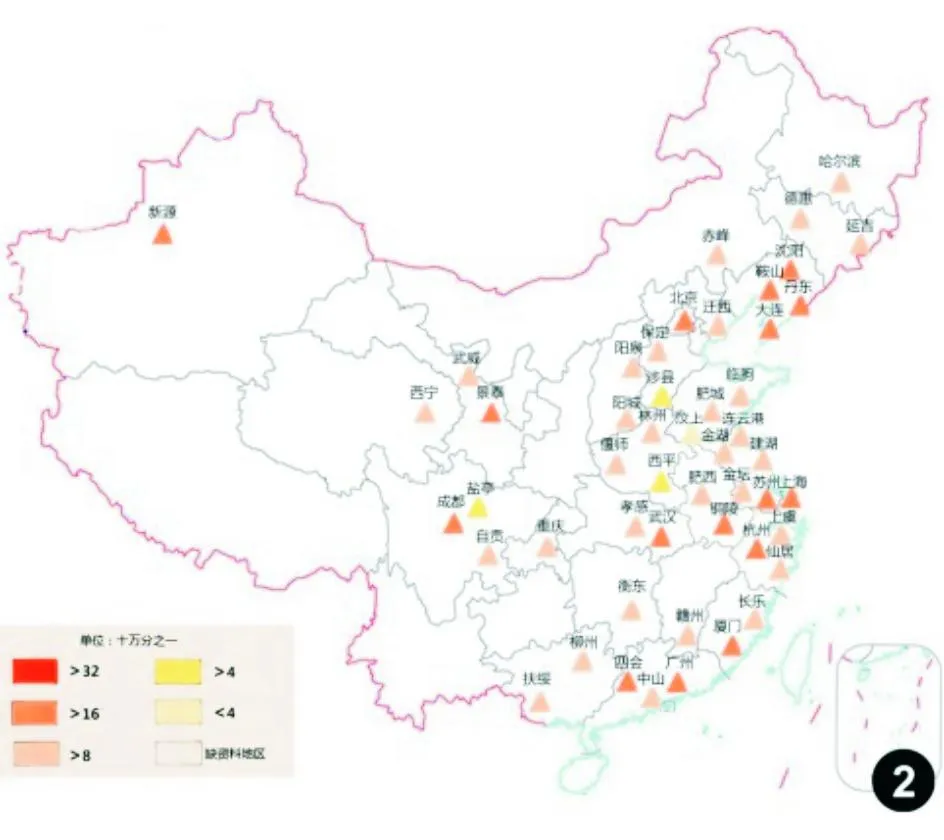
图2中国部分省市和地区女性结直肠癌发病率分布图(2009年)
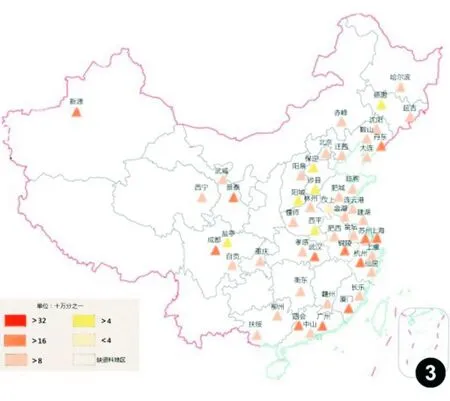
图3中国部分省市和地区男性结直肠癌死亡率分布图(2009年)
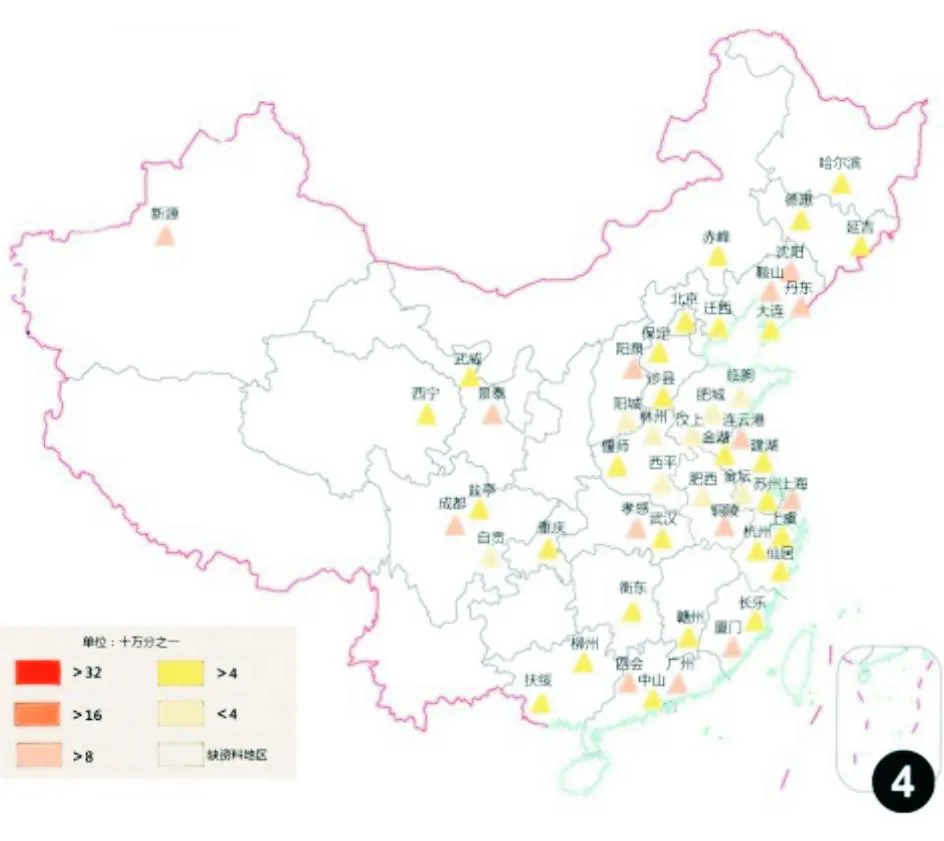
图4中国部分省市和地区女性结直肠癌死亡率分布图(2009年)
来自我国香港、启东、上海、天津的数据显示,结直肠癌平均5年年龄标化相对生存率为44%(36%~63%)[15];我国一项对超过1万例确诊为结直肠癌患者的研究发现,年龄标化5年相对生存率为47.2%,城市患者5年生存率>50%,农村患者则<40%[16],远低于欧美发达国家和日本。
四、危险因素
结直肠癌的病因虽尚不明确,但对其发病危险因素已有较多研究。目前认为结直肠癌的发生是由环境、饮食、生活方式、遗传等若干因素协同作用的结果[17]。
(一)结直肠癌的危险因素
1. 人口学因素:年龄是结直肠癌明确的危险因素,结直肠癌发病率随年龄增长而增加。我国结直肠癌的发病率和死亡率从40岁开始呈快速增长趋势,发病率在80岁以上年龄组达到高峰(197.4/10万)[18]。男性结直肠癌发病风险高于女性。
2. 家族史:结直肠癌是一种有明显遗传倾向的恶性肿瘤。meta分析显示,有一名以上一级亲属患结直肠癌时,该个体患结直肠癌的总体风险比为2.24,家族中有两名以上亲属患结直肠癌时,总体风险比将升至3.97;50岁的成年人如有一名以上一级亲属患结直肠癌,其患结直肠癌的风险由1.8%升至3.4%,如有两名以上一级亲属患结直肠癌,该风险升至6.9%[19]。我国台湾的一项研究[20]发现,结直肠癌患者的直系亲属患结直肠腺瘤的风险为对照组的2.33倍,高危腺瘤的风险为对照组的4.5倍,且腺瘤发生年龄提前,因此建议结直肠癌患者的直系亲属提前至40岁行结肠镜筛查。来自我国香港的研究[21]表明,结直肠癌患者的无症状兄弟姐妹发生结直肠癌、结直肠进展期腺瘤的风险均显著增加。
3. IBD:是结直肠癌明确的危险因素。曾有研究指出,约20%的IBD患者可在发病后10年内发生结直肠癌,其发生结直肠癌的风险是正常人群的2~4倍[22]。但最近的meta分析显示,溃疡性结肠炎(UC)患者平均随访14年后汇总标准化发病比为2.4(95% CI:2.1~2.7)[23]。我国一项多中心回顾性研究[24]表明,病程10年、20年、30年的UC患者发生结直肠癌的累积风险分别为1.2%、3.6%和14.4%。
4. 生活方式和饮食因素
(1)饮食:已有多项研究证明以摄入大量肉类、脂肪、糖和甜品为特点的西式膳食模式可增加结直肠癌发生风险[25]。高纤维饮食是结直肠癌的保护因素[26]。膳食模式与结直肠癌的相关性尚受性别、遗传等因素的影响。
(2)吸烟:吸烟人群结直肠癌发病风险是不吸烟人群的1.27倍,结直肠癌风险随日吸烟量、烟龄和累积吸烟量的增加而增高,烟龄>50年的人群发病风险较不吸烟人群增加38%。结直肠癌发病风险可随戒烟时间的延长和戒烟年龄的提前而降低[27]。
(3)超重或肥胖:超重或肥胖影响结直肠腺瘤的发生和癌变过程。体质指数(BMI)每增加5个单位,结直肠腺瘤的风险增加19%(RR 1.19);其发生风险独立于种族、地理分布、研究设计、性别等混杂因素[28]。
5. 2型糖尿病:与非糖尿病患者相比,2型糖尿病 患者的结直肠癌发生率增加27%,死亡率增加20%[29]。
(二)结直肠癌的报警症状
报警症状包括:消化道出血(黑便、血便等)、消瘦、腹泻、腹部肿块、排便习惯改变等。报警症状对结直肠癌的预测作用一直存在较多争议。国内大规模单中心研究[30]对超过1万例因下消化道症状就诊患者的结肠镜资料进行分析后发现,除腹部肿块外,其余报警症状对结直肠癌的预测作用极为有限,但有腹部肿块的患者绝大多数为晚期结直肠癌。因此在我国,有无报警症状并不能作为是否行结肠镜检查的决定因素。考虑我国结肠镜检查费用较为低廉、普及率高的现状,对有下消化道症状的患者建议行结肠镜检查排除肿瘤、炎症等器质性病变。
(三)结直肠癌风险分层
根据危险因素对不同人群进行个体化风险分层可筛选出高危受检者,具有重要临床意义。高危因素问卷是一种经济、可行的筛查方法,可通过病史、症状、家族史等筛选出高危人群,已在我国部分地区使用[31-33]。我国一项研究[34]发现,年龄、性别、吸烟史、糖尿病以及绿色蔬菜、腌制食品、油炸食品和白肉的摄入是结直肠癌的独立预测因素。2014年亚太结直肠癌筛查共识指出,年龄、男性、结直肠癌家族史、吸烟和肥胖是亚太地区结直肠癌和进展期腺瘤的危险因素,亚太风险评分可作为进展期结直肠肿瘤高危人群的筛选工具[35],适用于亚太地区无症状人群的结直肠癌筛查[36]。后续研究[37]提示基于我国无症状人群年龄、性别、吸烟、结直肠癌家族史、BMI和自诉糖尿病的评分系统可预测结直肠肿瘤的风险(包括腺瘤、进展期腺瘤和结直肠癌),有助于筛查方案的选择。根据该方案,并结合我国实际情况,可参考表1对患者进行风险评分:推荐高危患者(3~6分)行结肠镜检查,低危患者(0~2分)可考虑粪隐血筛查和(或)血清(浆)标记物筛查(如Septin 9 基因甲基化检测等)。

表1 预测结直肠肿瘤风险评分[37]
五、病理学
1. 分型:结直肠癌可分为腺癌、腺鳞癌、梭形细胞癌、鳞状细胞癌、未分化癌,其中腺癌又包括筛状粉刺型腺癌、髓样癌、微乳头癌、黏液腺癌、锯齿状腺癌、印戒细胞癌六个变型。非特殊类型腺癌依据腺样结构形成的比例,分为3个级别(高、中、低分化或1、2、3级)或2个级别(低级别、高级别)[38]。
2. 浸润深度分类:早期结直肠癌根据其浸润层次可分为黏膜内癌和黏膜下癌。黏膜下癌根据其浸润深度可分为SM1(癌组织浸润黏膜下层上1/3)、SM2(癌组织浸润黏膜下层中1/3)和SM3(癌组织浸润黏膜下层下1/3)。对于黏膜切除标本,SM1指癌组织浸润黏膜下层的深度<1 000 μm[39]。
3. 结直肠癌和癌前病变病理分型标准及其临床处理原则:参照1998年维也纳胃肠道上皮性肿瘤病理分型标准,根据不同内镜和病理诊断,选择不同的临床处理方式[40](表2)。
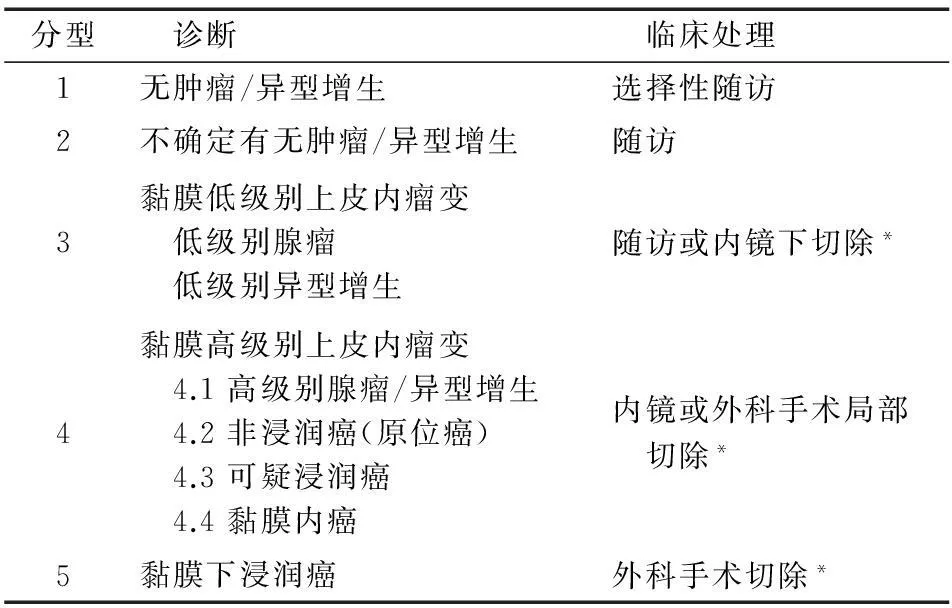
表2 胃肠道上皮性肿瘤维也纳分型(修订版)
*处理方式的选择由病变大小、浸润深度(通过内镜、放射影像学或内镜超声等评估)以及患者年龄、伴随疾病等因素共同决定
六、筛查
我国人口众多,直接采用结肠镜检查进行人群普查需消耗大量的人力、物力,且结肠镜检查有一定的并发症风险,因此对平均风险人群进行初筛,再针对高危人群行结肠镜精查,是行之有效的方法。
(一)筛查对象
多数亚洲国家设定50岁为结直肠癌筛查的起始年龄,我国50岁以上人群结直肠癌发生率显著上升,因此建议以50岁作为筛查的起始年龄。对75岁以上人群是否行筛查尚有争议,结合我国国情,暂不推荐对75岁以上人群进行筛查。由于40%~50%的结直肠癌患者无报警症状[30],因此不建议根据有无报警症状而纳入或排除筛查对象。
根据我国国情和结直肠癌的流行病学特征,符合以下①和②~③中任一项者均应列为高危人群,建议作为筛查对象:①年龄50~75岁,男女不限;②粪便隐血试验(FOBT)阳性;③既往有结直肠腺瘤性息肉,或UC、克罗恩病(CD)等癌前疾病。
遗传性非息肉病性结直肠癌(hereditary non-polyposis colorectal cancer, HNPCC):又称Lynch综合征,符合其诊断标准和家族中有HNPCC患者的人群应接受定期筛查,确证有MLH1或MSH2基因突变者,可从20~25岁或比家族中最小发病年龄早2~5年开始(若最小发病年龄低于25岁),每1~2年行结肠镜检查,35岁以后应每年检查[41]。而仅有MSH6[42]或PMS2[43]基因突变者结直肠癌发病年龄相对稍晚,可于25~30岁开始每2~3年行结肠镜检查,40~50岁后则应每1~2年检查。致病性突变基因未明确的家族可依据免疫组化染色和微卫星不稳定检测结果决定基因检测和筛查方案[44],非突变基因携带者按平均风险人群参与筛查,尚无法进行基因检测的家系原则上可参照突变阳性的家系进行规律监测以防漏诊。
APC基因相关性息肉病:包括经典的家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)、轻表型FAP(attenuated FAP, AFAP)、Gardner综合征、Turcot综合征等,应尽早行基因检测确诊,无症状家系成员也推荐接受检测。对确诊的APC基因相关性息肉病患者、无症状致病性APC基因突变携带者以及未行分子遗传学检测的家族成员应进行监测:从10~12岁开始,每1~2年进行一次乙状结肠镜或结肠镜检查;一旦发现腺瘤,则每年一次结肠镜检查,直至计划进行结肠切除术。AFAP推荐行全结肠镜检查,筛查开始年龄可稍推后(18~20岁)。确诊结直肠息肉病时或在25~30岁时(以时间较早者为准),应开始筛查结肠外病变,包括上消化道内镜(十二指肠腺瘤)、甲状腺癌、硬性纤维瘤等。
MUTYH相关息肉病(MUTYH-associated poly-posis, MAP):是一种高外显率常染色体隐性遗传病,临床表现类似AFAP,平均发病年龄为55岁左右。处理原则与AFAP相似,患者应从18~20岁开始,每两年进行一次结肠镜检查,并持续终身。
黑色素斑-胃肠多发息肉综合征(Peutz-Jeghers syndrome, PJS)的结肠镜筛查自18岁开始,每2~3年一次。幼年性息肉病(juvenile polyposis, JPS)15岁以前开始结肠镜检查,如发现息肉则每年一次,如未发现息肉则每2~3年一次。两者均需定期行上消化道内镜检查,同时不能忽视对小肠的监测,可行小肠镜或影像学检查。
(二)筛查方法
1. FOBT是结直肠癌无创筛查的重要手段,目前常用方法为愈创木脂法和免疫化学法。
(1)愈创木脂FOBT(gFOBT):价格低廉、检查便捷,人群筛查参与率相对较高,研究[45]证实其能降低结直肠癌的死亡率。但gFOBT检出结直肠癌及其癌前病变的敏感性较低[46],故无法显著降低结直肠癌的发病率。此外,其检查结果易受食物、药物等多种因素影响,假阳性率相对较高[47]。
(2)免疫化学FOBT(iFOBT):与gFOBT相比有更高的敏感性和特异性,且更为实用,检查结果不受食物或药物的影响,更适用于人群普查。
(3)序贯法FOBT方案:在gFOBT阳性的基础上加做iFOBT,如仍为阳性则行结肠镜检查[48]。我国大规模人群验证试验发现该方案具有较高的敏感性和特异性,可节约费用、降低结肠镜检查的工作量和患者的风险。
2. 血浆Septin 9基因甲基化检测:寻找外周血结直肠癌特异性分子标记物对提高受检者筛查依从性具有重要意义。甲基化Septin 9基因是结直肠癌早期发生、发展过程中的特异性分子标记物,血浆Septin 9基因甲基化检测已经过国内外多中心临床验证,第一代检测方法已在部分西方国家应用。第二代检测方法在技术方面有所改进,检出结直肠癌的敏感性高于第一代技术(79.3%~95.6%),特异性为84.8%~99%[49]。最近我国一项大规模临床试验发现该方法诊断结直肠癌的敏感性和特异性分别为74.8%和87.4%,两者均高于同期进行的iFOBT[50]。目前Septin 9基因甲基化检测已获国家食品药品监督管理总局(CFDA)批准(敏感性为74.8%,特异性为97.5%),可用于结直肠癌的早期诊断。
3. 其他无创筛查方法:虚拟结肠镜检查[51]、结肠胶囊内镜(CCE)[52]等依赖先进设备的无创筛查方法国外报道较多,但由于费用等问题,在我国推广有相当难度,患者因故无法接受其他结肠癌相关检查时可考虑使用。以多靶点粪便DNA检测[53]为代表的粪便检测在我国尚需进一步验证,而基于microRNA或代谢组学等的新兴无创筛查方法尚处于研究阶段。
4. 乙状结肠镜筛查:可显著降低平均风险人群结直肠癌的发病率和死亡率[54-55],但由于其自身的局限性,乙状结肠镜对近端结直肠癌发病率无明显降低作用[56]。37.9%的结肠腺瘤和42.4%的结肠癌位于近端结肠,因此单纯乙状结肠镜检查会遗漏大量结肠病变[57]。对需要行下消化道内镜检查者,建议行全结肠镜检查。
5. 结肠镜检查:结肠镜下活检病理检查是目前诊断结直肠癌的金标准,根据患者年龄、FOBT结果、结直肠癌家族史等危险因素筛选出结直肠癌高风险人群,进行有目的的结肠镜筛查是较为可行的诊断策略(图5)。
七、结肠镜检查
(一)检查前准备
1. 结肠镜诊断的准确性和治疗的安全性很大程度上取决于肠道准备的质量。本指南推荐服用2~3 L聚乙二醇(PEG)电解质等渗溶液,采用分次给药的方式进行肠道准备。PEG的口感对患者的依从性尤为重要。近年来,国内研发了PEG的新剂型,不含硫酸钠的PEG(SF-PEG)由于钾含量下降以及完全去除硫酸钠,气味和口味有所改善,患者耐受性和安全性更好,适用人群更广泛。理想的清洁肠道时间不应超过24 h,内镜诊疗最好于口服清洁剂结束后4 h内进行(麻醉结肠镜检查建议在6 h后进行)。对于不能获得充分肠道清洁的患者,可采取清洁灌肠、内镜下泵灌洗或第2天再次行加强的肠道准备。
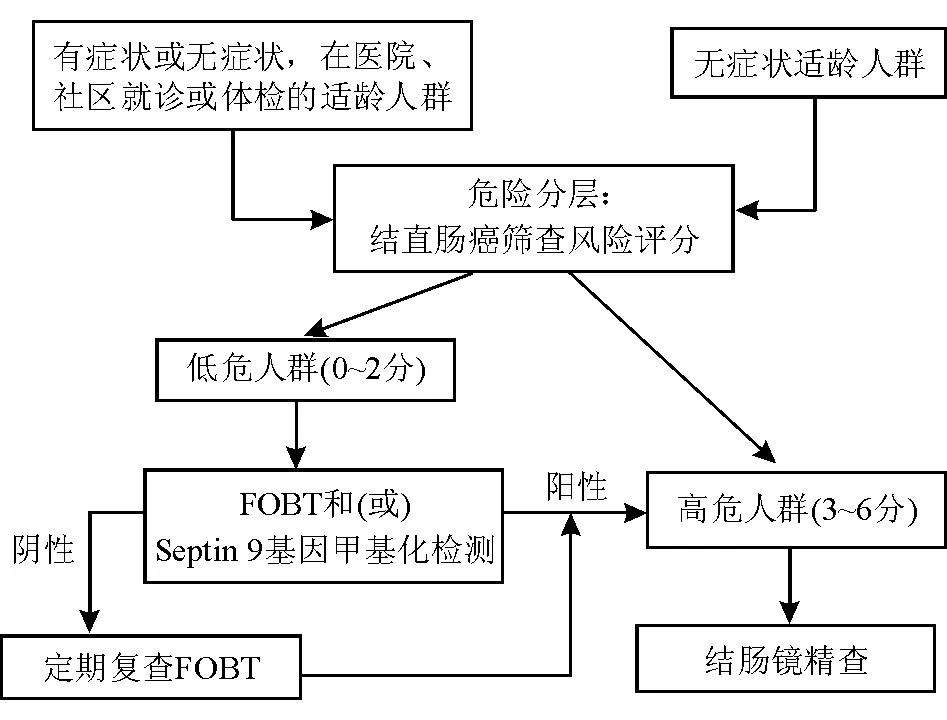
图5 早期结直肠癌筛查流程
2. 建议患者在结肠镜检查前1 d开始低纤维饮食,但对于饮食限制的时间不建议超过结肠镜检查前24 h。
3. 在结肠镜检查前给予解痉药,有条件的单位可在肠道准备时给予祛泡剂口服。
4. 有条件的单位可在麻醉医师配合下使用静脉麻醉,也可在有资质医师的监督下给予镇静、镇痛药,以提高受检者对内镜检查的接受度。
规范的肠道准备和静脉镇静或麻醉操作详见相关共识意见[58-59]。
(二)内镜检查过程
1. 检查前应做好解释工作以消除患者的恐惧感,进镜前先行肛门指诊以了解肛门和下段直肠情况。进镜时患者取左侧卧位,头部略向前倾,双腿屈曲。检查过程中根据情况可适当变动体位。
2. 内镜直视下从直肠开始循腔进镜直至回盲部,必要时可进入回肠末段观察。退镜时从回盲部、升结肠、横结肠、降结肠、乙状结肠、直肠依次退出,全面观察,尤其是皱襞后以及转折处。注意黏膜的色泽、光滑度、血供情况等,必要时可反转镜身观察升结肠、直肠末段和肛门部,退镜时间应不少于6 min[60],如发现可疑病变则需确定病变的具体部位和范围,并详细记录。检查过程中,如有黏液和气泡影响内镜视野,可用清水或祛泡剂及时冲洗。
3. 保证内镜图片数量和质量。为确保完整观察结肠和直肠,建议留图如下:回盲瓣1张,阑尾隐窝1张,盲肠、升结肠、肝曲、横结肠、脾曲、降结肠、乙状结肠、直肠应至少各留1~2张。如发现异常,需额外留图,同时需保证每张图片的清晰度。
(三)内镜检查技术
1. 普通白光结肠镜:隆起型早期结肠癌或癌前病变在普通白光结肠镜下较易识别,但扁平型病变不易被发现,检查时应仔细观察黏膜的细微变化(如局部色泽改变、局部呈结节状粗糙不平、轻微隆起或凹陷、毛细血管网中断或消失、黏膜质脆、易自发出血、肠壁僵硬、蠕动差或消失等)。
2. 放大内镜:可将病灶放大100~150倍,能观察结直肠黏膜腺管开口,即隐窝形态,可在不作黏膜活检的条件下判断病灶的组织学类型,对鉴别肿瘤性与非肿瘤性病变具有重要意义,并可对肿瘤的黏膜下侵犯程度进行较为准确的判断,为病变能否行内镜治疗提供依据。放大内镜下结直肠黏膜表面腺管开口的类型主要依据Kudo的腺管开口分型(图6)[61]。
3. 色素内镜:通过在局部喷洒染色剂以显示病变范围和黏膜表面形态,然后再用放大内镜观察结肠腺管开口形态,可提高结直肠癌早期诊断的准确性。常用染料包括靛胭脂、亚甲蓝、甲酚紫。
4. 电子染色内镜:窄带成像(narrow band imag-ing, NBI)技术、智能分光染色内镜(Fuji intelligent chromoendoscopy, FICE)、I-Scan等电子染色系统可通过对不同波长光的切换突出显示黏膜表面结构或微血管形态,清晰观察病变的边界和范围,获得与色素内镜类似的视觉效果。
研究提示,与普通高清白光结肠镜相比,应用这3种电子染色系统进行筛查并不能提高腺瘤性息肉的检出率[62],但是利用电子染色结合放大内镜观察黏膜腺管开口和黏膜表面微血管网,可对早期结直肠癌及其癌前病变的病理性质作出实时、准确的判断,为治疗方案的制订提供依据。电子染色系统鉴别肿瘤性与非肿瘤性结直肠息肉的敏感性约90%,特异性约85%[63],其中以NBI应用最为广泛,目前最常用的NBI分型是Sano分型。最新的“窄带成像国际结直肠内镜分型(narrow-band imaging international colorectal endoscopic classification, NICE分型)”不依赖放大内镜即可完成检查,较为简单实用,但其准确性尚需进一步验证。FICE、I-Scan的成像原理与NBI不同,其确切临床应用价值有待进一步验证。
5. 共聚焦激光显微内镜(confocal laser endo-microscopy, CLE):可将细微黏膜结构放大1 000倍,达到“光学活检”的目的,一般用于可疑病灶的精细观察。目前CLE对早期结直肠癌及其癌前病变的诊断价值研究结论并不一致,CLE还无法完全取代传统的组织病理学检查,尚不支持CLE在临床实践中常规使用[64-65]。
6. 自发荧光成像(autofluorescence imaging, AFI):可将活体组织的自发荧光转化为图像加以分析,主要根据不同色调区分肿瘤性病变与正常黏膜。其对设备要求较高,早期临床研究结论差异较大,目前并未在临床上推广应用。
7. 蓝激光成像(blue laser imaging, BLI):采用激光光源,弥补了白色光源难以发现黏膜表面细微结构的不足,提高了病变部位的可辨识度。BLI对结直肠肿瘤浸润深度的诊断准确性与NBI相似[66]。在我国,相关临床研究有待进一步开展。
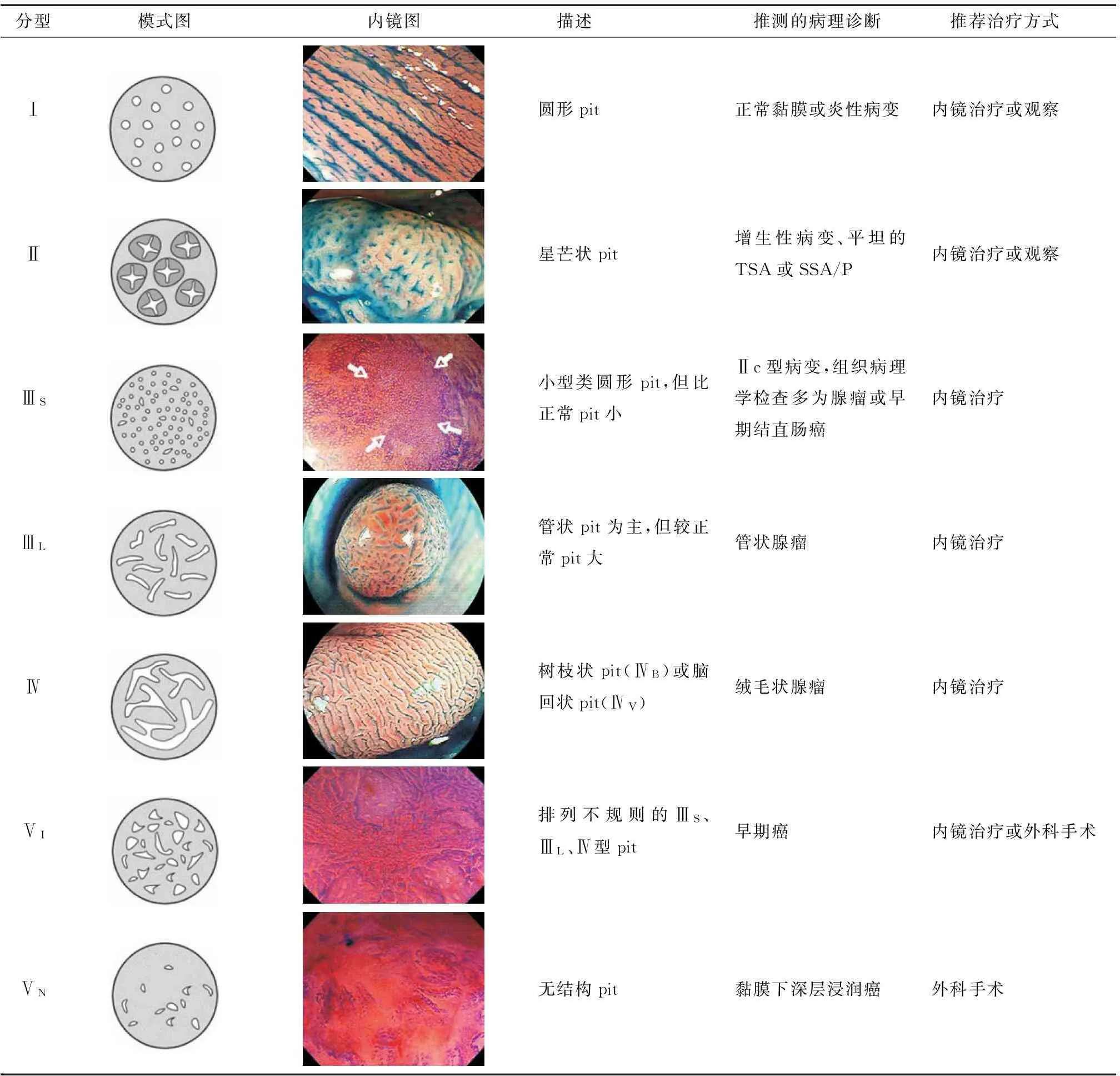
分型模式图内镜图 描述 推测的病理诊断 推荐治疗方式Ⅰ圆形pit正常黏膜或炎性病变内镜治疗或观察Ⅱ星芒状pit增生性病变、平坦的TSA或SSA/P内镜治疗或观察ⅢS小型类圆形pit,但比正常pit小Ⅱc型病变,组织病理学检查多为腺瘤或早期结直肠癌内镜治疗ⅢL管状pit为主,但较正常pit大管状腺瘤内镜治疗Ⅳ树枝状pit(ⅣB)或脑回状pit(ⅣV)绒毛状腺瘤内镜治疗ⅤI排列不规则的ⅢS、ⅢL、Ⅳ型pit早期癌内镜治疗或外科手术ⅤN无结构pit黏膜下深层浸润癌外科手术
图6结直肠pit pattern分型[61]早期结直肠癌或癌前病变的内镜下检查应以普通白光结肠镜检查为基础,在退镜过程中全面、细致地观察结直肠的各个部分,发现黏膜颜色、血管、形态等可疑改变时,根据设备状况和个人经验,综合使用染色内镜、放大内镜、CLE、荧光内镜等特殊技术以进一步了解病变的大小、范围、浸润深度等详细信息。
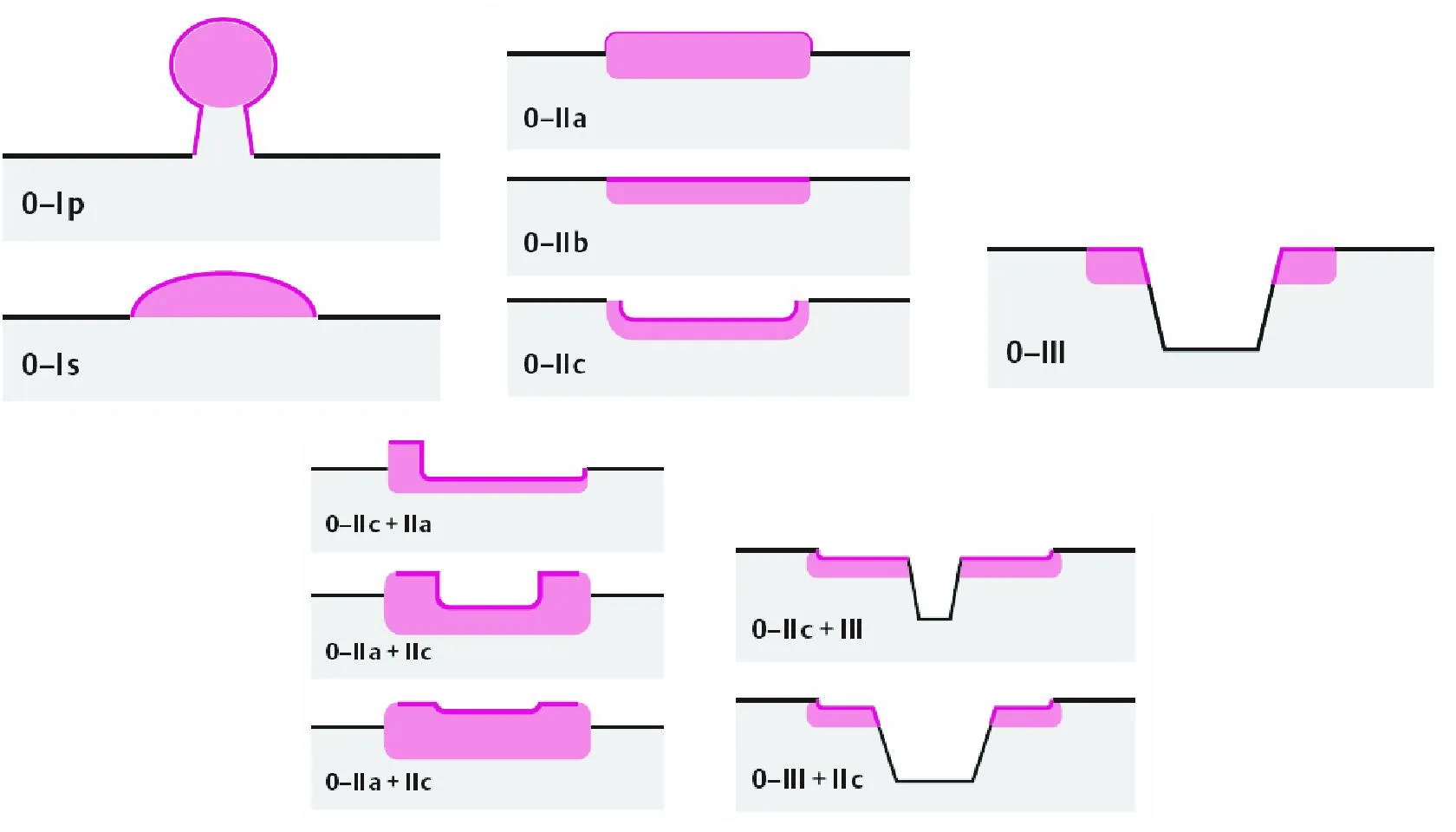
(四)早期结直肠癌的内镜分型
参照巴黎分型标准[39,67](图7)。
(五)组织病理学检查
1. 如普通白光结肠镜、染色内镜等特殊内镜技术观察后未发现可疑病灶,则无需活检。
2. 对可疑病变是否进行活检,需根据病变的性质和大小综合确定。可按照以下标准进行:对较小的隆起型病变,可先取1~2块组织,也可不行活检而尽早完整切除病变后送检。对较大的隆起型病变,建议取2~4块组织。对平坦型病变,单一部位活检不能反映病变全貌,多块活检则可能导致黏膜层与黏膜下层纤维化,增加后续内镜切除的难度,建议不进行活检而尽早整块切除病变后送检[68]。若具备NBI等高级内镜检查手段,在获得患者知情同意的前提下,可施行诊断性内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)。病理标本的具体处理过程详见我国相关共识意见[69]。
八、结肠镜质量控制
随着结肠镜技术的发展和对结肠镜认识的深入,结肠镜检查的质量控制逐渐受到关注,高质量的结肠镜检查是筛查项目成功的关键[35]。以下为目前较为公认的高质量结肠镜检查标准。
1. 良好的肠道准备比率应>85%。多数研究表明,肠道准备一般和较好时,结肠镜的腺瘤检出率相当[70];如肠道准备不充分,腺瘤检出率将显著降低,漏诊率显著上升[71]。在结肠镜报告中须描述肠道准备情况。目前已有多种肠道准备评分量表,波士顿量表在主动冲洗和吸引肠道之后进行评定,当评分≥5分时,息肉检出率可达40%,<5分时,息肉检出率降至24%[72],其具有稳定性较高、不同肠段的评分与该肠段息肉检出率相关且方便学习、推广等优点。此外,Ottawa评分和Aronchick评分已完成临床验证,也可作为肠道准备的评分标准。
2. 盲肠插镜率>95%。完成全结肠检查对预防结直肠癌具有重要意义,盲肠插镜率高于95%的内镜医师,其患者的间期癌发病率显著低于盲肠插镜率低于80%的内镜医师对应的患者[73]。
3. 退镜时间:与平均退镜时间<6 min的内镜医师相比,退镜时间>6 min者瘤变检出率显著提高(28.3% 对11.8%);中位退镜时间为9 min的内镜医师腺瘤、锯齿状息肉检出率最高[74]。鉴于我国国情,推荐退镜时间应至少保证6 min[75-76]。
4. 腺瘤检出率(adenoma detection rate, ADR):在50岁以上首次就诊的无症状平均风险人群中,ADR应>20%,男性>25%,女性>15%[77],近年来
图7早期结直肠癌内镜下分型(巴黎分型,2005年)[39]
该标准在欧美有提高的趋势。ADR被认为是与结肠镜检查质量相关性最高、最重要的指标;ADR每增加1.0%,相应的间期癌发病率将降低3.0%,ADR>33.5%的内镜医师组的患者间期癌风险最低[78]。但目前我国关于ADR的研究报道较少[79],在中国人群中能否使用上述界值,还有待进一步研究。
5. 穿孔率<1‰,息肉切除术后出血率<1%。控制结肠镜相关并发症发生率也是结肠镜质量控制的重要组成部分[80]。我国三级甲等教学医院的结肠镜穿孔率[81]和息肉切除术后出血率[82]均能达到上述标准,但缺乏国家级大样本数据和其他等级医院的相关数据。
九、术前评估
术前准确判断肿瘤浸润深度、范围以及有无淋巴结侵犯是选择合理治疗方式的关键。对肿瘤浸润范围的判断主要借助染色内镜和电子染色内镜[83],浸润深度的判断则主要依据病变大体形态、放大染色观察病变腺管开口分型、NBI分型等,超声内镜也可提供有用的信息,但目前缺乏统一的标准,受操作者水平影响较大,准确的评估仍依据术后病理诊断。以下为临床常用基本评估方法。
1. 大体形态:0-Ⅱa或0-Ⅱb病变以及颗粒均一型LST发生黏膜下或更深层次浸润风险较低(<2%),0-Ⅱc病变、非颗粒型和结节混合型LST黏膜下浸润风险则相对较高(>36%)。0-Ⅱc病变越大,黏膜下浸润癌风险越高,直径>1 cm的病变黏膜下浸润风险>70%[67]。结节混合型LST中,直径≥10 mm的结节易发生黏膜下浸润,最大的结节处浸润最深[84];非颗粒型LST中约30%表现为多灶性黏膜下浸润,凹陷处更为明显。
2. 腺管开口分型:日本工藤分型与病理诊断高度相关已得到公认[85],其中Ⅴ型腺管开口的细分对判断浸润深度有很大帮助,可分为ⅤI型(轻度不规则ⅤI型、重度不规则ⅤI型)和ⅤN型,目前认为轻度不规则ⅤI型癌浸润深度<1 000 μm,重度不规则ⅤI型和ⅤN型癌浸润深度则>1 000 μm[86]。
3. NBI分型:近年来推行的NICE分型试图不使用放大技术,在NBI高清结肠镜观察下综合评判病变的颜色、微血管结构和表面分型,较为简单易用。NICE 1型和NICE 2型能实时有效地区分增生性息肉和腺瘤[87],NICE 3型则能识别浸润超过1 000 μm 的黏膜下癌[88],但其准确性还存有争议,尚待在我国人群中进一步验证。
4. 内镜超声(endoscopic ultrasound, EUS)检查:包括普通EUS、小探头EUS(mini-probe EUS,mEUS)和直肠腔内超声(endorectal ultrasound, ERUS)。mEUS有利于发现适合内镜切除的T1病变[89-90],而判断N分期宜选用12 MHz的mEUS[91];ERUS则可精确评估中低位直肠肿瘤的浸润深度(T分期),准确性优于CT和MRI[92];EUS判断N分期的准确性欠佳,难以区分炎性和转移性淋巴结[93]。
5. CT检查:主要用于判断结直肠癌有无远处转移(准确度95%),对T分期(准确度67%)和N分期(准确度69%)的诊断作用有限[94]。推荐行增强CT检查,如有禁忌则可行增强MRI检查。
6. MRI检查:是直肠癌术前评估的重要检查,对治疗方式的选择有重要作用[92,95]。
7. 正电子发射计算机断层扫描(PET-CT):在判断有无局部或远处转移方面并不显著优于CT或MRI,且检查费用较高,故不推荐常规应用PET-CT对早期结直肠癌淋巴结侵犯进行评估[96]。
所有结直肠肿瘤疑有癌变时均应在白光和染色内镜下仔细观察,有条件时可行放大内镜和电子染色内镜检查以判断可能的浸润深度,预测淋巴结转移的风险。对0-Ⅱc病变、非颗粒型以及结节混合型LST,建议常规使用染色放大或电子染色内镜(NBI)评估黏膜下和深度浸润癌风险。除内镜下精细观察外,考虑到成本效益因素,本指南推荐早期结肠癌术前评估使用增强CT检查,有条件时可选用mEUS;早期直肠癌的术前评估则推荐使用ERUS和增强MRI检查。不推荐PET-CT作为常规评估方法。
十、治疗
(一)治疗原则
与传统外科手术相比,内镜下切除具有创伤小、并发症少、恢复快、费用低等优点,且疗效相当,5年生存率均可达到约90%[97-99]。原则上,无淋巴结转移或淋巴结转移风险极低、使用内镜技术可以完整切除、残留和复发风险低的病变均适合行内镜下切除(图8)。
(二)内镜切除术
早期结直肠癌常用的内镜切除技术主要包括常规内镜下息肉切除术、内镜黏膜切除术(endoscopic mucosal resection, EMR)、ESD等。
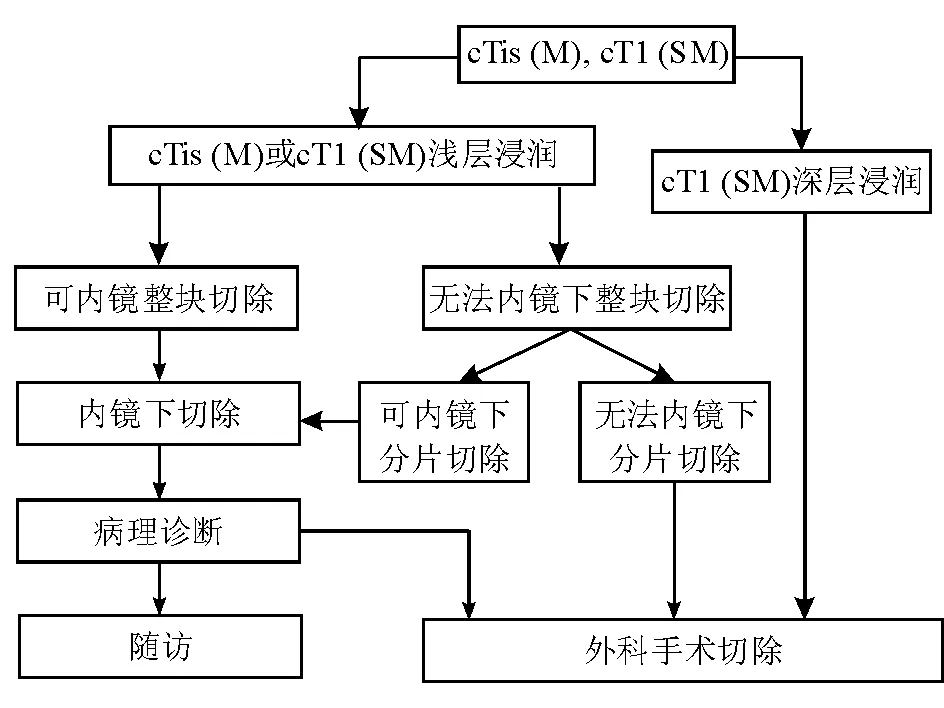
图8临床诊断为早期结直肠癌的内镜处理原则
前缀“c”:临床分型,基于选择治疗方式前的临床评估结果,对指导治疗方式的选择(内镜切除、外科手术切除和姑息治疗)至关重要,同时为评估治疗方法的效能提供依据;Tis、T1对应TNM分期中相应的T分期;M:黏膜层;SM:黏膜下层
1. 常规内镜下息肉切除术:高频电圈套法息肉切除术是切除直径>5 mm隆起型病变的常用方法,但对于直径>1 cm的广基病变有一定的不完全切除率,如怀疑伴绒毛成分、SSA/P癌变,应考虑行EMR[100]。热活检钳钳除术存在病变残留率高、对标本的组织结构有破坏、在右半结肠使用时迟发性出血和穿孔风险高等缺点,不推荐作为一线治疗方案[101]。冷圈套、冷活检钳技术也可用于较小息肉的安全摘除,但尚缺乏在早期结直肠癌中应用的证据,一般不用于切除可疑恶性的病变。
2. EMR
(1)定义:指内镜下将黏膜病灶整块或分块切除,用于胃肠道表浅肿瘤的诊断和治疗。
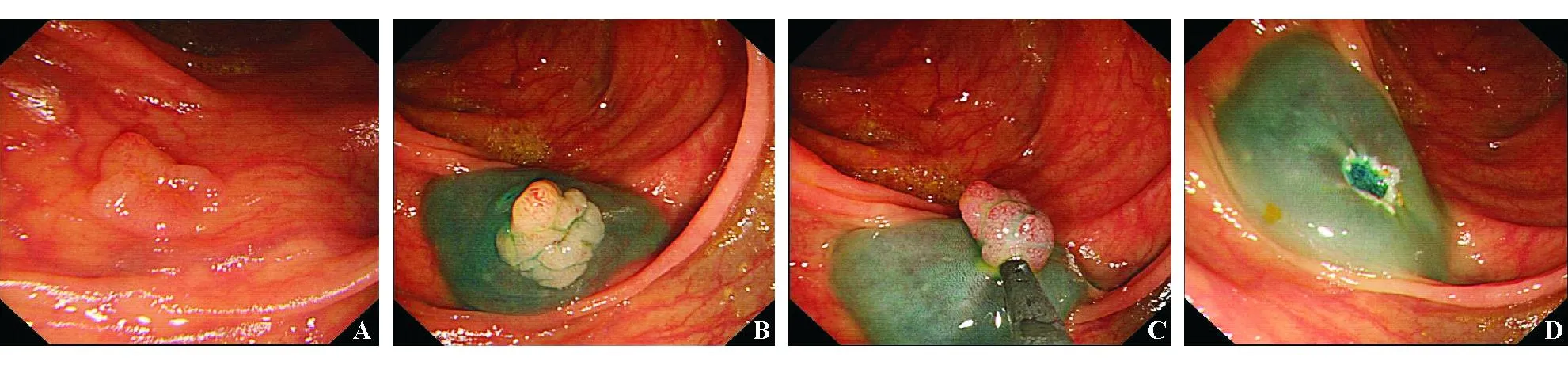
(2)分类:大致分为两种基本类型:非吸引法(黏膜下注射-切除法)和吸引法(透明帽法和套扎法)。其中,黏膜下注射-切除技术最常见,而透明帽或套扎技术使用较少,因切除病变大小有限并有全层切除的风险,用于切除结肠病变尤应慎重。内镜分片黏膜切除术(endoscopic piecemeal mucosal resection, EPMR)用于传统EMR不能一次完整切除的较大病灶,该技术将病灶分为几部分多次切除,适用于直径>2 cm的巨大平坦型病变。分片切除的组织标本体外拼接困难,影响精确的病理学评估,局部残留/复发风险高,分片较多者应密切随访[102]。EMR操作步骤详见图9。
(3)疗效:国外EMR治疗早期结直肠癌的整块切除率约为85%,治愈性切除率为68.6%~86%[103-104],当病变≥20 mm时,整块切除率仅为19.9%~30.7%[105-106]。国内缺乏EMR治疗早期结直肠癌的大宗病例报道,整块切除率为71.7%~87.4%,累积完整切除率为70.6%~91.7%[107-108],平坦型结直肠肿瘤的治愈性切除率>90%[109-110]。
3. ESD:其治疗早期结直肠癌的整块切除率和完全切除率更高,局部复发率更低。
(1)定义:是在EMR基础上发展起来的新技术,对不同部位、大小、浸润深度的病变,在进行黏膜下注射后使用特殊电刀,如IT刀、Dual刀、Hook刀等[111],逐渐分离黏膜层与固有肌层之间的组织,将病变黏膜和黏膜下层完整剥离的方法。
(2)操作步骤:①黏膜下注射,使病灶明显抬举;②部分或环周切开黏膜;③黏膜下剥离,使黏膜与固有肌层完全分离,一次完整切除病灶;④创面处理:包括创面血管处理和边缘检查;⑤标本处理和送检。因黏膜下注射前后大多数结直肠肿瘤边缘清晰可见,可省略标记步骤。ESD操作步骤详见图10。
(3)操作技术难度:结直肠ESD相对于上消化道ESD有其自身鲜明的特点,结肠肠壁菲薄、部分肠段相对游离、肠腔操作空间小等解剖因素决定其操作难度较大。困难ESD指操作时间长(一般超过120 min[112]或150 min[113])、出现穿孔、无法整块切除[113]等。增加ESD难度的因素包括:游离肠段[113-114]、病变累及≥2个皱襞、巨大肿瘤(如直径≥4 cm[112]或≥5 cm[113])、有瘢痕的病变或局部复发的病变[113](严重纤维化)等。
(4)疗效:在亚洲,ESD治疗早期结直肠肿瘤的整 块切除率为88.0%~98.3%,完全切除率为89.0%~92.0%[97,115-116],而欧洲中心的ESD整块切除率为67.1%~78.6%,完全切除率为62.4%~74.0%[117-118]。目前日本在处理结直肠病变时,ESD主要用于治疗最大径在2~5 cm之间的结直肠腺瘤和早期结直肠癌。国内结直肠ESD的发展极不均衡,只有少数大中心能常规开展该技术,整块切除率为85.5%~98.3%,治愈性切除率为83.3%~97.6%。结直肠ESD与腹腔镜辅助外科手术疗效相当,但并发症风险更小[119],相对于常规内镜切除和EMR,完整切除的优势非常明显[120]。
4. 其他内镜治疗方法:包括氩离子凝固术(argon plasma coagulation, APC)、光动力治疗(photodynamic therapy, PDT)、 激光疗法、 微波治疗等,但这些方法
A:横结肠Is型病变; B:黏膜下注射含靛胭脂的甘油果糖,病变充分抬举; C:收紧圈套器,并微微抬起,通高频电切除; D:术后仔细检查创面
图9EMR操作步骤
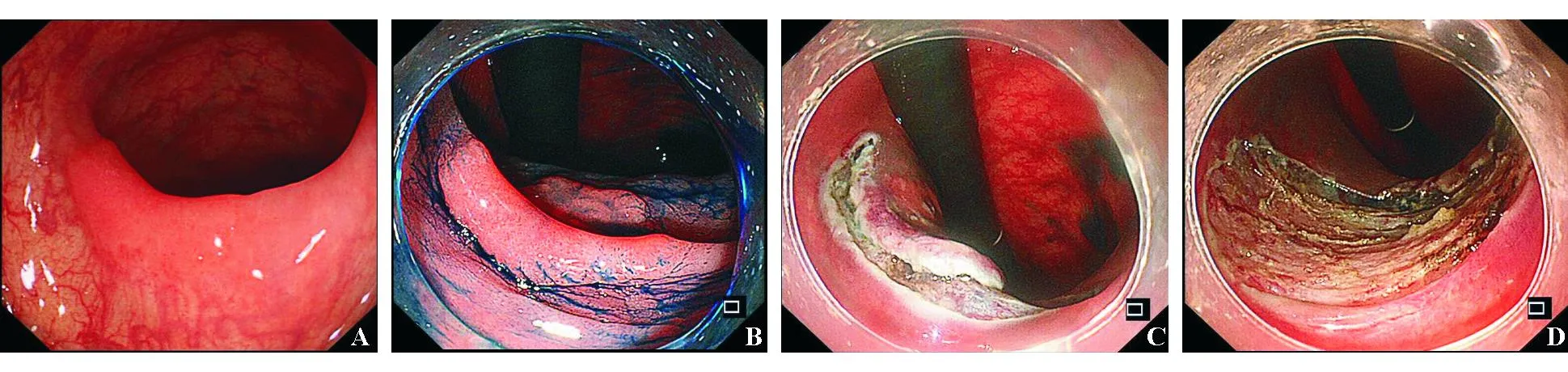
A:横结肠LST病变; B:染色后确定病变范围; C:黏膜下注射后剥离病变; D:病变完全剥离并完整切除后检查创面
只能去除肿瘤,不能明确病理学诊断,也无法肯定肿瘤是否获得根治,因此不建议作为早期结直肠癌的首选治疗方法,而只可作为无法耐受手术或内镜切除患者的治疗选择,治疗后需密切随访。
(三)适应证和禁忌证
内镜下切除治疗主要用于淋巴结转移风险低且可能完整切除的结直肠癌病变。目前国内尚无统一规范的内镜切除适应证,多以参考日本指南为主。
高频电圈套息肉切除术和EMR在我国已广泛开展,结直肠ESD虽不如日韩普及,但较欧美发展基础好。随着越来越多的医师掌握上消化道ESD技术,结直肠ESD将逐步发展和普及。本指南推荐的早期结直肠癌及其癌前病变内镜切除适应证和禁忌证见表3、表4。
(四)围手术期处理
1. 术前准备:评估患者全身状况,排除麻醉和内镜治疗禁忌证。向患者及其家属详细说明内镜切除治疗的相关事项,签署知情同意书。所有患者行心电监护,特殊情况可应用丙泊酚静脉麻醉。患者术前必须行凝血功能检查,如异常应予纠正后再行治疗。对服用抗凝药者,酌情停药5~7 d,必要时请相关学科协助处理[121]。术前应充分肠道准备[58,122],预计ESD操作时间较长者,如有条件,术中可使用CO2气泵。
2. 术后处理:术后第1天禁食;密切观察血压、脉搏、呼吸等生命体征的变化,进行必要的实验室检查,如临床表现和相关检查无异常,术后第2天进食流质或软食。

表3 早期结直肠癌及其癌前病变内镜切除适应证

表4 早期结直肠癌及其癌前病变内镜切除禁忌证
(1)术后用药:对于术前评估切除范围大、操作时间长、肠道准备差、穿孔风险高者,可考虑预防性使用抗菌药物。参考卫生部抗菌药物使用原则,选用第二代或第三代头孢菌素,可加用硝基咪唑类药物。术后用药总时间一般不超过72 h,但可酌情延长。评估认为出血风险较大者,可酌情使用止血药物。
(2)术后标本处理:术后对整块切除的标本进行冲洗和展平,黏膜面朝上固定于平板上,观察、测量并记录新鲜标本的大小、形状、黏膜病变的肉眼所见(大小、形状、颜色、硬度等),区分口侧断端和肛侧断端,拍照后将标本黏膜面朝下全部浸没于固定液中送检。病理申请单应提供详细的临床病史、推测的浸润深度、临床诊断和关注点。病理学取材、制片染色和规范化病理学报告参见《中国消化内镜活检与病理学检查规范专家共识(草案)》[69]。
(3)术后追加外科手术指征:当垂直切缘阳性时,需追加外科手术。如存在以下征象,建议行肠切除+淋巴结清扫术:黏膜下浸润深度≥1 000 μm,淋巴管、血管浸润阳性;低分化腺癌,印戒细胞癌或黏液癌,浸润最深部位有高级别肿瘤芽(2或3级)[123-124],带蒂息肉如有蒂浸润。日本两项大规模多中心研究[98-99]对行内镜切除的黏膜下浸润结直肠癌患者进行长期随访,发现垂直切缘阴性、中或高分化腺癌、无淋巴、血管侵犯和黏膜下浸润深度<1 000 μm 的患者(低危组),内镜切除术后追加与不追加外科手术远期预后相当,而高危组特别是高危直肠癌患者推荐追加外科手术(图11)。
(五)操作相关并发症及其处理
早期结直肠癌及其癌前病变内镜下切除虽属微创手术,但仍存在一定的并发症,以ESD更为常见,主要包括出血、穿孔、电凝综合征等(表5)。
1. 出血:术中出血指术中需要止血治疗(如电凝或止血夹止血)的局部创面出血;术后出血指术后2周内需急诊留观、住院或干预处理(再次行结肠镜干预或血管造影栓塞或外科手术)的出血,多发生在术后48 h内[133]。
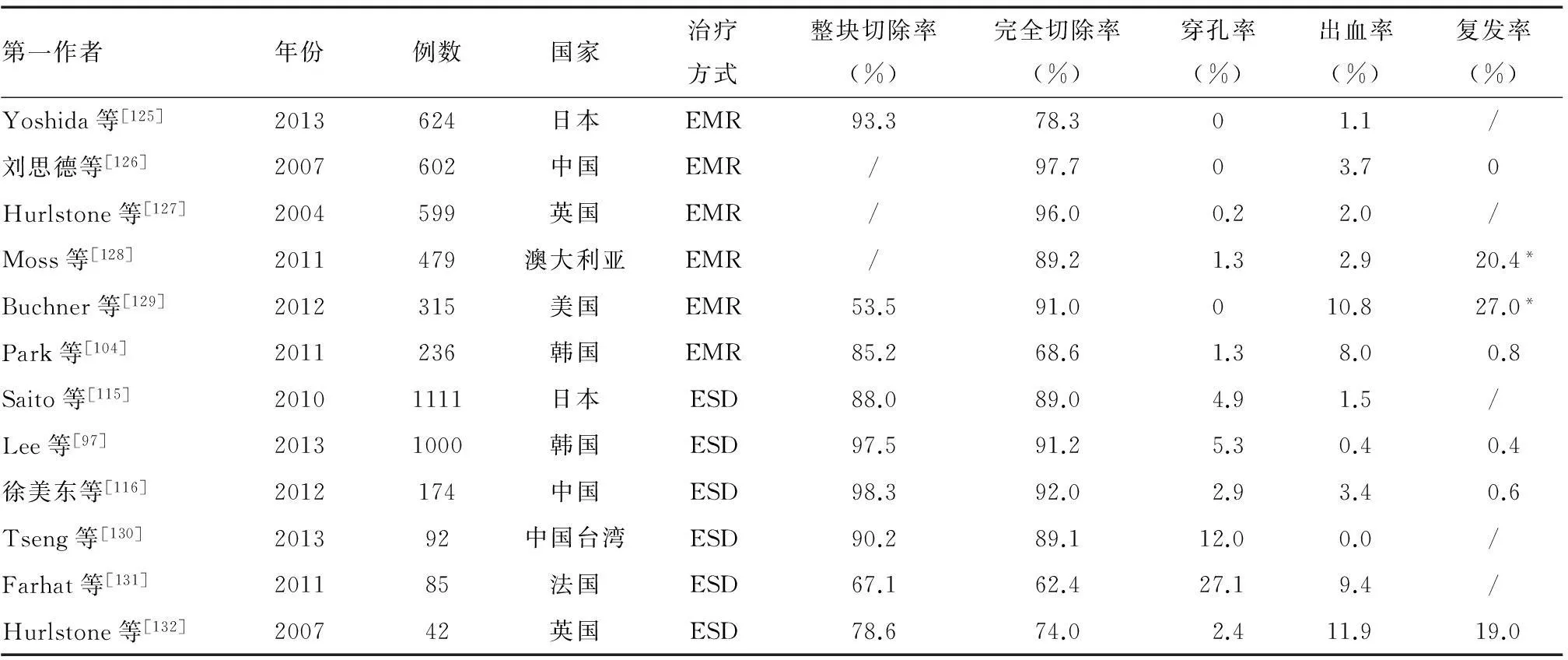
表5 各国EMR、ESD疗效和并发症发生情况
注: EMR部分为EPMR; “/”为无此数据; “*”为复发/残留率
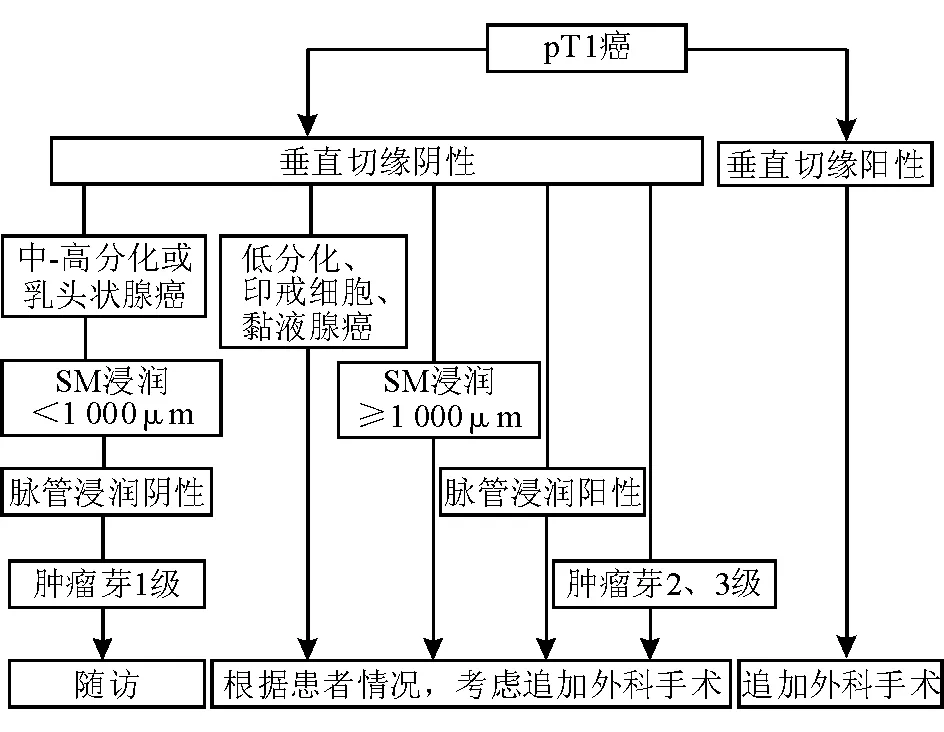
前缀“p”:病理分型,基于内镜切除标本病理诊断补充或修订后的临床分型
图11黏膜下浸润结直肠癌内镜下切除后处理流程
出血发生率:国外文献报道,EMR术中出血率为1.8%~18%[127,134],术后出血率为0.2%~7.2%[106,127,129],ESD术后出血率为0~3.6%[135-136]。研究发现EMR术中出血与病变较大、0-Ⅱa + Ⅰs病变、病变含绒毛成分以及操作者经验不足有关;病变位于右半结肠、近期服用阿司匹林、使用无微处理器控制的电切模式和术中出血者也易发生术后出血[105-106]。直肠病变是ESD迟发出血的独立危险因素[137]。国内EMR术中出血率为1.0%~3.1%[109,126],术后出血率为0.6%~3.0%[109-110],ESD的术中出血率为0~15.6%[138-139],术后出血率为1.4%~12.5%[140-141]。有报道显示,病变>20 mm是EMR术后发生并发症的独立危险因素[142]。对659例患者行下消化道ESD,发生迟发性出血10例,多位于低位直肠[143]。
止血原则和处理方法:术中出血多为自限性,少量渗血可电凝处理,喷射性出血可使用金属夹止血,ESD术中出血则因影响后续黏膜下剥离而较少使用止血夹。ESD术中如在黏膜下发现较小血管,可用电刀或APC直接电凝[144]。既往研究认为应在内镜切除术后常规使用APC或活检钳对创面可见血管进行处理,但最新随机对照研究[145]发现,对创面可见血管预凝并不能显著降低较大病变EMR后的迟发出血风险。大多数术后出血是自限性的,若患者循环情况稳定,无需内镜止血;如支持治疗后患者循环情况仍不稳定,则需于急诊结肠镜下进行确切止血,此时不推荐对创面出血点行热凝止血,因为可增加透壁损伤和穿孔风险[144]。
2. 穿孔:术中穿孔多能即刻发现,如操作结束后腹部平片发现膈下游离气体、CT发现腹腔游离气体或查体见明显广泛腹膜刺激征等,应考虑为术后穿孔。
穿孔发生率和危险因素:国外文献报道EMR穿孔率<1.5%[104,128],ESD穿孔率为0.8%~20.4%[146-147],国内ESD穿孔率为2.9%~14.5%[116,138-139,141,148-149]。复杂EMR和ESD是穿孔的高危因素,其他还包括使用热活检钳、操作医师经验不足等。LST病变、肿瘤较大和病变纤维化是ESD穿孔的危险因素,黏膜下注射透明质酸则为保护因素[97,146]。操作中应注意抽吸肠道内气体,可能有利于预防穿孔发生。
穿孔治疗原则和处理方法:穿孔早期发现后如肠道准备良好、无肠内容物漏入腹腔,应立即内镜下夹闭,如创面可有效夹闭且无弥漫性腹膜炎[150],保守治疗有望成功。早期内镜修复和使用CO2气体可减少外科手术率。内镜下使用金属夹早期夹闭10 mm以内的穿孔成功率>90%[151],国外研究证实OTSC(over-the-scope clip)系统可安全、有效地处理更大的穿孔[152],但需进一步临床评估。对临床疑有穿孔者,在影像学确诊前即可立即行经验性治疗,对怀疑和确诊穿孔的患者须密切监护生命体征,补液、静脉应用广谱抗菌药物。外科手术的适应证是内镜修补困难或失败和持续肠内容物漏出所致腹膜炎。一般穿孔超过4 h而未行内镜下夹闭处理的患者建议外科手术治疗。
3. 电凝综合征:又称息肉切除术后综合征或透壁综合征,表现为结肠病变高频电切除后出现的局限性腹痛、发热、白细胞升高、腹膜炎而无明显穿孔征象,发生率约为0.003%~0.1%[153]。高血压、病变 较大、形态平坦是电凝综合征的独立危险因素[154]。直肠和乙状结肠病变ESD术后电凝综合征发生风险较低,位于其他肠段、直径>30 mm的病变术后需密切观察[155]。对电凝综合征患者一般采取静脉补液、使用广谱抗菌药物、禁食直至症状消失等措施,通常能获得良好预后。
(六)术后处理
1. 术后复发率:国外报道,常规EMR局部复发率为0.8%~7.2%[103-104,134,156],EMR或EPMR切除较大结直肠病变后局部复发率较高,困难病例的局部残留/复发率甚至高达20.4%~27%[128-129],meta分析发现,EMR切除结直肠无蒂病变的中位局部复发率达15%,分片切除复发率高达20%,而整块切除后复发率仅为3%,分片切除是复发的惟一独立危险因素[11,102]。结直肠ESD的局部复发率仅为0~2.0%[97,157-158],与EMR相比,ESD局部复发的OR值为0.09[159]。国内文献报道EMR复发率为0~3.2%[110,142],ESD局部复发率为0~4.9%[116,138,140]。
2. 复发的预防和处理:切除病变后应仔细检查创面,有条件者建议使用染色或NBI观察,发现可见残留时尽量使用圈套器切除。研究[160]提示,使用APC电凝治疗复发风险高,可控性差。
3. 随访:国内较为公认的是治愈性切除后6个月和12个月各复查1次结肠镜,此后每年复查1次,并行肿瘤标记物和相关影像学检查。一般认为分片切除的病例,按评估复发风险不同在3~6个月内行首次复查为宜[161]。
(七)结肠息肉/腺瘤切除术后随访
根据国内外相关共识意见,结合我国实际情况,结肠息肉/腺瘤切除术后的随访间隔参考表6。

表6 结肠息肉/腺瘤切除术后随访间隔
注:初次结肠镜检查为肠道准备良好、到达回盲部、保证足够退镜时间的高质量结肠镜检查,并完整切除所有病变。若初次结肠镜检查质量较低,可适当缩短随访间隔。
锯齿状息肉病综合征:按照WHO 2010标准,定义为:符合以下一项标准:①乙状结肠近端的结肠中发现≥5个锯齿状病变,且2个或2个以上直径>10 mm;②有锯齿状息肉病家族史的受检者在乙状结肠近端的结肠发现任何锯齿状病变;③>20个锯齿状病变,且分布于整个结肠。
参与本指南制订的专家(按姓氏拼音排序):柏愚(上海长海医院消化内科)、包郁(四川省肿瘤医院内镜科)、蔡全才(上海长海医院消化内科)、陈星(山西省人民医院消化内科)、杜奕奇(上海长海医院消化内科)、戈之铮(上海仁济医院消化内科)、郭强(云南省第一人民医院消化内科)、韩树堂(江苏省中医院消化病诊疗暨内镜中心)、郝建宇(北京朝阳医院消化内科)、何利平(福建省立医院消化内科)、Kwong Ming Fock (霍光明,新加坡樟宜综合医院消化内科)、姜泊(北京清华长庚医院消化内科)、姜慧卿(河北医科大学第二医院消化内科)、金木兰(北京朝阳医院病理科)、李建生(郑州大学第一附属医院消化内科)、李汛(兰州大学第一医院普外二科)、李延青(山东大学齐鲁医院消化内科)、李兆申(上海长海医院消化内科)、厉有名(浙江大学附属第一医院消化内科)、廖专(上海长海医院消化内科)、刘吉勇(山东省立医院消化内科)、刘思德(广州南方医科大学南方医院消化内科)、吕宁(中国医学科学院肿瘤医院病理科)、吕农华(南昌医科大学第一附属医院消化内科)、马颖才(青海省人民医院消化内科)、彭贵勇(重庆西南医院消化科)、任旭(黑龙江省医院消化内科)、盛剑秋(北京军区总医院消化内科)、施宏(福建省肿瘤医院内镜科)、施瑞华(江苏省人民医院消化科)、苏秉忠(内蒙古医科大学附属医院消化内科)、William Tam(谭达恩,澳大利亚Lyell McEwin医院消化内科)、唐秀芬(黑龙江省医院消化病院)、唐涌进(《中华消化内镜杂志》编辑部)、王邦茂(天津医科大学总医院消化内科)、王贵齐(中国医学科学院肿瘤医院内镜科)、王实(浙江省肿瘤医院内镜中心)、吴齐(北京大学肿瘤医院内镜中心)、夏玉亭(沈阳军区总医院消化内科)、项平(上海华东医院消化内科)、徐国良(中山大学附属肿瘤医院内镜科)、徐红(吉林大学第一医院胃肠内科)、杨爱民(北京协和医院消化内科)、于恩达(上海长海医院肛肠外科)、于红刚(武汉大学人民医院消化内科)、于皆平(武汉大学人民医院消化内科)、袁媛(中国医科大学附属第一医院肿瘤研究所)、张子其(解放军总医院消化内镜中心)、智发朝(广州南方医科大学南方医院消化内科)、郑建明(上海长海医院病理科)
主要执笔者:上海长海医院消化内科柏愚、杨帆、马丹、邹文斌
图6根据文献61修改,经Elsevier出版公司授权。
参考文献
1 International Agency for Research On Cancer. World Health Organization. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012[EB/OL][2014-12-15]. http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx.
2 DeSantis CE, Lin CC, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (4): 252-271.
3 卫生部医政司, 结直肠癌诊疗规范专家工作组. 结直肠癌诊疗规范(2010年版)[J]. 中华胃肠外科杂志, 2010, 13 (11): 865-875.
4 中华人民共和国国家卫生和计划生育委员会医政司. 结直肠癌诊疗质量控制指标(试行)[EB/OL][2014-12-15]. http://www.moh.gov.cn/mohyzs/s3586/201203/54250.shtml.
5 中华医学会消化内镜学分会肠道学组. 中国早期大肠癌内镜诊治共识意见(天津, 2008 年 8 月 30 日)[J]. 中华消化内镜杂志, 2008, 25 (12): 617-620.
6 中华医学会消化病学分会. 中国结直肠肿瘤筛查、早诊早治和综合预防共识意见[J]. 胃肠病学, 2011, 16 (11): 666-675; 16 (12): 735-744.
7 Odze R, Riddell R, Bosman F, et al. Premalignant lesions of the digestive system[M]//Bosman FT, Carneiro F, Hruban RH, et al. WHO Classification of Tumours of the Digestive System. 4th ed. IARC, 2010: 10-12.
8 Snover D, Ahnen D, Burt R, et al. Serrated polyps of the colon and rectum and serrated polyposis[M]//Bosman FT, Carneiro F, Hruban RH, et al. WHO Classification of Tumours of the Digestive System. 4th ed. IARC, 2010: 160-165.
9 Leggett B, Whitehall V. Role of the serrated pathway in colorectal cancer pathogenesis[J]. Gastroenterology, 2010, 138 (6): 2088-2100.
10 Kudo Se, Lambert R, Allen JI, et al. Nonpolypoid neoplastic lesions of the colorectal mucosa[J]. Gastrointest Endosc, 2008, 68 (4 Suppl): S3-S47.
11 Belderbos TD, Leenders M, Moons LM, et al. Local recurrence after endoscopic mucosal resection of nonpedunculated colorectal lesions: systematic review and meta-analysis[J]. Endoscopy, 2014, 46 (5): 388-402.
12 Sanduleanu S, le Clercq CM, Dekker E, et al; On behalf of the Expert Working Group on ‘Right-sided lesions and interval cancers’, Colorectal Cancer Screening Committee, World Endoscopy Organization. Definition and taxonomy of interval colorectal cancers: a proposal for standardising nomenclature[J]. Gut, 2014, Sep 5. pii: gutjnl-2014-307992. [Epub ahead of print]
13 赫捷, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012: 56-59.
14 武鸣. 结直肠肛门癌[M]//全国肿瘤防治研究办公室, 全国肿瘤登记中心, 卫生部疾病控制局主编. 中国肿瘤死亡报告: 全国第三次死因回顾抽样调查. 北京: 人民卫生出版社, 2010: 77-91.
15 Sankaranarayanan R, Swaminathan R, Brenner H, et al. Cancer survival in Africa, Asia, and Central America: a population-based study[J]. Lancet Oncol, 2010, 11 (2): 165-173.
16 Zeng H, Zheng R, Guo Y, et al. Cancer survival in China, 2003-2005: A population-based study[J]. Int J Cancer, 2015, 136 (8): 1921-1930.
17 辛磊, 柏愚, 李兆申. 结直肠癌危险因素研究进展[J]. 中国实用内科杂志, 2014, 34 (12) : 1214-1216.
18 陈琼, 刘志才, 程兰平, 等. 2003~2007年中国结直肠癌发病与死亡分析[J]. 中国肿瘤, 2012, 21 (3): 179-182.
19 Butterworth AS, Higgins JP, Pharoah P. Relative and absolute risk of colorectal cancer for individuals with a family history: a meta-analysis[J]. Eur J Cancer, 2006, 42 (2): 216-227.
20 Tung SY, Wu CS. Risk factors for colorectal adenomas among immediate family members of patients with colorectal cancer in Taiwan: a case-control study[J]. Am J Gastroenterol, 2000, 95 (12): 3624-3628.
21 Ng SC, Lau JY, Chan FK, et al. Increased risk of advanced neoplasms among asymptomatic siblings of patients with colorectal cancer[J]. Gastroenterology, 2013, 144 (3): 544-550.
22 Farraye FA, Odze RD, Eaden J, et al; AGA Institute Medical Position Panel on Diagnosis and Management of Colorectal Neoplasia in Inflammatory Bowel Disease. AGA medical position statement on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease[J]. Gastroenterology, 2010, 138 (2): 738-745.
23 Jess T, Rungoe C, Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a meta-analysis of population-based cohort studies[J]. Clin Gastroenterol Hepatol, 2012, 10 (6): 639-645.
24 Gong W, Lv N, Wang B, et al. Risk of ulcerative colitis-associated colorectal cancer in China: a multi-center retrospective study[J]. Dig Dis Sci, 2012, 57 (2): 503-507.
25 Yusof AS, Isa ZM, Shah SA. Dietary patterns and risk of colorectal cancer: a systematic review of cohort studies (2000-2011) [J]. Asian Pac J Cancer Prev, 2012, 13 (9): 4713-4717.
26 Chen HM, Yu YN, Wang JL, et al. Decreased dietary fiber intake and structural alteration of gut microbiota in patients with advanced colorectal adenoma[J]. Am J Clin Nutr, 2013, 97 (5): 1044-1052.
27 Hannan LM, Jacobs EJ, Thun MJ. The association between cigarette smoking and risk of colorectal cancer in a large prospective cohort from the United States[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18 (12): 3362-3367.
28 Ben Q, An W, Jiang Y, et al. Body mass index increases risk for colorectal adenomas based on meta-analysis[J]. Gastroenterology, 2012, 142 (4): 762-772.
29 Jiang Y, Ben Q, Shen H, et al. Diabetes mellitus and incidence and mortality of colorectal cancer: a systematic review and meta-analysis of cohort studies[J]. Eur J Epidemiol, 2011, 26 (11): 863-876.
30 Bai Y, Xu C, Zou DW, et al. Diagnostic accuracy of features predicting lower gastrointestinal malignancy: a colonoscopy database review of 10,603 Chinese patients[J]. Colorectal Dis, 2011, 13 (6): 658-662.
31 Meng W, Cai SR, Zhou L, et al. Performance value of high risk factors in colorectal cancer screening in China[J]. World J Gastroenterol, 2009, 15 (48): 6111-6116.
32 Cai SR, Zhang SZ, Zhu HH, et al. Performance of a colorectal cancer screening protocol in an economically and medically underserved population[J]. Cancer Prev Res (Phila), 2011, 4 (10): 1572-1579.
33 魏晓敏, 董建树, 顾沈兵, 等. 上海市社区居民大肠癌筛查分析[J]. 中国健康教育, 2014, 30 (7): 623-626.
34 Cai QC, Yu ED, Xiao Y, et al. Derivation and validation of a prediction rule for estimating advanced colorectal neoplasm risk in average-risk Chinese[J]. Am J Epidemiol, 2012, 175 (6): 584-593.
35 Sung JJ, Ng SC, Chan FK, et al; Asia Pacific Working Group. An updated Asia Pacific Consensus Recommen-dations on colorectal cancer screening[J]. Gut, 2015, 64 (1): 121-132.
36 Yeoh KG, Ho KY, Chiu HM, et al; Asia-Pacific Working Group on Colorectal Cancer. The Asia-Pacific Colorectal Screening score: a validated tool that stratifies risk for colorectal advanced neoplasia in asymptomatic Asian subjects[J]. Gut, 2011, 60 (9): 1236-1241.
37 Wong MC, Lam TY, Tsoi KK, et al. A validated tool to predict colorectal neoplasia and inform screening choice for asymptomatic subjects[J]. Gut, 2014, 63 (7): 1130-1136.
38 Tumours of the colon and rectum[M]//Odze RD, Hamilton SR, Bosman FT, et al. WHO Classification of Tumours of the Digestive System. 2010, 4: 131-182.
39 Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract[J]. Endoscopy, 2005, 37 (6): 570-578.
40 Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited[J]. Gut, 2002, 51 (1): 130-131.
41 Lindor NM, Petersen GM, Hadley DW, et al. Recom-mendations for the care of individuals with an inherited predisposition to Lynch syndrome: a systematic review[J]. JAMA, 2006, 296 (12): 1507-1517.
42 Bonadona V, Bonaïti B, Olschwang S, et al; French Cancer Genetics Network. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome[J]. JAMA, 2011, 305 (22): 2304-2310.
43 Senter L, Clendenning M, Sotamaa K, et al. The clinical phenotype of Lynch syndrome due to germ-line PMS2 mutations[J]. Gastroenterology, 2008, 135 (2): 419-428.
45 Shaukat A, Mongin SJ, Geisser MS, et al. Long-term mortality after screening for colorectal cancer[J]. N Engl J Med, 2013, 369 (12): 1106-1114.
46 Brenner H, Tao S. Superior diagnostic performance of faecal immunochemical tests for haemoglobin in a head-to-head comparison with guaiac based faecal occult blood test among 2235 participants of screening colonoscopy[J]. Eur J Cancer, 2013, 49 (14): 3049-3054.
47 Lee CS, Ronan L, O’Morain C, et al. Screening for colorectal cancer: what fits best? [J]. Expert Rev Gastroenterol Hepatol, 2012, 6 (3): 301-312.
48 Jin P, Wu ZT, Li SR, et al. Colorectal cancer screening with fecal occult blood test: A 22-year cohort study[J]. Oncol Lett, 2013, 6 (2): 576-582.
49 Tóth K, Sipos F, Kalmár A, et al. Detection of methylated SEPT9 in plasma is a reliable screening method for both left- and right-sided colon cancers[J]. PLoS One, 2012, 7 (9): e46000.
50 Jin P, Kang Q, Wang X, et al. Performance of a second generation methylated SEPT9 test in detecting colorectal neoplasm[J]. J Gastroenterol Hepatol, 2015, 30 (5): 830-833.
51 Spada C, Stoker J, Alarcon O, et al. Clinical indications for computed tomographic colonography: European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastrointestinal and Abdominal Radiology (ESGAR) Guideline[J]. Endoscopy, 2014, 46 (10): 897-915.
52 Spada C, Hassan C, Galmiche JP, et al; European Society of Gastrointestinal Endoscopy. Colon capsule endoscopy: European Society of Gastrointestinal Endoscopy (ESGE) Guideline[J]. Endoscopy, 2012, 44 (5): 527-536.
53 Imperiale TF, Ransohoff DF, Itzkowitz SH, et al. Multi-target stool DNA testing for colorectal-cancer screening[J]. N Engl J Med, 2014, 370 (14): 1287-1297.
54 Segnan N, Armaroli P, Bonelli L, et al; SCORE Working Group. Once-only sigmoidoscopy in colorectal cancer screening: follow-up findings of the Italian Randomized Controlled Trial -- SCORE[J]. J Natl Cancer Inst, 2011, 103 (17): 1310-1322.
55 Schoen RE, Pinsky PF, Weissfeld JL, et al; PLCO Project Team. Colorectal-cancer incidence and mortality with screening flexible sigmoidoscopy[J]. N Engl J Med, 2012, 366 (25): 2345-2357.
56 Elmunzer BJ, Hayward RA, Schoenfeld PS, et al. Effect of flexible sigmoidoscopy-based screening on incidence and mortality of colorectal cancer: a systematic review and meta-analysis of randomized controlled trials[J]. PLoS Med, 2012, 9 (12): e1001352.
57 Bai Y, Gao J, Zou DW, et al. Distribution trends of colorectal adenoma and cancer: a colonoscopy database analysis of 11,025 Chinese patients[J]. J Gastroenterol Hepatol, 2010, 25 (10): 1668-1673.
58 中华医学会消化内镜学分会. 中国消化内镜诊疗相关肠道准备指南(草案)[J]. 中华消化内镜杂志, 2013, 30 (9): 481-483.
59 中华医学会消化内镜学分会, 中华医学会麻醉学分会. 中国消化内镜诊疗镇静/麻醉的专家共识意见[J]. 中华消化内镜杂志, 2014, 31 (8): 421-428.
60 Barclay RL, Vicari JJ, Doughty AS, et al. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy[J]. N Engl J Med, 2006, 355 (24): 2533-2541.
61 Tanaka S, Kaltenbach T, Chayama K, et al. High-magnification colonoscopy (with videos)[J]. Gastrointest Endosc, 2006, 64 (4): 604-613.
62 Pasha SF, Leighton JA, Das A, et al. Comparison of the yield and miss rate of narrow band imaging and white light endoscopy in patients undergoing screening or surveillance colonoscopy: a meta-analysis[J]. Am J Gastroenterol, 2012, 107 (3): 363-370.
63 Wanders LK, East JE, Uitentuis SE, et al. Diagnostic performance of narrowed spectrum endoscopy, autofluores-cence imaging, and confocal laser endomicroscopy for optical diagnosis of colonic polyps: a meta-analysis[J]. Lancet Oncol, 2013, 14 (13): 1337-1347.
64 Gómez V, Shahid MW, Krishna M, et al. Classification criteria for advanced adenomas of the colon by using probe-based confocal laser endomicroscopy: a preliminary study[J]. Dis Colon Rectum, 2013, 56 (8): 967-973.
65 Liu C, Li CQ, Zuo XL, et al. Confocal laser endomicro-scopy for the diagnosis of colorectal cancerinvivo[J]. J Dig Dis, 2013, 14 (5): 259-265.
66 Yoshida N, Hisabe T, Inada Y, et al. The ability of a novel blue laser imaging system for the diagnosis of invasion depth of colorectal neoplasms[J]. J Gastroenterol, 2014, 49 (1): 73-80.
67 The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003, 58 (6 Suppl): S3-S43.
68 Han KS, Sohn DK, Choi DH, et al. Prolongation of the period between biopsy and EMR can influence the nonlifting sign in endoscopically resectable colorectal cancers[J]. Gastrointest Endosc, 2008, 67 (1): 97-102.
69 中华医学会消化内镜学分会病理学协作组. 中国消化内镜活检与病理学检查规范专家共识 (草案) [J]. 胃肠病学, 2014, 19 (9): 549-553.
70 Johnson DA, Barkun AN, Cohen LB, et al; US Multi-Society Task Force on Colorectal Cancer. Optimizing adequacy of bowel cleansing for colonoscopy: recommen-dations from the US multi-society task force on colorectal cancer[J]. Gastroenterology, 2014, 147 (4): 903-924.
71 Chokshi RV, Hovis CE, Hollander T, et al. Prevalence of missed adenomas in patients with inadequate bowel preparation on screening colonoscopy[J]. Gastrointest Endosc, 2012, 75 (6): 1197-1203.
72 Lai EJ, Calderwood AH, Doros G, et al. The Boston bowel preparation scale: a valid and reliable instrument for colonoscopy-oriented research[J]. Gastrointest Endosc, 2009, 69 (3 Pt 2): 620-625.
73 Baxter NN, Sutradhar R, Forbes SS, et al. Analysis of administrative data finds endoscopist quality measures associated with postcolonoscopy colorectal cancer[J]. Gastroenterology, 2011, 140 (1): 65-72.
74 Butterly L, Robinson CM, Anderson JC, et al. Serrated and adenomatous polyp detection increases with longer withdrawal time: results from the New Hampshire Colonoscopy Registry[J]. Am J Gastroenterol, 2014, 109 (3): 417-426.
75 李芳伟, 张军, 左爱丽, 等. 退镜时间对大肠息肉检出率影响的研究[J]. 中华消化内镜杂志, 2009, 26 (4): 207-208.
76 张娜娜, 李鹏, 张澍田. 结肠镜检查时退镜时间和结直肠息肉发现率的回顾性分析[J]. 临床内科杂志, 2013, 30 (3): 176-178.
77 Rex DK, Bond JH, Winawer S, et al; U.S. Multi-Society Task Force on Colorectal Cancer. Quality in the technical performance of colonoscopy and the continuous quality improvement process for colonoscopy: recommendations of the U.S. Multi-Society Task Force on Colorectal Cancer[J]. Am J Gastroenterol, 2002, 97 (6): 1296-1308.
78 Corley DA, Jensen CD, Marks AR,et al. Adenoma detection rate and risk of colorectal cancer and death[J]. N Engl J Med, 2014, 370 (14): 1298-1306.
79 赵子夜, 李骏强, 单永琪, 等. 结直肠癌平均风险人群结肠镜检查的息肉与腺瘤检出率及其年龄分布情况[J]. 中华消化内镜杂志, 2014, 31 (2): 64-68.
80 Rex DK, Petrini JL, Baron TH, et al; ASGE/ACG Taskforce on Quality in Endoscopy. Quality indicators for colonoscopy[J]. Am J Gastroenterol, 2006, 101 (4): 873-885.
81 Shi X, Shan Y, Yu E, et al. Lower rate of colonoscopic perforation: 110,785 patients of colonoscopy performed by colorectal surgeons in a large teaching hospital in China[J]. Surg Endosc, 2014, 28 (8): 2309-2316.
82 Zhang Q, An SL, Chen ZY, et al. Assessment of risk factors for delayed colonic post-polypectomy hemorrhage: a study of 15553 polypectomies from 2005 to 2013[J]. PLoS One, 2014, 9 (10): e108290.
83 Kamiński MF, Hassan C, Bisschops R, et al. Advanced imaging for detection and differentiation of colorectal neoplasia: European Society of Gastrointestinal Endoscopy (ESGE) Guideline[J]. Endoscopy, 2014, 46 (5): 435-449.
84 Uraoka T, Saito Y, Matsuda T, et al. Endoscopic indications for endoscopic mucosal resection of laterally spreading tumours in the colorectum[J]. Gut, 2006, 55 (11): 1592-1597.
85 Kudo S, Tamura S, Nakajima T, et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy[J]. Gastrointest Endosc, 1996, 44 (1): 8-14.
86 Kobayashi Y, Kudo SE, Miyachi H, et al. Clinical usefulness of pit patterns for detecting colonic lesions requiring surgical treatment[J]. Int J Colorectal Dis, 2011, 26 (12): 1531-1540.
87 Hewett DG, Kaltenbach T, Sano Y, et al. Validation of a simple classification system for endoscopic diagnosis of small colorectal polyps using narrow-band imaging[J]. Gastroenterology, 2012, 143 (3): 599-607.e1.
88 Hayashi N, Tanaka S, Hewett DG, et al. Endoscopic prediction of deep submucosal invasive carcinoma: validation of the narrow-band imaging international colorectal endoscopic (NICE) classification[J]. Gastrointest Endosc, 2013, 78 (4): 625-632.
89 Gall TM, Markar SR, Jackson D, et al. Mini-probe ultrasonography for the staging of colon cancer: a systematic review and meta-analysis[J]. Colorectal Dis, 2014, 16 (1): O1- O8.
90 Puli SR, Bechtold ML, Reddy JB, et al. Can endoscopic ultrasound predict early rectal cancers that can be resected endoscopically? A meta-analysis and systematic review[J]. Dig Dis Sci, 2010, 55 (5): 1221-1229.
91 Haji A, Ryan S, Bjarnason I, et al. Colonoscopic high frequency mini-probe ultrasound is more accurate than conventional computed tomography in the local staging of colonic cancer[J]. Colorectal Dis, 2012, 14 (8): 953-959.
92 Bipat S, Glas AS, Slors FJ, et al. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging -- a meta-analysis[J]. Radiology, 2004, 232 (3): 773-783.
93 Lahaye MJ, Engelen SM, Nelemans PJ, et al. Imaging for predicting the risk factors -- the circumferential resection margin and nodal disease -- of local recurrence in rectal cancer: a meta-analysis[J]. Semin Ultrasound CT MR, 2005, 26 (4): 259-268.
94 Leufkens AM, van den Bosch MA, van Leeuwen MS, et al. Diagnostic accuracy of computed tomography for colon cancer staging: a systematic review[J]. Scand J Gastroenterol, 2011, 46 (7-8): 887-894.
95 Klessen C, Rogalla P, Taupitz M. Local staging of rectal cancer: the current role of MRI[J]. Eur Radiol, 2007, 17 (2): 379-389.
96 Brush J, Boyd K, Chappell F, et al. The value of FDG positron emission tomography/computerised tomography (PET/CT) in pre-operative staging of colorectal cancer: a systematic review and economic evaluation[J]. Health Technol Assess, 2011, 15 (35): 1-192, iii-iv.
97 Lee EJ, Lee JB, Lee SH, et al. Endoscopic submucosal dissection for colorectal tumors -- 1,000 colorectal ESD cases: one specialized institute’s experiences[J]. Surg Endosc, 2013, 27 (1): 31-39.
98 Ikematsu H, Yoda Y, Matsuda T, et al. Long-term outcomes after resection for submucosal invasive colorectal cancers[J]. Gastroenterology, 2013, 144 (3): 551-559.
99 Yoda Y, Ikematsu H, Matsuda T, et al. A large-scale multicenter study of long-term outcomes after endoscopic resection for submucosal invasive colorectal cancer[J]. Endoscopy, 2013, 45 (9): 718-724.
100Pohl H, Srivastava A, Bensen SP, et al. Incomplete polyp resection during colonoscopy - results of the complete adenoma resection (CARE) study[J]. Gastroenterology, 2013, 144 (1): 74-80.e1.
101Metz AJ, Moss A, McLeod D, et al. A blinded comparison of the safety and efficacy of hot biopsy forceps electrocauterization and conventional snare polypectomy for diminutive colonic polypectomy in a porcine model[J]. Gastrointest Endosc, 2013, 77 (3): 484-490.
102Sakamoto T, Matsuda T, Otake Y, et al. Predictive factors of local recurrence after endoscopic piecemeal mucosal resection[J]. J Gastroenterol, 2012, 47 (6): 635-640.
103Kim MN, Kang JM, Yang JI, et al. Clinical features and prognosis of early colorectal cancer treated by endoscopic mucosal resection[J]. J Gastroenterol Hepatol, 2011, 26 (11): 1619-1625.
104Park JJ, Cheon JH, Kwon JE, et al. Clinical outcomes and factors related to resectability and curability of EMR for early colorectal cancer[J]. Gastrointest Endosc, 2011, 74 (6): 1337-1346.
105Metz AJ, Bourke MJ, Moss A, et al. Factors that predict bleeding following endoscopic mucosal resection of large colonic lesions[J]. Endoscopy, 2011, 43 (6): 506-511.
106Burgess NG, Metz AJ, Williams SJ, et al. Risk factors for intraprocedural and clinically significant delayed bleeding after wide-field endoscopic mucosal resection of large colonic lesions[J]. Clin Gastroenterol Hepatol, 2014, 12 (4): 651-661. e1-3.
107刘晓岗, 李易, 阳运超, 等. 内镜黏膜切除术治疗早期大肠癌60例及随访观察[J]. 中国内镜杂志, 2012, 18 (11): 1174-1177.
108徐健, 徐良, 李林涛, 等. 影响内镜黏膜切除术治疗早期结直肠癌疗效的危险因素分析[J]. 中华消化外科杂志, 2013, 12 (5): 366-369.
109刘宇虎, 柳娟, 陈桂权, 等. 结直肠侧向发育型肿瘤内镜诊断与治疗[J]. 现代消化及介入诊疗, 2012, 17 (5): 264-267.
110于恩达, 孟荣贵, 徐洪莲, 等. 内镜黏膜切除术治疗大肠广基大息肉[J]. 中华消化内镜杂志, 2005, 22 (5): 299-303.
111刘枫, 李兆申. 内镜黏膜下剥离术治疗器械的发展现状[J]. 中华消化内镜杂志, 2012, 29 (12): 661-664.
112Sato K, Ito S, Kitagawa T, et al. Factors affecting the technical difficulty and clinical outcome of endoscopic submucosal dissection for colorectal tumors[J]. Surg Endosc, 2014, 28 (10): 2959-2965.
113Hori K, Uraoka T, Harada K, et al. Predictive factors for technically difficult endoscopic submucosal dissection in the colorectum[J]. Endoscopy, 2014, 46 (10): 862-870.
114Mizushima T, Kato M, Iwanaga I, et al. Technical difficulty according to location, and risk factors for perforation, in endoscopic submucosal dissection of colorectal tumors[J]. Surg Endosc, 2015, 29 (1): 133-139.
115Saito Y, Uraoka T, Yamaguchi Y, et al. A prospective, multicenter study of 1111 colorectal endoscopic submucosal dissections (with video) [J]. Gastrointest Endosc, 2010, 72 (6): 1217-1225.
116徐美东, 王小云, 周平红, 等. 内镜黏膜下剥离术治疗不同亚型结直肠侧向发育型肿瘤的临床与病理研究[J]. 中华消化内镜杂志, 2012, 29 (8): 422-428.
117Repici A, Hassan C, De Paula Pessoa D, et al. Efficacy and safety of endoscopic submucosal dissection for colorectal neoplasia: a systematic review[J]. Endoscopy, 2012, 44 (2): 137-150.
118Uraoka T, Parra-Blanco A, Yahagi N. Colorectal endoscopic submucosal dissection: is it suitable in western countries? [J]. J Gastroenterol Hepatol, 2013, 28 (3): 406-414.
119Kiriyama S, Saito Y, Yamamoto S, et al. Comparison of endoscopic submucosal dissection with laparoscopic-assisted colorectal surgery for early-stage colorectal cancer: a retrospective analysis[J]. Endoscopy, 2012, 44 (11): 1024-1030.
120Nakajima T, Saito Y, Tanaka S, et al. Current status of endoscopic resection strategy for large, early colorectal neoplasia in Japan[J]. Surg Endosc, 2013, 27 (9): 3262-3270.
121Fujimoto K, Fujishiro M, Kato M, et al; Japan Gas-troenterological Endoscopy Society. Guidelines for gastro-enterological endoscopy in patients undergoing antithrombotic treatment[J]. Dig Endosc, 2014, 26 (1): 1-14.
122中华医学会消化内镜学分会. 中国消化内镜诊疗相关肠道准备共识意见[J]. 中华消化内镜杂志, 2013, 30 (10): 541-549.
123Tanaka S, Asayama N, Shigita K, et al. Towards safer and appropriate application of endoscopic submucosal dissection for T1 colorectal carcinoma as total excisional biopsy: future perspectives[J]. Dig Endosc, 2015, 27 (2): 216-222.
124Watanabe T, Itabashi M, Shimada Y, et al; Japanese Society for Cancer of the Colon and Rectum. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2010 for the treatment of colorectal cancer[J]. Int J Clin Oncol, 2012, 17 (1): 1-29.
125Yoshida N, Naito Y, Inada Y, et al. Multicenter study of endoscopic mucosal resection using 0.13% hyaluronic acid solution of colorectal polyps less than 20 mm in size[J]. Int J Colorectal Dis, 2013, 28 (7): 985-991.
126刘思德, 陈烨, 白杨, 等. 内镜下黏膜切除术(EMR)治疗平坦型大肠肿瘤的临床研究[J]. 中国消化内镜, 2007, 1 (1): 23-28.
127Hurlstone DP, Cross SS, Drew K, et al. An evaluation of colorectal endoscopic mucosal resection using high-magnification chromoscopic colonoscopy: a prospective study of 1000 colonoscopies[J]. Endoscopy, 2004, 36 (6): 491-498.
128Moss A, Bourke MJ, Williams SJ, et al. Endoscopic mucosal resection outcomes and prediction of submucosal cancer from advanced colonic mucosal neoplasia[J]. Gastroenterology, 2011, 140 (7): 1909-1918.
129Buchner AM, Guarner-Argente C, Ginsberg GG. Outcomes of EMR of defiant colorectal lesions directed to an endoscopy referral center[J]. Gastrointest Endosc, 2012, 76 (2): 255-263.
130Tseng MY, Lin JC, Huang TY, et al. Endoscopic submucosal dissection for early colorectal neoplasms: clinical experience in a tertiary medical center in taiwan[J]. Gastroenterol Res Pract, 2013, 2013: 891565.
131Farhat S, Chaussade S, Ponchon T, et al; SFED ESD study group. Endoscopic submucosal dissection in a European setting. A multi-institutional report of a technique in development[J]. Endoscopy, 2011, 43 (8): 664-670.
132Hurlstone DP, Atkinson R, Sanders DS, et al. Achieving R0 resection in the colorectum using endoscopic submucosal dissection[J]. Br J Surg, 2007, 94 (12): 1536-1542.
133Burgess NG, Williams SJ, Hourigan LF, et al. A management algorithm based on delayed bleeding after wide-field endoscopic mucosal resection of large colonic lesions[J]. Clin Gastroenterol Hepatol, 2014, 12 (9): 1525-1533.
134Kim HH, Kim JH, Park SJ,et al. Risk factors for incomplete resection and complications in endoscopic mucosal resection for lateral spreading tumors[J]. Dig Endosc, 2012, 24 (4): 259-266.
135Shono T, Ishikawa K, Ochiai Y, et al. Feasibility of endoscopic submucosal dissection: a new technique for en bloc resection of a large superficial tumor in the colon and rectum[J]. Int J Surg Oncol, 2011, 2011: 948293.
136Suh JP, Youk EG, Lee EJ, et al. Endoscopic submucosal dissection for nonpedunculated submucosal invasive colorectal cancer: is it feasible? [J]. Eur J Gastroenterol Hepatol, 2013, 25 (9): 1051-1059.
137Terasaki M, Tanaka S, Shigita K, et al. Risk factors for delayed bleeding after endoscopic submucosal dissection for colorectal neoplasms[J]. Int J Colorectal Dis, 2014, 29 (7): 877-882.
138付兰英, 王雷, 杨小军, 等. 内镜黏膜剥离术治疗41例大肠侧向发育型肿瘤的疗效分析[J]. 第三军医大学学报, 2012, 34 (21): 2200-2203.
139龚伟, 刘思德, 智发朝, 等. 内镜黏膜下剥离术治疗大肠侧向发育型肿瘤的探讨[J]. 中华消化内镜杂志, 2012, 29 (5): 255-258.
140Zhou PH, Yao LQ, Qin XY. Endoscopic submucosal dissection for colorectal epithelial neoplasm[J]. Surg Endosc, 2009, 23 (7): 1546-1551.
141刘铁梅, 周彩芳, 时强, 等. 内镜黏膜下剥离术治疗巨大早期低位直肠癌及其癌前病变的价值[J]. 中华消化内镜杂志, 2013, 30 (3): 138-141.
142金黑鹰, 吴崑岚, 朱勇, 等. 影响结直肠肿瘤内镜下黏膜切除术预后的多因素分析[J/OL]. 中华普外科手术学杂志(电子版), 2009, 3 (2): 544-548.
143张轶群, 姚礼庆, 周平红, 等. 内镜下黏膜剥离术后迟发性出血的治疗及危险因素分析[J]. 中华消化内镜杂志, 2010, 27 (12): 647-649.
144Holt BA, Bourke MJ. Wide field endoscopic resection for advanced colonic mucosal neoplasia: current status and future directions[J]. Clin Gastroenterol Hepatol, 2012, 10 (9): 969-979.
145Bahin FF, Naidoo M, Williams SJ, et al. Prophylactic Endoscopic Coagulation to Prevent Bleeding After Wide-field Endoscopic Mucosal Resection of Large Sessile Colon Polyps[J]. Clin Gastroenterol Hepatol, 2015, 13 (4): 724-730. e1-2.
146Kim ES, Cho KB, Park KS, et al. Factors predictive of perforation during endoscopic submucosal dissection for the treatment of colorectal tumors[J]. Endoscopy, 2011, 43 (7): 573-578.
147Sohara N, Hagiwara S, Arai R, et al. Can endoscopic submucosal dissection be safely performed in a smaller specialized clinic?[J]. World J Gastroenterol, 2013, 19 (4): 528-535.
148许松欣, 丁岩冰. 结直肠肿瘤内镜黏膜下层剥离术穿孔的临床危险因素[J]. 胃肠病学和肝病学杂志, 2013, 22 (12): 1212-1215.
149钟芸诗, 姚礼庆, 许剑民, 等. 内镜黏膜下剥离术治疗直肠扁平癌前期疾病和黏膜内癌临床价值[J]. 中国实用外科杂志, 2011, 31 (6): 497-500.
150Hotta K, Shinohara T, Oyama T, et al. Criteria for non-surgical treatment of perforation during colorectal endoscopic submucosal dissection[J]. Digestion, 2012, 85 (2): 116-120.
151Byeon JS. Colonic perforation: can we manage it endo-scopically? [J]. Clin Endosc, 2013, 46 (5): 495-499.
152Weiland T, Fehlker M, Gottwald T, et al. Performance of the OTSC System in the endoscopic closure of iatrogenic gastrointestinal perforations: a systematic review[J]. Surg Endosc, 2013, 27 (7): 2258-2274.
153ASGE Standards of Practice Committee, Fisher DA, Maple JT, Ben-Menachem T, et al. Complications of colonoscopy[J]. Gastrointest Endosc, 2011, 74 (4): 745-752.
154Cha JM, Lim KS, Lee SH, et al. Clinical outcomes and risk factors of post-polypectomy coagulation syndrome: a multicenter, retrospective, case-control study[J]. Endoscopy, 2013, 45 (3): 202-207.
155Jung D, Youn YH, Jahng J, et al. Risk of electro-coagulation syndrome after endoscopic submucosal dissection in the colon and rectum[J]. Endoscopy, 2013, 45 (9): 714-717.
156Mahadeva S, Rembacken BJ. Standard “inject and cut” endoscopic mucosal resection technique is practical and effective in the management of superficial colorectal neoplasms[J]. Surg Endosc, 2009, 23 (2): 417-422.
157Fujishiro M, Yahagi N, Kakushima N, et al. Outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms in 200 consecutive cases[J]. Clin Gastroenterol Hepatol, 2007, 5 (6): 678-683.
158Isomoto H, Nishiyama H, Yamaguchi N, et al. Clinico-pathological factors associated with clinical outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms[J]. Endoscopy, 2009, 41 (8): 679-683.
159Wang J, Zhang XH, Ge J, et al. Endoscopic submucosal dissection vs endoscopic mucosal resection for colorectal tumors: a meta-analysis[J]. World J Gastroenterol, 2014, 20 (25): 8282-8287.
160Moss A, Williams SJ, Hourigan LF,et al. Long-term adenoma recurrence following wide-field endoscopic mucosal resection (WF-EMR) for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR (ACE) study[J]. Gut, 2015, 64 (1): 57-65.
161Winawer SJ, Zauber AG, Fletcher RH, et al; US Multi-Society Task Force on Colorectal Cancer; American Cancer Society. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society[J]. Gastroenterology, 2006, 130 (6): 1872-1885.
(2015-04-23收稿)
·短篇论著·
通信作者:*本文李兆申,上海长海医院消化内科,Email: zhsli@81890.net;王贵齐,中国医学科学院肿瘤医院内镜科,Email: wangguiq@126.com;姜泊,北京清华长庚医院消化内科,Email:drjiang@163.com
DOI:10.3969/j.issn.1008-7125.2015.06.006
