内脏高敏感大鼠结肠特异背根神经节神经元TRPV1表达和电生理特征变化*
2015-02-22袁莉莉,余跃,蒋楠等
内脏高敏感大鼠结肠特异背根神经节神经元TRPV1表达和电生理特征变化*
袁莉莉1#余跃1&蒋楠1陈凤琴1王巧民1王烈成2
安徽医科大学附属省立医院消化内科1(230001)安徽医科大学基础医学院生理教研室2

*基金项目:安徽省自然科学基金项目(1208085MH174);2010年安徽省高校省级自然科学研究重点项目(KJ2010A192)
#Email: yuan30303@163.com
背景:内脏高敏感被认为是肠易激综合征的主要病理生理机制之一。目的:探讨内脏高敏感大鼠结肠特异背根神经节(DRG)神经元上的TRPV1表达及其电生理特征。方法:20只10 d龄大鼠随机分为模型组和对照组,模型组以结直肠内灌注乙酸诱导内脏高敏感模型,对照组灌注等量0.9% NaCl溶液。以结肠壁注射DiI荧光染料逆行标记DRG神经元(即结肠特异DRG神经元),免疫荧光法检测DRG神经元上的TRPV1表达,膜片钳技术记录神经元电生理特征。结果:模型组结肠特异DRG神经元上的TRPV1表达阳性率明显高于对照组(46.1%对36.6%,P<0.01),平均阈电流值明显低于对照组[(57.80±1.32) pA对(73.45±4.51) pA,P<0.05],2倍阈电流刺激下动作电位频率明显高于对照组[(8.20±1.10) Hz对(4.54±0.66) Hz,P<0.05],差异均有统计学意义。模型组60 mm Hg 结直肠扩张压力下的腹壁回撤反射(AWR)评分与TRPV1表达阳性率、2倍阈电流刺激下动作电位频率呈正相关(r=0.87和r=0.73,P<0.01),与阈电流值呈负相关(r=-0.81,P<0.01)。结论:结肠特异DRG神经元TRPV1表达上调、细胞兴奋性增加,可能是内脏高敏感形成的重要环节。
关键词内脏高敏感;背根神经节;瞬时受体电位通道;TRPV1;膜片钳术;电生理学
Patch-Clamp Techniques;Electrophysiology
内脏高敏感被认为是肠易激综合征的主要病理生理机制之一[1]。脊髓背根神经节(dorsal root ganglion, DRG)作为痛觉传入的第一级神经元,在痛觉的外周机制中起重要作用[2]。研究[3]显示瞬时受体电位香草素受体1(transient receptor potential vanilloid type-1, TRPV1)参与了内脏高敏感的触发和维持,然而结肠特异DRG神经元上的TRPV1表达及其电生理特征鲜见报道。本研究应用内脏高敏感大鼠模型并与正常对照组进行对比,以明确结肠特异DRG神经元TRPV1表达和细胞兴奋性在内脏高敏感形成中的作用。
材料与方法
一、实验动物
5 d龄SPF级Sprague-Dawley大鼠20只,由安徽医科大学实验动物中心提供。每10只幼鼠与1只哺乳母鼠共同饲养于1个塑料笼内,母鼠自由饮食。饲养环境为每12 h昼夜节律变换,室温18~24 ℃,幼鼠与母鼠分离后每4只1笼喂养。
二、方法
1. 模型制备和内脏敏感性评估[4]:幼鼠自10 d起随机分为2组,每组10只:①内脏高敏感模型组:10~23 d内,每天予结直肠内灌注乙酸。将经石蜡油润滑的连续硬膜外导管(直径1 mm)经肛门插入2 cm,注入0.5% 乙酸0.2 mL。②对照组:每天结直肠内灌注等量0.9% NaCl溶液。23 d后的2周内,不进行任何实验操作。灌注结束2周后,将压力表、注射器与自制指套气囊以三通管连接,将气囊经肛门插入2 cm。大鼠置于透明塑料笼内,适应环境30 min后行结直肠扩张(colorectal distention, CRD),气囊注气压力分别为20、40、60、80 mm Hg(1 mm Hg=0.133 kPa),每次持续20 s后休息2 min。通过观察腹壁回撤反射(abdominal withdrawal reflex, AWR)判定内脏敏感性。AWR评分标准:有动作停顿并见短暂头部运动,1分;腹肌收缩,2分;腹部抬起,3分;身体呈弓状和骨盆抬起,4分。AWR的观察采用双盲法,操作者随机时相性向气囊内注气,观察者同步独立观察、评估AWR并记录评分。每一压力重复扩张3次,AWR评分取均值。
2. 逆行标记结肠特异DRG和TRPV1免疫荧光法检测[5]:大鼠8周龄时麻醉,开腹暴露结肠,于结肠膀胱水平向口腔方向约6 cm处取10~15个点,每点注射1 μL荧光染料1,1’-二(十八烷基)-3,3,3’,3’-四甲基吲哚羰基花青高氯酸盐(DiI,InvitrogenTM, Thermo Fisher Scientific Inc.)。为防止染料泄漏、污染相邻器官,注射针留针1 min,且每点注射后均以0.9% NaCl溶液清洗。DiI注射1周后,迅速分离L5~S1DRG,置于4%多聚甲醛溶液中固定6~8 h,移至4 ℃ 30%蔗糖溶液中沉淀。恒冷切片机切片,切片以10%兔血清封闭1 h,加入羊抗大鼠TRPV1多克隆抗体(1∶100稀释, Santa Cruz Biotechnology, Inc.)4 ℃过夜,加入FITC标记的兔抗羊IgG(1∶50稀释, 武汉博士德生物工程有限公司)37 ℃避光孵育30 min,Hoechst(碧云天生物技术研究所)染核,甘油封片。每个DRG随机取3张切片,每张切片随机取3个视野,计算TRPV1阳性细胞占总DiI标记细胞的百分率。
3. 全细胞膜片钳记录[6]:DiI注射1周后,迅速分离T13~L2、L5~S1DRG,置于含胰蛋白酶和胶原酶的DMEM培养基中消化后制成细胞悬液,滴加于小玻片上,行全细胞膜片钳记录。记录时滤波频率为1 kHz,采集频率为10 kHz。在电流钳模式下,分别检测模型组和对照组各20个DRG神经元,以引起细胞产生动作电位的最小刺激电流为阈电流,记录阈电流值和2倍阈电流刺激下的动作电位频率,结果取均值。
三、统计学分析
结果
一、 AWR评分
20 mm Hg CRD压力下,模型组与对照组间AWR评分差异无统计学意义(P>0.05);40、60、80 mm Hg CRD压力下,模型组AWR评分均明显高于对照组,差异有统计学意义(P<0.05)(图1),提示内脏高敏感模型建立成功。
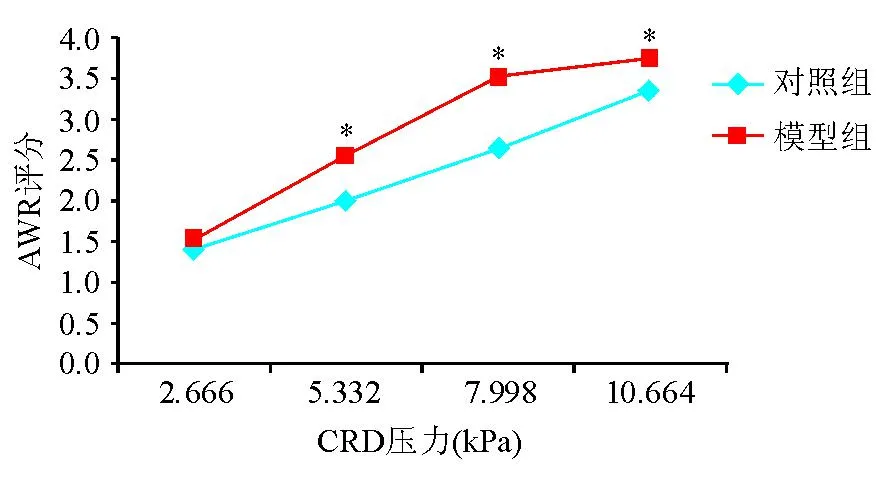
*两组间比较,P<0.05
二、结肠特异DRG神经元TRPV1表达
TRPV1免疫阳性神经元多为中小型细胞,DiI标记的结肠特异DRG神经元上可见TRPV1表达(图2),未见大细胞表达TRPV1。模型组DiI标记的323个结肠特异DRG神经元上,TRPV1阳性细胞数为149个,对照组DiI标记的322个结肠特异DRG神经元上,TRPV1阳性细胞数为118个,两组间TRPV1表达阳性率差异有统计学意义(46.1%对36.6%,P<0.01)。
三、结肠特异DRG神经元阈电流值和动作电位频率变化
在电流钳模式下,模型组结肠特异DRG神经元平均阈电流值为(57.80±1.32) pA,对照组为(73.45±
4.51) pA,组间差异有统计学意义(P<0.05)。在500 ms的记录时间内,模型组2倍阈电流刺激下动作电位频率为(8.20±1.10) Hz,对照组为(4.54±0.66) Hz,组间差异亦有统计学意义(P<0.05)(图3)。
四、内脏敏感性与结肠特异DRG神经元TRPV1表达和电生理特征的相关性
Pearson相关系数分析显示,在60 mm Hg的CRD压力下,模型组AWR评分与结肠特异DRG神经元TRPV1表达阳性率(r=0.87,P<0.01)和2倍阈电流刺激下动作电位频率(r=0.73,P<0.01)呈正相关,与阈电流值(r=-0.81,P<0.01)呈负相关,提示随着AWR评分的增加,结肠特异DRG神经元TRPV1表达和细胞兴奋性增加。
讨论
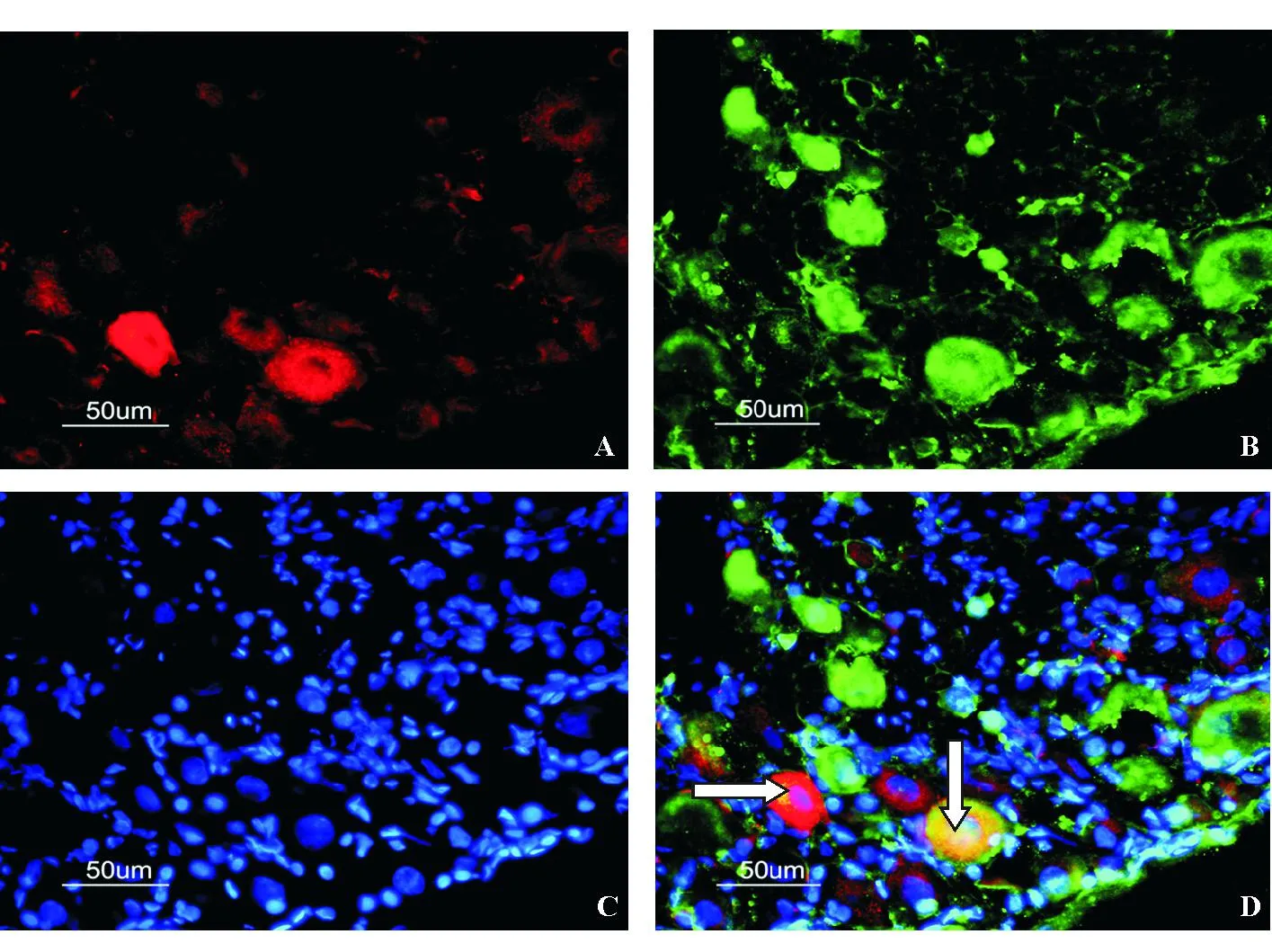
肠道感觉神经传导通路包含三级神经元:DRG神经元、脊髓背角神经元和大脑皮层神经元,各种类型的神经纤维将三级神经元联系在一起,形成感觉通路,传入通路中任意环节的异常变化都会导致机体感觉异常。本课题组前期研究发现,幼年期结直肠内灌注0.9% NaCl溶液的大鼠与幼年期未予A:DiI标记的结肠特异DRG神经元;B:TRPV1免疫阳性神经元;C:Hoechst染色细胞核;D:A、B、C合成图,向下箭头所示为DiI、TRPV1、Hoechst共表达细胞,向右箭头所示为DiI、Hoechst共表达细胞,无TRPV1表达
图2结肠特异DRG神经元TRPV1表达(免疫荧光染色)
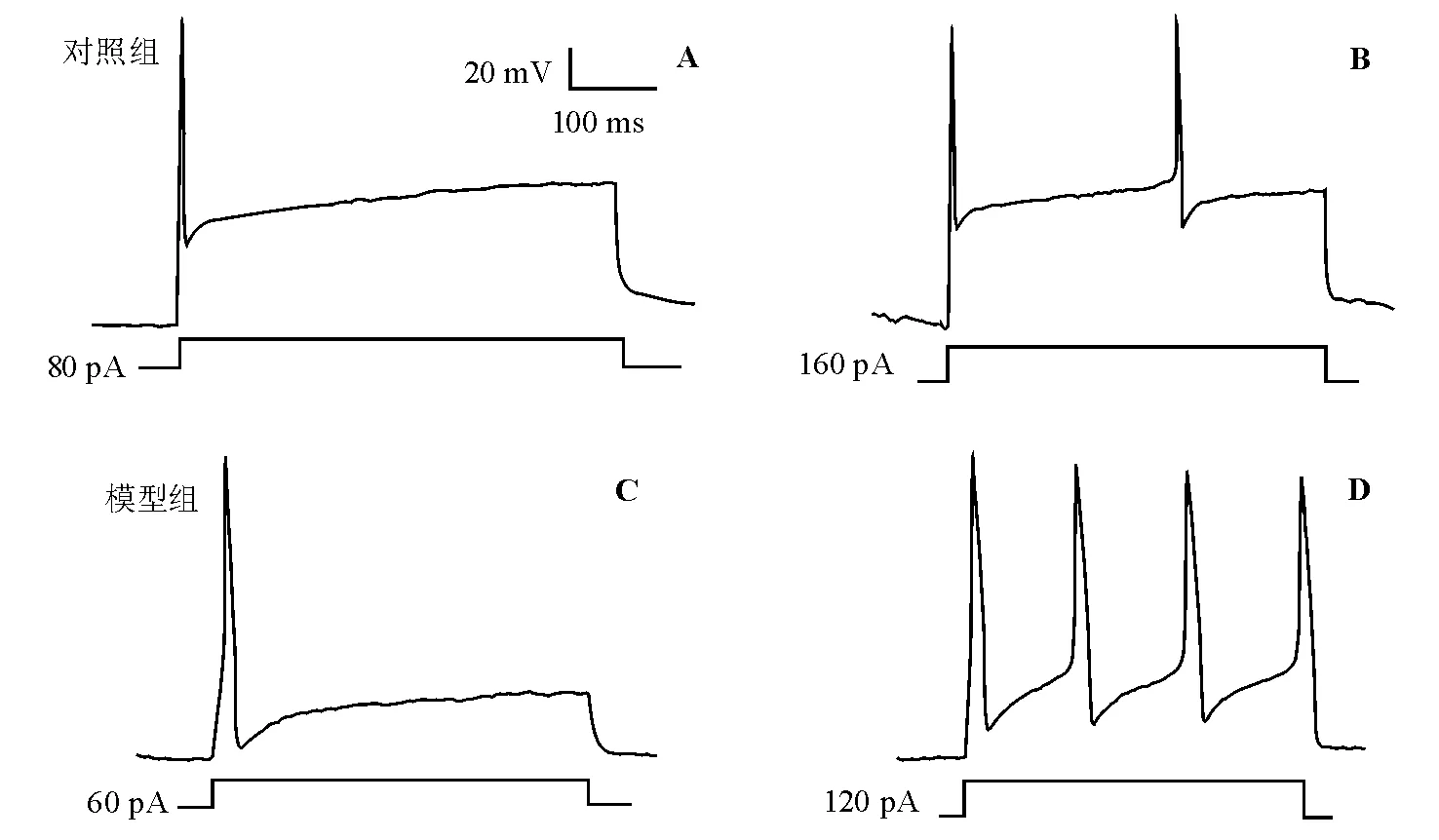
A:对照组阈电流刺激下动作电位频率;B:对照组2倍阈电流刺激下动作电位频率;C:模型组阈电流刺激下动作电位频率;D:模型组2倍阈电流刺激下动作电位频率
图3结肠特异DRG神经元动作电位频率变化
灌肠的大鼠对CRD刺激的AWR评分无明显差异,故本研究采用目前国内外较为公认的慢性内脏致敏模型[7],仅选用幼年期0.9% NaCl溶液灌肠大鼠作为对照,探讨乙酸刺激结直肠内脏高敏感形成后结肠特异DRG神经元的TRPV1表达和电生理特征变化情况。此外,由于支配结肠的DRG多集中于T13~L2、L5~S1区域内[8],其他区域结肠特异DRG分布相对较少,故本研究选择这两个区域的DRG为研究对象,未能取其他区域的DRG作为对照是本研究的不足之处。
本研究通过在实验大鼠结肠壁注射DiI荧光染料逆行示踪观察到,在DiI标记的结肠特异DRG神经元上,内脏高敏感模型组TRPV1表达阳性率显著增加,且与内脏敏感性呈正相关,故推测其致敏机制可能与结肠特异DRG神经元上部分TRPV1的敏化有关。有研究显示,在三硝基苯磺酸(TNBS)诱导的大鼠结肠炎模型中,局部炎症能增加肠神经支配的DRG上的TRPV1表达[9];在避水应激诱导的内脏高敏感大鼠模型中亦发现,DRG神经元上的TRPV1表达增加,且使用TRPV1拮抗剂能明显减弱内脏敏感性、阻碍TRPV1表达上调[10]。这些研究均提示DRG神经元上的TRPV1表达增加在内脏高敏感的形成中具有重要作用,与本研究结果相符。
TRPV1主要分布于DRG和三叉神经节中的中、小直径神经元,是初级感觉神经元外周末梢伤害性刺激的分子整合者,可被辣椒素、H+和伤害性热刺激(>43 ℃)激活,同时神经肽、缓激肽、前列腺素、神经生长因子、5-羟色胺等可通过TRPV1途径直接刺激神经的疼痛感受器[11]。TRPV1激活后导致Ca2+内流,神经元细胞膜去极化,产生动作电位,并将这些信息上传至中枢,最终形成痛觉过敏[10]。研究[12]发现TRPV1是神经源性炎症反应进程中的重要介质,感觉神经元上的TRPV1接受刺激后引起细胞膜去极化,直接或间接激发传入神经末梢释放P物质(SP)、降钙素基因相关肽(CGRP)等感觉神经肽。同时,TRPV1还可与多种信号分子相互作用,如蛋白酶激活受体,参与内脏高敏感形成[13]。
本研究应用全细胞膜片钳电流钳技术记录到内脏高敏感模型组结肠特异DRG神经元平均阈电流值显著低于对照组,在500 ms的记录时间内,模型组2倍阈电流刺激下动作电位频率显著高于对照组,提示模型组结肠特异DRG神经元的兴奋性高于对照组。上述结果表明内脏高敏感伴有结肠特异DRG神经元兴奋性增加,表现为阈电流降低和动作电位频率增加。推测乙酸刺激结直肠引起的局部炎症能增加肠神经支配的DRG上的TRPV1表达,激活的TRPV1引起Ca2+内流,神经元细胞膜去极化,产生动作电位,参与痛觉过敏形成。本研究通过相关性分析证实内脏高敏感与结肠特异DRG神经元的TRPV1表达和细胞兴奋性增加之间存在密切联系。
既往研究显示多种内脏炎症后可见DRG神经元兴奋性增加,如胃溃疡[14]、慢性胰腺炎[15]、间质性膀胱炎[16]等,可能与神经元上的重要离子(如Na+、K+、Ca2+)通道、嘌呤能受体功能改变有关[2]。本研究发现内脏高敏感大鼠模型结肠特异DRG神经元TRPV1表达上调、细胞兴奋性增加,可能是内脏高敏感形成的重要环节,为后续拟开展的脊髓电刺激治疗肠易激综合征内脏高敏感性腹痛的研究奠定了基础。
参考文献
1 Barbara G, Cremon C, De Giorgio R, et al. Mechanisms underlying visceral hypersensitivity in irritable bowel syndrome[J]. Curr Gastroenterol Rep, 2011, 13 (4): 308-315.
2 Chung JM, Chung K. Importance of hyperexcitability of DRG neurons in neuropathic pain[J]. Pain Pract, 2002, 2 (2): 87-97.
3 Jones RC 3rd, Xu L, Gebhart GF. The mechanosensitivity of mouse colon afferent fibers and their sensitization by inflammatory mediators require transient receptor potential vanilloid 1 and acid-sensing ion channel 3[J]. J Neurosci, 2005, 25 (47): 10981-10989.
4 袁莉莉,余跃,蒋楠,等. 内脏高敏感模型大鼠结肠特异背根神经节神经元的形态学和兴奋性研究[J]. 安徽医科大学学报, 2013, 48 (11): 1300-1303.
5 Xu GY, Winston JH, Shenoy M, et al. The endogenous hydrogen sulfide producing enzyme cystathionine-beta synthase contributes to visceral hypersensitivity in a rat model of irritable bowel syndrome[J]. Mol Pain, 2009, 5: 44.
6 Qian AH, Liu XQ, Yao WY, et al. Voltage-gated potassium channels in IB4-positive colonic sensory neurons mediate visceral hypersensitivity in the rat[J]. Am J Gastroenterol, 2009, 104 (8): 2014-2027.
7 Xu GY, Shenoy M, Winston JH, et al. P2X receptor-mediated visceral hyperalgesia in a rat model of chronic visceral hypersensitivity[J]. Gut, 2008, 57 (9): 1230-1237.
8 Chaban VV. Visceral sensory neurons that innervate both uterus and colon express nociceptive TRPV1 and P2X3 receptors in rats[J]. Ethn Dis, 2008, 18 (2 Suppl 2): S2-20-4.
9 Zhou Q, Price DD, Caudle RM, et a1.Visceral and somatic hypersensitivity in a subset of rats following TNBS-induced colitis[J]. Pain, 2008, 134 (1-2): 9-15.
10Hong S, Fan J, Kemmerer ES, et al. Reciprocal changes in vanilloid (TRPV1) and endocannabinoid (CB1) receptors contribute to visceral hyperalgesia in the water avoidance stressed rat[J]. Gut, 2009, 58 (2): 202-210.
11Meents JE, Neeb L, Reuter U. TRPV1 in migraine patho-physiology[J]. Trends Mol Med, 2010, 16 (4): 153-159.
12Geppetti P, Trevisani M. Activation and sensitization of the vanilloid receptor: role in gastrointestinal inflammation and function[J]. Br J Phamacol, 2004, 141 (8): 1313-1320.
13Amadesi S, Cottrell GS, Divino L, et al. Protease-activated receptor 2 sensitizes TRPV1 by protein kinase Cepsilon- and A-dependent mechanisms in rats and mice[J]. J Physiol, 2006, 575 (Pt 2): 555-571.
14Dang K, Bielefeldt K, Gebhart GF. Gastric ulcers reduce A-type Potassium currents in rat gastric sensory ganglion neurons[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 286 (4): G573-G579.
15Xu GY, Winston JH, Shenoy M, et al. Enhanced excitability and suppression of A-type K+ current of pancreas-specific afferent neurons in a rat model of chronic pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 291 (3): G424-G431.
16Sculptoreanu A, de Groat WC, Buffington CA, et al. Protein kinase C contributes to abnormal capsaicin responses in DRG neurons from cats with feline interstitial cystitis[J]. Neurosci Lett, 2005, 381 (1-2): 42-46.
(2014-11-27收稿;2015-01-25修回)
·共识与指南·
Expression of TRPV1 and Electrophysiological Characteristics of Colon-specific Dorsal Root Ganglion Neurons in Rat Model of Visceral HypersensitivityYUANLili1,YUYue1,JIANGNan1,CHENFengqin1,WANGQiaomin1,WANGLiecheng2.1DepartmentofGastroenterology,AffiliatedProvincialHospital,AnhuiMedicalUniversity,Hefei(230001);2DepartmentofPhysiology,AnhuiMedicalUniversityBasicMedicalCollege,Hefei
Correspondence to: YU Yue, Email: yuyuemd@163.com
Background: Visceral hypersensitivity is considered to be one of the major pathophysiological mechanisms of irritable bowel syndrome. Aims: To investigate the expression of TRPV1 and electrophysiological characteristics of colon-specific dorsal root ganglion (DRG) neurons in rat model of visceral hypersensitivity. Methods: Twenty 10-day-old rats were randomly divided into two groups. In model group, visceral hypersensitivity was induced by colorectal administration of acetic acid; while in control group the same amount of saline was administered. Colon-specific DRG neurons were labeled retrogradely by injection of DiI, a fluorochrome, into the colon wall. Expression of TRPV1 in DRG neurons was detected by immunofluorescence and the electrophysiological characteristics of DRG neurons was detected by using patch-clamp technique. Results: In model group, the expression rate of TRPV1 in colon-specific DRG neurons was significantly higher than that in controls (46.1%vs. 36.6%,P<0.01), the average rheobase was significantly decreased [(57.80±1.32) pAvs. (73.45±4.51) pA,P<0.05], while the frequency of action potentials (APs) in response to doubling rheobase stimulation was significantly increased [(8.20±1.10) Hzvs. (4.54±0.66) Hz,P<0.05]. Score of abdominal withdrawal reflex (AWR) under a 60 mm Hg colorectal distention was positively correlated with the expression rate of TRPV1 and the frequency of APs in response to doubling rheobase stimulation (r=0.87 andr=0.73,P<0.01), but was negatively correlated with the rheobase (r=-0.81,P<0.01) in model group. Conclusions: Increased expression of TRPV1 and excitability in colon-specific DRG neurons might be a crucial step in formation of visceral hypersensitivity.
Key wordsVisceral Hypersensitivity;Dorsal Root Ganglion;Transient Receptor Potential Channels;TRPV1;
通信作者&本文,Email: yuyuemd@163.com
DOI:10.3969/j.issn.1008-7125.2015.06.005
