杨树嫩茎质外体中脯氨酸含量测定方法的建立
2015-02-17马金龙姜国斌
马金龙,姜国斌,金 华,郭 鹏,吴 懿
(大连民族学院a. 生命科学学院;b.环境与资源学院,辽宁 大连116605)
Kemble 和Macpheson 在研究黑麦时发现,干旱条件下游离脯氨酸大量积累[1],脯氨酸在渗透调节方面发挥着细胞质渗透调节物质和防脱水剂的作用。从遗传角度看,植物的抗渗透胁迫功能是一种数量性状,是由多种基因控制的综合反应,脯氨酸积累只是植物细胞对渗透胁迫反应的一种[2]。将脯氨酸作为一种渗透保护剂的观点是由Csonka 等在研究细菌抵抗渗透胁迫时提出的[3]。Handa 等 和Rhodes 等 都曾报道过马铃薯培养细胞在渗透胁迫下能迅速积累脯氨酸,培养细胞对渗透胁迫表现出较强的适应能力[4-5]。植物的组织、器官和全株试验中,同样也发现了众多的事例说明脯氨酸的积累与抗渗透胁迫之间有显著的正相关[6]。
在渗透胁迫条件下,植物中有10 类基因被诱导表达,产生的物质与植物抗胁迫密切相关[7]。脯氨酸能够稳定蛋白质或通过渗透调节维持细胞膨压或氧化还原代谢恢复细胞的氧化还原平衡,研究植物抗逆性时,也是重要的研究指标[8]。脯氨酸是水溶性最大的氨基酸[9],也是抗渗透压的小分子物质。在发生干旱、盐渍时,植物周围环境渗透压发生变化,大部分植物会积累大量的脯氨酸,从而抵制高渗环境对植物生存和生长的影响[10-12]。
植物质外体是溶质和水分运输、信号转导、抵抗逆境等许多重要生理生化过程的动态空间,植物质外体各项指标的研究技术和方法亟待解决和突破。本研究在前期建立的植物嫩茎质外体汁液微透析技术以及对盐胁迫下杨树嫩茎质外体离子等的微透析和光合生理影响研究的基础上,建立了微透析嫩茎质外体中脯氨酸含量鉴定体系,进而实现植物质外体渗透胁迫生理机制研究技术和理论的创新。
1 材料与方法
1.1 材料
盆栽试验所采用的“吴屯杨”(Populus wutunensis)、“欧美杨”(中荷64)(P. euramericana)及“小美旱杨”[P. simonii ×(P. pyramidalis +Salix matsudana)]由辽宁省阜新县林业局提供。在4月上旬进行插条盆栽(内径20 cm、高16 cm),每隔5 ~7 d 浇0.5 L Hoagland 营养液1 次,注意防雨及植株病虫害防治。微透析MD 取样后进行高效液相色谱HPLC 分析,每个样品均重复3 次。
1.2 仪器
高效液相色谱仪(日本岛津,LC -20A),配有LC-20AT 泵、LC-20AB 二极管阵列检测器和岛津液相色谱工作站,岛津Inertsil ODS -SP 色谱柱(250mm×4.6 mm,5μm),柱温31℃,流动相A:0.05 mol·L-1醋酸钠溶液,流动相B∶乙腈-流动相A(1∶1),洗脱条件:A∶B(50∶50),流速:1.0 mL·min-1,检测波长:254 nm,进样量20 μL[13];微透析MD 仪(瑞典CMA -400);微透析微量注射泵(美国BASi)。
1.3 相关标准溶液的配制[14]
(1)储备液配制:取脯氨酸标准品(上海生工)适量,精密称量,加0.1 mol·L-1的盐酸溶液制成每1 mL 含脯氨酸0.1 mg 的溶液,即为对照品储备液。
(2)标准液:精密量取储备液1 mL,置于10 mL 玻璃试管中,精密加入1.2 %苯异硫氰酸酯PITC -乙腈溶液及14 %的三乙胺-乙腈溶液各2 mL,漩涡混匀1 min,室温放置20 min 后,加入正己烷15 mL 萃取,精密移取下层液4 mL,置于5 mL 容量瓶中,用流动相A 定容,经微孔滤膜(0.45 μm)滤过,即得标准液。
(3)空白液:取0.1 mol·L-1的盐酸溶液置于10 mL 玻璃试管中,后续步骤同(1)。
1.4 植物质外体透析液样品的获取
微透析体系由导引管、微透析探针、连接管、灌注介质、微量注射泵和样品收集器组成。由于杨树茎组织相对动物组织较硬,为防止损伤探针,先用导引管插入幼嫩茎的取样部位,然后再植入探针。探针与嫩茎呈30° ~45°角植入。为防止灌流液损失和探针脱落,采用牙托水(取少许自凝粉,吸取适量义齿基托树脂液剂搅拌至黏糊状)将探针插入部位密封好;灌流速度为1 μL·min-1,灌流液为Millipore-Q 超纯水。选取截留量为30 kD 的探针[15]。
1.5 微透析探针体外回收率和加标回收率的测定
体外相对回收率:在与微透析取样杨树嫩茎相同的条件下,将微透析探针放入已知浓度的脯氨酸标准液中进行取样,每次取样前平衡30 min。测定质量浓度与标准液质量浓度之比就是体外相对回收率。试验重复3 次,得到的体外相对回收率为9.5 %。
汁液浓度计算公式:

式中,C 为质外体汁液中某离子浓度,C1 为原子吸收分光光度计测定的质量浓度值,10 为稀释倍数,0.095 为体外相对回收率。
加标回收率:将微透析仪速度设为1 μL·min-1,选取吴屯杨嫩茎进行微透析取样,获取4份透析液待测。在每份透析液中准确吸取300 μL于4 支小离心管内,分别加入一定体积的标准溶液。测定脯氨酸质量浓度,根据测定结果换算成透析液中加标前后脯氨酸的质量值。重复3 次,计算加标回收率。
1.6 数据处理及分析
试验数据用Excel 2007 预处理后,采用SPSS17.0 软件进行分析,Sigma plot10.0 作图。
2 结果与分析
2.1 脯氨酸标准品定性分析
脯氨酸标准品的HPLC 图谱如图1,60 μL 透析液中脯氨酸HPLC 图谱如图2。从两图中可以看出,二者的脯氨酸出峰时间均为20.8 min,峰形尖锐,表明60 μL 微透析样品完全可以检出脯氨酸。
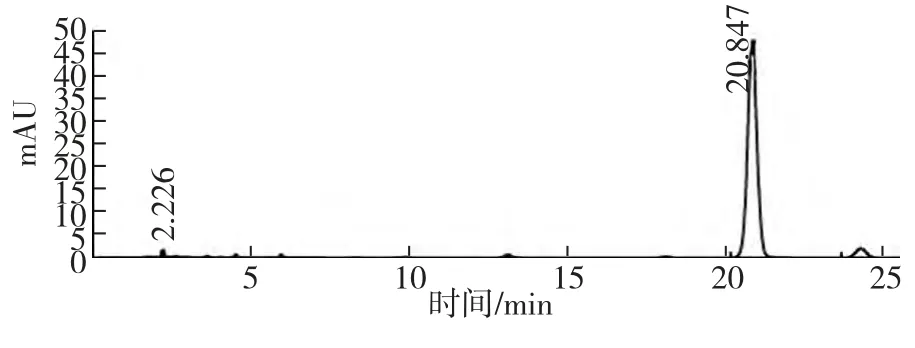
图1 标准方法衍生化脯氨酸HPLC 图

图2 60μL 标准品透析液中脯氨酸HPLC 图
2.2 标准曲线及检出限的测定
为了绘制脯氨酸标准曲线,配制10 mg·L-1脯氨酸的储备液,分成5 个质量浓度梯度,标准溶液在确定的色谱条件下分别进样。以峰面积为纵座标,以进样质量浓度为横座标,将相关数据输入Excel 2003 进行运算,得到脯氨酸的线性回归方程及其相关系数(见表1)。从表1 可以看出,各标样溶液的质量浓度与其峰面积线性关系良好,相关系数在0.998 5 ~1.000 0。

表1 脯氨酸的线性回归方程数据
根据以上色谱条件作标准曲线(如图3),可以看出,脯氨酸质量浓度和峰面积呈现良好的线性关系。

图3 脯氨酸标准曲线
2.3 透析液脯氨酸样品的测定
取透析液60 μL,置于0.5 mLTube 管中,加入0.1 mol·L-1PITC - 乙腈溶液25 μL,1.0 mol·L-1三乙胺- 乙腈溶液25 μL,混匀,室温放置1 h 后,加50 % 乙腈溶液100 μL,混匀,加入正己烷100 μL,漩涡混匀1 min,放置10 min,取下层溶液,即得标准液。所用试剂和超纯水均经过微孔滤膜(0.45 μm)滤过。同时需要配制空白液:取0.1 mol·L-1的盐酸溶液置于0.5 mL Tube 管中,后续步骤同透析液衍生化方法。
将微透析样品在确定的色谱条件下直接进样,测得的峰面积代入回归方程计算出测定值,再依据探针的体外回收率对测定值进行修正。试验过程中每隔60 min 收集透析液进一次样,透析液样品色谱如图4。3 种杨树(吴屯杨、欧美杨、小美旱杨)的微透析液中脯氨酸的测定结果见表2。

图4 3 种杨树透析液中脯氨酸紫外吸收图谱

表2 3 种杨树透析液中脯氨酸质量浓度 mg·L -1
2.4 透析液样品加标回收率的测定
透析液样品加标回收率试验结果见表3。

表3 脯氨酸加标回收结果
3 结论与讨论
脯氨酸是抗渗透压的最重要的小分子物质之一,在发生干旱、盐渍时,植物周围环境渗透压明显发生变化,而大部分植物会积累大量的脯氨酸,抵制高渗环境对植物生存和生长的影响。传统的试验方法选取植物部分组织破碎后再提取脯氨酸,一方面破坏了植株,无法进行持续研究;另一方面只能测得部分组织中脯氨酸的含量[9,12]。本研究采取微透析法,完全克服了这些缺点,而且可以精准定位质外体中的脯氨酸,还可以在以后的逆境胁迫研究中,与胁迫同步进行杨树质外体中脯氨酸含量变化研究,保证研究的准确、及时和定位。因微透析法本身就是对样品的一种高倍数稀释,虽然透析液中脯氨酸含量较少,但通过衍生化方法[14],再结合高精度的HPLC 仪器,完全可以准确检测杨树嫩茎质外体中脯氨酸的含量。
微透析取样样品量少,衍生化是一个难点。本研究最终确定,样品体积为60 μL 时进行衍生化可得到较好的结果。从研究结果可以看出,通过微透析取样,将样品进行PITC 衍生化,得到吴屯杨、欧美杨和小美旱杨3 种杨树嫩茎脯氨酸的质量浓度分别为0.341,0.365,0.254 mg·L-1,结果可靠,重复性好。试验证明,微透析法是研究植物抗逆生理的有效方法。
[1]KEMPLE A R,MACPHERSON H T. Liberation of amino acid in perennial rye grass during witting[J]. Biochem,1954,58:45 -49.
[2]贾文锁,王学臣,张蜀秋,等. 干旱胁迫下ABA 由蚕豆根向地上部的运输及其在叶片组织中的分布[J].植物生理学报,1996,22(4):363 -367.
[3]CSONKA L N,GELVIN S B,GOODER B W,et al.Nucleotide sequence of a mutation in the proB gene Escherichia coli that confers proline overproduction and osmotic stress[J]. Microbiol Rev,1988,53:121 -147.
[4]HANDA S,BRESSAN R A,HANDA A K,et al. Solutes contributing to osmotic adjustment in cultured plant cells adapted to water stress[J]. Plant Physiol,1983,73:834 -843.
[5]RHODES D,HANDA S,BRESSAN R A. Metabolic changes associated with adaption of plant cells to water stress[J].Plant Physiol,1986,82:890 -903.
[6]DELAUNEY A J,VERMA D P S. Proline biosynthesis and osmoregulation in plants[J].Plant Journal,1993,4(2):215 -223.
[7]FOOLAD M R,JONE R A. Mapping salt - tolerance genes in tomato (Lycopersicon esculentum)using trait -based marker analysis[J]. Theoretical and Applied Genetics,1993,87:184 -192.
[8]许祥明,叶和春,李国凤.脯氨酸代谢与植物抗渗透胁迫的研究进展[J].植物学通报,2000,17(6):536 -542.
[9]覃勇荣,谭静,刘旭辉. 桂西北岩溶地区古树脯氨酸含量的比较分析[J]. 中国岩溶,2011,3(1):67 -71.
[10]冀宪领,盖英萍,牟志美. 干旱胁迫对桑树生理生化特性的影响[J]. 蚕业科学,2004,30(2):117 -120.
[11]徐迎春,李绍华,柴成林. 水分胁迫期间及胁迫解除后苹果叶碳同化物代谢规律的研究[J]. 果树学报,2001,18(1):1 -6.
[12]陈亚鹏,陈亚宁,李卫红. 干旱胁迫下的胡杨脯氨酸累积特点分析[J]. 干旱区地理,2003,12(4):420-424.
[13]MA Jinlong,JIANG Guobin,JIANG Bo,et al. Determination of four kinds of endogenous hormones in poplar dialyzate by HPLC with microdialysis[J]. Acta Chromatographica,2013,25(4):627 -637.
[14]邹秦文,肖新月,程显隆,等. 白令胶囊中17 种氨基酸的柱前衍生化RP-HPLC 法含量测定[J]. 药物分析杂志,2010,30(9):1630 -1635.
[15]马金龙,姜国斌,姚善泾,等. 微透析法研究盐胁迫下杨树嫩茎内源激素和叶片叶绿素荧光参数的变化[J]. 植物生理学报,2013,49(9):943 -948.
