IBS-D患者直肠乙状结肠交界黏膜MC活化及类胰蛋白酶的变化及作用研究
2015-02-16胡敏鹂华宏军杨小云陈跃华
胡敏鹂 华宏军 杨小云 陈跃华
浙江省金华市中心医院消化内科,浙江金华321300
IBS-D患者直肠乙状结肠交界黏膜MC活化及类胰蛋白酶的变化及作用研究
胡敏鹂 华宏军 杨小云 陈跃华▲
浙江省金华市中心医院消化内科,浙江金华321300
目的研究MC的活化及类胰蛋白酶在IBS-D中的发病机制中所起到的作用。方法选择满足RomeⅢ诊断标准的IBS-D患者20例,健康的志愿者10例。应用免疫组化方法对肠黏膜MC染色,计算每高倍视野下MC的数量及活化MC占MC总数的比例,并与IBS-D患者GSRS进行相关性分析。结果IBS-D患者MC数量与正常对照组对比差异有统计学意义(P<0.05);且其活化MC比率显著高于正常对照组(P<0.01)。IBS-D患者活化MC胞质增多,胞质染色呈深褐色,并可见脱颗粒现象。MC细胞活化分数与GSRS呈正相关(r=0.626,P=0.003)。结论IBS-D患者MC数量明显增加及活化,与其发病机制密切相关,类胰蛋白酶在IBS-D中可能起着关键作用。
腹泻型肠易激综合征;肥大细胞;类胰蛋白酶;内脏敏感性;免疫组化
肠易激综合征(IBS)属于一种常见的功能紊乱疾病,其发病的主要特点是腹部出现疼痛不适以及排便不规律等,肠道缺乏可以支持症状的器质性改变和生化学异常[1]。IBS是一种全球性疾病,人群患病率因民族、社会文化及生活习惯、地域、诊断标准选择等的不同而存在差异。欧美国家的总患病率约在10%~15%之间[2],国内两项流行病学调查显示北京市和广东省的IBS患病率分别为7.26%和11.5%[3,4]。作为临床上常见的慢性功能性肠病,IBS的病因与发病机制是当前研究的热点,但由于比较复杂,尚不十分清楚,可能与脑-肠轴功能异常、胃肠动力改变、肠道感染、内脏敏感增高、精神心理因素、神经-免疫-内分泌网络调控紊乱等有关。近年来的多项研究发现肥大细胞活化所分泌的的炎症介质类胰蛋白酶在IBS肠道痛觉阈值下降、敏感性增高形成中可能起到关键性的作用。类胰蛋白酶是人们对肥大细胞进行过组织酶染色时发现,具有多种生物活性。按分子结构类胰蛋白酶可分α和β2种类型,几乎特异性地由组织肥大细胞分泌,通过激活蛋白酶活化受体-2(PAR-2)起作用[5,6]。β-类胰蛋白酶属于中性丝氨酸蛋白酶中的一种,分子量为134 000 Da,结构是由4个相同的亚单位和肝素糖蛋白组成的四聚体,主要存在于肥大细胞胞质的小颗粒内,占整个肥大细胞总蛋白的25%,是肥大细胞内含最丰富的一种分泌性介质[7]。当特异性抗原进入机体后,诱导B细胞产生特异性IgE抗体,并且与抗体结合之后又继续和肥大细胞表面存在的FcεRI受体相互结合,这样肥大细胞就会被激活,然后通过脱颗粒的方法把类胰蛋白酶分泌出来,类胰蛋白酶通过激活含有神经肽类物质神经表面的PAR-2,使邻近的肠伤害感受神经元兴奋,传递伤害信息,导致内脏感觉的变化。本实验通过对人直肠乙状结肠交界黏膜肥大细胞作类胰蛋白酶免疫组化染色分析,并计数肥大细胞数量及活化肥大细胞百分率,探讨肥大细胞数量及活化、类胰蛋白酶的变化对肠易激综合征的影响,从而为探讨肠易激综合征发病机制提供理论依据。
1 资料与方法
1.1 一般资料
选择浙江省金华市中心医院2014年5~12月在消化内科门诊及住院部肠易激综合征患者20例,诊断标准符合RomeⅢ诊断标准,其中男8例,女12例,年龄23~64岁,平均41.2岁。另选择10例为结肠息肉摘除术后复查的患者、痔疮患者或健康体检者,结肠镜和病理检查未均发现结肠黏膜有病理性改变且无IBS临床症状者作为正常对照组。男4例,女6例;年龄27~57岁,平均37.3岁。
1.2 标本来源
上述的所有研究对象都在结肠镜的检查中发现,在肛门15 cm的直肠和乙状结肠的相交处取少量的黏膜组织,立即用10%甲醛固定,然后制成石蜡切片,然后用石蜡包裹标本以及连续切片2张,其中1张使用HE染色处理,1张用于肥大细胞类胰蛋白酶免疫组化研究。
1.3 试剂及主要仪器
鼠抗人类胰蛋白酶单克隆抗体(Santa Cruz生物技术有限公司);DAB显色剂试剂盒(北京中杉金桥公司);免疫染色一抗稀释液(碧云天生物技术研究所);PBS磷酸盐缓冲液(粉剂)(福州迈新生物技术开发有限公司);柠檬酸抗原修复液(粉剂)(北京鼎国昌盛生物技术有限责任公司);抗鼠/兔二步法免疫组化检测试剂(上海中杉桥生物有限公司);HE染色试剂盒(北京生物工程有限公司);超净工作台(苏州SW-CJ-IFD型);显微镜、倒置显微镜(日本OLYMPUS公司);高压锅(中国顺发公司);电热恒温干燥箱GZX-GF-101型(上海跃进医疗器械厂)。
1.4 方法
1.4.1 常规HE染色取材组织经固定后,石蜡包埋,4 μm切片,切片放入60℃烤箱烘烤30 min;切片经用二甲苯脱蜡,各级梯度乙醇水化:二甲苯(Ⅰ)10 min→二甲苯(Ⅱ)10 min→100%乙醇5 min→95%的乙醇5 min→85%乙醇5 min→75%乙醇5 min→蒸馏水洗4 min(充分水洗,然后把水吸干);苏木素液染色10 min,自来水冲洗;1%盐酸酒精分化30 s(提插数下,自来水洗);碳酸锂5 s,充分水洗;置75%伊红乙醇液5 min;常规脱水,透明,封片:85%乙醇5 min→95%乙醇(Ⅰ)5 min→95%乙醇(Ⅱ)5 min→100%乙醇(I)5 min→100%乙醇(Ⅱ)5 min→二甲苯(I)5 min→二甲苯(Ⅱ)5 min→中性树脂封固。
1.4.2 免疫组织化学检测肥大细胞类胰蛋白酶肠石蜡标本常规4 μm切片,免疫组化采用非生物素即用型二步法(PV-9000)检测类胰蛋白酶的表达。设立阳性对照(阳性表达的切片由试剂公司提供),以PBS代替一抗作为阴性对照。按试剂盒说明书进行。结果判定:在肥大细胞中,类胰蛋白酶主要在胞质中的颗粒内表达,并且胞浆会被染成棕黄色的就是阳性。对于阴性对照组来说,除了细胞核被染成了蓝色之外,胞浆内没有棕黄色颗粒。在光镜下进行拍照,随机抽选10个400倍的视野进行观察,计数MC总数和活化MC数,MC计数以平均每高倍视野的MC个数表示,活化MC比率则以活化MC数占总MC数的比值表示,采取的是Image Pro Plus 6.0软件,用来对平均光密度进行测量,最后进行统计意义分析研究。
1.5 IBS-D胃肠道症状评分(GSRS)
在IBS-D患者就诊时进行,主要选择的是GSRS标准。详细的评分细则包括:腹部疼痛感不适的程度;排便的异常次数以及频率;是否有急便、排便困难等等问题;出现黏液便的频度。具体的程度评分:0=无;1=表示有一点症状,属于轻度;2=表示有症状但是不影响正常生活,属于中度;3=表示存在影响正常活动的症状,属于重度。频率评分:0=无;1=偶尔(1%~24%时间内出现);2=经常(25%~50%时间内出现);3=持续(>50%时间内出现)。
1.6 统计学方法
采用SPSS17.0软件。肥大细胞数、活化肥大细胞百分率、消化道症状评分值等计量资料采用(x±s)描述,数据资料分析采用独立样本t检验,多样本比较采用单因素方差分析(LSD法),肥大细胞活化率与胃肠道症状评分(GSRS)相关性用Spearman等级相关检验。假如α=0.05,以P<0.05示差异具有统计学意义,P<0.01表示差异具有高度统计学意义。
2 结果
2.1 免疫组化结果分析及MC计数
结果显示,MC主要分布于黏膜固有层和黏膜下层,细胞呈卵圆形、梭形或不规则形状。在高倍镜下(×400,图1)MC通过免疫化的类胰蛋白酶染色之后,胞质呈现为深褐色,细胞核为蓝色,那些没有经过脱颗粒的细胞属于完整的,而且胞质均匀、清晰,那些脱颗粒的细胞出现了破裂,会有少量的颗粒漏出,积聚在周围,而且细胞的形态是不规则的;采用IPP 6.0图像软件测定MC类胰蛋白酶平均光密度。IBS-D患者升结肠黏膜的MC数量(8.423±1.372个/高倍视野)要远远大于健康对照组(5.172±0.821个/高倍视野),差异具有统计学意义(P<0.05);IBS-D组的MC脱颗粒率(67.000± 0.231)%也高于对照组(22.000±0.152)%,差异有高度统计学意义(P<0.01);IPP 6.0图像软件测平均光密度,IBS-D组类胰蛋白酶表达与正常对照组比较差异有高度统计学意义(P<0.01)。见表1。
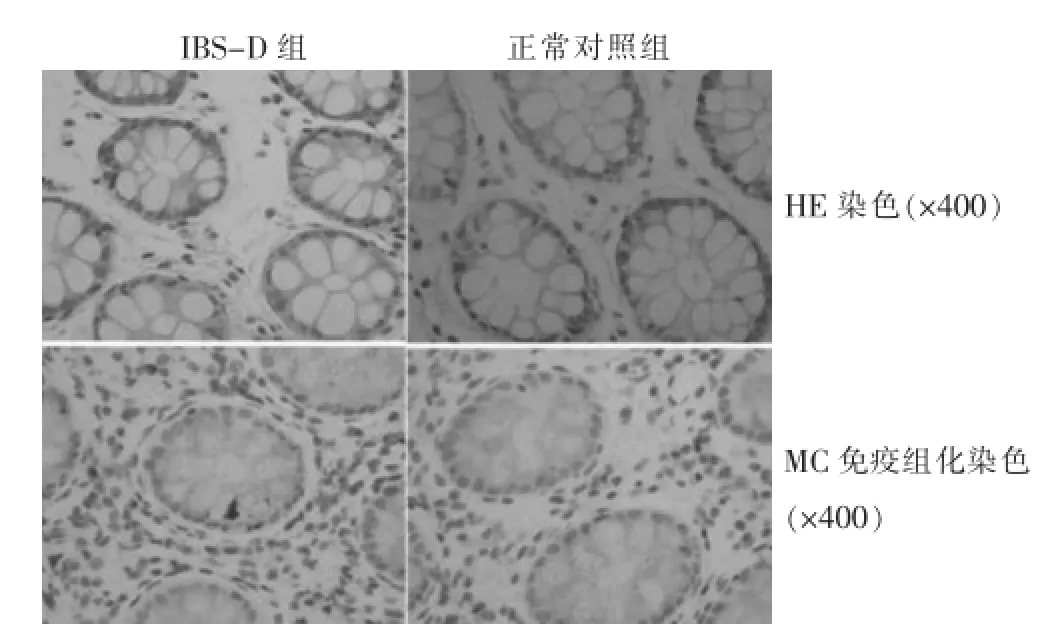
图1 两组HE染色及免疫组化染色
表1 两组结肠黏膜MC数量及活化率的比较(±s)
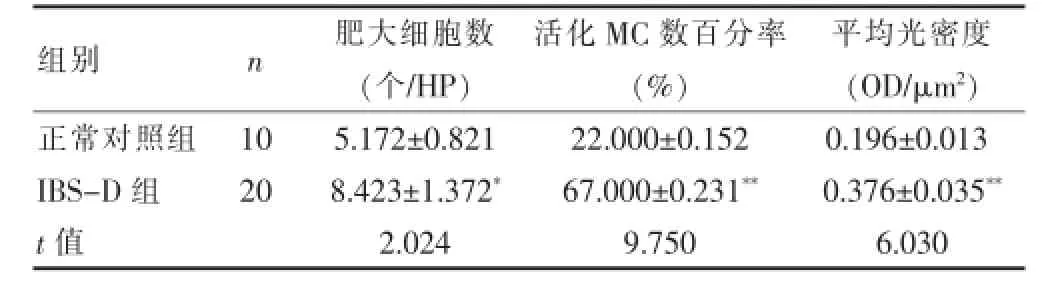
表1 两组结肠黏膜MC数量及活化率的比较(±s)
注:vs对照组,*P<0.05,**P<0.01
组别n肥大细胞数(个/ H P)活化M C数百分率(%)平均光密度(O D / μ m2)正常对照组I B S -D组t值1 0 2 0 5 . 1 7 2 ± 0 . 8 2 1 8 . 4 2 3 ± 1 . 3 7 2*2 . 0 2 4 2 2 . 0 0 0 ± 0 . 1 5 2 6 7 . 0 0 0 ± 0 . 2 3 1**9 . 7 5 0 0 . 1 9 6 ± 0 . 0 1 3 0 . 3 7 6 ± 0 . 0 3 5**6 . 0 3 0
2.2 MC数量及活化百分率、类胰蛋白酶表达与胃肠道症状相关性分析
IBS-D患者的胃肠道症状评分为6~11分,平均(7.10±1.43)分。关于肥大细胞以及腹部症状之间是否存在相关性的问题,主要是通过Spearman等级相关分析显示肥大细胞活化百分率与腹部的症状的总体分数、腹部疼痛不适的程度呈正比例关系,但是和其他的症状没有任何关系;类胰蛋白酶的表达和腹部的症状总分数、腹部疼痛不适的程度还有排便的异常呈正比例关系,但是和其他的症状没有关系。见表2。
3 讨论
IBS的发病机制尚不明确,患者多表现为发作—缓解交替,过去观点认为仅是患者胃肠动力发生紊乱所致。随着对IBS深入研究发现,IBS临床症状表现复杂,已难以用单一生物模式来简单解释。现有研究认为本病与肠道运动异常、内脏感觉过敏、肠道感染及菌群失调、脑肠作用、免疫异常、食物不耐受、慢性应激、遗传环境等因素有关[8]。近年来,许多研究显示神经-免疫-内分泌系统调控异常在IBS的发病中扮演着关键性的角色[9],但其中病理生理机制尚未能弄清。之前已有较多研究报到IBS患者结肠黏膜肥大细胞数量增多、脱颗粒增加,肥大细胞可释放多种生物活性介质,可能与肠运动功能紊乱和内脏感觉异常改变密切相关。本实验通过对指定部位肠黏膜肥大细胞免疫组化染色,计数其数量及活化率、类胰蛋白表达与IBS腹部症状的相关性,来进一步探讨肥大细胞数量增多及活化在肠易激综合征症状发生中的作用。
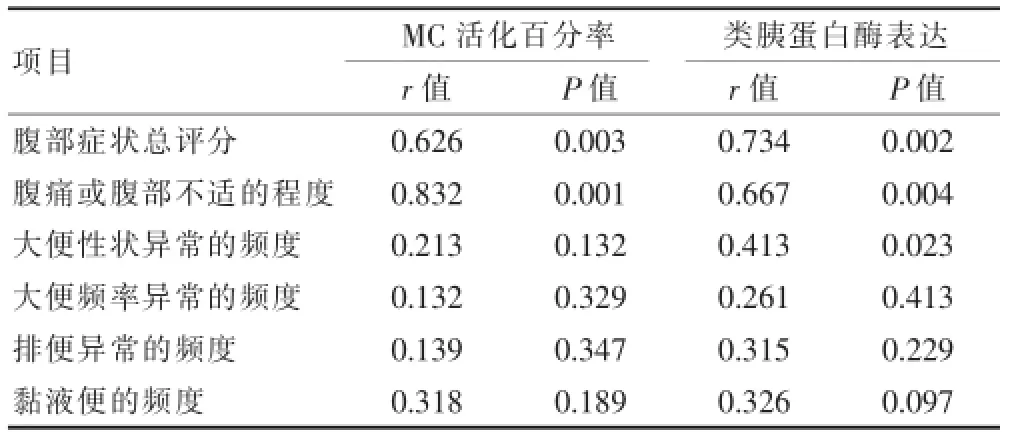
表2 MC活化百分率与腹部症状评分相关分析
肥大细胞(MC)在胃肠道分布广泛,是肠道免疫系统的重要效应细胞[10],构成机体抗感染免疫的第一线防线,通过释放多种潜在生物活性介质刺激炎症细胞,产生级联瀑布效应,参与多种消化疾病的生理病理过程。Demir等[11]报道IBS患者结肠和末端回肠黏膜肥大细胞数量明显高于正常人,在腹泻型IBS患者中,这种差异更为明显,这后多项研究表明MC与IBS之间联系紧密,逐渐成为人们研究的热点。另有大量实验结果发现,MC与传导内脏疼痛的神经纤维接触密切,表明二者之间存在直接双向的交流:一方面,与MC接触的神经纤维可释放多种神经肽,与MC表面的相应受体结合,导致MC活化并释放介质,影响肠动力及痛觉阈值;另一方面,MC通过其合成分泌的神经递质作用于神经细胞上相应受体,将有害信息传至神经中枢,导致中枢敏感性增高,参与IBS的发生发展[12]。MC在免疫途径和非免疫途径介导下活化,是神经-免疫-内分泌系统重要的调节细胞,调节肠道生理功能,IBS的发病可能与这个网络的调控紊乱有关。MC既具有免疫活性,又同时受多种神经肽调节,分泌多种活性介质,参与肠黏膜的免疫反应调节。当各种因素如肠道感染、食物过敏、精神心理紧张等触发机体免疫系统,激活MC,使其脱颗粒并释放类胰蛋白酶、组胺、前列腺素、5-HT、血小板活化因子、白三烯等多种生物活性介质,其中类胰蛋白酶含量最丰富,是MC中的一种重要的生物活性介质,主要存在于MC胞质内,是MC激活和脱颗粒的重要标志。因其具有高度的选择性及敏感性,成为鉴别肥大细胞的重要标志。对肥大细胞类胰蛋白酶进行免疫组化特异性染色,与以往采取的甲苯胺蓝方法相比,结果更清晰、可靠,更适合对MC细胞的观察。
有学者发现IBS患者的结肠组织中存在大量肥大细胞浸润,肥大细胞数目明显增多、活化,肠黏膜中类胰蛋白酶、组胺、5-HT等肥大细胞的产物的含量明显增高。国外研究发现MC稳定剂(如色甘酸二钠、酮替芬)对MC有拮抗作用,可调整内脏感觉及肠运动功能,使IBS症状得到改善[13]。有研究发现MC浸润和介质释放与IBS患者腹痛感觉等症状有关。类胰蛋白酶属于丝氨酸蛋白水解酶,可以用来激活蛋白酶的活化受体-2,即PAR-2,用来刺激感觉神经元引起相应反应。有试验证实结肠内广泛存在PAR-2阳性的神经元,类胰蛋白酶通过识别水解PAR-2胞外区的N-端,暴露其配体激活序列进而激活PAR-2。激活PAR-2后由活化磷脂酶C,使用G蛋白进行引导,通过绝大部分的信号产生生物学效应。肠道内PAR-2阳性神经元兴奋性增高,释放兴奋性神经递质P物质(SP)和降钙素基因相关肽(CGRP),传递痛觉信息,持续刺激中枢系统使其对各种刺激引起的痛觉过敏,感受疼痛阈值降低,敏感性增高[14]。而有研究表明肠道黏膜存在持续低度炎症反应,此反应发生发展过程也有PAR-2参与,此反应的特征为粒细胞浸润及黏膜下水肿,被认为是IBS发生发展中的重要因素之一。
IBS患者结肠黏膜MC数量增多、浸润、活化及其脱颗粒,类胰蛋白酶的释放被认为是肠易激综合征发生的真正原因,MC的数目增加还有活化都会和IBS的症状呈正比例关系,过程主要是通过释放类胰蛋白酶,刺激活化受体-2完成。PAR-2的激活容易造成感受神经元的过度兴奋,产生伤害性的神经递质,引起内脏中的渗透压发生变化,然后增加敏感性;另一个角度,活化受体-2的激活使结肠黏膜上皮细胞间隙增宽、有害物质进入,结肠的低度炎症容易发生转移,这样就会使MC更加快速的表达活化、类胰蛋白酶的合成释放,最终引起肠易激综合症的发生。IBS的病因和发病机制比较复杂,是由多因素相互作用的结果,尚未能完全阐明,而对MC及其分泌的类胰蛋白酶等相关介质在IBS病理生理过程调控机制的深入研究,这样就可以让人们更好的去认识发病机制,对于MC以及类胰蛋白酶的选择性干预得以实现,还可能会找到治疗IBS的新的方法,所以具有非常吸引人的前景。本实验通过对直肠乙状结肠交界黏膜MC的数量及其活化程度的测定,类胰蛋白酶表达程度的分析,研究分析肠粘膜MC以及类胰蛋白酶在腹泻型肠易激综合征中发病机制中的作用。实验结果中MC数量明显增多及活化,类胰蛋白酶量合成增多及释放。机体类胰蛋白酶几乎全部来源于MC的合成与分泌,IBS-D组MC数目明显多于正常对照组,且具有统计学意义,但与腹部症状评分无明显相关。腹部症状评分主要与MC是否致敏及活化、类胰蛋白酶表达程度有关,MC活化率及类胰蛋白酶表达程度与肠易激综合征胃肠道症状相关性说明MC活化及类胰蛋白酶与肠易激综合征发病机制密切相关,而阐明MC被激活,类胰蛋白酶释放的调控机制将为肠易激综合征的治疗开辟新的途径,具有较高的临床价值[15]。
[1]刘思濛,郑鹏远,李付广,等.婴儿双歧杆菌对肠易激综合征小鼠肠道黏膜CRF受体表达及肥大细胞活化的影响[J].中华微生物学和免疫学杂志,2014,(8):571-576.
[2]王深皓,董蕾,李路,等.5-HT4受体激动剂对肠易激综合征患者消化间期运动及胃肠激素的影响[J].西安交通大学学报(医学版),2014,35(2):254-257.
[3]马晓芬,江桂华,李淑美,等.肠易激综合征患者静息态功能磁共振成像比率低频振幅研究[J].中华神经医学杂志,2014,13(3):292-295.
[4]杨文君,冯银琼.培菲康联合马来酸曲美布丁治疗肠易激综合征78例临床分析[J].四川医学,2014,(11):1483-1485.
[5]蔡曼妮,孙晓宁.肠易激综合征与肠道树突状细胞[J].宁夏医科大学学报,2014,36(10):1181-1184.
[6]陈东晖,陈海荣,刘志强,等.利用小鼠模型研究肠道免疫功能紊乱在肠易激综合征致病机制中的作用[J].中华微生物学和免疫学杂志,2013,33(6):445-451.
[7]杜宗汉,王文强,陈杰,等.黛力新联合匹维溴胺双歧三联活菌治疗肠易激综合征的临床研究[J].西部医学,2014,26(7):891-893.
[8]余颖聪,李建新,吴淑娟,等.姜黄素对肠易激综合征模型大鼠5-羟色胺和脑源性神经营养因子的影响[J].中华神经医学杂志,2013,12(5):480-485.
[9]王景杰,秦明,刘震雄,等.干细胞因子/c-kit在肠易激综合征中的作用和地位[J].医学与哲学,2012,33(16):74-75,80.
[10]Farhadi A,Fields JZ,Keshavarzian A.Mucosal mast cells are pivotal elements in inflammatory bowel disease that connect the dots:Stress,intestinal hyperpermeability and inflammation[J].World J Gastroenterol,2007,13(22):3027-3030.
[11]Demir M,Gokturk HS,Ozturk NA,et al.Helicobacter py lori prevalence in diabetes mellitus patients with dyspep tic symptoms and its relationship toglycemic control and late complications[J].Dig Dis Sci,2008,53(10):2646-2649.
[12]于丰彦,迟宏罡,邹颖,等.肠易激综合征与HLA-DQB1基因多态性的相关性[J].广东医学,2013,34(5):717-718.
[13]吴皓萌,徐志伟,敖海清,等.肠易激综合征的中医证候判别分析[J].广东医学,2014,35(5):765-767.
[14]陈桂良.匹维溴铵联合黛力新治疗肠易激综合征的疗效观察[J].广东医学院学报,2010,28(2):161-162.
[15]张鸣鸣,姜敏.肠易激综合征发病机制研究进展[J].世界华人消化杂志,2009,17(24):2484-2490.
Study on MC activation and tryptase change in rectosigmoid adjacent mucosa of IBS-D patients and their role
HU MinliHUA HongjunYANG XiaoyunCHEN Yuehua
Department of Gastroenterology,Jinhua Central Hospital in Zhejiang Province,Jinhua321300,China
Objective To study the role of MC activation and tryptase in the pathogenesis of IBS-D patients.Methods Twenty IBS-D patients meeting the RomeIII diagnostic criteria and 10 healthy volunteers were selected.The immunohistochemical method was used for intestinal mucosa MC staining.The MC count and the proportion of activated MC out of the total MC count under each high power field were calculated and used for correlation analysis with the GSRS of IBS-D patients.Results The MC count of IBS-D patients had statistically significant difference to that of the normal control group(P<0.05),and the ratio of activated MC of the IBS-D patients was significantly higher than that of the normal control group(P<0.01).The cytoplasm of activated MC in the IBS-D patients increased and displayed a dark brown color,and degranulation was observed.The activated proportion of MC cells was in a positive correlation to the GSRS (r=0.626,P=0.003).Conclusion The MC count increases and activates obviously in the patients with IBS-D,which are closely related to the pathogenesis,and tryptase may play a key role in IBS-D.
Diarrhea-predominant irritable bowel syndrome;Mast cells;Tryptase;Visceral sensitivity;Immunohistochemistry
R361.3
A
1673-9701(2015)24-0001-04
2015-04-01)
浙江省中医药科技计划项目(2014ZB126)
▲通讯作者
