盐酸介质中APPB对A3钢的缓蚀作用
2015-02-15苏铁军李克华罗运柏
苏铁军,李克华,罗运柏,习 伟
(1.长江大学 工程技术学院,荆州434020;2.长江大学 化学与环境工程学院,荆州434023;3.武汉大学 化学与分子科学学院,武汉430072)
苯并咪唑衍生物热稳定性好,无特殊刺激性气味,毒性较小,其结构包括苯并咪唑母体环、苯并咪唑环上与N成键的1位取代基或与C成键的2位取代基[1]。许多研究表明,苯并咪唑衍生物能对酸液中的金属起到缓蚀作用。目前,这些工作主要是针对2位取代的苯并咪唑衍生物来研究其缓蚀作用[1-4]。本工作对利用胺甲基化改性得到的一种1位取代苯并咪唑:1-(1-苯胺基-3-苯基-2-丙烯基)-2,3-二氢苯并咪唑(APPB,见图1),采用失重法、动电位极化法和电化学阻抗法考察了盐酸浓度、介质温度和缓蚀剂浓度对APPB缓蚀作用的影响,讨论了APPB对盐酸中A3钢的腐蚀动力学行为及其与A3钢表面的吸附行为。

图1 APPB的分子结构Fig.1 Molecular structrue of APPB
1 试验
1.1 失重试验
按SY 5405-1996《酸化用缓蚀剂性能试验方法及评价指标》中的要求,配制一定浓度的盐酸,将A3钢片依次用400、800、1200目砂纸打磨,再依次用乙醇、丙酮洗净,晾干,放入干燥器保存。在酸液中加入APPB,恒温4h,测定A3钢片在盐酸中的损失质量,然后按式(1)和式(2)分别计算腐蚀速率和缓蚀率。

式中:v为腐蚀速率(g·m-2·h-1),W0和W分别为腐蚀前和腐蚀后的A3钢片质量(g),S为挂片表面积(m-2),t为腐蚀时间(h)。
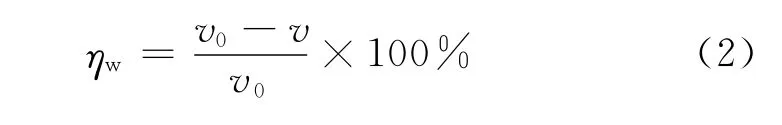
式中:ηw为缓蚀率,v0和v分别为未加APPB及加入APPB后的腐蚀速率。
1.2 电化学测试
在A3钢片表面用AB胶涂抹均匀,依次用400、800、1200目砂纸将工作面打磨光亮,再用乙醇和丙酮洗净,干燥器保存。所用仪器为CHI660E电化学工作站,测试时,采用三电极体系,AB胶包裹的A3钢片作为工作电极,铂盘电极为辅助电极,饱和甘汞电极作为参比电极。极化曲线测量的电位扫描范围为-0.8~-0.2V,扫描速率为0.5mV·s-1。腐蚀电位、腐蚀电流、阴极和阳极的塔菲尔斜率均由仪器自带软件拟合得到,电化学阻抗谱测试的频率范围为0.1Hz~10kHz,交流激励信号幅值为5mV。
为了进一步判断APPB对A3钢片极化行为的影响,计算了缓蚀剂作用系数。在相应腐蚀电位下,缓蚀剂的阴极和阳极作用系数由式(3)、(4)计算[5]:
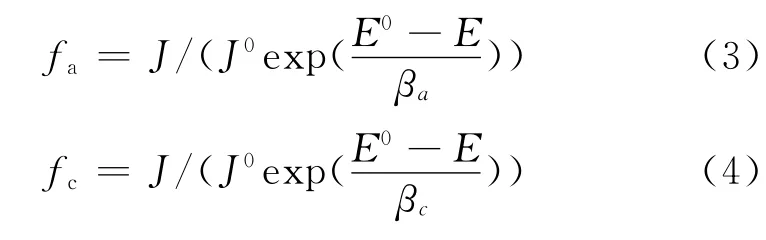
式中:fa和fc分别为缓蚀剂对电化学反应的阳极作用系数和阴极作用系数,J和E分别为加入缓蚀剂后的腐蚀电流密度和腐蚀电位,J0和E0分别为未加缓蚀剂时的腐蚀电流密度和腐蚀电位,βa和βc分别为用自然对数表示的塔菲尔斜率。当缓蚀剂的作用系数fj(j=a,c)<1时,说明缓蚀剂在该电位下对电极反应是起抑制作用的,若fj越小,说明对电极反应的抑制作用越强,缓蚀效果越好。当缓蚀剂的作用系数fj(j=a,c)>1时,则表明缓蚀剂对电极反应起促进作用,会加速腐蚀的发生[5]。
1.3 接触角测定
将A3钢片按前述方法进行打磨、洗净和干燥后,浸入不加APPB和加入一定浓度APPB的盐酸溶液中,4h后取出,洗净,烘干。用JC2000D测量仪(上海中晨)测定水滴与钢片表面的接触角。
2 结果与讨论
2.1 盐酸浓度对APPB缓蚀作用的影响
在温度为300K,5%~25%浓度的盐酸中,采用失重法和极化曲线法考察了APPB对A3钢的缓蚀性能,试验结果分别见表1和图2,拟合得到的极化曲线参数列于表2。
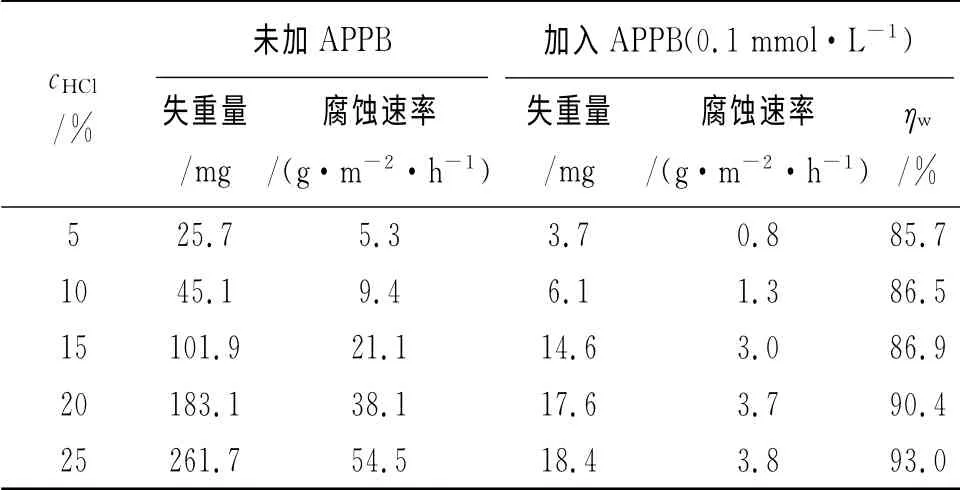
表1 不同盐酸浓度下的失重法测试结果(300K)Tab.1 Results of weight loss in various concentrations of HCl solution with or without APPB(300K)
从表1可见,在相同的酸液浓度条件下,与空白酸液相比,加入APPB后,钢片的腐蚀速率都有明显降低。随着酸液浓度的上升,无论是未加还是加入APPB,腐蚀速率均有增大的趋势。但由于加入APPB后腐蚀速率随酸液浓度上升而增大的幅度要小于未加APPB的增大幅度,缓蚀率并未随之下降,相反还有所增加。
从表2可见,在不同浓度的酸液中,加入APPB后的腐蚀电流均小于相同酸液浓度时未加APPB的腐蚀电流,表明APPB抑制了电极反应的发生。缓蚀剂的阳极作用系数fa和阴极作用系数fc均小于0.2,表明APPB对阴极和阳极反应均有较强的抑制作用。随着盐酸浓度的增加,无论是未加APPB,还是加入APPB(0.1mmol·L-1),腐蚀电流均随酸液浓度的升高而增大。但是二者增大的幅度有明显的差异:未加APPB时,当盐酸浓度从5%增加到25%时,腐蚀电流 增长了27倍;加入APPB后,同样条件下,腐蚀电流仅增长17倍。可见,与未加APPB的相比,在酸液中加入0.1mmol·L-1缓蚀剂APPB后,腐蚀电流增大的趋势明显放缓,这与失重法试验所得到的腐蚀速率随酸浓度增加的变化趋势是一致的,其原因可能是较低的pH有利于含有苯并咪唑基团的APPB与A3钢表面发生供质子的化学吸附[6]。
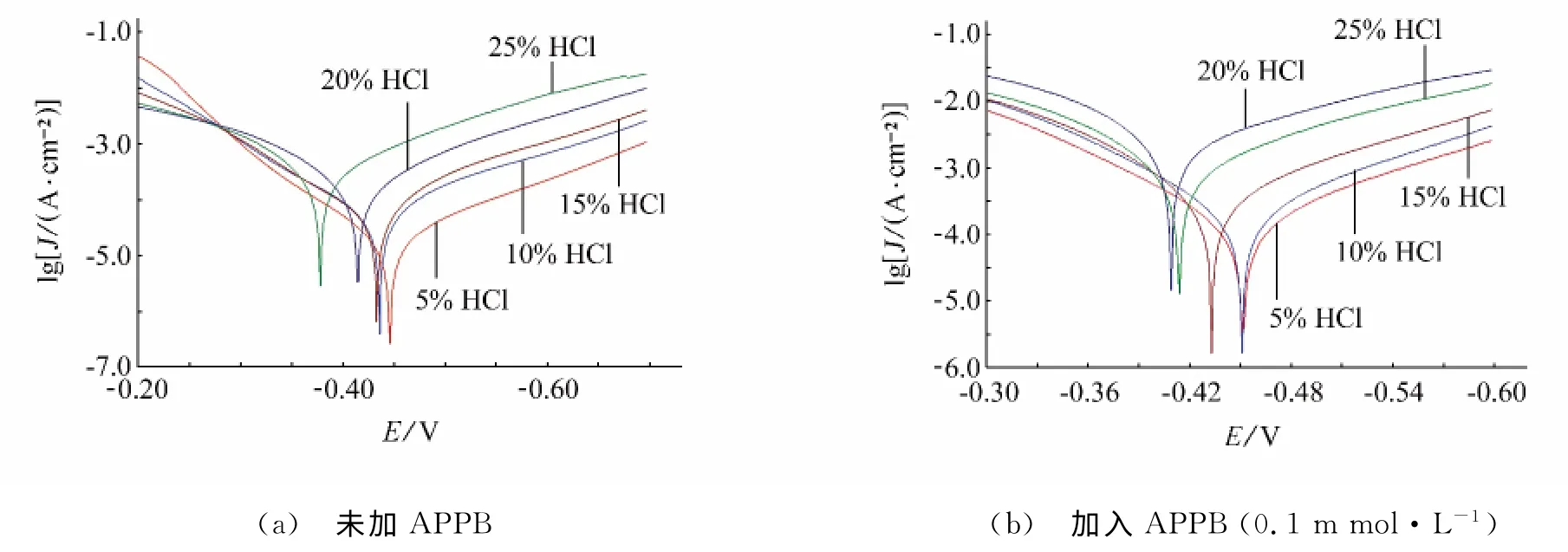
图2 不同盐酸浓度下对A3钢的极化曲线Fig.2 Polarization curves for A3steel in different concentrations of HCl solution(a) blank (b) 0.1mmol·L-1 APPB
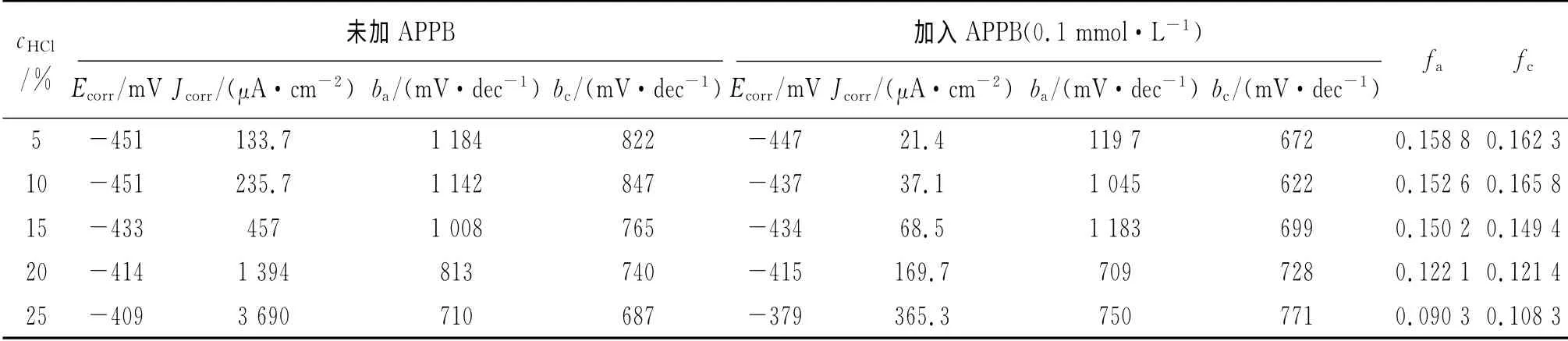
表2 不同盐酸浓度下极化曲线参数(300K)Tab.2 Polarization parameters in HCl solutions with different concentrations(300K)
2.2 介质温度对缓蚀作用的影响及动力学分析
在APPB为0.15mmol·L-1的15%盐酸中,用失重法和极化曲线法考察了300、305、310、325K时的缓蚀情况,结果见表3和图3,拟合得到的极化曲线参数见表4。
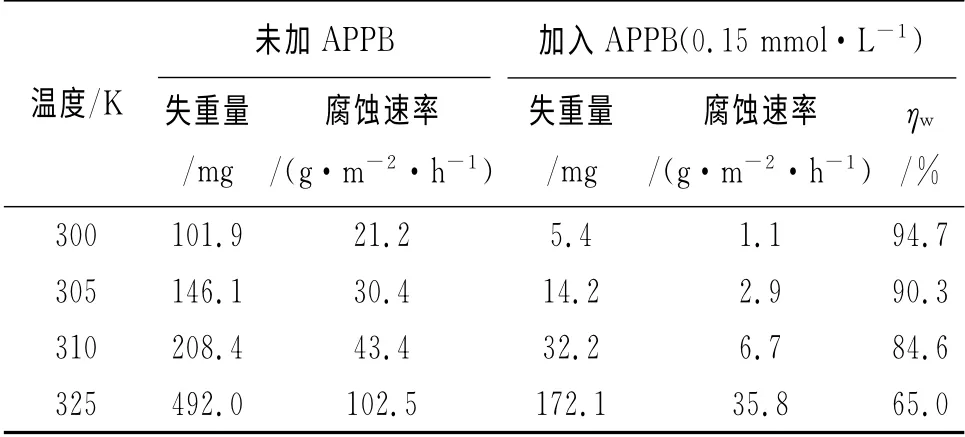
表3 不同温度下的失重法测试结果(15%HCl,0.15mmol·Lˉ1 APPB)Tab.3 Results of weight loss at various temperatures(15%HCl,0.15mmol·L-1 APPB)
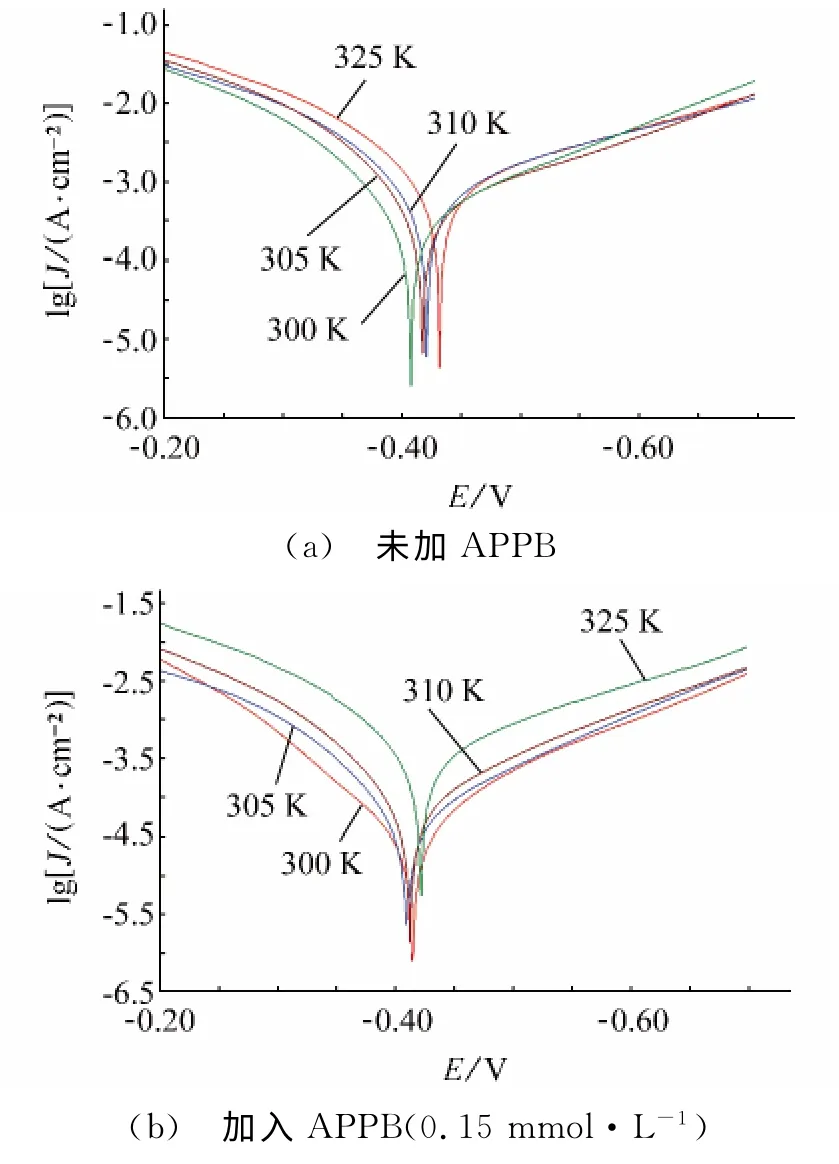
图3 不同温度条件下的极化曲线Fig.3 Polarization curves for A3steel at different temperatures(a) blank (b) 0.15mmol·L-1 APPB
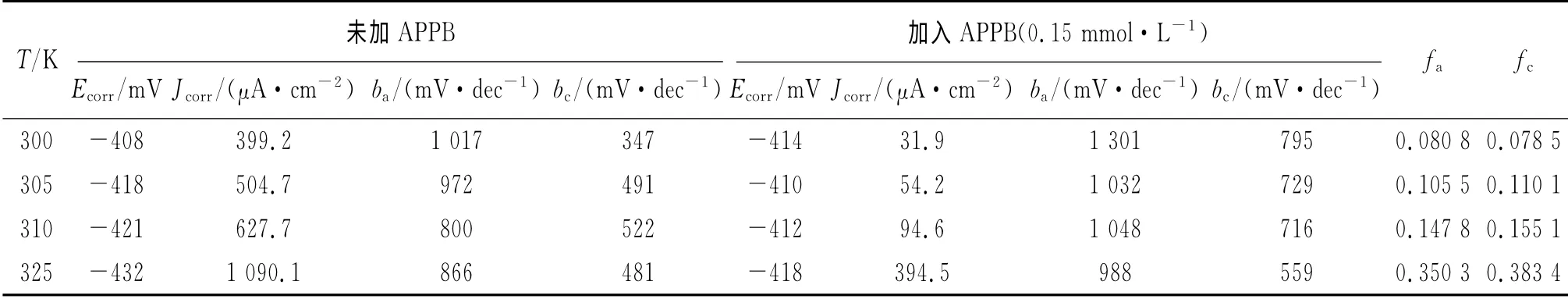
表4 不同温度条件下的极化曲线参数Tab.4 Polarization parameters at different temperatures
从表3可见,随着温度的升高,腐蚀速率上升,缓蚀率下降,原因是升高的温度削弱了APPB在A3钢表面的吸附作用。从表4来看,腐蚀电流密度随着温度升高而增大,而且阴极和阳极的缓蚀作用系数也随之递增,这表明APPB是一种温控型的缓蚀剂,温度的升高将会降低APPB的缓蚀效果。这与表3中失重法所得到的缓蚀率随温度升高而降低的变化趋势相吻合。
通常可将腐蚀过程视为一个Arrhenius过程[7],又因为腐蚀速率与电流密度成正比[8],所以可用式(5)来计算腐蚀反应的活化能:
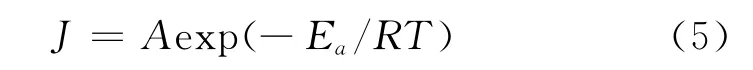
式中:J为腐蚀电流,A为指前因子,Ea为活化能,T为温度。以ln(J)对T-1作图,所得曲线如图4所示。从图4中拟合得到的直线斜率可求得腐蚀过程的活化能。计算结果表明,未加APPB时,A3钢在15%盐酸中发生腐蚀反应的活化能是32.41kJ/mol,加入0.15mmol·L-1的APPB后,腐蚀过程的活化能增大到72.99kJ/mol。由此可见,加入APPB后,腐蚀过程的活化能上升,意味盐酸对A3钢的腐蚀变得更加困难。研究表明,加入缓蚀剂后若活化能升高,则该缓蚀剂在金属表面的吸附是物理吸附[9]。由此判断,APPB在A3钢表面的吸附存在物理吸附过程。
2.3 APPB浓度对缓蚀作用的影响及吸附热力学分析
在300K,15%HCl中,采用失重法、极化曲线法和电化学阻抗谱考察了不同浓度APPB的缓蚀性能,结果分别见表5、图5,极化曲线参数拟合结果见表6。从表6可见,在所研究的浓度范围内,腐蚀电位变化不大。随着体系中APPB浓度的增大,腐蚀电流明显减小,阳极和阴极的塔菲尔斜率呈现上升的趋势,阴极和阳极的缓蚀作用系数均小于1且随APPB浓度增大而逐渐变小,这些均表明随着APPB浓度的上升,缓蚀效果趋好,这与表5中失重法的结果是一致的,同时也可看出APPB是一种混合控制型缓蚀剂。

图4 未加APPB和加入APPB(0.15mmol·L-1)后的Arrhenius曲线Fig.4 Arrhenius curves without APPB and with 0.15mmol·L-1 APPB
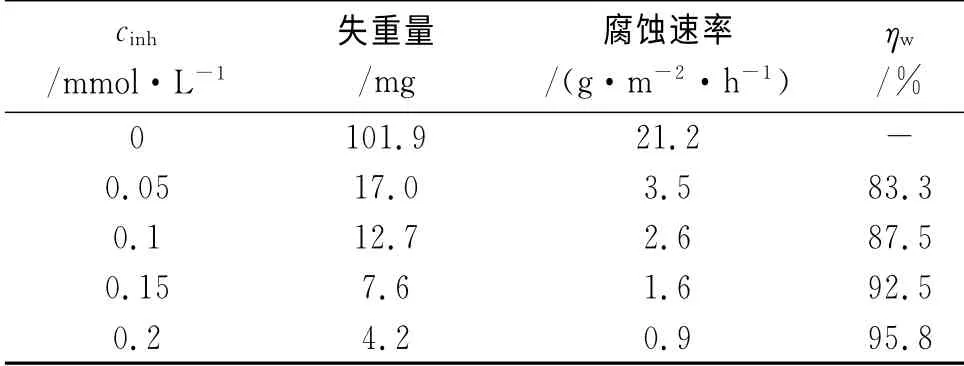
表5 不同浓度APPB的失重测试结果(300K)Tab.5 Results of weight loss in solutions with various concentrations of APPB(300K)
从图5(b)可见,Nyquist曲线显示为一个压扁的半圆形单一容抗弧,因此可以采用单一时间常数的等效电路拟合相关参数[10],其中,Rs为溶液电阻,CPE为常相位角元件,由CPE-T(相当于双电层电容)和CPE-P(弥散指数)组成,Rp为电荷转移电阻,拟合结果见表7。从表中可见,随着酸液中PAB和PPB浓度的升高,CPE-T减小,表明电极界面的双电层电容减小。这是由于缓蚀剂分子取代了水分子吸附于A3钢表面,而有机缓蚀剂分子的介电常数比水分子大,导致缓蚀剂吸附于A3钢表面的界面电容要明显小于水分子吸附于A3钢表面的电容值[11]。CPE-P变化不大,表明电极反应过程仍为电化学控制过程[12]。Rp随缓蚀剂浓度的上升而增大,表明加入APPB后腐蚀过程中电极反应的阻力增大。这与失重法和极化曲线得到的结论相符。根据几何覆盖效应缓蚀机理[13],用失重法所得到的缓蚀率ηw来代替覆盖度θ,则Langmuir吸附等温方程可用式(6)来表示:
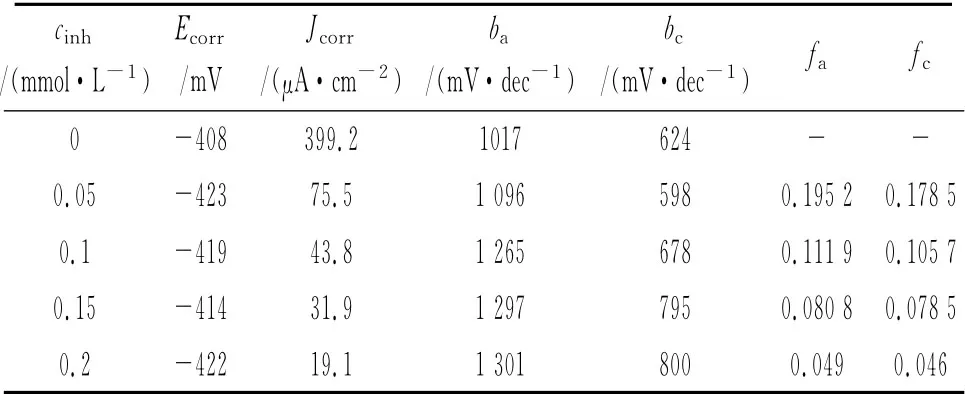
表6 不同浓度APPB条件下的极化曲线参数Tab.6 Polarization parameters in 15%HCl with various concentrations of APPB
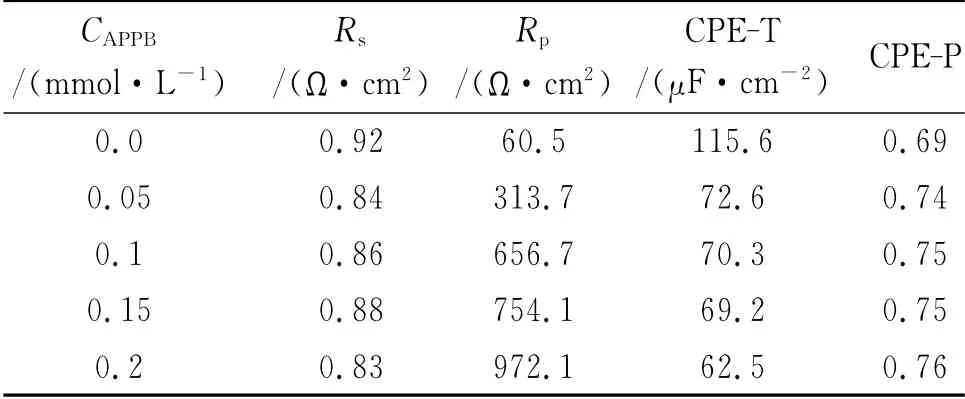
表7 不同浓度APPB条件下的交流阻抗参数Tab.7 Impedance parameters in 15%HCl with various concentrations of APPB
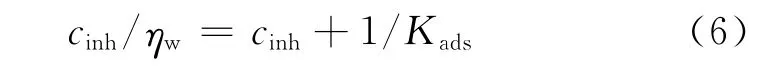
以cinh/ηw对cinh作图,所得图形如图6所示。从图6的拟合结果可见,cinh/ηw和cinh之间有着较好的线性关系,表明用Langmuir等温方程来描述APPB与A3钢在盐酸中的吸附行为是合适的。根据图中直线方程的截距,计算得到的吸附平衡常数Kads为78 186mol-1,再由关系式ΔGθads=-RTln(Kads),可算出吸附吉布斯自由能ΔGθads为-38.1kJ/mol。ΔGθads为负,表明APPB可自发吸附于A3钢表面。一般认为,如果吸附自由能绝对值不超过20kJ/mol,则该吸附过程为物理吸附,如果吸附自由能达到40kJ/mol及以上,则说明该吸附过程为化学吸附[14-15]。因此,APPB在A3钢表面的吸附除了物理吸附外,还存在着化学吸附。

图6 吸附等温线Fig.6 Langmuir isotherm adsorption of APPB at 300K
2.4 接触角测定
图7 为经过未加APPB的酸液和加入0.1mmol·L-1APPB的酸液浸泡后的A3钢片与水之间的润湿情况。从图中可以看出,经过未加APPB的盐酸溶液浸泡后,钢片表面上的水滴塌陷程度大,其接触角为38.7°;而经过加入0.1mmol·L-1APPB的盐酸溶液浸泡后,钢片表上的水滴塌陷程度较小,其接触角为71.8°。可见,经加入APPB的酸液浸泡后,钢片表面的润湿性变差,其原因应是APPB能够吸附于钢片表面,形成了疏水膜。同时,这层疏水膜能降低腐蚀介质粒子与钢片表面接触的机会,从而起到对钢片的缓蚀作用。
2.5 量子化学计算
采用Gaussian03W软件,运用DFT/B3LYP方法,在6-31G*基组水平上对所研究分子进行几何构型优化,并进行频率分析,确保所得的结构均为势能面上的极小点(无虚频)[16],在同一基组水平上计算分子的前线轨道能量和分布。通过量子化学计算,APPB分子的HOMO能量EHOMO为-9.708eV,LUMO能 量ELUMO能 量 为-2.697eV,图8为计算所得的APPB的HOMO和LUMO表面。从图中可见,APPB分子HOMO主要分布在苯并咪唑环及其与之相连的苯胺N上,说明这一区域的电子云密度最大,有较强的供电子能力,可与Fe的3d空轨道形成配位键;LUMO轨道主要分布于丙烯基的双键部位,说明这一区域可接受Fe成键轨道的电子形成反馈键。而且APPB分子HOMO与LUMO的这种非重叠分布还有利于分子以平行的方式吸附于Fe表面[17],从而增大对Fe表面的覆盖面积,提高缓蚀效果。

图7 A3钢片与水的接触角Fig.7 Contact angels between A3steel surface and water:(a)blank and(b)0.1mmol·L-1 APPB

图8 APPB的前线轨道分布Fig.8 Frontier molecule orbital plots of APPB(a):HOMO,(b):LUMO
3 结论
(1)APPB对碳钢的盐酸腐蚀有良好的抑制作用,缓蚀作用随APPB浓度的升高而增大。加入APPB后,提高了A3钢片在盐酸中发生腐蚀反应的活化能,使得腐蚀反应的进行需要克服更高的能垒,使腐蚀作用难以发生。
(2)APPB是一种混合控制型缓蚀剂,它可与Fe原子形成配位键和反馈键,能在盐酸溶液中自发的吸附于A3钢表面,这种吸附作用遵循Langmuir吸附等温式,吸附过程兼具物理吸附和化学吸附的特点。
[1]宋力,张帆,王海平,等.2(4-吡啶基)苯并咪唑对碳钢的缓蚀行为[J].腐蚀与防护,2013,34(2):142-146.
[2]POPOVA A,SOKOLOVA E,RAICHEVA S.AC and DC study of the temperature effect on mild steel corrosion in acid media in the presence of benzimidazole derivatives[J].Corrosion Science,2003,45(1):33-58.
[3]ZHANG F,TANG Y M,CAO Z Y.Performance and theoretical study on corrosion inhibition of 2-(4-pyridyl)-benzimidazole for mild steel in hydrochloric acid[J].Corrosion Science,2012,61(1):1-9.
[4]胡松青,米思奇,贾晓林.苯并咪唑类缓蚀剂的3DQSAR研究及分子设计[J].高等学校化学学报,2011,32(10):2402-2409.
[5]曹楚南.腐蚀电化学原理[M].北京:化学工业出版社,2004:201-203.
[6]吴荫顺,郑家燊.电化学保护和缓蚀剂应用技术[M].北京,化学工业出版社,2006:496-497.
[7]ALJOURANI J,RAEISSI K,GOLOZAR M A.Benzimidazole and its derivativesas corrosion inhibitors for mild steel in 1MHCI solution[J].Corrosion Scienee,2009,51(8):1836-1843.
[8]王凤平,康万利,敬和平.腐蚀电化学原理、方法及应用[M].北京:化学工业出版社,2008:13-14.
[9]MORAD M A,EI-DEANA A M K.2,2′-Dithiobis(3-cyano-4,6-dimethylpyridine):A new class of acid corrosion inhibitors for mild steel[J].Corrosion Sciecce,2006,48(11):3398-3412.
[10]何桥,张胜涛,李伟华,等.酸性介质中新型三唑类缓蚀剂在碳钢上的吸附行为[J].腐蚀与防护,2008,29(5):243-246.
[11]WANG X,YANG H,WANG F.An investigation of benzimidazole derivative as corrosion inhibitor for mild steel in 1MHCl solution[J].Corrosion Science,2009,51(5):1836-1843.
[12]宋伟伟,张静,杜敏.新型不对称双季铵盐缓蚀剂在HCl中对Q235钢的缓蚀行为[J].化学学报,2011,69(16):1851-1856.
[13]LAGRENEE M,MERNARI B M,BOUANIS M,et al.Study of the mechanism and inhibiting efficiency of 3,5-bis(4-methylthiophenyl)-4H-1,2,4-triazole on mild steel corrosion in acidic media[J].Corrosion Science,2002,44(3):573-579.
[14]ALJOURANI J,RAEISSI K,GOLOZAR M A.Benzimidazole and its derivativesas corrosion inhibitors for mild steel in 1MHCI solution[J].Corrosion Science,2009,51(8):1836-1843.
[15]MARTINEZ S,STERN I.Inhibitory mechanism of low-carbon steel corrosion by mimosa tannin in sulphuric acid solutions[J].Journal of Applied Electrochemistry,2001,31(9):973-978.
[16]卑凤利,陈海群,杨绪杰,等.苯并咪唑衍生物的合成-晶体结构及量子化学计算[J].有机化学,2004,24(3):300-305.
[17]张军,赵卫民,郭文跃,等.苯并咪唑类缓蚀剂缓蚀性能的理论评价[J].物理化学学报,2008,24(7):1239-1244.
