铜绿假单胞菌毒性蛋白ExoU的研究进展
2015-02-14鞠晓红李正花马爱新
鞠晓红,李正花,马爱新,李 瑶
铜绿假单胞菌毒性蛋白ExoU的研究进展
鞠晓红1,李正花2,马爱新1,李 瑶1
铜绿假单胞菌是一种重要的条件致病菌,有多种毒力因子,其中Ⅲ型分泌系统(T3SS)在其引起的急性感染中发挥至关重要的作用,是铜绿假单胞菌感染、致病的重要因素。T3SS主要通过靶向输送4种效应蛋白(ExoS、ExoT、ExoU和ExoY)对宿主细胞发挥毒性作用。其中ExoU是最具破坏性的蛋白,与感染的发生、预后及治疗密切相关。本文主要将近年来与毒性蛋白ExoU有关的研究进展做一简要综述,旨在为铜绿假单胞菌感染的控制及治疗提供参考。
铜绿假单胞菌;Ⅲ型分泌系统;ExoU;多重耐药;毒力基因
铜绿假单胞菌广泛分布于自然界及人和动物机体皮肤、呼吸道及肠道中,是一种常见的条件致病菌。在机械性气道损伤、免疫抑制或患有艾滋病、肿瘤的患者常引起急性肺炎,尤其肺纤维化患者更易引起致死性感染[1]。目前已知铜绿假单胞菌成功感染宿主细胞并导致疾病的主要原因是Ⅲ型分泌系统(typeⅢsecretion system,TTSS)的作用,通过T3SS将毒性蛋白ExoS、ExoT、ExoU和ExoY直接注入宿主细胞,引起肌动蛋白细胞骨架重排、细胞坏死,有利于细菌的入侵和扩散并逃避宿主吞噬细胞的吞噬或降解[2,3]。4种蛋白中,ExoU是主要毒性蛋白,ExoU阳性菌株在体内外均可引起细胞坏死、死亡,直接关系到感染患者的病情进展及预后,在致病过程中发挥关键作用[4-5]。因此,深入探讨毒性蛋白ExoU在感染中的作用及机制,成为研发新药靶标、有效预防和治疗铜绿假单胞菌感染的迫切需要。
1 ExoU蛋白的基因控制
ExoU蛋白的表达和分泌由铜绿假单胞菌T3SS的毒力基因对exoU/spcU决定。spcU基因编码ExoU蛋白的分子伴侣SpcU(一种小分子酸性蛋白),常与ExoU以1∶1的比例在菌细胞内特异性结合,阻止蛋白不恰当聚合或分泌、提高分泌前及分泌时的稳定性,但本身不向菌细胞外分泌。铜绿假单胞菌T3SS涉及的相关基因有43个,其中exoU/spcU位于染色体上与转位、分泌和调节相关基因不同的基因岛(genomic island)上。Kulasekara BR等[6]对来自美国不同医院的6株铜绿假单胞菌利用酵母重组克隆技术进行exoU/spcU基因岛检测,结果共发现3个ExoU基因岛(分别命名为A岛、B岛和C岛),均插入在tRNALys基因中,占据两个开放读码框架(ORF)。A岛长度为81.17 kb,包含77个ORF,GC平均含量57.0%,明显低于核基因组的66.7%,exoU/spcU位于第76和77 两个ORF;B岛长度为29.85 kb,包含41个ORF,GC平均含量56.8%,exoU/spcU位于第26和27 两个ORF;C岛长度为3.89 kb,包含3个ORF,exoU/spcU位于第2和第3个ORF,与A岛极其相似,起始部位的256 bp 85.2%与A岛相同,3个基因岛两端的正向重复序列完全一致。进一步将A岛的基因序列与质粒pKLC102上的exoU基因序列比较,发现二者高度同源。 pKLC102整合酶基因93%与A岛相同,使其有能力插入到染色体tRNALys基因位点两侧,据此推断铜绿假单胞菌的ExoU基因岛可能来源于与pKLC102质粒亲缘关系密切的带有插入序列和转座子的整合型质粒。推测最初铜绿假单胞菌可能通过基因水平转移获得携带有exoU/spcU基因的祖先质粒(ancestral plasmid),随后发生染色体整合,在整合过程中维持质粒独立存在和转移的部分必须基因被删除或缺失,最终导致整合的外源基因以基因岛的形式稳定存在于染色体基因组中,exoU/spcU基因转移罕见。不同铜绿假单胞菌ExoU基因岛中许多保守片段也有较大变化,但全部保留有完整的exoU/spcU基因对,由此认为选择分泌功能性ExoU蛋白可能是细菌适应环境压力的进化结果。
一般认为,在T3SS 4种毒素蛋白的结构基因exoS、exoT、exoU和exoY中,同一株铜绿假单胞菌不能同时携带exoS和exoU基因,二者互为排斥[7-8]。由于exoS基因缺乏基因岛的典型特征,目前认为exoS与基因岛无关,因此推测exoU与exoS基因相互排斥不可能是质粒不相容的结果,exoS基因可能在exoU/spcU基因整合进细菌染色体之前已经被菌体获得,由于遗传因素将随后进入菌体的ExoU基因岛删除[6]。也有人认为可能是二者占据相同的基因位点因而互相排斥[9]。但最近几年国内外的多项研究均显示在同一株铜绿假单胞菌中可以同时检测到exoS和exoU基因[10-12],具体机制不明,是否意味着细菌在环境压力下发生基因位点改变、抑或毒力增强的结果?今后仍需进一步加强研究工作。
2 ExoU蛋白结构
ExoU是由687个氨基酸残基组成、分子量74 kD的水溶性蛋白质,以往研究认为ExoU由3个结构域(domain)组成,从N端到C端分别是分子伴侣结构域、磷脂酶A2(PLA2)结构域和膜定位结构域[13]。Claire G等[14]根据功能进一步将分子伴侣结构域划分为两个子域(subdomain),是序列上不连续而空间构象相邻的两部分。Halavaty AS等[15]研究认为,ExoU实际折叠成4个结构域(图1[15]),结构域内部存在多个无序区域(图中Ⅰ~Ⅷ表示),其中PLA2活性结构域无序基序最多,推测可能是细菌控制正确发挥PLA2活性的一种生理机制。ExoU分泌后在辅助活化因子作用下,无序基序转变为功能性结构,发挥PLA2的细胞毒活性。空间构象上分子伴侣SpcU与其中的3个功能区相接触。
结构域1是分子伴侣SpcU结合区(SpcU-BD),由不连续的两部分组成,靠近N端的55-101位氨基酸和C端的472-502位氨基酸区域,其中65-101位氨基酸残基折叠成1个α螺旋和4个β片层结构,是与分子伴侣相结合的最主要部位;472-502位氨基酸残基折叠成1个β片层和4个α螺旋结构,没有结合SpcU的能力,推测可能作为一个独特的“平台”结构,其功能是执行两个关键结构域(PLA2域和膜定位域)的桥联。
结构域2是PLA2活性区(PLA2-D),以往研究认为这一区域位于107-357位氨基酸之间,而Halavaty AS等[15]通过纯化的ExoU晶体结构研究认为,这一区域可能实际开始于102位氨基酸,延伸至471位氨基酸,357位异亮氨基酸之后的基序可能有助于反平行β片层结构形成,以利于与膜定位区和SpcU结合。PLA2酶催化区与其他已知的磷脂酶具有很低的序列同源性,但核心β片层与人类胞浆型PLA2(c PLA2)和植物patain样PLA2结构高度相似[16-17]。PLA2活性和细胞毒性高度依赖Ser142、氧阴离子洞(Oxyanion hole)及Gly286,三者空间构象相邻。Ser142和Asp344构成ExoU蛋白的催化二分体(catalytic dyad),任何一个位点被替换或变异都会使PLA2活性丧失。Ser142位于漏斗样结构中心,周围包绕许多柔韧的环状结构,3个甘氨酸(Gly111,112,113)在相邻位置构成氧阴离子洞作为支撑骨架,维持磷脂酶反应中间过渡状态的电荷稳定;酶催化位点Asp344位于无序区Ⅲ。Lys178是ExoU进入宿主细胞后的泛素化位点。一旦ExoU在细胞膜上定位,Lys178即成为泛素化的目标。Lys178靠近酶活性中心,位于具有高度柔韧性的区域,侧链距离Ser142约7埃。然而泛素化的结果不是导致ExoU蛋白降解,而是使ExoU蛋白活化的关键步骤,详细机制尚未阐明,推测可能是泛素修饰后引起蛋白质结构重排的结果[18]。
503-603位氨基酸残基和604-687位氨基酸残基分别构成了ExoU的第3个和第4个结构域,主要发挥膜定位功能,使效应蛋白靶向进入宿主细胞膜的区域。结构域3形成左手螺旋,而结构域4形成的螺旋束同时与分子伴侣和PLA2区域相连。679-683位氨基酸变异菌株不能与细胞膜上的磷脂酰肌醇-4,5-二磷酸(PI(4,5)P2)结合,提示ExoU的细胞膜靶位点是PI(4,5)P2,而发挥膜定位的关键基序是679-683位氨基酸残基[14]。不过,多数研究认为膜定位区位于550-687氨基酸之间,属于1个独立功能区[19-20]。至于ExoU的功能区到底如何划分更为合理,有待于对ExoU作用机制的更深入研究。
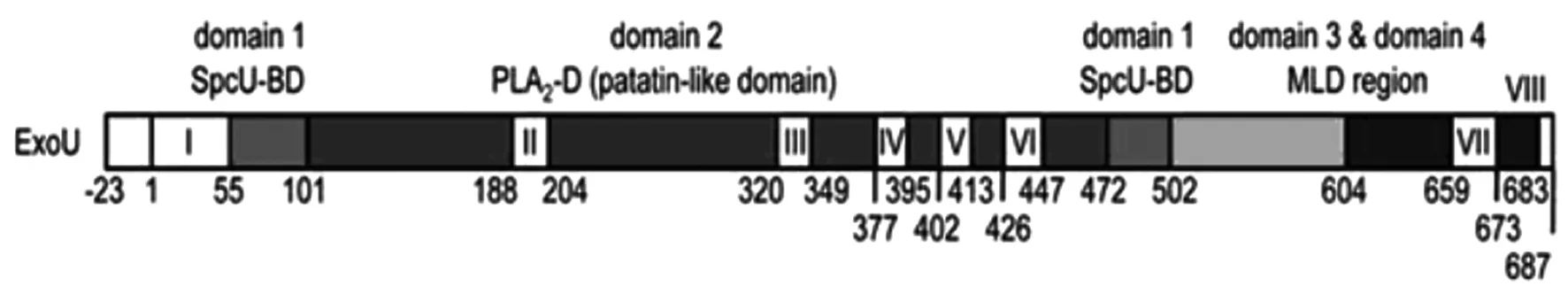
图1 铜绿假单胞菌ExoU蛋白结构图Fig.1 Structure of ExoU of Pseudomonas aeruginosa
3 ExoU蛋白的生物学活性及调控
ExoU是具有强大细胞毒性的磷脂酶A家族成员,主要表现为PLA2活性,属于钙非依赖性磷脂酶,又称含patatin磷脂酶结构域酯酶,是一种天然表面活性剂,未被T3SS分泌时,与分子伴侣SpcU以1:1比例结合成无活性复合物。分泌后选择性与真核细胞膜上的PI(4,5)P2结合,在辅助因子的协同作用下ExoU蛋白被激活,刺激宿主细胞释放大量花生四烯酸进而生成生物活性介质,诱导细胞变圆、皱缩,进而导致细胞骨架崩溃、裂解死亡,细胞死亡的主要原因是坏死[19,21-22]。在Hela细胞感染模型中,培养液中预先加入PI(4,5)P2可明显增强ExoU的细胞毒性,进一步研究发现PI(4,5)P2不是通过增加细菌数量而是通过增强效应发挥细胞毒作用[14]。在鼠肺炎模型中,活化的ExoU能引起巨噬细胞和上皮细胞急性细胞毒反应;在人类严重的铜绿假单胞菌感染病例,ExoU能特异性杀伤中性粒细胞,降低患者免疫防御能力,使患者更易发生二重感染[23]。除了主要的细胞毒活性外,在上皮细胞ExoU还能激活c-Jun氨基末端激酶(JNK)信号转导通路和AP-1介导的促炎基因表达[24],激活NK-κB信号通路,刺激IL-8基因表达及IL-8分泌[25]。
同ExoS、ExoT和ExoY相似,ExoU发挥细胞毒活性需要真核细胞提供辅助因子的协同刺激,这是细菌的一种重要自我保护机制,因为ExoU完全有能力水解细菌自身细胞膜,这种细胞辅助因子的真核细胞特异性使铜绿假单胞菌能选择性的破坏宿主细胞而不影响细菌的自身安全及产毒。在体外,将纯化的重组ExoU(rExoU)与脂质体共培养检测不到PLA2活性,而与酵母细胞或哺乳动物细胞提取液共培养即可检测到PLA2活性,经蛋白酶或加热处理细胞提取液后PLA2活性显著降低,提示在真核细胞中存在蛋白类辅助因子。目前认为真核细胞泛素、泛素化蛋白及Cu/Zn超氧化物歧化酶(SOD1)可能是这种毒素的重要活化因子[26,27]。进一步研究发现[26,28],SOD1经处理消除酶活性(如去除金属离子)后依然能够活化ExoU,说明辅助因子SOD1可能不是通过酶活性,而是通过诱导ExoU发生结构重排使其发挥活性效应。Benson MA等[18]采用位点定向的自旋标记技术(SDSL)结合电子顺磁共振光谱技术(EPR)研究rExoU功能时发现,在S137R1中加入SOD1和脂质体能发生明显的光谱变化,并且存在SOD1浓度依赖性;在S643R1中单独加入脂质体无光谱变化,但加入SOD1后发生显著光谱改变,推测ExoU的构象改变可能发生在酶催化活性部位和C端区域。纯化的ExoU/SpcU复合物,即使在辅助因子SOD1过剩时,仍然缺乏水解磷脂类似物(如花生四烯酰基硫脂酰胆碱)的能力,推测ExoU的辅助活化因子和分子伴侣SpcU可能以相似的方式与蛋白结合,因而二者相互竞争,SpcU的存在抑制PLA2活性发挥[15]。PI(4,5)P2与泛素共存时,能发挥协同作用增强ExoU的PLA2活性;PI(4,5)P2含量减少的酵母细胞突变体,对ExoU介导的杀细胞效应敏感性下降,由此推测PI(4,5)P2可能是一种新型的ExoU共激活因子[21]。
4 ExoU蛋白相关性实验室检测
目前围绕铜绿假单胞菌ExoU蛋白的检测主要包括三方面内容,一是直接检测蛋白,二是检测蛋白编码基因exoU,三是检测蛋白的PLA2生物学活性。由于T3SS分泌效应蛋白的先决条件是有适宜的环境条件,并与宿主细胞密切接触,由宿主细胞提供辅助活化因子,因此蛋白直接检测和PLA2活性检测不适用于临床分离菌株常规检查,一般只用于实验室研究。目前临床应用较多的是基因检测,通过设计引物扩增基因、测序,检测临床分离菌株exoU基因携带率,间接反映ExoU蛋白与临床疾病类型、病情进展、预后及耐药等相关性。
5 ExoU与临床疾病
由于存在地区、环境、用药习惯及疾病类型等差异,相关文献报道ExoU蛋白编码基因exoU检出率相差很大,比较趋向一致的结果是exoU阳性菌株感染病例一般较为严重。36株烧伤患者伤口分泌物检出的多药耐药铜绿假单胞菌中,exoU基因100%阳性[29]。糖尿病足患者感染exoU阳性菌株与exoS阳性菌株相比具有更低的治愈率(25% vs 65.2%)和更高的截肢率(33.3% vs 8.7%)[30]。Idris SN等研究认为[31]exoU阳性菌株存在感染部位和性别差异,更易引起呼吸道感染(61%),在男性患者中检出率更高(83%)。Garey KW等[32]回顾性分析122例铜绿假单胞菌感染的菌血症患者,发现exoS阳性检出率明显高于exoU(72.1% vs 27%),但二者致死率未见显著差异(35% vs 43%),推测菌血症患者死亡率高的原因可能与铜绿假单胞诱导血管内皮细胞凋亡,容易导致DIC和感染性休克有关[33]。今后应通过增加样本类型和样本量,同时检测exoU阳性菌株的蛋白表达状况,进一步探讨ExoU与临床疾病及病情严重程度的确切相关性。
6 ExoU与耐药相关性
近年来,随着广谱抗菌药物的大量应用、甚至滥用,铜绿假单胞菌耐药问题日益突出,碳青霉烯类、氟喹诺酮类药物耐药成为威胁感染患者生命的重要因素,在南韩59.6%的碳青霉烯类耐药的铜绿假单胞菌表现为对氟喹诺酮类药物耐药[34]。Hye等[11]分析66株碳青霉烯类药物耐药的铜绿假单胞菌发现,exoU携带率远高于exoS(66.7% vs30.3%),与exoS阳性菌株相比exoU阳性菌株对氟喹诺酮药物具有更高的耐药率(93.2% vs 45%),进一步研究发现exoU阳性菌株氟喹诺酮耐药决定区(QRDRs)多位点突变率高达90.9%,显著高于exoS阳性菌株的35%,同时携带两种基因的菌株100%属于多位点变异。Mellissa[35]等分析270株铜绿假单胞菌,其中54%氟喹诺酮耐药,exoU阳性菌株耐药率63%,明显高于exoS阳性菌株的49%,多点突变率显著高于exoS阳性菌株(53% vs 39%),突变位点以Thr83lle和Ser87Leu为主,突变率达70%。欧洲的一项调查结果同样显示[36],exoU阳性菌株与铜绿假单胞菌的多药耐药性及氟喹诺酮耐药之间存在明显相关性,认为可能exoU阳性菌株更能适应氟喹诺酮药物富集的环境。角膜炎患者分离的铜绿假单胞菌耐药分析亦显示[37],exoU阳性菌株与阴性菌株相比对环丙沙星、庆大霉素、氧氟沙星具有更高的耐药性。
关于exoU阳性菌株耐药性更强的详细机制目前还不清楚,推测可能与下列因素有关:①外排泵系统过度表达:在加有外排泵抑制剂(EPI)时,97%的exoU阳性菌株对左氧氟沙星的MIC值降低至少8倍,其中55%的耐药菌株重新表现为对氟喹诺酮敏感[35];②与细菌启动SOS应答有关:低浓度左氧氟沙星即可启动细菌的SOS应答,诱导产生具有“错误倾向”的DNA修复酶,引起细菌广泛的基因突变[38]。由此推测,在药物压力下exoU阳性菌株在SOS应答中可能更倾向于产生耐药相关聚合酶,通过耐药突变的发生使细菌得以存活;③与细菌DNA的拓扑结构有关[35]:某些基因的启动子对DNA超螺旋状态的变化高度敏感,超螺旋可能改变启动子区结构使其进入转录、表达状态,推测exoU阳性菌株可能携带有拓扑结构敏感启动子,氟喹诺酮类药物作用于细菌的DNA旋转酶使DNA超螺旋状态改变,致使细菌拓扑结构敏感的耐药基因表达。
目前国内有关T3SS及其效应蛋白与细菌耐药相关性的研究较少,现有的研究资料关于exoU基因和ExoU蛋白与铜绿假单胞菌耐药是否相关存在分歧。吴爱武等研究认为[10],铜绿假单胞菌多重耐药菌株与非多重耐药菌株exoU携带率无显著性差异(10% vs 11.76%),多重耐药菌株exoU基因检出率明显低于exoS基因(10% vs 73.33 %),认为可能与检测标本量较少,且未检测基因表达产物有关。安浩君等[39]对感染性心内膜炎患者血标本检测结果显示,多重耐药菌株中exoU基因与exoS基因检出率相比无显著差异(42.67% vs 49.33%)。然而,董晨晓等[40]对43株临床分离铜绿假单胞菌的研究结果与上述观点相反,结果显示exoU阳性菌株对临床常用抗菌药物耐药率明显高于exoS阳性菌株,认为携带exoU的菌株有更高的耐药性。不同研究结果的差异可能与不同地区、不同感染来源的菌株有关,但T3SS效应基因及效应蛋白与耐药及多重耐药的关联应进一步加以深入研究实,以期为多重耐药菌株感染的控制提供策略。
综上所述,目前尽管已对铜绿假单胞菌T3SS的毒性蛋白ExoU和其编码基因exoU的认识和研究取得了很大进展,但许多确切机制仍有待于进一步阐明,如控制ExoU分泌的调控网络、是否还有未知的激活ExoU发挥毒性效应的共刺激因子、共刺激因子与宿主细胞膜结合靶位如何协同增强毒性作用,以及针对ExoU蛋白分泌、活化的抑制剂筛选问题等,是今后需要不断努力的方向。
[1]Folkesson A, Jelsbak L, Yang L, et al. Adaptation ofPseudomonasaeruginosato the cystic fibrosis airway: an evolutionary perspective[J]. Nat Rev Microbiol, 2012, 10(12): 841-851.
[2]Engel J, Balachandran P. Role ofPseudomonasaeruginosatype III effectors in disease[J]. Curr Opin Microbiol, 2009, 12(1): 61-66.
[3]Hauser AR. The type III secretion system ofPseudomonasaeruginosa: infection by injection[J]. Nat Rev Microbiol, 2009, 7(9): 654-665.
[4]Howell HK, Logan LK, Hausera AR. Type III secretion of ExoU is critical during earlyPseudomonasaeruginosapneumonia[J]. MBio, 2013, 4(2): e00032
[5]Schulert GS, Feltman H, Rabin SDP, et al. Secretion of the toxin ExoU is a marker for highly virulentPseudomonasaeruginosaisolates obtained from patients with hospital-acquired pneumonia[J]. J Infect Dis, 2003, 188(11): 1695-1706.
[6]Kulasekara BR, Kulasekara HD, Wolfgang MC, et al. Acquisition and evolution of theexoUlocus inPseudomonasaeruginosa[J]. J Bacteriol, 2006, 188(11): 4037-4050.
[7]Andersson DJ. The biological cost of mutational antibiotic resisitance: any practical conclusion?[J]. Curr Opin Microbiol, 2006, 9(5): 461-465.
[8]Lin HH, Huang SP, Teng HC, et al. Presence of theexoUgene ofPseudomonasaeruginosais correlated with cytotoxicity in MDCK cells but not with colonizationin BALB/c mice△[J]. J Clin Microboil, 2006, 44(12): 4596-4597.
[9]Lei CB, Chao Y, Sun XH, et al. Detection of virulence genes inPseudomonasaeruginosaand its clinical significance[J]. Clin J Clin Lab Sci, 2011, 29(4): 301-303. (in Chinese) 类承斌,晁艳,孙相红,等.铜绿假单胞菌毒力基因检测及临床意义[J].临床检验杂志,2011,29(4):301-303.
[10]Wu AW, Huang JR. Detection and analysis of gene exoS and exoU inPseudomonasaeruginosa[J]. Chin J Health Lab Tech, 2013, 23(1): 129-132. (in Chinese) 吴爱武,黄孑然.铜绿假单胞菌exoS、exoU基因的检测与分析[J].中国卫生检验杂志,2013,23(1):129-132.
[11]Cho HH, Kwon KC, Kim S, et al. Correlation between virulence genotype and fluoroquinolone resistance in carbapenem-resistantPseudomonasaeruginosa[J]. Ann Lab Med, 2014, 34(4): 286-292.
[12]Ferreira ML, Dantas RC, Faria AL, et al. Molecular epidemiological survey in quinolone and carbapenem-resistant genotype and its association with type III secretion system inPseudomonasaeruginosa[J]. J Med Microbiol, 2015, 64(Pt3): 262-271.
[13]Galle M, Carpentier I, Beyaert R. Structure and function of the type III secretion system ofPseudomonasaeruginosa[J]. Curr Protein Peptide Scie, 2012, 13(8): 831-842.
[14]Gendrin C, Contreras-Martel C, Bouillot S, et al. Structural basis of cytotoxicity mediated by the type III secretion toxin ExoU fromPseudomonasaeruginosa[J]. PLoS Pathog, 2012, 8(4): e1002637.
[15]Halavaty AS, Borek D, Tyson GH, et al. Structure of the type III secretion effecter protein ExoU in complex with its chaperone SpcU[J]. PLoS One, 2012, 7(11): e49388.
[16]Dessen A, Tang J, Schmidt H, et al. Crystal structure of human cytosolic phospholipase A2 reveals a novel topology and catalytic mechanism[J]. Cell, 1999, 97(3): 349-360.
[17]Rydel TJ, Williams JM, Krieger E, et al. The crystal structure, mutagenesis, and activity studies reveal that patatin is a lipid acyl hydrolase with a Ser-Asp catalytic dyad[J]. Biochemistry, 2003, 42(22): 6696-6708.
[18]Benson MA, Komas SM, Schmalzer KM, et al. Induced conformational changes in the activation of thePseudomonasaeruginosatype III toxin, ExoU[J]. Biophys J, 2011, 100(5): 1335-1343.
[19]Rabin SD, Veesenmeyer JL, Bieging KT, et al. A C-terminal domain targets thePseudomonasaeruginosacytotoxin ExoU to the plasmamembrane of host cells[J]. Infect Immun, 2006, 74(5): 2552-2561.
[20]Stirling FR, Cuzick A, Kelly SM, et al. Eukaryotic localization, activation and ubiquitinylation of a bacterial type III secreted toxin[J]. Cell Microbiol, 2006, 8(8): 1294-1309.
[21]Tyson GH, Hauser AR. Phosphatidylinositol 4,5-bisphosphate is a novel coactivator of thePseudomonasaeruginosacytotoxin ExoU[J]. Infect Immun, 2013, 81(8): 2873-2881.
[22]Sato H, Frank DW. Intoxication of host cells by the T3SS phospholipase ExoU: PI(4,5)P2-associated, cytoskeletal collapse and late phase membrane blebbing[J]. PLoS One, 2014, 9(7): e103027.
[23]El Solh AA, Akinnusi ME, Wiener-Kronish JP, et al. Persistent infection withPseudomonasaeruginosain ventilator-associated pneumonia[J]. Am J Respir Crit Care Med, 2008, 178(5): 513-519.
[24]Cuzick A, Stirling FR, Lindsay SL, et al. The type III pseudomonal exotoxin U activates the c-Jun NH2-terminal kinase pathway and increases human epithelial interleukin-8 production[J]. Infect Immun, 2006, 74(7): 4104-4113.
[25]de Lima CD, Calegari-Silva TC, Pereira RM, et al. ExoU Activates NF-kB and Increases IL-8/KC Secretion duringPseudomonasaeruginosaInfection[J]. PLoS One, 2012, 7(7): e41772.
[26]Sato H, Feix JB, Frank DW, et al. Identification of superoxide dismutase as a cofactor for thePseudomonastype III toxin, ExoU[J]. Biochemistry, 2006, 45(34): 10368-10375.
[27]Anderson DM, Schmalzer KM, Sato H, et al. Ubiquitin and ubiquitin-modified proteins activate thePseudomonasaeruginosaT3SS cytotoxin, ExoU[J]. Mol Microbiol, 2011, 82(6): 1454-1467.
[28]Schmalzer KM, Benson MC, Frank DW. Activation of ExoU phospholipase activity requires specific C-terminal regions△[J]. J Bacteriol, 2010, 192(7): 1801-1812.
[29]Zhou XJ, Xu GL, Ying YH. Investigation of resistance genes and virulence factors in drug-resistantPseudomonasaeruginosaisolated from burn department[J]. Clin J Nosocomiol, 2014, 24(7): 1580-1582. (in Chinese) 周晓娟,徐根隆,应华永.烧伤科耐药铜绿假单胞菌耐药性与毒力基因研究[J].中华医院感染学杂志,2014,24(7):1580-1582.
[30]Zhang J, Chu Y, Wang P, et al. Clinical outcomes of multidrug resistantPseudomonasaeruginosainfection and the relationship with type III secretion system in patients with diabetic foot[J]. Int J Low Extrem Wounds, 2014, 13(3): 205-210.
[31]Idris SN, Desa MN, Aziz MN, et al. Antimicrobial susceptibility pattern and distribution of exoU and exoS in clinical isolates ofPseudomonasaeruginosaat a Malaysian hospital[J]. Southeast Asian J Trop Med Public Health, 2012, 43(1): 116-123.
[32]Garey KW, Vo QP, Larocco MT, et al. Prevalence of type III secretion system protein exoenzymes and antimicrobial susceptibility patterns from bloodstream isolates of patients withPseudomonasaeruginosa[J]. J Chemother, 2008, 20(6): 714-720.
[33]Chen DY, Liu Y, Xu PP, et al. Apoptosis of vascular endothelial cells induced byP.aeruginosaand its L-forms[J]. Chin J Zoonoses, 2011, 27(1): 37-40. (in Chinese) 陈登宇,刘 勇,徐萍萍,等.铜绿假单胞菌及其L型诱导血管内皮细胞凋亡的实验研究[J].中国人兽共患病学报,2011,27(1):37-40.
[34]Lee JY, Ko KS. OprD mutations and inactivation, expression of efflux pumps and AmpC, and metallo-β-lactamases in carbapenem-resistant Pseudomonas aeruginosa isolates from South Korea[J]. Int J Antimicrob Agents, 2012, 40(2): 168-172.
[35]Agnello M, Wong-Beringer A. Differentiation in quinolone resistance by virulence genotype inPseudomonasaeruginosa[J]. PLoS One, 2012, 7(8): e42973.
[36]Maatallah M, Cheriaa J, Backhrouf A, et al. Population structure ofPseudomonasaeruginosafrom five mediterranean countries: evidence for frequent recombination and epidemic occurrence of CC235[J]. PLoS One, 2011, 6(10): e25617.
[37]Borkar DS, Acharya NR, Leong C, et al. Cytotoxic clinical isolates ofPseudomonasaeruginosaidentified during the Steroids for Corneal Ulcers Trial show elevated resistance to fluoroquinolones[J]. BMC Ophthalmol, 2014, 54(14): 1-6.
[38]Cirz RT, O’Neill BM, Hammond JA, et al. Defining the Pseudomonas aeruginosa SOS response and its role in the global response to the antibiotic ciprofloxacin[J]. J Bacteriol,2006, 188(20): 7101-7110.
[39]An HJ, Chen HG, Li X, et al. Study of gens responsible for the drug resisitance ofPseudomonasaeruginosain patients with infective endocarditis[J]. J Pathog Biol, 2014, 9(12): 1071-1074. (in Chinese) 安浩君,陈慧刚,李霞,等.感染性心内膜炎患者分离株铜绿假单胞菌耐药基因研究[J].中国病原生物学杂志,2014,9(12):1071-1074.
[40]Dong CX, Song SD, Wang Y, et al. Carrying ofexoSandexoUin 43 clinical isolates ofPseudomonasaeruginosaand their drug resistance[J]. Clin Infect Ctrl, 2010, 9(2): 93-96. (in Chinese) 董晨晓,宋诗铎,王悦,等.43株临床铜绿假单胞菌exoS、exoU基因携带及其耐药性[J].中国感染控制杂志,2012,9(2):93-96.
Research progress of toxic protein ExoU inPseudomonasaeruginosa
JU Xiao-hong1,LI Zheng-hua2,MA Ai-xin1,LI Yao1
(1.DepartmentofPathogen,JilinMedicalCollege,Jilin132013,China;2.DepartmentofClinicalLaboratory,theHospitalofChemicalIndustrialCompanyinJilin,Jilin132022,China)
Pseudomonasaeruginosais an important conditioned pathogen with the multitude of virulence factors. Among them, the type Ⅲ secretion system (T3SS) which is the most important pathogenic factors plays a crucial role in the acute infection ofPseudomonasaeruginosa. This system exert cytotoxicity through targeted delivery of protein effector (ExoS, ExoT, ExoU and ExoY) into host cell. In particular, ExoU is a potent cytotoxin closely related to disease development, outcomes and therapy. In this paper, we briefly review research progress on the toxic protein ExoU for recent years, aiming at serving as a guide for infection control and treat ofPseudomonasaeruginosa.
Pseudomonasaeruginosa; type Ⅲ secretion system (T3SS); EoxU; multiple drug resistance; toxic gene
1.吉林医药学院病原学教研室,吉林 132013; 2.吉林化工医院检验科,吉林 132001; Email:Lijin838@126.com
10.3969/j.issn.1002-2694.2015.11.018
R378.99
A
1002-2694(2015)11-1069-06
2015-04-17;
2015-08-21
