化学遗传学简介
2015-02-13高磊雷晓光1
高磊雷晓光1,*
(1北京大学化学与分子工程学院化学生物学系 北京100871;2北京协和医学院研究生院 北京100730;3北京生命科学研究所 北京102206)
随着人类基因组计划的完成,人类已经进入了后基因组时代。如何确定每个基因所对应蛋白的功能成为遗传学家所面临的难题。传统的遗传学研究方法主要是利用各种基因突变来改变所研究生物体的遗传基因,从而获得可稳定遗传的变异体,并利用变异体来确定基因或者蛋白的功能。虽然我们利用模式生物,通过传统的遗传学研究方法,已经确定了许多基因的功能,但这种方法也存在着许多不足[1-2]:①许多基因具有遗传冗余性,突变其中之一并不会出现遗传性状的改变;②某些基因对于生物体来讲非常重要,突变了该基因使得生物体无法存活;③对于繁殖速率慢,个体较大,基因组是多倍体的哺乳动物来说,得到稳定遗传的突变体是很困难的;④对于复杂系统来讲,某些蛋白的功能可以通过其他方式来调控(例如磷酸化、去磷酸化),并不能通过简单的减少其表达来确定其功能[3]。生物活性小分子能够与特定蛋白质相互作用,并可以条件性地改变靶标蛋白的功能和活性,所以克服了基因冗余和基因致死等难题,这种新的遗传学研究的方法被称为化学遗传学(chemical genetics)[4]。由于生物活性小分子可以随时加入或移除,这使得化学遗传学除了克服基因冗余和基因致死等难题外,还有与生俱来的优势——时空可控性。正因为化学遗传学的这些优势,使得它在现代药物靶点的发现上扮演着越来越重要的角色[3]。
1 化学遗传学的发展历史
化学遗传学是建立在两个前提之上的:①生物活性小分子能够获得;②这些小分子能够与生物体内的靶标蛋白(或称为受体)结合[1]。化学遗传学概念的雏形最早可以追溯到几百年甚至几千年前,那时人们已经开始使用天然产物来治疗一些病症。例如,早在公元前15世纪,古埃及人就利用柳树皮的提取物来治疗头疼、发烧或者炎症。但在当时,人们并不清楚在柳树皮提取物中的有效化学成分是什么,更不清楚它的作用机制。在18世纪,许多研究者开始意识到,在植物提取液中,可能是某一种单一的成分作用于动物的某个部位。1804年,第一个生物活性小分子——吗啡被Friedrich Sertürner从罂粟中分离出来,证实了人们的猜想。在1826年前后,柳树皮中治疗头痛的有效成分——水杨酸(著名的阿司匹林就是水杨酸的衍生物)也被分离出来。这些具有生物活性的天然产物的分离不仅推动了近现代制药工业的发展,更重要的是奠定了化学遗传学发展的基础,使人们认识到,单一化合物就可以具有生物学活性。
虽然当时人们已经认识到,在柳树皮提取液中,是水杨酸发挥着药效,但并不清楚它的作用机制。在19世纪早期,Francois Magendie和Claude Bernard提出,这些生物活性小分子可能作用于身体的某些部位;随后Rudolf Buchheim认识到,药物的生物学活性可能是由于药物分子与细胞内组分发生了生物化学反应而引起的;直到20世纪初,Paul Ehrlich才提出了受体的概念,他把受体定义为“小分子唯一的特定蛋白靶标”。对于化学遗传学来说,受体的提出是一个重大的突破,它使人们开始重视和利用生物活性小分子与蛋白的相互作用,这使化学遗传学研究方法逐步走向成熟。
化学遗传学的发展是建立在有机合成特别是天然产物全合成的基础之上的。随着天然产物分离和有机合成技术的日趋成熟,越来越多的生物活性小分子被合成出来(例如雷帕霉素、紫杉醇等)。这些化合物往往表现出良好的生物学活性,吸引着科学家去找寻它们的受体。作为化学遗传学的奠基人之一,哈佛大学的Stuart Schreiber教授无疑是其中的佼佼者。从他1981年独立工作以来,他与合作者合成了许多具有非常重要生物活性的天然产物,包括FK506、lactacystin、trapoxin等。通过化学遗传学的研究方法,1988年,Stuart Schreiber发现了FK506受体蛋白——FKBP12,阐明了免疫抑制剂FK506是通过构成FKBP12-FK506-钙调磷酸酶三元复合体来抑制钙调磷酸酶的活性[5];1995年,他使用氚标记的方法,发现lactacystin可以特异性地与20S蛋白酶体结合[6];1997年,他利用从微生物中分离出来的一种环五肽类天然产物——trapoxin,找到了一种全新功能的蛋白——组蛋白去乙酰化酶(HDAC)[7]。组蛋白去乙酰化酶的发现不仅给抗癌药物的研发带来了新的思路,更对表观遗传学的发展有着深刻的影响。1997年,他因在化学合成方面的贡献和对生物学及医学的间接影响而获得了四面体有机化学创新奖(Tetrahedron Prize for Creativity in Organic Chemistry)。在随后的1998年,他发表了名为《Chemical Genetics Resulting from a Passion for Synthetic Organic Chemistry》的综述,介绍了把这种利用有机小分子配体来研究蛋白功能的方法定义为化学遗传学(chemical genetics)的理由和自己是如何走上化学遗传学这条道路[8]。从此,化学遗传学的概念越来越受到人们的关注和认同。
2 传统遗传学和化学遗传学
在研究某一生物学系统的功能时,常用的方法就是通过打破该系统的平衡来观察和分析该系统被扰动后的功能变化。而打破生物学系统平衡的最传统的方式就是基因突变,这种遗传学研究方法被称为经典遗传学(classic genetics)。经典遗传学根据研究过程的不同可以分为两类[9](图1A):①如果我们对一个已知基因的功能感兴趣,我们可以对其进行突变,然后观察突变之后的表型变化,这样就能知道该基因的功能,这种由基因到表型的研究方法被称为反向遗传学(reverse genetics);②对细胞进行随机突变,得到大量的突变体,在这些突变体中找到感兴趣的表型,最后再找到对应的基因,这种由表型到基因的方法叫做正向遗传学(forward genetics)。打破生物学系统平衡的另一种方式是利用生物活性小分子与其受体的相互作用来引起某个生物学系统改变的方式,而这种方法就是化学遗传学。与经典遗传学类似,化学遗传学也可以分为正向化学遗传学(forward chemical genetics)和反向化学遗传学(reverse chemical genetics),如图1B所示[9]。一般来讲,正向化学遗传学研究过程遵循着以下步骤:①利用高通量筛选技术(HTS)对已有的化合物库进行大规模筛选(目的与正向遗传学中的随机突变类似);②找到能引起感兴趣表型的生物活性小分子;③利用这个分子来找到靶标蛋白。如果我们对某个已知的蛋白的功能比较感兴趣,就可以利用反向遗传学的方法来研究其功能:①利用HTS技术对已有的化合物库进行筛选,找到能与该蛋白特异性结合的小分子;②将该小分子加入到生物体中进行共培养,观察生物体表型和功能的变化;③将蛋白和表型或功能变化直接关联起来,就能知道该蛋白的生物学功能。
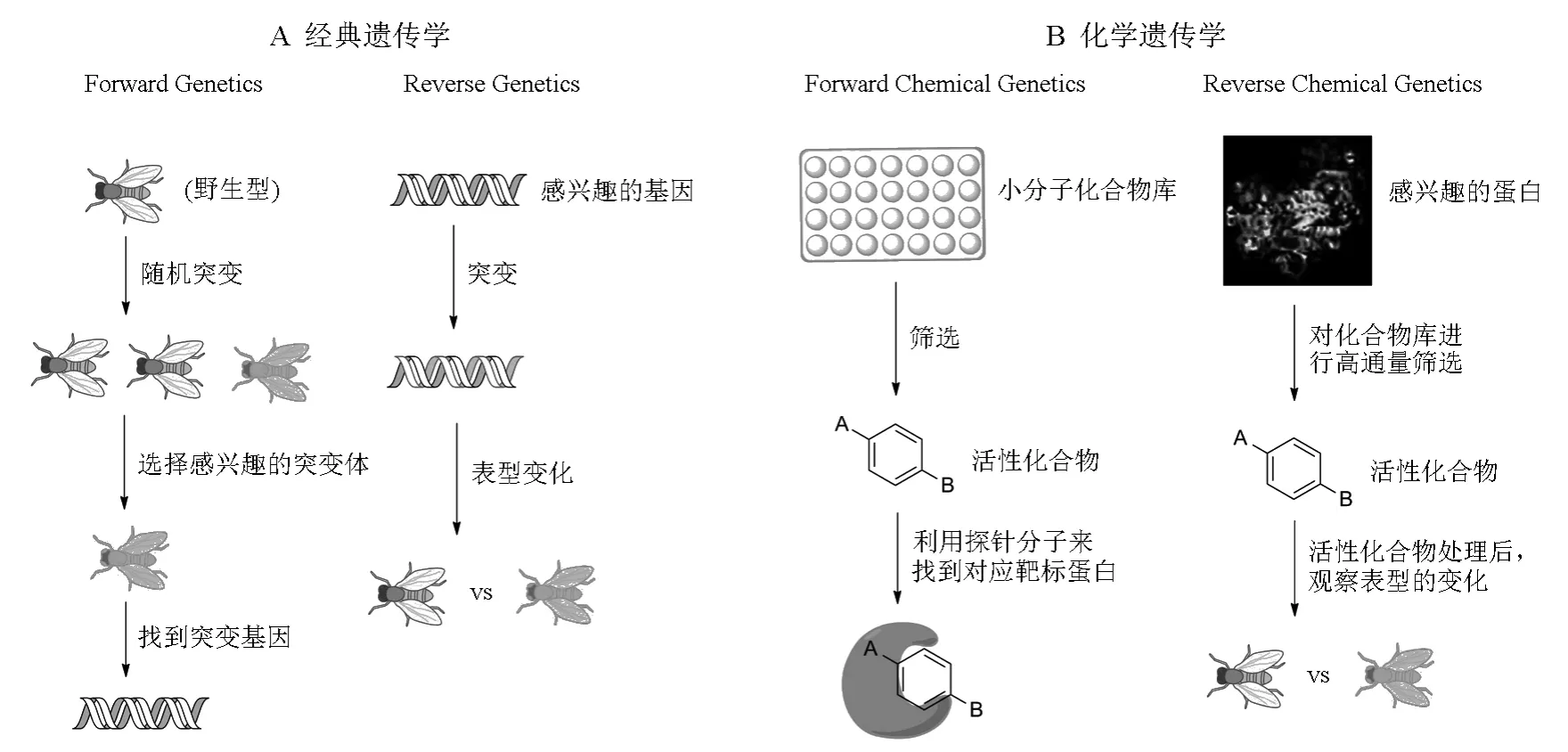
图1 经典遗传学和化学遗传学的实验流程
从化学遗传学研究方法的实验流程可以看出,快速筛选技术(例如高通量筛选技术)的发展对于化学遗传学的进步有着深刻的影响,它使我们能够简单高效地对某个表型或者实验现象进行成百上千次的筛选。其次,化学遗传学的发展也离不开能快速合成结构多样、数目庞大的化合物库的技术,例如组合化学(combinatorial synthesis)、固相合成化学(solid phase synthesis)和多样性导向合成(diversity oriented synthesis)。这些技术使快速合成结构多样的小分子有机化合物成为现实;而后商业用小分子化合物库的出现,极大地促进了化学遗传学方法的普及。再次,对于正向化学遗传学来说,利用小分子探针从复杂的生物体系中找到其特异性靶标蛋白的技术,例如蛋白质亲和层析技术,也是一个不可缺少的工具;而对于反向化学遗传学来说,蛋白质的表达和纯化技术是重中之重。此外,其他技术[10-11]也对化学遗传学的发展起着推动作用。例如,蛋白质结晶学帮助了生物学家了解蛋白的结构和功能,而在此基础上,化学家利用计算机模拟技术就能更准确地设计和合成该蛋白的小分子配体,极大地推动了反向遗传学研究方法的应用。
3 化学遗传学在药物靶标发现上的应用
3.1 发现全新的生物靶点和生物作用机制
在真核细胞内,遗传信息——基因存在于染色体上,而染色体主要是由组蛋白包裹着DNA折叠而成。组蛋白末端在一般情况下由于赖氨酸和精氨酸的存在而带正电荷,正电荷会帮助组蛋白包裹带负电的DNA。一旦赖氨酸或者精氨酸的氨基被乙酰化,那么组蛋白的正电荷消失,使得染色小体的结构变得松散,转录因子能够与启动子结合而促进某些基因的转录和翻译。组蛋白去乙酰化酶(histone deacetylase)的作用就是脱去组蛋白近氨基端赖氨酸上的乙酰基团,使得组蛋白带正电,这样组蛋白就能够与DNA更紧密结合,从而阻止了该区域基因的转录和翻译。在早期研究中,曲古抑菌素和一种来源于微生物的环五肽类天然产物——trapoxin被证明可以抑制组蛋白去乙酰化的过程,但具体的机制并不是很清楚。1996年,Stuart Schreiber等人通过研究结构和活性关系(SAR),发现亲电基团环氧酮对于抑制组蛋白去乙酰化是必不可少的活性基团。随后,他们利用全合成的技术,合成了氚取代的trapoxin和探针分子(图2),利用蛋白质亲和标记及亲和层析的方法找到了一个全新功能的蛋白——组蛋白去乙酰化酶[7]。至此,有机小分子trapoxin抑制组蛋白去乙酰化过程的机制不再是个谜:trapoxin和N-乙酰基赖氨酸几乎是电子等排的,所以trapoxin可以作为一个竞争性的底物与组蛋白去乙酰化酶结合,结合之后,亲电基团环氧酮能够与组蛋白去乙酰化酶活性位点上富含电子的氮原子反应,这样使得组蛋白去乙酰化酶不可逆地失去活性。利用正向化学遗传学的方法,Stuart Schreiber等人不仅发现表观遗传学里最重要的蛋白之一——组蛋白去乙酰化酶,还为癌症治疗带了新的思路。例如,2006年,美国食品药品监督管理局(FDA)批准了用于治疗皮肤T细胞淋巴瘤(CTCL)的组蛋白去乙酰化酶抑制剂药物——伏立诺他(vorinostat)。
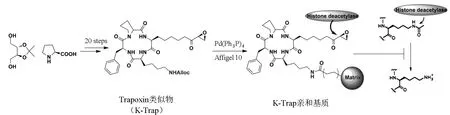
图2 trapoxin探针合成及其作用机理研究
3.2 发现已知生物靶点的新的调控机制或生物学功能
2009年起,本实验室系统地研究了具有复杂结构的倍半萜内酯类天然产物的全合成。以相同的倍半萜内酯单体(dehydrozaluzanin C)作为合成前体,利用集成全合成策略,我们实现了对结构更加复杂的二倍体(ainsliadimers A and B)[12]和三倍体(ainsliatrimers A and B)[13]的仿生合成。在随后的生物学活性研究上,我们发现ainsliatrimers A能通过诱导凋亡的方式杀死癌细胞,但这类天然产物的作用机理并不清楚。利用多样化合成和生物正交反应的策略,我们实现了ainsliatrimers A在HeLa细胞内的荧光定位,发现其靶蛋白位于细胞核内(图3)。
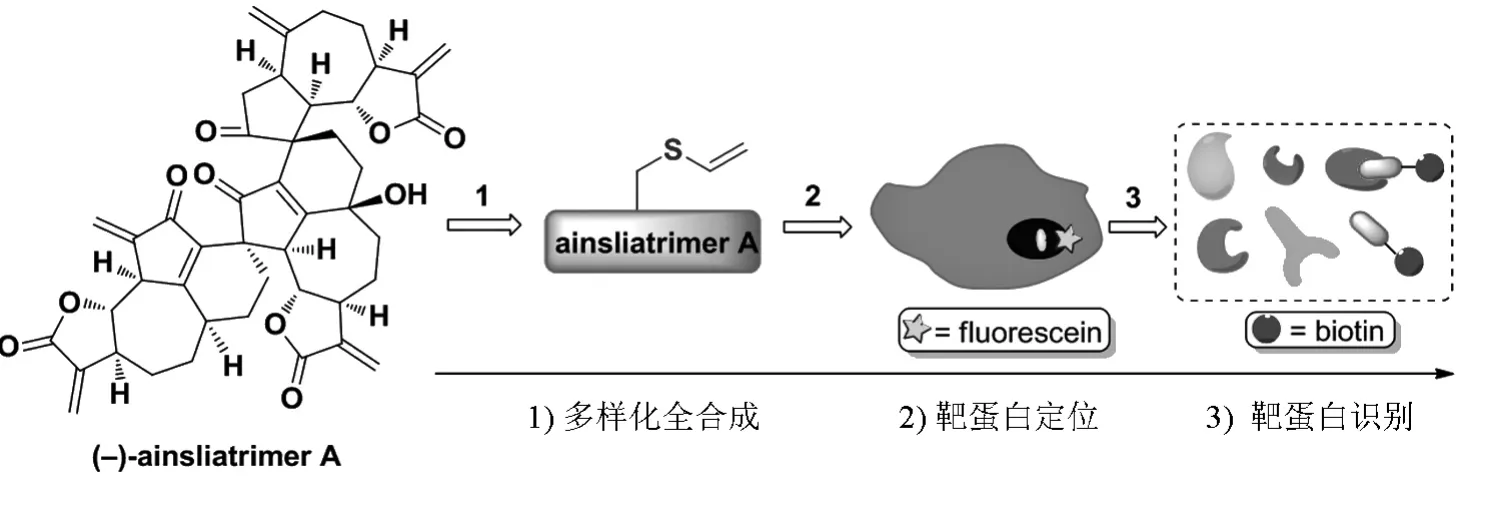
图3 利用天然产物ainsliatrimers A的分子探针来探寻细胞内蛋白靶标的过程
接下来,我们将基于ainsliatrimers A的小分子探针与HeLa细胞核提取物进行共孵育,利用“pull-down”和肽质量指纹图谱分析(peptide mass fingerprinting analysis),我们找到了两个最可能的核蛋白——过氧化物酶体增殖物活化受体γ(PPARγ)和组蛋白去乙酰化酶2(HDAC2)。为了进一步确定ainsliatrimers A的靶标蛋白,我们利用RNA干扰技术分别对这两个蛋白进行Knockdown实验。实验结果显示,降低PPARγ的表达能够明显减弱ainsliatrimers A的细胞毒性;而降低HDAC2的表达并不能提高ainsliatrimers A处理下的HeLa细胞存活率。这些结果显示,ainsliatrimers A的靶标蛋白是PPARγ而不是HDAC2[14]。
本实验室除了利用天然产物作为生物活性小分子来探索其蛋白靶标外,也通过高通量筛选来找到有生物活性的有机小分子,并利用这类小分子来进行化学遗传学相关研究。细胞坏死是细胞死亡的另一个途径,但相比于“凋亡”来说,其具体的细胞学机制并不清楚。2009年,王晓东课题组[15]及另两个课题组——Francis Ka-Ming Chan课题组[16]和韩家淮课题组[17]先后在《Cell》和《Science》上发表文章,阐明了受体相互作用蛋白3(RIP3)在受体相互作用蛋白1(RIP1)介导的细胞程序性坏死中起着重要作用,但RIP3下游的靶标蛋白却仍是个谜。2012年,本实验室与王晓东实验室合作,建立了细胞坏死小分子抑制剂的高通量筛选模型,从大约有20万个化合物的小分子库中筛选到一个先导化合物(IC50≈1μmol/L),随后对其进行结构优化,得到作用于RIP3下游通路的生物活性小分子——necrosulfonamide(NSA,IC50≤0.2μmol/L),并将其改造成为小分子探针。通过利用免疫沉淀和质谱分析,我们发现混合连接激酶结构域样蛋白(MLKL)可以与RIP3相互作用,随后利用小分子探针进行“pull-down”实验,找出的靶标蛋白正是MLKL,这说明MLKL很可能是RIP3下游的底物。我们通过研究结构和活性关系(SAR),发现在NSA中,α,β-不饱和酮结构对于该小分子与MLKL的N端片段相互作用是必不可少的。由此,我们推测,MLKL可能通过半胱氨酸上的巯基与不饱和酮形成不可逆的共价键,从而抑制了细胞坏死(图4)。通过比较人和小鼠的MLKL的N端片段,我们发现,在这一区域内,除了86位半胱氨酸外,人源MLKL的所有半胱氨酸都与小鼠相同,而该小分子仅仅能与人源MLKL结合而不能与鼠源MLKL结合,所以我们推测是86位的半胱氨酸与该分子形成了共价键。随后我们把86位半胱氨酸突变成丝氨酸,发现该小分子失去了抑制细胞坏死的活性且不能与人源MLKL结合,这进一步证实了该小分子是通过与86位半胱氨酸形成共价键来抑制细胞坏死的。为了进一步证实MLKL是RIP3的底物,我们在体外对RIP3和MLKL进行培养,随后对MLKL进行质谱分析,发现MLKL的357位的苏氨酸和358位的丝氨酸被RIP3磷酸化。这说明MLKL就是RIP3在细胞坏死信号通路中的底物,它对于细胞坏死非常重要[18]。
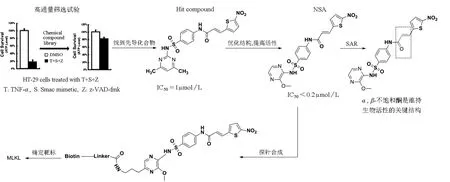
图4 利用正向化学遗传学的方法发现RIP3下游底物蛋白——MLKL
4 总结与展望
许多生物学知识都来源于经典遗传学,然而仅仅利用经典遗传学方法来探索生物学系统的功能是不够的。化学遗传学研究方法是利用可透过细胞膜的生物活性小分子来快速、可逆、条件性地干扰靶标蛋白的功能,从而实现对生物学系统功能的定量时空可控。化学遗传学作为经典遗传学方法的补充和延伸,很好地克服了经典遗传学研究方法所面临的困难,进一步推动了我们对生物学的了解和认知。目前来讲,化学遗传学研究还面临着一些挑战,例如:如何高效产生结构不同且复杂的生物活性小分子;如何克服生物活性小分子在生物系统中存在的多效性难题(off targets效应)等。但我们相信,随着有机合成技术的完善、蛋白结构信息的积累以及一些新技术的出现,化学遗传学研究方法将进一步推动生物学、医学等领域的发展,给人类社会带来巨大的进步。
[1]Stockwell B R.Nat Rev Genet,2000,1:116
[2]赵鹏,张礼和.大学化学,2004,19(2):1
[3]Cong F,Cheung A K,Huang S A.Annu Rev Pharmacol Toxicol,2012,52:57
[4]赵扬.植物生理学报,2011,47(1):1
[5]Harding M W,Galat A,Uehling D E,et al.Nature,1989,341:758
[6]Fenteany G,Standaert R F,Lane W S,et al.Science,1995,268(5211):726
[7]Taunton J,Hassig C A,Schreiber S L.Science,1996,272(5260):408
[8]Schreiber S L.Bioorgan Med Chem,1998,6(8):1127
[9]Walsh D P,Chang Y T.Chem Rev,2006,106(6):2476
[10]Smukste I,Stockwell B R.Annu Rev Genomics Hum Genet,2005,6:261
[11]Spring D R.Chem Soc Rev,2005,34:472
[12]Li C,Yu X L,Lei X G.Org Lett,2010,12(19):4284
[13]Li C,Dong T,Dian L Y,et al.Chem Sci,2013,4:1163
[14]Li C,Dong T,Li Q,et al.Angew ChemⅠnt Ed,2014,53(45):12111
[15]He S,Wang L,Miao L,et al.Cell,2009,137(6):1100
[16]Cho Y S,Challa S,Moquin D,et al.Cell,2009,137(6):1112
[17]Zhang D W,Shao J,Lin J,et al.Science,2009,325(5938):332
[18]Sun L,Wang H,Wang Z,et al.Cell,2012,148(1-2):213
