牛血清白蛋白与奎宁和奎尼丁的相互作用研究
2015-02-02轩春芝杨成成傅英姿
轩春芝,李 桢,马 骄,杨成成,傅英姿
(西南大学化学化工学院,重庆400715)
牛血清白蛋白与奎宁和奎尼丁的相互作用研究
轩春芝,李 桢,马 骄,杨成成,傅英姿*
(西南大学化学化工学院,重庆400715)
牛血清白蛋白(BSA)自组装在经电沉积纳米金修饰的玻碳电极表面,构建了简单的电化学手性传感界面,并讨论了该界面与不同浓度范围的抗疟疾手性药物奎宁和奎尼丁的相互作用。实验采用扫描电子显微镜(SEM)和循环伏安技术(CV)研究了手性界面的表面形貌和电化学行为,并用差分脉冲伏安法(DPV)和紫外-可见分光光度法(UV-Vis)测试了BSA与奎宁、奎尼丁之间的选择性作用。实验结果表明,当奎宁和奎尼丁浓度小于5.0×10-4mol/L时,手性界面与奎尼丁作用后获得较大的电流响应,而当奎宁和奎尼丁的浓度等于或大于5.0×10-4mol/L时,手性界面与奎宁作用后获得较大的电流响应;这是由于较大浓度时,奎宁和奎尼丁会破坏BSA的内部氢键、暴露疏水腔,使BSA以一种更疏松的状态存在,有利于电子传递。
选择性作用;奎宁;奎尼丁;牛血清白蛋白;电沉积纳米金
0 引言
手性是自然界的基本属性表达了化合物分子结构不对称的特征,广泛存在于生命科学、医学、药物科学和食品科学等领域中。特别是在手性药物中,由于药性与药物分子的空间立体结构密切相关,不同构型的对映体虽然具有相同的物理性质但在生物体内的代谢过程、药效及毒理性等存在较大的差异,多数情况下手性药物中仅其中一个对映体具有药理活性而另一个对映体没有活性甚至可能具有相反的药理作用[1-3]。例如,R-巴比士衍生物在临床上具有麻醉剂的效果,而S-异构体不仅没有疗效,还会使人痉挛,给人体的健康带来副作用以及危害。奎宁和奎尼丁由平面喹啉和一个刚性奎尼丁环与一个二级甲醇桥组成如图1所示,是重要的金鸡纳碱均可以用于
治疗疟疾,但是奎尼丁的抗疟活性是奎宁的4倍多[4]。目前,奎宁常被用于治疗夜间抽搐和关节炎,而奎尼丁则用于治疗先天性肌无力。因此,发展简单、可靠、快速、低成本的识别奎宁和奎尼丁的方法具有重要意义。目前,主要的手性识别方法有光谱法、毛细管电泳法、高效液相色谱法和核磁共振法,但这些方法操作复杂、成本高而且样品需要复杂的前处理[5-7],电化学方法因其具有操作简便、成本低、样品无需前处理等优点已成为广大研究者关注的热点[8-9]。

图1 奎宁和奎尼丁的结构Fig.1 Structures of quinine(QN)and quinidine(QD)
血清白蛋白是生物体循环系统中最丰富的蛋白质是维持血液渗透压的主要大分子[10],在药物运输与药效等方面发挥着重要作用[11]。血清白蛋白可以作为载体与药物及一些具有生物活性的小分子发生可逆性结合,从而增加疏水性药物的溶解性以调节它们在体内或体外的运输[12],因此,血清白蛋白具有重要的医用价值。牛血清白蛋白(BSA)由于其易得,易溶,成本低等优点使其得到了极大的关注及应用。BSA是由583个氨基酸残基组成的多肽链,其中35个半胱氨酸组成17个二硫键,在肽链的34位有一个自由的巯基,其二级结构为高度的ɑ-螺旋结构,是一种天然的手性选择剂,已成功地用于电化学手性传感器中。然而,由于蛋白质对氧化还原活性位点具有屏蔽作用,会阻碍电子传递而制约BSA的应用范围[13-16]。因此,增加BSA与电极之间的电子传递速率是构建电化学传感器的关键。该文经电沉积获得具有高比表面、优良电子传导能力的纳米金(AuNPs),不仅操作简单,而且纳米金良好的生物相容性为蛋白质提供了适宜的微环境,既增加了蛋白质的固载量又能保持其生物活性[17-19]。而后BSA通过巯基与纳米金形成Au-S键自组装在纳米金表面形成手性表面并用于后续实验的进一步分析。
1 实验部分
1.1 试剂和仪器
硫酸奎宁(98%)、硫酸奎尼丁(98%)和氯金酸(HAuCl4·4H2O,99.99%)均购于阿拉丁试剂公司(中国上海),牛血清白蛋白(BSA,98%)购于百灵威试剂公司(中国北京)。工作缓冲溶液为0.1 mol/L磷酸缓冲溶液 (PBS,pH7.4)制备的5.0×10-3mol/L[Fe(CN)6]4-/3-溶液。其余化学试剂均为分析纯,无需进一步纯化即可直接使用,所有实验用水均为二次蒸馏水。
所有电化学测试均在CHI 440A电化学工作站(中国,上海辰华)上进行。标准三电极体系中,以饱和甘汞电极为参比电极,铂丝电极为对电极,玻碳电极或修饰电极为工作电极。扫描电子显微图像由S-4800扫描电子显微镜(SEM,日本日立)得到,紫外-可见吸收光谱由UV-2450紫外-可见分光光度仪(UV-Vis,日本岛津)得到。
1.2 手性生物传感界面制备
裸玻碳电极(GCE,Φ=4mm)分别用1.0、0.3和0.05 μm的Al2O3抛光粉打磨抛光,依次在乙醇和二次蒸馏水中超声清洗,自然晾干。随后,将玻碳电极置于1%的HAuCl4溶液中,在-0.2 V施加恒电位沉积30 s,取出并用蒸馏水冲洗干净。然后,在该修饰电极表面滴加10 μL,1.0 mg/mL的BSA溶液,将该修饰电极置于4℃下保存过夜。电极构建示意图如图2所示。
2 结果与讨论
2.1 界面的SEM检测
图3给出了AuNPs和BSA自组装在AuNPs(BSA/AuNPs)上的表面形貌。AuNPs为密集的待开花粒状纳米颗粒(图a)。BSA自组装在AuNPs上之后,AuNPs的边缘出现不规则的突起且粒径增大(图b)。
2.2 修饰界面的电化学特性
实验采用循环伏安技术(CV)研究了电极修饰过程中电极表面的电化学特性。电化学测试在5.0×10-3mol/L的[Fe(CN)6]4-/3-(pH7.4)溶液中进行,扫速为0.1 V/s。如图4所示,裸GCE呈现一
对可逆的氧化还原峰(曲线a),经AuNPs修饰后(AuNPs/GCE)峰电流增加(曲线b),源于AuNPs增大了电子传递速率;BSA自组装在AuNPs上后,峰电流响应明显降低(曲线c)。
2.3 手性传感界面对奎宁奎尼丁的选择性作用
紫外-可见光谱特性:紫外-可见吸收光谱是研究化学反应活性、结构变化和生物体系的重要方法和手段[20]。该文研究了不同浓度的奎宁、奎尼丁对手性选择剂BSA结构的影响,实验结果如图5所示,BSA(1.0 mg/mL)的紫外-可见光谱(曲线a)显示,由于n→π*的跃迁,BSA在280 nm处出现最大吸收峰[21];向BSA溶液中分别加入较小浓度的奎宁 (图5 A)和奎尼丁 (图5 B)后(1.0×10-5mol/L曲线b,1.0×10-4mol/L曲线 c),BSA的紫外-可见吸收强度在280 nm有少许的降低但并没有消失,说明BSA分子结构没有发生变化;然而,当奎宁、奎尼丁的浓度增大到5.0×10-3mol/L时(曲线d),BSA在280 nm的吸收峰消失,迁移到300~400 nm处,说明BSA分子结构发生了扩展导致疏水腔的减少使得BSA采用一种更疏松的状态存在[22]。

图2 传感界面构建过程图和不同浓度的奎宁、奎尼丁的差分脉冲伏安响应:(A)1.0×10-4mol/L QN/QD,(B)5.0×10-3mol/L QN/QD(a)BSA/AuNPs/GCE,(b)QD/BSA/AuNPs/GCE,(c)QN/ BSA/AuNPs/GCEFig.2 Stepwise assembly of the sensing platform and DPVs for different concentration of QN and QD:(A)0.1 mmol/L QN/QD(B)5 mmol/L QN/QD,(a)BSA/AuNPs/ GCE;(b)QD/BSA/AuNPs/GCE;(c)QN/BSA/AuNPs/GCE

图3 (a)AuNPs和(b)BSA/AuNPs的SEM表征Fig.3 SEM images:(a)AuNPs,(b)BSA/AuNPs
差分脉冲伏安(DPV)响应:采用DPV技术研究了最佳条件下不同浓度的奎宁、奎尼丁在手性传感界面(BSA/AuNPs/GCE)上的电化学行为。如图6A所示,当BSA/AuNPs/GCE与1.0×10-4mol/L的奎宁、奎尼丁作用后,电流响应信号下降,且奎尼丁(曲线b)的电流下降量大于奎宁(曲线c),两者峰电流变化差(ΔI=ΔIQN-ΔIQD)为5.58 μA;当BSA/AuNPs/GCE与5.0×10-3mol/L的奎宁、奎尼丁作用后,电流响应信号增大,且奎宁(曲线c)的电流增加量大于奎尼丁(曲线b),两者峰电流变化之差为16.23 μA(图6 B)。
产生这种有趣的现象的原因可能是:当BSA/ AuNPs/GCE与较低浓度 (小于5.0×10-4mol/L)奎宁、奎尼丁作用时,因BSA阻碍电子传递,导致电
流响应信号降低,且奎尼丁降低更多,奎尼丁的作用较强;而当BSA/AuNPs/GCE与较高浓度(等于或大于5.0×10-4mol/L)奎宁、奎尼丁作用时,由于高浓度的奎宁、奎尼丁会破坏BSA的内部氢键、暴露疏水腔,使BSA以一种更疏松的状态存在,有利于电子传递[23],所以,不仅电流响应信号增强而且作用强弱也发生了反转,奎宁的电流增强更多。该结果与紫外-可见分光光谱所得结果一致。2.4 实验条件的优化
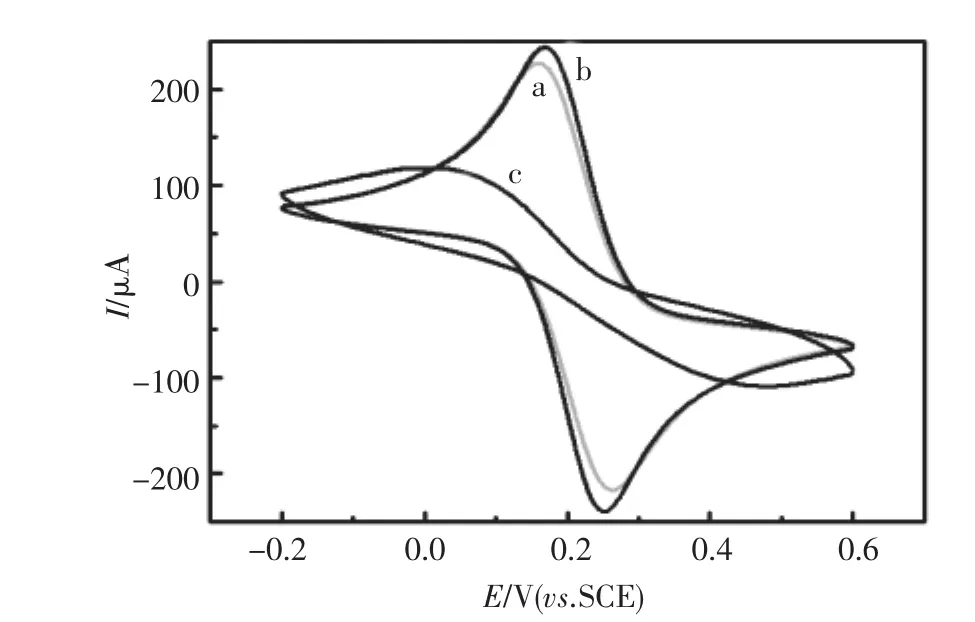
图4 不同界面的CV响应:(a)裸GCE,(b)AuNPs/ GCE,(c)BSA/AuNPs/GCEFig.4 CVs of different interfaces:(a)bare GCE,(b) AuNPs/GCE,(c)BSA/AuNPs/GCE

图5 紫外-可见光谱:(A)QN/BSA,(B)QD/BSA(a-d):0,1.0×10-5,1.0×10-4,5.0×10-4mol/L奎宁、奎尼丁与1.0 mg/mL BSA作用Fig.5 UV-Vis spectra of(A)QN/BSA,(B)QD/BSA system(a-d):0,0.01,0.1,0.5 mmol/L QN/QD with 1.0 mg/mL BSA
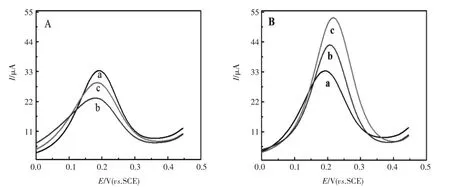
图6 手性传感界面对不同浓度奎宁、奎尼丁的DPV响应:(A)1.0×10-4mol/L奎宁、奎尼丁,(B)5.0×10-3mol/L奎宁、奎尼丁,(a)BSA/AuNPs/GCE,(b)QD/BSA/AuNPs/GCE,(c)QN/BSA/AuNPs/GCEFig.6 DPVs of(A)0.1 mmol/L QN,QD,(B)5.0 mmol/L QN,QD:(a)BSA/AuNPs/GCE,(b)QD/BSA/AuNPs/GCE, (c)QN/BSA/AuNPs/GCE
考察BSA/AuNPs/GCE在奎宁、奎尼丁溶液中的孵育时间非常重要。图7给出了从5~30 min手性界面分别与奎宁(曲线a)和奎尼丁(曲线b)
作用的电流-时间图。从图7A可以看出,当BSA/ AuNPs/GCE与1.0×10-4mol/L的奎宁、奎尼丁作用后,峰电流的变化随时间的增加而增加,但奎宁电流增加的比奎尼丁的慢且低,最大峰电流变化差在15 min处出现 (图7 B)。当BSA/AuNPs/ GCE与5.0×10-3mol/L的奎宁、奎尼丁作用后,峰电流的变化也随时间的增加而增加,且奎宁电流增加的更快更高,最大峰电流变化差出现在15 min。因此,选用15 min为最佳手性识别孵育时间。
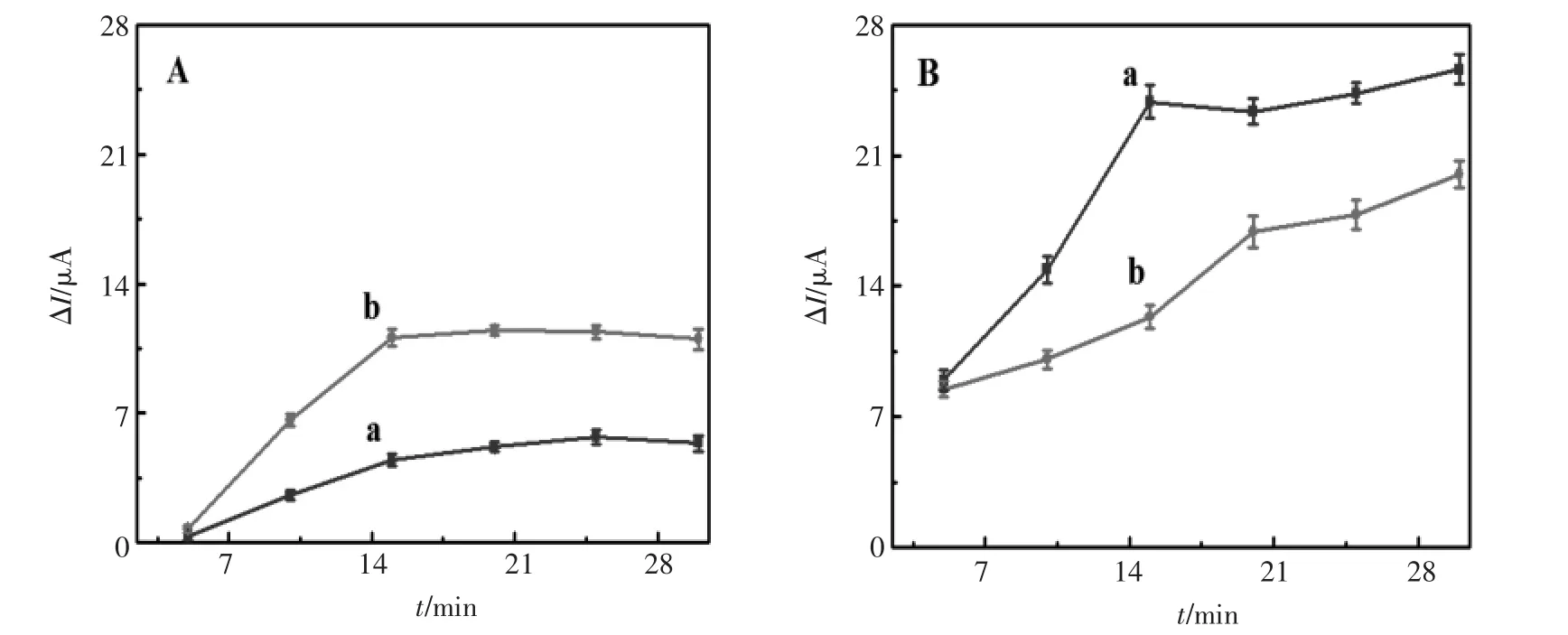
图7 孵育时间对手性识别的影响:(A)1.0×10-4mol/L奎宁、奎尼丁,(B)5.0×10-3mol/L奎宁、奎尼丁:(a)奎宁,(b)奎尼丁Fig.7 Time dependence of chiral recognition:(A)0.1 mmol/L QN/QD,(B)5.0 mmol/L QN/QD:(a)QN,(b)QD
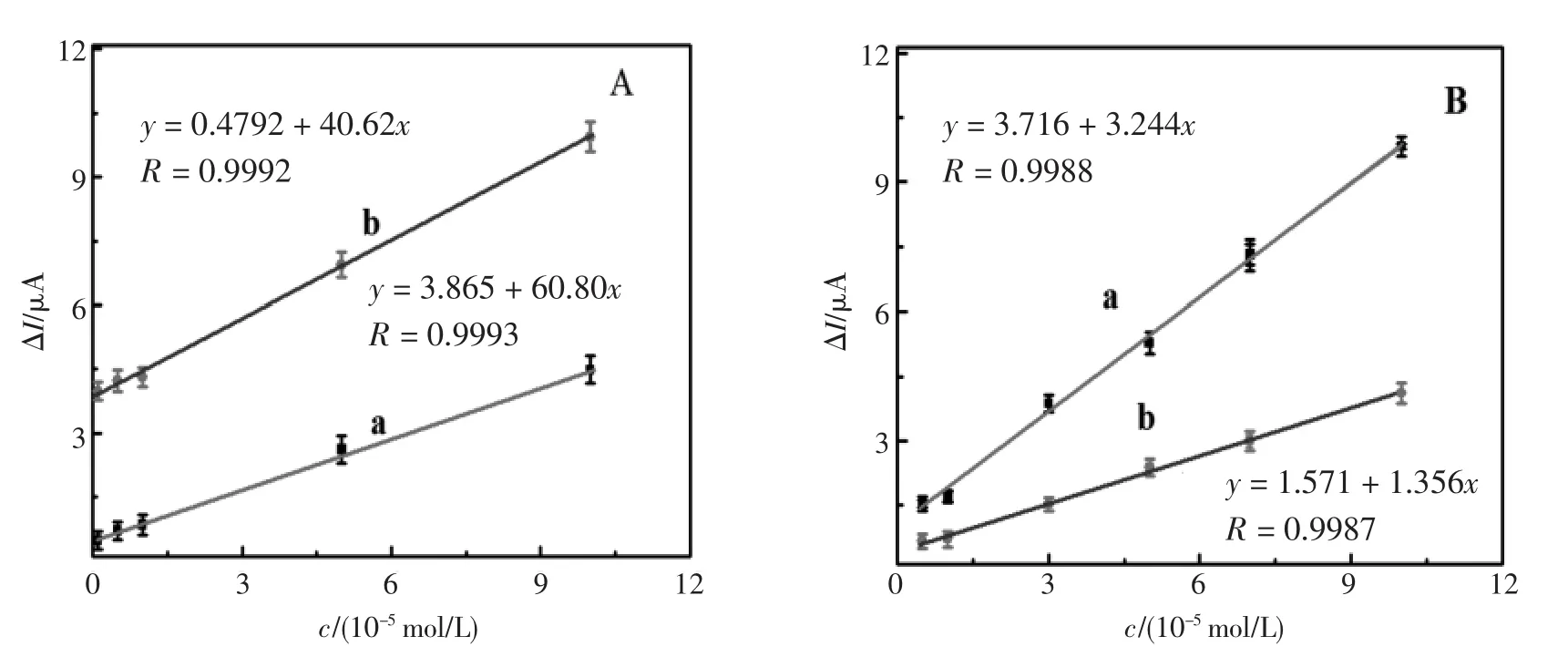
图8 峰电流变化与奎宁和奎尼丁的浓度的响应关系:(A)1.0×10-6~1.0×10-4mol/L,(B)5.0×10-4~1.0×10-2mol/L:(a)奎宁,(b)奎尼丁Fig.8 Dependence of the peak current change on the concentration of(a)QN,(b)QD:(A)0.001~0.1 mmol/L, (B)0.5~10.0 mmol/L
2.5 线性
为了进一步研究电流响应与奎宁、奎尼丁浓度的关系,在最佳条件下,进行了手性界面与一系列浓度的奎宁(直线a)和奎尼丁(直线b)作用后的差分脉冲伏安测试。图8(A)展示了BSA/ AuNPs/GCE与浓度从1.0×10-6mol/L到1.0×10-4mol/L的奎宁、奎尼丁作用后的峰电流的变化,可看出,BSA/AuNPs/GCE与奎宁、奎尼丁作用后的峰电流变化均与浓度的增加成比例且奎尼丁增加的更快更高,线性方程分别为y=3.865+60.80 x (R=0.9993)和y=0.4792+40.62x(R=0.9992);图8(B)展示了BSA/AuNPs/GCE与一系列浓度大于或等于5.0×10-4mol/L的奎宁、奎尼丁作用后峰电流的变化,可看出,BSA/AuNPs/GCE与浓度从5.0×10-4mol/L到1.0×10-2mol/L的奎宁、奎尼丁作用后的峰电流变化也与浓度的增加成比例,奎宁增加的快且高,线性方程分别为y=3.716+ 3.244 x(R=0.9988)和y=1.571+1.356x(R=0.9987)。
2.6 基于BSA与纳米粒子的识别方法对比
近年来,BSA做为手性选择剂在手性识别中得到了一定的应用[24-25]。现将已有方法对比,如表1,该研究利用BSA自组装在纳米金表面识别奎宁和奎尼丁,并具有较高的手性选择性。
2.7 传感器的实际应用
通过检测奎宁和奎尼丁消旋体溶液中奎宁的含量(QN%)来研究该传感器的实际应用。保持消旋体溶液总浓度为1.0×10-4mol/L和1.0×10-3mol/L,QN的含量从0到100%变化。如图9所示,峰电流响应与奎宁含量的增加成线性关系,说明该传感器可用于奎宁和奎尼丁消旋体的检测。

表1 基于BSA与纳米粒子识别方法对比Tab.1 Comparison of discrimination methods based on BSA and nanoparticles
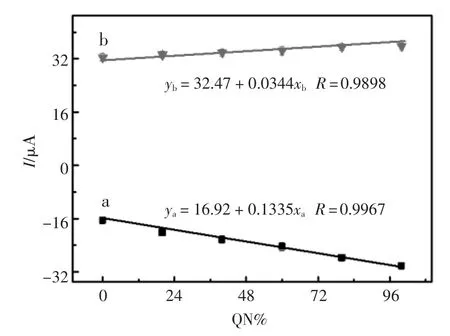
图9 不同浓度的奎宁和奎尼丁的消旋体的电流响应(a)1.0×10-4mol/L,(b)1.0×10-3mol/LFig.9 Current response of the enantiomeric composition of QN and QD at different concentrations:(a)0.1 mmol/L,(b) 1.0 mmol/L
3 结论
实验利用BSA自组装在电沉积纳米金修饰的玻碳电极表面,构建了一个简单可靠的电化学传感界面用于与奎宁和奎尼丁的选择性作用研究。由于奎宁和奎尼丁的空间结构不同,导致与BSA的作用程度不同;而且不同浓度范围内的奎宁、奎尼丁与BSA的作用方式也不同,当奎宁、奎尼丁的浓度小于5.0×10-4mol/L时,因BSA的阻碍作用,奎宁和奎尼丁与其作用后峰电流降低且奎尼丁降低得更多;当奎宁、奎尼丁的浓度增大到5.0×10-4mol/L时,奎宁、奎尼丁会破坏BSA的结构而有利于电子的传输,使峰电流升高且奎宁升高得更多。该传感器不仅能够识别奎宁和奎尼丁,而且为其他手性药物或手性小分子与BSA的作用提供了一定的理论基础具有潜在的应用价值。
[1]Trojanowicz M,Kaniewska M.Electrochemical Chiral Sensors and Biosensors[J].Electroanal.,2009,21:229-238.
[2]Chen C,Shi H J,Zhao G H.ChiralRecognition and Enantioselective Photoelectrochemical Oxidation toward Amino Acids on Single-Crystalline ZnO[J].Phys. Chem.C.,2014,118:12041-12049.
[3]Yan T Q,Orihuela C.Rapid and high throughput separation technologies—Steady state recycling and supercritical fluid chromatography for chiral resolution of pharmaceutical intermediates[J].Chromatogr.A.,2007,1156: 220-227.
[4]Caldwell J.Importance of stereospecific bioanalytical monitoring in drug development[J].Chromatogr.A., 1996,719:3-13.
[5]Walle T,Kristina-walle U,Wilson M J,et al.Stereoselective ring oxidation of propranolol in man[J].Br.J.clin. Pharmac.,1984,18:741-747.
[6]Ali I,Gaitonde V D,Aboul-Enein H Y,et al.Chiral separation of β-adrenergic blockers on CelluCoat column by HPLC[J].Talanta.,2009,78:458-463.
[7]Na N,Hu Y P,Ouyang J,et al.Use of polystyrene nanoparticles to enhance enantiomeric separation of propranolol by capillary electrophoresis with Hp-beta-CD as chiral selector[J].Anal.Chim.Acta.,2004,527: 139-147.
[8]Sanghavi B J,Srivastava A K.Adsorptive stripping voltammetric determination of imipramine,trimipramine
and desipramine employing titanium dioxide nanoparticles and an Amberlite XAD-2 modified glassy carbon paste electrode[J].Analyst.,2013,138:1395-1404.
[9]Sanghavi B J,Kalambate P K,Karna S P,et al.Voltammetric determination of sumatriptan based on a graphene/ gold nanoparticles/Nafion composite modified glassy carbon electrode[J].Talanta.,2014,120:1-9.
[10]Carter D C,Ho J X.Structure of serum albumin[J].Adv. Protein Chem.,1994,45:153–203.
[11]Olson R E,Christ D D.Plasma protein binding of drugs [J].Ann.Rep.Med.Chem.,1996,31:327–337.
[12]Hu Y J,Liu Y,Wang J B,et al.Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin[J].Pharmaceut Biomed.,2004,36: 915-919.
[13]Gübitz G.Separation of Drug Enantiomers by HPLC Using Chiral Stationary Phases-A Selective Review[J]. Chromatographia.,1990,30:555-564.
[14]Kato M,Sakai-Kato K,Matsumoto,N,et al.A Protein-Encapsulation Technique by the Sol-Gel Method for the Preparation of Monolithic Columns for Capillary Electrochromatography[J].Anal.Chem.,2002,74:1915-1921.
[15]Baptista M S,Indig G L.Effect of BSA Binding on Photophysical and Photochemical Properties of Triarylmethane Dyes[J].Phys.Chem.B.,1998,102:4678-4688.
[16]Sen T,Haldar K K,Patra A.Au Nanoparticle-Based Surface Energy TransferProbe forConformational Changes of BSA Protein[J].Phys.Chem.C.,2008,112: 17945–17951.
[17]Pingarrón J M,Yáñez-Sedeño P,González-Cortés A. Gold nanoparticle-based electrochemical biosensors[J]. Electrochim.Acta.,2008,53:5848-5866.
[18]Wang Z J,Li M Y,Su P P,et al.Direct electron transfer of horseradish peroxidase and its electrocatalysis based on carbon nanotube/thionine/gold composites[J]. Electrochem Commun.,2008,10:306-310.
[19]Yáñez-Sedeño P,Pingarrón J M.Gold nanoparticlebased electrochemical biosensors[J].Anal Bioanal Chem.,2005,382:884-886.
[20]Hu Y J,Liu Y,Wang J B,et al.Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin[J].Pharmaceut Biomed.,2004,36: 915-919.
[21]Cheng Z J,Zhang Y T.Fluorometric investigation on the interaction of oleanolic acid with bovine serum albumin [J].Mol.Struct.,2008,879:81-87.
[22]Kamat B P.Study of the interaction between fluoroquinolones and bovine serum albumin[J].Pharmaceut Biomed.,2005,39:1046-1050.
[23]Liu Y,Chen M M,Wang S H,et al.New insight into the stereoselective interactions of quinine and quinidine, with bovine serum albumin[J].Mol.Recognit.,2014, 27:239-249.
[24]Liu F K,Wei G Z,Cheng F Z.Immobilization of a Monolayer of Bovine Serum Albumin on Gold Nanoparticles for Stereo-specified Recognition of Dansyl-norvaline[J]. Chin.Chem.Soc.,2003,50:931-937.
[25]Liu C M,Liang R P,Wang X N,et al.A versatile polydopamine platform for facile preparation of protein stationary phase for chip-based open tubular capillary electrochromatography enantioseparation[J].Chromatogr. A.,2013,1294:145-151.
The enantioselective interaction between bovine serum albumin and quinine/quinidine
Xuan Chun-zhi,Li Zhen,Ma Jiao,Yang Cheng-cheng,Fu Ying-zi*
(School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
A simple chiral sensing platform for enantioselective recognition of the anti-malaria chiral drug of quinine(QN)and quinidine(QD)was fabricated via the self-assembled of bovine serum albumin(BSA)on the electrodepositive gold nanoparticles(AuNPs)modified glassy carbon electrode.The sensing platform was characterized with scanning electron microscope(SEM)and cyclic voltammetry(CV).Differential pulse voltammetry(DPV)and Ultraviolet-visible spectroscopy(UV-Vis)were used to study the enantioselective interaction between QN/QD and bovine serum albumin.The results displayed that after the self-assembled interface interacting with QN and QD,a larger electrochemical signal was achieved from QD when the concentration of QN and QD less than 5.0×10-4mol/L,however,a larger singal was obtained from QN when the concentration of QN and QD increased to 5.0×10-4mol/L due to QN and QD damaged the intraprotein hydrogen bonds of BSA which make BSA unfold and compelled the protein adopt a more imcompact conformation state which enhanced the electron transfer rate.
enantioselective interaction;quinine;quinidine;bovine serum albumin;gold nanoparticles
*通信联系人,E-mail:fyzc@swu.edu.cn
