信号放大技术在电化学免疫传感器中的应用
2015-02-02韩静,卓颖,袁若
韩 静,卓 颖,袁 若
(西南大学化学化工学院,重庆400715)
信号放大技术在电化学免疫传感器中的应用
韩 静,卓 颖,袁 若*
(西南大学化学化工学院,重庆400715)
电化学免疫传感器是一种将电化学分析方法与免疫学技术相结合而发展起来的具有响应快速、灵敏度高、选择性好、操作简单、成本低等优点的生物传感器。近年来,基于新型纳米材料催化、酶催化以及生物学放大技术用于蛋白质检测的电化学免疫传感器的研究颇受关注。该研究综述简要介绍电化学免疫传感器的基本原理,重点评述了近年来基于各种信号放大技术在电化学免疫传感器中的应用进展。
信号放大;电化学;免疫传感器;综述
0 引言
近年来随着纳米技术、信息科学以及生物科学的不断创新,电化学生物传感技术也得到了迅速的发展。在众多的生物传感器中,电化学免疫传感器因与化学、医学、生物学等众多学科相互渗透、相互交叉而占据着非常重要的位置[1-2]。值得注意的是,电化学免疫传感器具有如下特点:1)具有较好的特异性和选择性;2)专一性强,只对特定的底物起反应,而且不受颜色、浊度影响;3)体积小,可实现连续在线监测;4)响应快,样品用量少,可以反复多次使用;5)成本低,便于推广普及。正是因为电化学免疫传感器具有响应快速、灵敏度高、选择性高、操作简单、成本低廉等显著优点被广泛应用到生命科学以及分析化学等研究领域。
1 电化学免疫传感器
电化学免疫传感器是基于抗原抗体之间高亲和性和高特异性的结合反应,以抗体或抗原作为分子识别元件,通过换能器将免疫反应前后所引起目标分析物浓度的信号转换为相应的电化学信号,从而实现对目标分析物的定量检测。图1是电化学免疫传感器的检测原理示意图。电化学免疫传感器具有快速、灵敏、选择性高、测试费用低、灵活便携、适用于联机化、有望实现在线检测等特点,在临床诊断、生物分析等领域具有巨大的发展前景[3]。
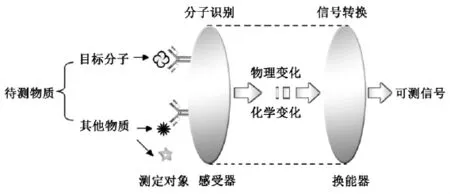
图1 电化学免疫传感器原理示意图Fig.1 Scheme of the principle for an electrochemical immunosensor
2 信号放大技术在生物传感器中的应用
随着生物传感技术的不断发展以及人们对其要求的日益提高,研制具有灵敏度高、检测限低、选择性和稳定性好以及经济实用的生物传感器成为当务之急。为了提高检测灵敏度,需要引入信号放大技术,它是实现对痕量蛋白定量检测的重用手段。下面就纳米材料催化、酶催化、亲和素-生物素放大、生物放大技术以及多种信号放大技术联用在电化学生物传感器中的应用分别作简要介绍。
2.1 纳米材料信号放大
纳米材料除了用作纳米载体固载标记物(如酶、信号物质、抗体、适体等),还展现出优异的电催化活性,非常适合于研制高灵敏度、高选择性的电化学生物传感器。一般情况下,纳米材料主要通过以下几种方式来增强传感器的响应信号:1)利用纳米材料大的比表面积来提高信号物质以及具有催化活性的纳米粒子或酶的固载量,从而放大响应信号;2)利用纳米材料自身良好的催化活性及可作为模拟酶的独特性质,实现信号放大[4]。其中以小粒径的纳米金、纳米铂(Pt)、纳米钯(Pd)、Fe3O4等在信号催化放大方面的应用最为常见。
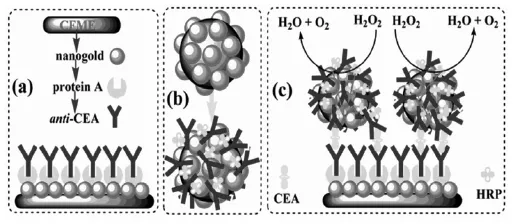
图2 金磁纳米微球标记信标抗体构建夹心型电化学免疫传感器[7]Fig.2 Magnetic gold nanospheres for the construction of sandwich-type electrochemical immunosensor from Ref.[7], Copyright 2008 ACS
南京大学朱俊杰、陈洪渊教授研究小组制备了纳米金-溶胶状碳纳米复合材料并用于构建高灵敏的电化学免疫传感器[5]。南京大学鞠熀先教授课题组利用纳米粒子大的比表面积和银沉积相结合的方法构建了三重信号放大策略用于检测CEA电化学免疫传感器,检测限达pg级[6]。袁若教授研究组[7]用金磁纳米微球标记信标抗体用于夹心酶联免疫分析检测CEA(图2)。实验表明,金磁纳米微球可以显著提高信标抗体和酶的固载量,检测下限为10 pg/mL,比传统的酶联免
疫法(ELISA)低了2个数量级。鞠熀先教授研究组[8]用AuPd双金属合金构建高灵敏电化学免疫传感器用于检测小分子氯霉素(图3)。研究表明,与单一的纳米材料(Au或Pd)相比,AuPd复合纳米材料不仅有单一材料的协同效应,而且具有更加优异的性能,如大的比表面积、表面更易功能化、更多的结合位点以及更高的催化活性等特点。
另外,部分纳米材料还具有类过氧化物模拟酶的性质,对特定的底物展现出高效的催化活性。例如,韩国釜山国立大学H.Yang教授研究小组最近报道了一种通过标记的纳米金电催化还原对硝基酚为对氨基酚以放大响应信号的高灵敏电化学免疫传感器[9]。Chunming Wang教授研究组[10]制备了纳米Pt和Fe3O4功能化的石墨烯纳米复合材料,该复合物对甲醇的催化氧化表现出高效的催化活性。福州大学唐点平教授研究小组[11]利用Fe3O4类过氧化物酶活性与过氧化氢高效催化性构建了一种反向比色免疫分析新方法用于对PSA的高灵敏检测(图4)。
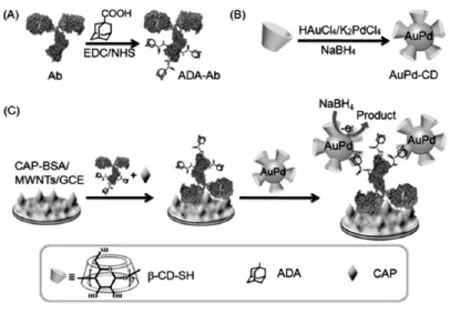
图3 AuPd双金属合金构建高灵敏电化学免疫传感器[8]Fig.3 Electrochemical immunoassay procedure for the detection of a small molecule from Ref[8],Copyright 2013 ACS
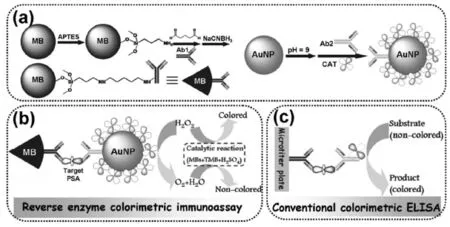
图4 类过氧化物酶Fe3O4纳米磁珠用于反向比色免疫分析示意图[11]Fig.4 Schematic illustration of magneto-controlled enzyme-mediated reverse colorimetric immunoassay protocol from Ref.[11],Copyright 2013 ACS
2.2 酶催化信号放大
酶(enzyme)在生物体中扮演重要的角色,是由生命体所产生具有生命调节能力的活性蛋白,
具有高效催化性和高度专一性。基于此,可以通过酶催化其相应的底物发生氧化还原反应实现信号放大,从而构建高灵敏的电化学生物传感器。常用的生物酶有辣根过氧化物酶(HRP)、细胞色素c氧化酶(Cytc)、葡萄糖氧化酶(GOx)、碱性磷酸酯酶(AP)、葡萄糖脱氢酶(GDH)等。
南京大学夏兴华教授研究组报道了采用电化学原位合成法直接将GOx修饰到电极表面的SiO2三维网状结构中[12],构建高灵敏的葡萄糖生物传感器。北京大学邵元华研究小组制备了高度有序的硅纳米管并用于Cytc的直接电催化[13]。陈洪渊教授研究小组[14]用酶催化(AP)在底物抗坏血酸酯 (AA-p)存在下原位产生抗坏血酸(AA),构建高灵敏的光电化学夹心型免疫传感器,这项研究工作为光电化学免疫分析的发展提供了新的方法。Yoon-Bo Shim研究组[15]合成一种铁的配合物(FePhenTPy)作为电子媒介体修饰丝网印刷电极,通过葡萄糖脱氢酶(GDH)及其辅酶(NAD+)双重催化放大构建了简单的葡萄糖生物传感器(图5)。
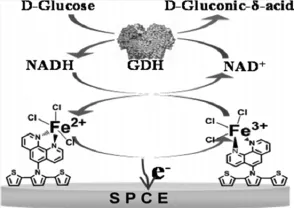
图5 葡萄糖脱氢酶及其辅酶构建葡萄糖生物传感器原理图[15]Fig.5 Schematic illustration of glucose biosensors based on glucose dehydrogenase and its coenzyme from Ref.[15], Copyright 2013 ACS
此外,在多酶标记实现信号放大时往往会出现这样一种情况,在同时标记不同种类的酶时,一种酶催化生成的产物恰好是另一种酶催化反应所需要的底物[16]。比如,Md.Aminur Rahman教授研究组[17]将辣根过氧化物酶(HRP)和葡萄糖氧化酶 (GOx)同时标记到羧基化碳纳米管表面(图6)。首先GOx在底物葡萄糖存在下会产生H2O2,然而生成的H2O2恰好是HRP催化的底物。如此HRP和GOx形成双酶联级催化,对于免疫传感器的信号放大作用显著优于单酶。该免疫传感器对CEA的检测限分别达到4.4 pg/mL。
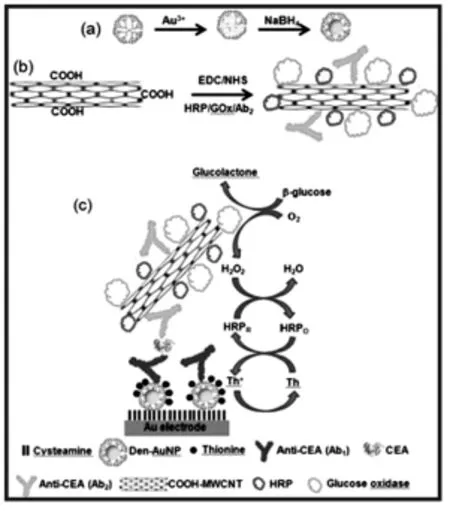
图6 双酶标记的碳纳米管构建多重信号催化放大的电化学免疫传感器[17]Fig.6 Schematic illustrations of the fabrication of the electrochemical CEA immunosensor and detection principle from Ref.[17],Copyright 2013 ACS
韩国釜山国立大学H.Yang教授[18]将单酶和双酶的催化性能进行了对比(图7)。当在信标抗体上仅标记一种酪氨酸酶(Tyr),此时只有单重的信号放大。当在信标抗体上同时标记β-半乳糖苷酶(Gal)和Tyr,在底物苯基β-D-半乳糖存在下,Gal首先将其转换为苯酚。生成的产物可以进一步被Tyr催化生成邻苯二酚,最后邻苯二酚再次被Tyr催化生成邻苯醌。通过双酶催化实现了三重信号放大,从而大大提高了传感器的灵敏度。
2.3 亲和素-生物素信号放大
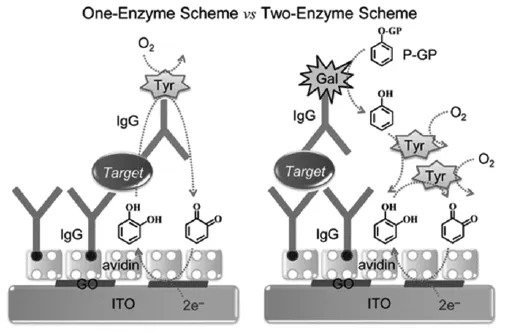
图7 基于单酶和双酶催化放大构建信号增强型电化学免疫传感器原理示意图[18]Fig.7 Schematic illustrations of the fabrication of the electrochemical immunosensor and detection principle for one-enzyme and two-enzyme from Ref.[18],Copyright 2014 ACS
生物素(biotin)俗称维生素H,是由一个咪唑酮环和带羧基的噻吩环所组成。亲和素(avidin)是由四个亚基组成的一种碱性糖蛋白。从分子结构可以看出,1个亲和素分子理论上能够结合4个生物素分子,从而实现信号放大。更重要的是,亲和素与生物素在很短的时间内就能快速结合,并且二者间的特异性和亲和力非常强,其结合能力往往是抗原与抗体作用力的10~100万倍。此外,多数的抗体、蛋白质、DNA、酶等都很容易被生物素化,并且经过生物素处理后,生物分子其原有的生物活性不会降低。因此,基于亲和素-生物素信号放大在生物学、分子生物学、生物化学、临床医学等领域得到广泛的应用[19-21]。陈洪渊教授研究组将信标抗体用生物素进行修饰,当加入亲和素之后,在1个亲和素位点上可以特异性结合更多生物素标记的G碱基,有效提高了G碱基的固载量,通过hemin-G结构对H2O2的催化完成对前列腺特异性抗原的高灵敏检测[22]。美国北达科他州立大学刘国东教授研究小组用脱铁蛋白纳米颗粒将小分子铁氰化钾包裹在其空腔内,利用亲和素-生物素技术将生物素标记的脱铁蛋白标记在信标抗体上,在纳米磁珠表面进行双抗夹心免疫反应[23]。通过调节pH,可以将脱铁蛋白的空腔打开,这样铁氰化钾可以释放到检测底液中,从而用电化学测试完成对目标分析物的定量检测(图8)。基于1个亲和素可以特异性结合4个生物素标记的脱铁蛋白,实现信号放大。与其它固定方式相比,该方法能够有效增加电活性物
质的固定量,减少电极表面的非特异性吸附,有效放大响应信号,提高传感器的灵敏度。
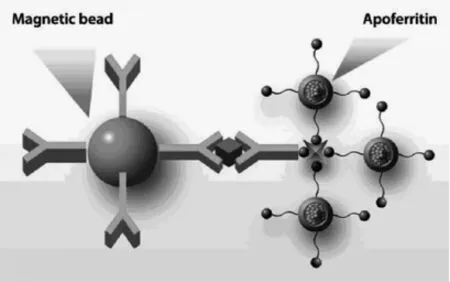
图8 亲和素-生物素放大技术构建电化学免疫传感器示意图[23]Fig.8 Schematic diagram of the principle for the electrochemical immunosensor with biotin-streptavidin affinity for amplification from Ref.[23],Copyright 2006 ACS
2.4 杂交链式反应信号放大
杂交链式反应(HCR)是由Dirks和Pierce[24]在2004年提出的,该反应在室温下就可以进行,无需变温和其它酶的辅助。其基本原理是依据碱基互补配对的原则,通过单链DNA作为引物链诱导寡核苷酸相互杂交、扩增形成一条具有二维或三维结构的双链DNA(dsDNA),从而实现信号放大的目的。由于该反应通过引物链引起的反应,因此可以有效地降低背景信号、减少假阳性信号的产生,从而引起了研究者的极大兴趣。例如,唐点平教授研究组[25]利用分子生物学技术—DNA基于杂交链反应作为信号放大手段,将引物DNA和信标抗体固定在纳米金上,实现高灵敏CEA检测。首先用纳米金标记信标抗体,并在纳米金表面修饰上S0作为引发链。然后自发的与两条单链 (分别为含G碱基序列的S1和S2)发生HCR反应。当加入hemin后,聚合双链上大量的G碱基能与hemin结合形成DNzyme,从而实现电化学信号的放大。鞠熀先教授研究组[26]将HCR用于构建DNA传感器 (图9)。首先利用目标DNA作为引发链,诱发两条发夹型单体通过HCR得到长链dsDNA,由于dsDNA带负电荷能将大量带正电荷的Ag+相嵌其中,通过纳米Ag增强拉曼信号构建了简单、灵敏的免标记型DNA传感器。由于HCR不需要加入酶,以单链DNA作为引发剂诱导链聚合反应,操作简单,条件温和,也可用于其他生物传感器的构建。
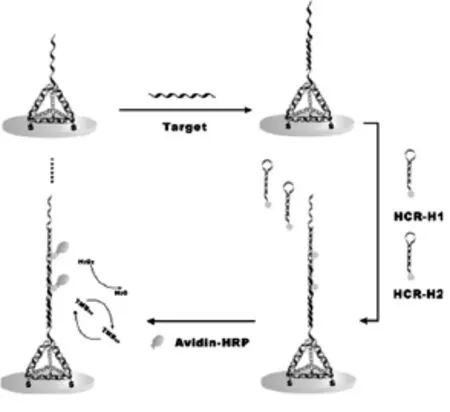
Xiaolei Zuo教授研究组[27]利用HCR信号放大技术构建了三维立体结构的电化学生物传感器用于检测MicroRNA(图10)。利用四面体结构上的目标DNA作为引发链,诱发两条标记有生物素的发夹型单体在电极表面通过HCR得到的长链dsDNA,通过生物素-亲和素识别能够将大量的亲和素修饰的生物酶(HRP)嵌入其中,再经酶与底物催化实现多重信号放大。
3 结论
电化学免疫分析是将分析化学与临床诊断相结合,利用抗体-抗原反应的高亲合作用建立起来的新型免疫分析技术,是疾病诊断、疗效观察和医学研究的重要途径。然而,在临床检测中,一般对样品的检测灵敏度不高,而过长时间的检测又会耽误病人的治疗时机,因此研制准确、快速、高灵敏的免疫传感器是非常重要的。为了提高传感器的灵敏度,通过将纳米材料与多种信号放大技术,如新型纳米材料催化、酶催化以及生
物学放大技术相结合是实现灵敏快速的分析检测的常用手段。
图10 基于HCR信号放大的电化学生物传感器原理图[27]
Fig.10 Schematic of electrochemical DNA detection.Probes are immobilized on a 3D tetrahedral scaffold,and signal is amplified by HCR from Ref.[27],Copyright 2014 ACS
[1]Suginta W,Khunkaewla P,Schulte A.Electrochemical biosensor applications of polysaccharides chitin and chitosan[J].Chemical Reviews,2013,113(7):5458-5479. [2]Zhu C Z,Yang G H,Li H,et al.Electrochemical sensors and biosensors based on nanomaterials and nanostructures[J].Analytical Chemistry,2015,87(1):230-249.
[3]陈慧连,陈伟锐.电化学免疫传感生物传感器的发展概述[J].广州化工,2013,41(11):56-58.
[4]Tang J,Zhou J,Li Q F,et al.In situ amplified electronic signal for determination of low-abundance proteins coupling with nanocatalyst-based redox cycling[J].Chemical Communications,2013,49:1530-1532.
[5]Cui R J,Liu C,Shen J M,et al.Gold nanoparticle-colloidal carbon nanosphere hybrid material:Preparation, characterization,and application for an amplified electrochemical immunoassay[J].Advanced Functional Materials,2008,18(15):2197-2204.
[6]Lin D J,Wu J,Wang M,et al.Triple signal amplification of graphene film,polybead carried gold nanoparticles as tracing tag and silver deposition for ultrasensitive electrochemicalimmunosensing[J].AnalyticalChemistry, 2012,84(8):3662-3668.
[7]Tang D P,Yuan R,Chai Y Q.Ultrasensitive electrochemical immunosensor for clinical immunoassay using thionine-doped magnetic gold nanospheres as labels and horseradish peroxidase as enhancer[J].Analytical Chemistry,2008,80(5):1582-1588.
[8]Wang L S,Lei J P,Ma R N,et al.Host-guest interaction of adamantine with a β-Cyclodextrin functionalized AuPd bimetallic nanoprobe for ultrasensitive electrochemical immunoassay of small molecules[J].Analytical Chemistry,2013,85:6505-6510.
[9]Das J,Aziz M A,Yang H.A nanocatalyst-based assay for proteins:DNA-free ultrasensitive electrochemical detection using catalytic reduction of p-nitrophenol by goldnanoparticle labels[J].Journal of the American Chemical Society,2006,128(50):16022-16023.
[10]Lin S X,Shen C M,Lu D B,et al.Synthesis of Pt nanoparticles anchored on graphene encapsulated Fe3O4magnetic nanospheres and their use as catalysts for methanol oxidation[J].Carbon,2013,53:112-119.
[11]Gao Z Q,Xu M D,Hou L,et al.Magnetic bead-based reverse colorimetric immunoassay strategy for sensing biomolecules[J].Analytical Chemistry,2013,85(14): 6945-6952.
[12]Jia W Z,Wang K,Zhu Z J,et al.One-step immobilization of glucose oxidase in a silica matrix on a Pt electrode by an electrochemically induced Sol-Gel process[J].Langmuir,2007,23(23):11896-11900.
[13]Mu C,Zhao Q,Xu D S,et al.Silicon nanotube array/gold electrode for direct electrochemistry of cytochrome c[J]. The Journal of Physical Chemistry B,2007,111(7): 1491-1495.
[14]Zhao W W,Ma Z Y,Yan D Y,et al.In situ enzymatic ascorbic acid production as electron donor for CdS quantum dots equipped TiO2nanotubes:A general and efficient approach for new photoelectrochemical immunoassay[J].Analytical Chemistry,2012,84:10518-10521.
[15]Kim D M,Kim M Y,Reddy S S,et al.Electron-transfer mediator for a NAD-glucose dehydrogenase-based glucose sensor[J].Analytical Chemistry,2013,85(23): 11643-11649.
[16]Akter R,Rhee C K,Rahman M A.A highly sensitive quartz crystal microbalance immunosensor based on magnetic bead-supported bienzymes catalyzed mass enhancement strategy[J].Biosensors and Bioelectronics, 2015,66:539-546.
[17]Jeong B J,Akter R,Han O H,et al.Increased electrocatalyzed performance through dendrimer-encapsulated gold nanoparticles and carbon nanotube-assisted multiple bienzymatic labels:Highly sensitive electrochemical immunosensor for proteindetection[J].Analytical Chem-
istry,2013,85(3):1784-1791.
[18]Park S,Singh A,Kim S,et al.Electroreduction-based electrochemical-enzymatic redox cycling for the detection of cancer antigen 15-3 using graphene oxide modified indium-Tin oxide electrodes[J].Analytical Chemistry,2014,86:1560-1566.
[19]Zhu Q,Chai Y Q,Zhuo Y,et al.Ultrasensitive simultaneous detection of four biomarkers based on hybridization chain reaction and biotin-streptavidin signal amplification strategy[J].Biosensors and Bioelectronics,2015, 68:42-48.
[20]Date T,Sekine J,Matsuno H,et al.Polymer-binding peptides for the noncovalent modification of polymer surfaces:Effects of peptide density on the subsequent immobilization of functional proteins[J].ACS Applied Materials&Interfaces,2011,3(2):351-359.
[21]Shukla R S,Tai W Y,Mahato R,et al.Development of streptavidin-based nanocomplex for siRNA delivery[J]. Molecular Pharmaceutics,2013,10(12):4534-4545.
[22]Liu J,Lu C Y,Zhou H,et al.A dual-functional electrochemical biosensor for the detection of prostate specific antigen and telomerase activity[J].Chemical Communications,2013,49:6602-6604.
[23]Liu G D,Wang J,Wu H,et al.Versatile apoferritin nanoparticle labels for assay of protein[J].Analytical Chemistry,2006,78:7417-7423.
[24]Dirks R M,Pierce N A.Triggered amplification by hybridization chain reaction[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(43):15275-15278.
[25]Hou L,Wu X P,Chen G N,et al.HCR-stimulated formation of DNA zymeconcatamers on gold nanoparticle for ultrasensitive impedimetric immunoassay[J].Biosensors and Bioelectronics,2015,68:487-493.
[26]Gao F L,Lei J P,Ju H X.Label-free surface-enhanced Raman spectroscopy for sensitive DNA detection by DNA-mediated silver nanoparticle growth[J].Analytical Chemistry,2013,85(24):11788-11793.
[27]Ge Z L,Lin M H,Wang P,et al.Hybridization chain reaction amplification of microRNA detection with a tetrahedralDNA nanostructure-based electrochemical biosensor[J].Analytical Chemistry,2014,86:2124-2130.
Signal amplification strategies applied in electrochemical immunosensors
Han Jing,Zhuo Ying,Yuan Ruo*
(College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
Electrochemical immunosensors are valuable analytical tools as the advantages of rapid response,high sensitivity,good selectivity,simple manipulation and low cost,which combined the merits of electrochemical and immunoassay.Recently,amplified electrochemical biosensors have been received much attention,which achieved by employing nanomaterials,enzymes catalysis and biological amplification technique.The principle of electrochemical immunosensorsare presented,and the signal amplification strategies applied in electrochemical immunosensors are extensively reviewed.
signal amplification;electroanalysis;immunosensors;review
国家自然科学基金资助项目(21275119,21105081)
*通信联系人,E-mail:yuanruo@swu.edu.cn
