前列腺癌细胞乳鼠移植瘤动物模型的建立
2015-02-02曾家豫袁红霞廖世奇
曾家豫,张 虹,袁红霞,牛 童,廖世奇*
(1.西北师范大学生命科学学院,甘肃兰州 730070;
2.甘肃省医学科学研究院分子生物中心,甘肃兰州 730050)
前列腺癌细胞乳鼠移植瘤动物模型的建立
曾家豫1,张虹1,袁红霞2,牛童1,廖世奇2*
(1.西北师范大学生命科学学院,甘肃兰州730070;
2.甘肃省医学科学研究院分子生物中心,甘肃兰州730050)
摘要:为构建前列腺癌细胞(PC3)乳鼠移植瘤动物模型,在体外培养PC3细胞,经软琼脂克隆形成实验筛选PC3细胞株中具有克隆形成能力的细胞,常规传代后取对数生长期细胞,接种约2×107mL-1单细胞悬液0.1 mL于出生2 d的乳鼠颈部和前肢交界处皮下,建立移植肿瘤动物模型,观察乳鼠肿瘤生长特点,并用病理组织HE染色和免疫组织化学染色鉴定PC3在乳鼠皮下的成瘤情况.结果显示注射后乳鼠未见明显的不良反应.1~6 d可见乳鼠皮下肿胀,且能触及到黄豆粒大小的肿物;7~15 d肿物变大,肉眼能观察到明显肿物;16~21 d时肿物有消退迹象.病理组织HE染色观察显示肿块为肿瘤组织,免疫组织化学染色显示肿物中CD133呈强阳性表达.
关键词:PC3;软琼脂克隆形成;乳鼠移植瘤;肿瘤组织
1材料与方法
1.1材料
Dulbecco’s modified eagie medium(DMEM)培养基、L-谷氨酰胺(Gln)和胰蛋白酶(购自Gibco公司),胎牛血清(FBS)(购自Hyclone),低熔点琼脂糖(购自上海生工生物工程技术服务有限公司),青霉素和链霉素(购自甘肃省肿瘤医院),瑞士-吉姆萨染色液和台盼兰染液(购自珠海贝索生物技术有限公司),CD133抗体和免疫组化二抗试剂盒(购自北京博奥森生物技术有限公司),DAB染色试剂盒(购自天根生化科技北京有限公司).
CO2培养箱(SANYO),倒置显微镜(重庆光学仪器厂),普通光学显微镜(OLYMPUS),细胞培养皿(NUNC)(兰州鹏程生物技术有限公司).
3只Wistar孕鼠(购自甘肃省医学科学研究院动物实验中心),待其生产后第2 d,对新生乳鼠进行称重分类,每只母鼠留8只乳鼠,每组设2只为对照组乳鼠,其余6只为实验组乳鼠.
1.2细胞培养
从液氮罐中取出冻存的PC3细胞,迅速放入预热的37 ℃水浴锅中,快速震荡溶化,1 000 r·min-1离心5 min后,将细胞接种于已配制好的含10% FBS和1% L-Gln的DMEM完全培养基中,置于37 ℃,5%的CO2培养箱中培养.每隔2~3 d更换细胞培养液,待其长到铺满皿底80%时传代.
依据Friedenstein[11]提出的全骨髓贴壁培养法分离和纯化大鼠骨髓间充质干细胞(BMSCs)做为阴性对照组细胞,常规传代培养.
1.3软琼脂克隆
1.3.1软琼脂储备胶的制备下层胶制备:配制1.2%的低熔点琼脂糖,高压灭菌,待其温度降至37 ℃左右后置于37 ℃水浴锅备用.取1.5 mL 1.2%低熔点琼脂糖加入已经配好的1.5 mL 2×DMEM培养基(含20% FBS+1% Gln),混匀后倒入六孔板中制成软琼脂底板,置于冰袋上待其冷却凝固后备用.上层胶制备:配制0.7%的低熔点琼脂糖,高压灭菌,待其温度降至37 ℃左右后置于37 ℃水浴锅备用,取1.5 mL 0.7%低熔点琼脂糖加入已经配好的约含有1~3×103mL-1PC3细胞的等体积2×DMEM培养基中,混匀后倒入软琼脂底层上,制成双琼脂层,置于冰袋上待其冷却凝固后置于培养箱中培养7~14 d左右镜检,观察软琼脂克隆团的形成情况.
1.3.2单细胞软琼脂克隆团的获取软琼脂克隆团形成第14 d置于倒置显微镜下观察,标记并挑出较大克隆团后置于细胞培养皿中培养.第3 d观察有无贴壁细胞生长,若有则弃去含有琼脂渣的培养基,加入新鲜培养基培养,每隔2~3 d更换细胞培养液,待细胞铺满皿底80%~90%时传代;若无贴壁细胞生长则弃去培养皿,重新挑取单克隆团细胞.
1.4乳鼠移植瘤动物模型的构建
取对数生长期的实验组细胞PC3和对照组细胞BMSCs,经胰蛋白酶消化后,DMEM完全培养基终止消化,1 000 r·min-1离心7 min,弃上清,DMEM完全培养基重悬细胞,台盼蓝计数后,调整细胞浓度约为2×107mL-1.用1 mL注射器吸取0.1 mL PC3细胞悬液接种于实验组乳鼠皮下,对照组乳鼠皮下注射0.1 mL BMSCs细胞悬液.注射后每天定时观察乳鼠皮下的成瘤情况,用游标卡尺测量皮下肿物的直径,以大于0.5 cm为成瘤成功.
1.5病理组织观察和免疫组织化学检测
剥离乳鼠皮下产生的肿物,9% 福尔马林液固定,组织过夜脱水后,石蜡包埋切片.切片组织经过二甲苯和梯度酒精脱水脱蜡,苏木精染色3~5 min,1% HCl分色1~3 s,碳酸锂返蓝2 min,伊红染色2 min,酒精脱水,干燥后中性树脂封片.在光学显微镜下观察组织病理切片形态.
免疫组织化学染色按照免疫组化二抗试剂盒说明书操作:石蜡切片烘烤30 min后,二甲苯和梯度酒精脱水脱蜡,柠檬酸盐缓冲液抗原修复5 min,PBS冲洗3×3 min,3%去离子水孵育15 min,PBS冲洗3×3 min,滴加试剂A(山羊血清)室温孵育15 min,倾去勿洗,滴加一抗(阴性对照组一抗用PBS代替),37 ℃孵育2 h,PBS冲洗3×3 min,滴加试剂B室温孵育15 min,PBS冲洗3×3 min,滴加试剂C室温孵育15 min,PBS冲洗3×3 min,DAB显色,自来水冲洗,干燥,中性树脂封片.光学显微镜下观察抗体表达部位.
2结果与分析
2.1PC3软琼脂克隆团产生和单细胞克隆团形成
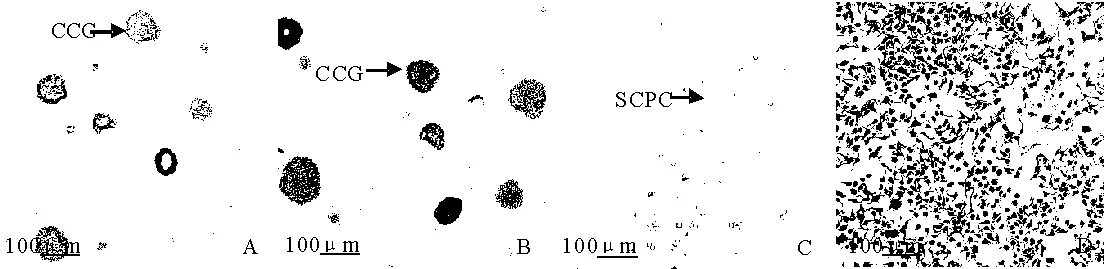
图1软琼脂克隆
Fig 1Soft agar colony formation assay
A.PC3细胞软琼脂克隆团形成第7 d;B.PC3细胞软琼脂克隆团形成第13 d;C.分离培养 PC3细胞软琼脂克隆团,D. PC3细胞软琼脂克隆团挑出后瑞士吉姆萨染色.CCG.细胞克隆团;SCPC.软琼脂克隆团挑出细胞.
A.The 7 day of PC3 cells soft agar cloning formation;B.The 13 day of PC 3 soft agar cloning formation;C.Separately cultured PC3 cells;D.Switzerland - Jim dyeing separately cultured PC3 cells.CCG.Cell clone group.SCPC.Soft agar cloning pick out the cell.
PC3接种第7 d时软琼脂上产生了较小的细胞克隆团(图1:A),待其长到13 d时,形成较大的细胞克隆团(图1:B).选取较大克隆团细胞在液体培养基中分离培养(图1:C,D)后发现,这部分从软琼脂克隆团上挑出的单细胞比未经软琼脂克隆的细胞表现出更强的增殖能力.
2.2乳鼠皮下成瘤
18只实验组乳鼠皮下均有直径大于0.5 cm的肿物产生,6只对照组乳鼠皮下均无异物产生且生长状态良好.肉眼观察实验组乳鼠发现:注射第2 d后乳鼠腋下发红肿胀,触摸质软;第3~4 d乳鼠腋下发红完全消失,肿胀部分逐渐变硬,触摸可发现有黄豆粒大小可移动肿物存在(图2:A).第7 d乳鼠皮下肿物逐渐增大,触摸质硬(图2:B).第16 d之后,部分乳鼠维持肿物大小不变,部分乳鼠肿物开始消退(图2:C).第21 d之后,除3只乳鼠皮下存在极小肿物外(图2:D),其余乳鼠肿物均消退.表明在初接种PC3细胞时乳鼠免疫系统发育不完善,肿瘤细胞能够被宿主的免疫系统接受并逃离免疫系统的监控即具有免疫耐受性,使肿瘤在皮下发生并生长.接种16 d及之后,有部分乳鼠皮下肿物开始消退,提示此时接种鼠的免疫系统已逐渐发育完全,能够对接种的异质细胞进行免疫监控和杀灭.接种21 d后,只有3只鼠皮下存在肿瘤,类似于部分肿瘤存在于人类非免疫缺陷人群中,其余鼠消退证明此时小鼠免疫功能已发育完全.
2.3病理组织变化和CD133表达
观察病理组织切片HE染色结果发现:肿物组织内有大片弥漫性分布、紊乱无章排列的肿瘤细胞存在,细胞形态大小不一,核大深染,可见明显病理性不规则核分裂相,为中度不典型增生,病理学上诊断为肿瘤组织(图3:A).免疫组织化学染色结果显示该肿瘤组织表达了前列腺癌干细胞特异性表面标志物分子CD133细胞膜和细胞浆均呈阳性(++)(图3:B).
3讨论
肿瘤的发生和发展是一个非常复杂的过程,在生物体内直接研究癌细胞的产生机理和细胞生物学特性受到很多因素的影响.因此,建立理想动物移植瘤模型对各种基础研究和临床研究都有非常重要的意义,但要求该模型的肿瘤发生部位、发病机制以及生物学特性等方面均要符合所研究的人源肿瘤.可移植肿瘤动物模型具有接种肿瘤细胞后实验动物带有同一肿瘤,个体差异较小、生长状况和宿主反应一致,可以较为客观的判断肿瘤治疗的疗效等特点,在目前肿瘤模型研究中应用较为广泛.肿瘤动物模型的移植主要有两种[12]:同种移植和异种移植;同种移植是指模型动物间的移植,而异种移植是指任何人和裸鼠之间的移植.一般的鼠移植性实验肿瘤为自发性或者诱发性肿瘤,这部分肿瘤经传代后可保持其原有特性,从而成为移植性肿瘤.

图2 乳鼠注射PC3后的成瘤图
A.接种PC3 3 d乳鼠皮下肿物;B.接种PC3 7 d乳鼠皮下肿物;C.接种PC3 17 d乳鼠皮下肿物;D.接种PC3 21 d乳鼠皮下肿物;E.接种PC3 10 d皮下解剖图;F.剥离肿物.Sm.皮下肿物;SMD.皮下肿物消失;SSM.皮下小肿物;Pt.剥离肿物.
A.The subcutaneous masses of inoculated with PC3 cells 3 day;B.The subcutaneous masses of inoculated with PC3 cells 7 day;C.The subcutaneous masses of inoculated with PC3 cells 17 day;D.The subcutaneous masses of inoculated with PC3 cells 21 day;E.Subcutaneous anatomy of inoculation with PC3 10 day;F.Peel tumor.Sm.Subcutaneous masses;SMD.Subcutaneous masses disappear;SSM.Subcutaneous small masses;Pt.Peel tumor;

图3 乳鼠皮下肿物HE染色和免疫组化CD133抗体染色
A.乳鼠皮下肿物病理HE染色;B.乳鼠皮下肿物免疫组化CD133抗体染色;M.核分裂相.
A.Neonatal mice subcutaneous tumor of HE staining;B.Neonatal mice subcutaneous tumor of CD133 antibody immunohistochemical staining;M.Mitotic.
软琼脂克隆形成实验(Soft agar assay)是体外研究肿瘤的一项重要实验,常用来检测转化细胞和肿瘤细胞[13].Li等人的研究发现[14]:通过软琼脂克隆形成实验筛选出的肿瘤细胞在动物成瘤实验中具有强的成瘤和转移能力,并且具有肿瘤干细胞特性[15].因此本实验利用目前研究较为成熟的前列腺癌细胞PC3中存在极少部分具有致瘤性的CD133+前列腺癌干细胞[16-18]做为模型动物的接种细胞系,通过软琼脂克隆形成实验筛选出此类细胞中具有强克隆集落形成能力和增殖能力的肿瘤细胞接种于乳鼠皮下,提高致瘤成功率.实验结果显示:接种PC3细胞乳鼠成瘤率为100%,在接种2~15 d移植瘤稳定而快速增长,移植瘤经剥离后病理切片HE染色观察有大片弥漫性分布的癌细胞,且有典型的病理学不规则核分裂相存在,病理学上诊断为肿瘤组织,免疫组织化学染色后前列腺癌干细胞表面标志物CD133表达水平呈强阳性,表明本实验成功建立了乳鼠移植瘤模型.
综上所述,本实验利用出生2 d乳鼠成功构建了动物移植瘤模型,由于刚出生乳鼠的免疫细胞在个体发育的早期对抗原易形成耐受性,因此易于移植瘤的成活和生长,同时正常的免疫机体环境也模拟了临床上肿瘤发生的微环境.此外,乳鼠移植瘤模型能够体现宿主免疫监控移植瘤这一过程,模拟临床肿瘤发生.且这一模型具有成瘤率高、易于存活、生长条件简单等特点,是一种比较理想的移植瘤动物模型.
参考文献:
[1]ILLERT B,OTTO C,BRAENDLEIN S,et al.Optimization of a metastasizing human gastric cancer model in nude mice[J].Microsurgery,2003,23(5):508-512.
[2]潘海涛,杨述华,刘勇,等.可移植性鼠骨肉瘤肿瘤模型的建立[J].华中医学杂志,2005,29(6):471-472.
[3]谭玉波,林晨,李扬秋.联合免疫缺陷小鼠的发展及其人免疫重建的研究[J].第三军医大学学报,2005,27(13):1415-1417.
[4]齐丽娟,宋雁,王伟,等.用环磷酰胺建立小鼠免疫抑制动物模型[J].卫生研究,2010,39(3):313-315.
[5]范萍,王水,查小明,等.BALC/c小鼠乳腺癌移植模型的研究[J].中华实验外科杂志,2004,21(7):873-875.
[6]韩斌.615小鼠结肠癌肝转移模型的建立[J].医药论坛杂志,2005,26(23):25-27.
[7]BOONMARS T,WU Z,NAGANO I,et al.Expression of apoptosis-related factors in muscles infected with Trichinella spiralis[J].Parasitology,2004,128(3):323-332.
[8]范文平,刘巍,贺争鸣,等.乳鼠作为实验动物模型非实验因素死亡原因探讨及管理对策[J].中国药事,2013,27(4):369-372.
[9]任庆杰,李敏,杨晓岚,等.Cox.A16型手足口病乳鼠动物模型的建立及免疫、病理特征[J].中国兽医学报,2013,33(11):1685-1690.
[10]夏群,陈兰举,陈明武,等.轮状病毒肠道外感染乳鼠模型的建立[J].蚌埠医学院学报,2010,35(1):1-3.
[11]FRIEDENSTEIN A J,GORSKAJA J F,KULAQINA N N.Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J].ExpHematol,1976,4(5):267-274.
[12]李雁,汤钊猷.我国肝癌模型研究的历史和现状[J].中华实验外科杂志,2001,18(5):479-480.
[13]ANDERSON S N,TOWNE D L,BURNS D J,et al.A high-throughput soft agar assay for identification of anticancer compound[J].JBiomolScreen,2007,12(7):938-945.
[14]LI L,PRICE J E,FAN D,et al.Correlation of growth capacity of human tumor cells in hard agarose with their in vivo proliferative capacity atspecific metastatic sites[J].JNatlCancerInst,1989,81(18):1406-1412.
[15]HAMBURGER A W,SALMON S E.Primary bioassay of human tumor stem cells[J].Science,1977,197(4302):461-463.
[16]COLLINS A T,BERRY P A,HUDE C,et al.Prospective identification of tumorigenic prostate cancer stem cell[J].CancerRes,2005,65(23):10946-10951.
[17]俞诗源,陈琛.中药复方对麻黄素成瘾小鼠大脑额叶结构的影响[J].西北师范大学学报:自然科学版,2013,49(2):84-89.
[18]陈慧,宁明刚,刘宇,等.沙冬青种子总黄酮对小鼠急性毒性作用研究[J].甘肃农业大学学报,2013,48(3):14-18.
(责任编辑俞诗源)
E-mail:zengjy@nwnu.edu.cn
*通讯联系人,男,研究员,博士.主要研究方向为特异性核酸适配体的筛选和干细胞的分化阻断.
E-mail:lshiqi@126.com
Establishment of the prostate cancer xenograft
model in neonatal mice
ZENG Jia-yu1,ZHANG Hong1,YUAN Hong-xia2,NIU Tong1,LIAO Shi-qi2
(1.College of Life Sciences,Northwest Normal University,Lanzhou 730070,Gansu,China;
2.Laboratory of Molecular Biology,Gansu Academy of Medical Sciences,Lanzhou 730050,Gansu,China)
Abstract:To establishment prostate cancer cell(PC3) xenograft model in neonatal mice,PC3 cell strain is culture in vitro and perform the soft agar assay to screen the PC3 cells for their ability wihch can form colonies in soft agar.After passaged by conventional methods,the cells which in logarithmic growth phase are collect,and then make into single-cell suspension with cell density of 2×107mL-1.0.1 mL single-cell suspension is injected subcutaneously into the cross point of neck and fore limb in 2 d newborn neonatal mice.The growth characteristics of transplanting PC3 in mice are observed and the tumor properties are identified by histopathology and immunohistochemistry in neonatal mice subcutaneous.Results show there is no adverse reactions in neonatal mice after the injection.The mice subcutaneous swelling and solid bean-like pallet can be felt in 1~6 d,the tumor become large and the naked eye can be observed significant oncogenesis in 7~15 d.But there are signs of tumor regression in 16~21 d.Pathological HE staining indicates that the mass of oncogenesis are tumor tissue and immunohistochemical staining shows the tumor tissue expression of CD133 strong positive.
Key words:PC3;soft agar colony formation;neonatal mice xenograft;tumor tissue随着肿瘤起源问题研究的不断深入,肿瘤的治疗实验也开始迅速发展.动物移植瘤模型是肿瘤实验研究中一项非常重要的手段,因此,建立理想的动物移植瘤模型对研究各种癌细胞的生长、转移能力及分子机制调控有极其重要的意义[1].可移植肿瘤动物模型是目前应用最为广泛的肿瘤研究模型[2],常见的移植瘤动物模型有裸鼠移植瘤模型[3]、环磷酰胺(CTX)免疫抑制小鼠模型[4]以及正常BALC/c小鼠[5]模型.有研究显示[6-7],理想的移植瘤动物模型中的实验动物应为免疫功能正常、成瘤后动物有一定成活期的近交系.乳鼠作为一种机体免疫功能尚未发育完全的小鼠,具有在移植瘤初期对抗原易形成耐受性的特点,常被广泛应用于病原体的致病性和毒理学研究,特别在药品监测和相关特殊科研中[8-10],但以乳鼠作为移植瘤模型未见相关报道.因此,本实验拟以出生2 d左右的乳鼠做为移植瘤模型动物,皮下注射PC3细胞构建动物移植瘤模型,旨在为肿瘤的实验研究提供新的模型动物.
中图分类号:R-332
文献标志码:A
文章编号:1001-988Ⅹ(2015)02-0073-05
作者简介:曾家豫(1962—),男,内蒙古乌兰察布人,教授,博士.主要研究方向为分子酶学和酶的固定化.
