亚硝气用于1BP料液的调价
2015-01-17常尚文周贤明李高亮刘金平唐洪彬孟昭凯陈志旭郑卫芳
常尚文,周贤明,何 辉,李高亮,兰 天,刘金平,唐洪彬,孟昭凯,陈志旭,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
亚硝气用于1BP料液的调价
常尚文,周贤明,何 辉,李高亮,兰 天,刘金平,唐洪彬,孟昭凯,陈志旭,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
由1BP料液制备2AF料液的过程中需要氧化去除1BP中还原剂,同时将Pu(Ⅲ)氧化至Pu(Ⅳ)。以气液并流模式在玻璃填料柱中研究了亚硝气对模拟1BP料液中还原剂的氧化情形,考察了亚硝气用量、料液停留时间、HNO3浓度和温度对模拟1BP料液中还原剂氧化率的影响。结果表明:25 ℃时,在羟胺、肼浓度均约为0.08 mol/L,c(HNO3)=1.5 mol/L、ρ0(U(Ⅳ))=1.26 g/L、Pu(Ⅲ)(以Fe(Ⅱ)代替)质量浓度为8.76 g/L的1BP料液中,当N2O4液体为还原剂总量的1.2倍(摩尔比)、停留时间为3 min时,1BP料液中还原剂的氧化率达到99.9%以上,Pu(Ⅲ)的氧化率在99.9%以上。
N2O4;1BP调价;Pu(Ⅲ)氧化;填料柱
目前关于HNO2与U(Ⅳ)、羟胺(HAN)、肼(N2H4)以及HNO2与Pu(Ⅲ)之间的反应已有较详细的研究,并得到了相关的动力学方程。但是关于U(Ⅳ)、羟胺、肼、钚同时存在的1BP料液中,HNO2对还原剂及对Pu(Ⅲ)的氧化性能鲜有文献进行详细研究。为此,本工作拟采用N2O4液体作为HNO2的气源,在玻璃填料柱中考察连续进料情形下模拟1BP料液的氧化情形,考察HNO2对羟胺、肼、U(Ⅳ)、Pu(Ⅲ)氧化的影响因素,为后处理厂中进行连续1BP料液的氧化工段提供基础数据与运行经验。
1 实验部分
1.1 试剂与仪器
N2O4液体为工业化产品,常温下密度为1.44 kg/L,气化温度23 ℃,其它试剂为市售分析纯。
Fe(NO3)2制备方法:将铁粉缓慢加入到含有0.3 mol/L 肼的HNO3溶液中(铁粉与HNO3的摩尔比4∶10),不断搅拌控制温度在30~40 ℃,反应结束后控制pH值在3左右并过滤,即可得到草绿色Fe(NO3)2溶液。
MSP1-C1工业注射泵,保定兰格恒流泵有限公司;LPS202双路稳压稳流电源,北京TRADEX公司;λ950紫外可见分光光度计,美国梅特勒公司。玻璃氧化柱:φ50 mm×800 mm,共6个进(出)料口(带循环水夹套)。填料类型:不锈钢θ环。
1.2 分析方法
羟胺浓度采用邻菲啰林-硫酸高铁铵显色法分析,分析下限为10-6mol/L。肼浓度采用对二甲氨基苯甲醛显色法,检测下限为10-6mol/L。将样品溶液稀释一定倍数,加入NaAc溶液,30%(质量比)对二甲氨基苯磺酸,α萘胺溶液显色15 min,测量样品在525 nm处吸光度值。该法的检测下限为10-7mol/L。
本实验中铀为U(Ⅳ)、U(Ⅵ)共存状态,为了分析N2O4对U(Ⅳ)的氧化效果,在分析微量铀之前进行U(Ⅳ)与U(Ⅵ)的分离:调节待分析样品的c(HNO3)≈1 mol/L,加入与水相等体积的0.5 mol/L TTA/二甲苯溶液,萃取15 min后离心分相保留有机相;再用8 mol/L的HNO3溶液以1∶1的相比反萃有机相5 min,离心分相后保留水相;调节水相的酸度约为2 mol/L左右,以1∶1的相比加入0.5 mol/L的TOPO/二甲苯溶液,实现微量铀与其它干扰核素的分离(将干扰核素还原、络合),然后负载铀的三辛基氧膦(TOPO)经2-(5-Br-2吡啶基偶氮)-5-二乙胺苯酚(Br-PADAP)溶液显色后在575 nm波长下测量其吸光度,依据标准工作曲线计算微量铀浓度。该法分析铀质量浓度的范围为0.001~0.12 g/L。
1.3 实验方法
按照真实1BP料液的组成,即c(HNO3)≈1.5 mol/L、c(HAN)≈0.08 mol/L、c(N2H4)≈0.08 mol/L的条件,采用气液并流的模式研究NOx气体氧化羟胺(HAN)、肼(N2H4)、U(Ⅳ)、Pu(Ⅲ)。其中NOx气体的初始进料为N2O4液体。N2O4液体经注射泵量取准确体积后注入到温度为70 ℃的气化罐中,再通入到氧化柱的底端,与含还原剂的1BP料液发生反应。
2 结果与讨论
2.1 N2O4用量的影响
实验中为了便于控制氧化剂的加入量,采用计量泵将液体N2O4加入反应器。离开储罐经过计量泵后,最终以液体和气体混合(因过程温度高于N2O4沸点)的形式进入反应器。在此过程中,N2O4亦发生分解(方程式(1)与(2))。
(1)
(2)
这些氮氧化物在溶液中会发生反应生成HNO2(方程式(3)—(5)),与羟胺和肼发生氧化还原反应。
(3)
(4)
(5)
目前已有许多学者对HNO2与肼的反应进行了研究,结果表明,HNO2与肼以及羟胺的反应中存在诸多副反应[8]。同时HNO2与肼反应时受反应物配比的影响,反应物摩尔比不同,反应发生的途径及其产物也不同。当HNO2的量小于肼时,主要产物是HN3(方程式(6))。当HNO2的用量超过肼,方程式(6)中生成的HN3会继续与HNO2反应(方程式(7))[9]。
HNO2+N2H4=HN3+2H2O
(6)
HNO2+HN3=N2O+N2+H2O
(7)
在本实验条件下,N2O4生成的HNO2的量超过肼,因此HNO2与肼的反应可表示为总的反应式(8)。
(8)
HNO2与羟胺反应基本不受反应物配比的影响,其化学反应式如式(5)[9]。
(9)
考虑到钚的临界安全问题,在后处理厂中通常使用柱形反应器,故本实验也采用氧化柱。为了保证反应物充分接触,柱中加有不锈钢θ环填料。氧化剂(N2O4、NO2)和模拟料液(羟胺和肼,U(Ⅳ)、Pu(Ⅲ))从氧化柱底部加入,接触发生反应后从柱顶出口流出。停留时间(t)计算如式(10)。
(10)
式中:V有效为氧化柱的有效体积,等于柱体积减去填料体积;Q为氧化剂和模拟料液的总流量。
在停留时间5 min、25 ℃、c(HNO3)≈1.5 mol/L、模拟1BP料液流量167 mL/min条件下考察N2O4和还原剂摩尔比(r)为0.6~1.6时,羟胺和肼的氧化结果列入表1。由表1可知:当r≥0.9时,肼和羟胺的浓度均低于10-5mol/L,氧化率(Y)均大于99.9%,表明N2O4能够消耗掉料液中的还原剂;当r≤0.75时,羟胺被氧化的量要比肼小,这是因为氧化剂不足、肼和羟胺竞争所致。肼、羟胺与亚硝酸的竞争反应中各自的速率方程为公式(11)和(12)。
-dc(N2H4)/dt=
k1c(N2H4)c(HNO2)c(H+)
(11)
在θ=25 ℃、离子强度I=0.5 mol/L的条件下,k1=3.4×104(mol/L)2/min,Ea=36 kJ/mol。
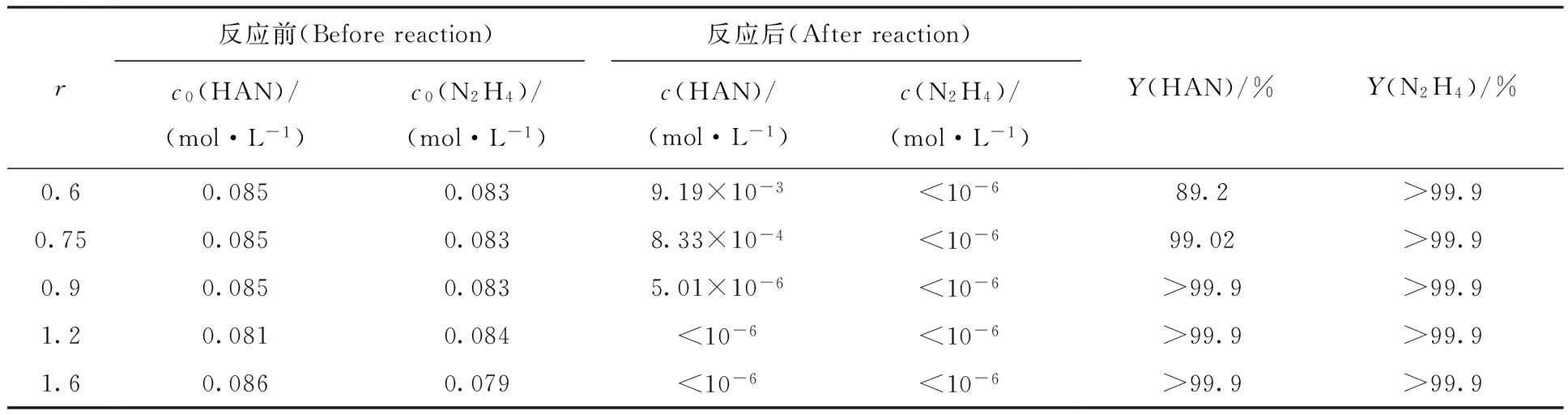
表1 不同N2O4用量对羟胺、肼氧化率的影响Table 1 Influence of N2O4 dosage on the oxidation rate of HAN and N2H4
Tachimori等[8]研究了羟胺与亚硝酸的反应动力学,得到了反应动力学方程如下:
-dc(HAN)/dt=
k2c(HNO2)c(HAN)c(H+)
(12)
当θ=25 ℃时,k2=436 (mol/L)2/min,Ea=48.1 kJ/mol。
若用HNO2的消耗速率表示反应进行,所发生的竞争反应总速率为方程(13):
-dc(HNO2)/dt=
k1c(HNO2)c(N2H4)c(H+)+
k2c(HNO2)c(HAN)c(H+)
(13)
N2O4液体从氧化柱底端进入到氧化柱中,气化后溶解于HNO3溶液形成HNO2。由于N2O4液体的气化及其溶解均需要一定的时间,因此在氧化柱的底部HNO2浓度相对较低。经分析料液在氧化柱中停留时间1 min处的HNO2浓度约为0.02 mol/L,将此数据代入方程(11)得到肼浓度从0.08 mol/L降低到10-5mol/L以下仅需要0.6 s;代入方程(12)得到羟胺浓度从0.08 mol/L降低到10-5mol/L以下约需0.8 min。因此HNO2对肼的氧化速率明显比对羟胺的快。在氧化剂不足时,5 min内,肼的氧化率可达99.9%以上,而羟胺的氧化率低,为90%左右。
2.2 停留时间的影响
研究了料液在玻璃填料柱中不同停留时间时羟胺和肼的氧化特性,结果列入表2。由表2可知:只有在第1 min时羟胺的氧化率低于99.5%,第2 min时,Y(HAN)=99.72%,接近99.9%,可能是分析误差的原因,在其余条件下羟胺和肼的氧化率均在99.9%以上。将式(11)—(13)进行积分,将在不同时间下的总还原剂、肼和羟胺的消耗率示于图1。由图1可知:在约0.6 s时,N2H4的浓度已降低到10-5mol/L以下,此后剩余总还原剂浓度基本等于剩余羟胺浓度;当反应45 s时,HAN的浓度也降至10-5mol/L以下,该数据与表2结果比较接近。当停留时间为3 min时,HAN浓度由0.084 mol/L降低到10-5mol/L量级上,这可能是由于从氧化柱底端通入的N2O4气体并未完全溶解,从而导致HAN未能快速氧化。为了保证羟胺和肼的完全氧化,后续实验中将料液在填料柱中的停留时间控制为3 min。
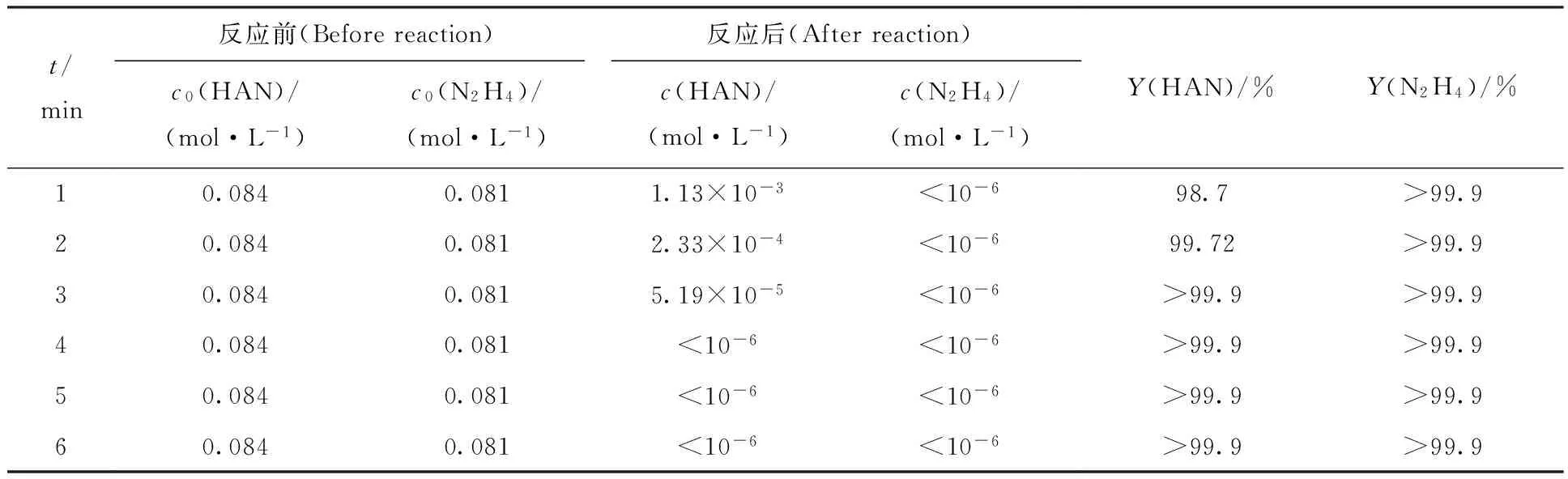
表2 不同停留时间对羟胺、肼氧化率的影响Table 2 Influence of reaction time on the oxidation rate of HAN and N2H4
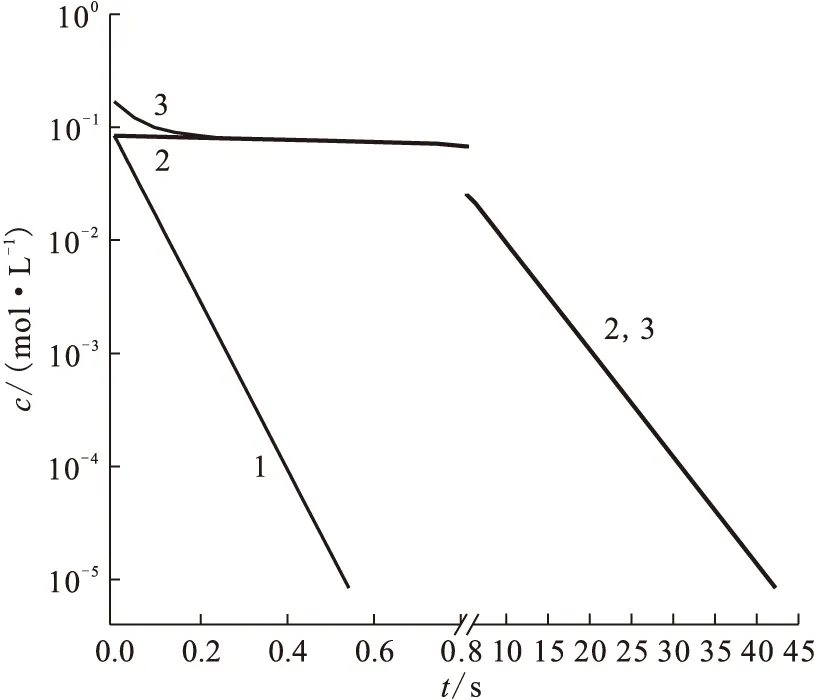
c0(HAN)=0.084 mol/Lc0(N2H4)=0.081 mol/L,c(HNO3)=1.5 mol/Lc(HNO2)=0.02 mol/L,θ=25 ℃1——N2H4,2——HAN,3——HAN+N2H4图1 HAN、N2H4和总还原剂浓度随时间的变化Fig.1 Concentration of HAN and N2H4 at different reaction time
2.3 HNO3浓度的影响
研究了HNO3浓度为0.5~2.0 mol/L时,羟胺和肼的氧化特性,结果列入表3。由表3可知:随着HNO3浓度从0.5 mol/L增大到2.0 mol/L,肼的氧化率均保持在99.9%以上,羟胺的氧化率从94.95%增大到99.9%以上。该结果表明,增大反应体系中HNO3浓度,羟胺和肼的氧化速率加快。同时,从动力学方程式(12)和(13)可以看出,增大体系中HNO3浓度,羟胺和肼的氧化速率均加快。本文的实验结果与此相符。
2.4 温度的影响
文献[5]报道Fe、Pu离子均对HNO2氧化U(Ⅳ)的反应具有催化效果,且其催化效果相当,因此可采用Fe(Ⅱ)代替Pu(Ⅲ)制备1BP料液来模拟其氧化过程。研究了14~25 ℃模拟1BP料液中各还原剂的氧化特性,结果列入表4。由表4可知,在14、25、40 ℃下,出口料液中残留羟胺、肼的浓度均低于分析方法的下限(10-6mol/L),这表明羟胺、肼的氧化率均高于99.9%。但是在14 ℃,U(Ⅳ)和Fe(Ⅱ)在出口料液中的残留质量浓度分别为0.26 g/L和1.79 g/L,氧化率分别为79.4%和16.7%。这表明U(Ⅳ)与Fe(Ⅱ)并未完全氧化。而当温度升高到25 ℃后,U(Ⅳ)和Fe(Ⅱ)氧化率即可达到99.9%以上。

表3 不同HNO3浓度对羟胺、肼氧化率的影响Table 3 Influence of nitric acid concentration on HAN and N2H4 oxidation rate

表4 不同温度对羟胺、肼、U(Ⅳ)氧化率的影响Table 4 Influence of reaction temperature on HAN, N2H4, and U(Ⅳ) oxidation rate
3 结 论
以气液并流模式在玻璃填料柱中研究了亚硝气对模拟1BP料液中还原剂的氧化特性,考察了亚硝气用量、料液停留时间、HNO3浓度和温度对模拟1BP料液中还原剂氧化率的影响。结果表明:当25 ℃时,在羟胺、肼浓度均约为0.08 mol/L,c(HNO3)=1.5 mol/L,ρ0(U(Ⅳ))=1.26 g/L,Pu(Ⅲ)(以Fe(Ⅱ)代替)质量浓度为8.76 g/L的模拟1BP料液中,当N2O4液体摩尔量为还原剂总量的1.2倍、停留时间为3 min时,1BP料液中还原剂的氧化率达到99.9%以上,Pu(Ⅲ)的氧化率在99.9%以上。
[1] 顾忠茂,叶国安.先进核燃料循环体系研究进展[J].原子能科学技术,2002,36(2):160-167.
[2] 叶国安,张虎.核燃料后处理技术发展及其放射化学问题[J].化学进展,2011,23(7):1289-1294.
[3] 于恩江,刘黎明,费洪澄,等.U(Ⅳ)用作Purex过程中Pu(Ⅳ)还原剂的研究[J].核化学与放射化学,1992,14(4):207-214.
[4] 胡晓丹,丁戈龙,刘文彬.钚化学的进展,1967-2000[M].北京:原子能出版社,2008:28-29.
[5] 张绍绮,隗秀芳,叶国安,等.Purex流程以N2O4调节钚价态的研究[J].原子能科学技术,1993,27(3):1360-1371.
[6] 本尼迪克特M,皮格福得T H,利瓦伊H W.核化学工程[M].汪德熙,王方定,祝疆,等译.北京:原子能出版社,1988:387.
[7] 李高亮,何辉,郑卫芳,等.N2O4用于1BP中Pu的无盐调价研究[M]∥中国原子能科学研究院年报.北京:原子能出版社,2008:246-247.
[8] Tachimori S. Numerical simulation for chemical reactions of actinide elements in aqueous nitric acid solution[J]. J Nucl Sci Techonol, 1991, 28(3): 218-227.
[9] Koltunov V S, Marchenko V I. Kinetics of hydrazine oxidation with nitrous acid[J]. Kinetikai Kataliz, 1966, 55(7): 224-229.
Conditioning of 1BP by Nitrous Gases
CHANG Shang-wen, ZHOU Xian-ming, HE Hui, LI Gao-liang, LAN Tian, LIU Jin-ping, TANG Hong-bin, MENG Zhao-kai, CHEN Zhi-xu, ZHENG Wei-fang
China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China
PUREX process was the only commercialized hydrometallurgy reprocessing process, which could recycle the uranium and plutonium in spent nuclear fuel successfully. Pu(Ⅲ) should be oxidized to Pu(Ⅳ) before it was extracted into TBP-diluent in plutonium purification cycle of PUREX process. Meanwhile, the reductants in 1BP feed, such as hydroxamine, hydrazine and U(Ⅳ) should be oxidized. Previous research showed that N2O4was an excellent and salt-free oxidant to the reductants. Therefore, oxidation of the reductants by nitrous gases mentioned above were studied in glass packed column in a gas liquid concurrent flow model. The results show that the dosage of N2O4, the reaction time in column and reaction temperature have significant impact on the oxidation of the reductants. When the residence time of the 1BP feed in glass column is 3 min and the dosage of N2O4is 1.2 times higher than that of the total reductants, more than 99.9% of reductants are oxidized, and the oxidation rate of Pu(Ⅲ) is also higher than 99.9%.
N2O4; conditioning of 1BP; oxidation of Pu(Ⅲ); packed column reactor
2014-10-10;
2015-04-27
常尚文(1969—),男,河北怀安人,高级工程师,核燃料循环与材料专业
O614.353
A
0253-9950(2015)06-0403-05
10.7538/hhx.2015.37.06.0403
