新疆核桃分心木总皂苷的提取纯化工艺研究
2015-01-12朱青梅令狐晨阿依吐伦斯马义新疆医科大学药学院乌鲁木齐830011
朱青梅,令狐晨,阿依吐伦·斯马义(新疆医科大学药学院,乌鲁木齐 830011)
新疆核桃分心木总皂苷的提取纯化工艺研究
朱青梅,令狐晨,阿依吐伦·斯马义*(新疆医科大学药学院,乌鲁木齐 830011)
目的 优选核桃分心木总皂苷的最佳提取纯化工艺。方法 以齐墩果酸为对照品,利用紫外可见分光光度法测定核桃分心木中的总皂苷含量;利用单因素实验结果设计正交实验,考察了乙醇体积分数、提取时间、料液比和提取次数对核桃分心木总皂苷提取率的影响;利用大孔吸附树脂对核桃分心木总皂苷进行纯化工艺研究。结果 最佳提取工艺为:加25倍量体积分数80%乙醇,80℃回流提取2次,每次2h;最佳纯化工艺为:采用D101大孔吸附树脂,最大上样量为180mL,水洗脱量8BV,洗脱剂体积分数50%乙醇,洗脱体积7BV。结论 该法简易可行,效果较佳。
核桃分心木;总皂苷;提取工艺;大孔吸附树脂;纯化工艺
新疆核桃分心木(Diaphragma juglandis Fructus)为胡桃科植物胡桃果核的干燥木质隔膜,俗称核桃隔膜;体轻,多破碎成半圆形片状或不规则片状,气微,味微涩[1];维吾尔医用于治疗肾虚,其疗效显著[23],也有用于治疗遗精、滑精、遗尿、尿血、带下、泻痢等症[4]。现代研究表明,核桃隔膜具有抗氧化、抗菌、抗衰老、调节免疫等多种药理作用[5]。目前,国内外关于核桃属植物及核桃楸各药用部位的研究较多,
但对核桃分心木总皂苷类成分的研究,迄今国内尚未见相关文献报道。作者采用了紫外可见分光光度法,以齐墩果酸为对照品,确定了核桃分心木总皂苷的最佳提取方法以及大孔吸附树脂纯化方法,从而为研究核桃分心木总皂苷的药理作用奠定基础。
1 仪器与试药
1.1 仪器 UV2250型紫外可见分光光度计UV2250(日本岛津);EYELAN-1001型旋转蒸发仪(上海爱朗仪器有限公司);DK-S24型电热恒温水浴锅、DHG-9053A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);SK3200H型超声清洗仪(上海汉克科学仪器有限公司);ABl04-N型多功能电子天平(梅特勒-托利多仪器上海有限公司);FW135型粉碎机(北京市永光明医疗仪器厂);2HWY-2102C型恒温培养振荡器(上海智城分析仪器有限公司)。
1.2 试药 齐墩果酸对照品(上海源叶生物科技有限公司,质量分数≥98%,批号YY20110428);核桃分心木(购于新疆和田地区,由新疆医科大学药学院帕丽达·阿布利孜教授鉴定为胡桃科植物胡桃果核的干燥木质隔膜;D101型大孔吸附树脂、X-5型大孔吸附树脂和AB-8型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);高氯酸、冰醋酸、甲醇等均为分析纯试剂。
2 方法与结果
2.1 线性关系的考察
2.1.1 对照品溶液的制备 精密称取齐墩果酸对照品5.0mg,置于50mL量瓶中,加甲醇溶解并定容至刻度,摇匀,即得到质量浓度为0.1mg·mL-1的对照品溶液,备用。
2.1.2 标准曲线的绘制 精密量取齐墩果酸对照品溶液0.3,0.4,0.5,0.6,0.8,1.0和1.3mL,置于10mL具塞试管中,挥干甲醇,依次加入新配制的50g·L-1香草醛-冰醋酸溶液0.2mL,高氯酸0.8mL,密封,摇匀,70℃水浴15min后,冰水浴中迅速冷却,加入冰醋酸5mL,摇匀,静置15min,待测。将对照品溶液在200~700nm范围内扫描,结果在563nm处有较大吸收,故将563nm作为最佳吸收波长。以吸光度(A)为纵坐标、质量浓度(C)为横坐标,得到齐墩果酸标准曲线:A=39.221C-0.026 4(r=0.999 2),表明齐墩果酸质量浓度在0.005 0~0.021 67g·L-1范围内与吸光度呈良好线性关系[6]。
2.2 单因素考察
2.2.1 提取温度 恒定料液比1∶20,提取1次,提取时间1h,提取溶剂乙醇,分别考察提取温度40,50,60,70,80和85℃对总皂苷提取率的影响,结果总皂苷的提取率分别为1.05%,1.15%,1.44%,1.37%,1.57%和1.49%,故选择80℃。
2.2.2 乙醇体积分数 恒定料液比1∶20,提取1次,提取时间1h,提取温度80℃,分别选取体积分数为40%,50%,60%,70%,80%和95%的乙醇溶液进行提取,结果总皂苷的提取率分别为0.68%,1.09%,1.10%,1.47%,2.05%和1.91%,故选择80%的乙醇。
2.2.3 提取时间 恒定料液比1∶20,提取1次,提取温度80℃,提取溶剂乙醇,分别考察提取0.5,1,1.5,2,2.5和3h对总皂苷提取率的影响,结果总皂苷的提取率分别为1.5%,1.58%,1.57%,1.79%,1.53%和1.45%,故每次提取2h。
2.2.4 固液比 恒定提取时间1h,提取1次,提取温度80℃,提取溶剂乙醇,分别考察料液比1∶8,1∶10,1∶14,1∶18,1∶20,1∶25和1∶30对总皂苷提取率的影响,结果总皂苷的提取率分别为0.93%,1.12%,1.18%,1.53%,1.57%,1.65%和1.58%,故选择固液比1∶25。
2.2.5 提取次数 恒定料液比1∶20,提取时间1h,提取温度80℃,提取溶剂乙醇,分别考察提取1,2和3次对总皂苷提取率的影响,结果总皂苷的提取率分别为1.48%,1.92%和2.0%,故选择提取3次。
2.3 正交实验 由单因素考察结果,选择影响核桃分心木总皂苷提取的4个主要因素分别为乙醇体积分数、提取时间、固液比和提取次数,以分心木总皂苷提取率为考察指标设计正交实验。分别称取核桃分心木粉末5.0g,按表1完成正交实验,均在温度80℃下提取。各因素水平见表1,正交实验结果见表2,方差分析结果见表3。

表1 正交实验因素水平Tab.1 Levels and factors of orthogonal test
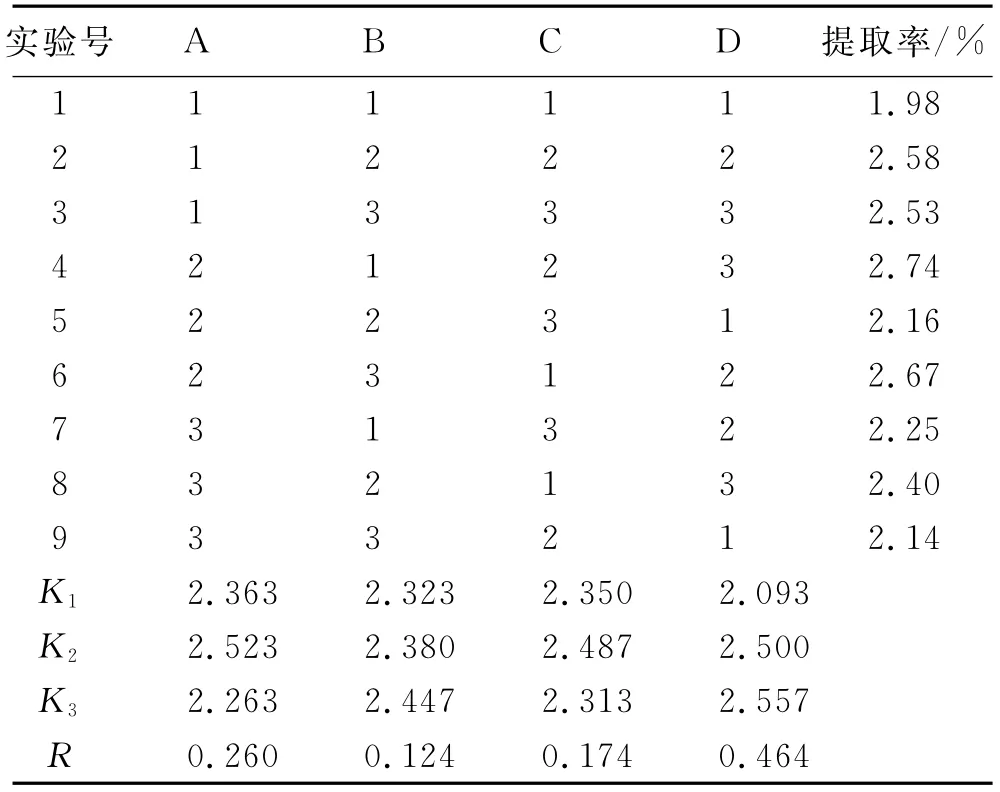
表2 正交实验结果Tab.2 Results of orthogonal test
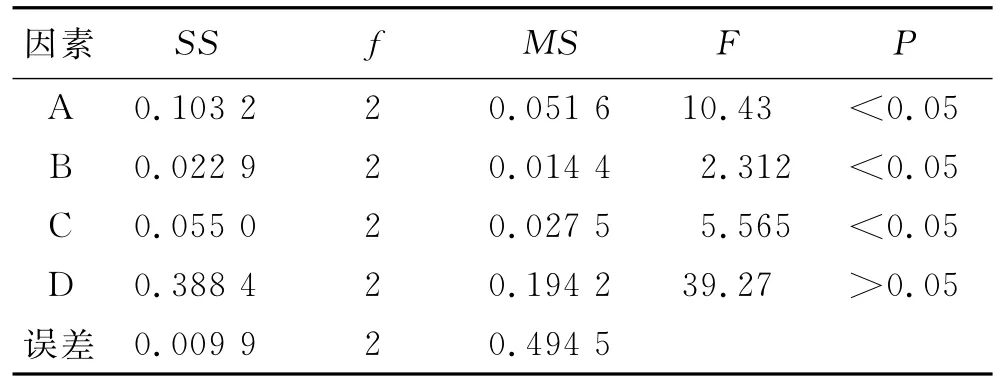
表3 正交实验方差分析Tab.3 Variance analysis of orthogonal test
由表2分析可知,新疆核桃分心木的最佳提取工艺是A2B3C2D3,又由表3可知,4个因素的重要程度为:D>A>C>B,即提取次数>乙醇体积分数>固液比>提取温度,且D为主要影响因素,A为重要影响因素。由于提取2次和提取3次的总皂苷提取率相差不大,为节约试剂和缩短实验时间,选择提取2次。综合考虑后选择A2B3C2D2作为最佳提取工艺,即提取2次,每次2h,乙醇体积分数为80%,固液比为1∶25。
2.4 验证实验 称取粉碎后的核桃分心木5.0g,平行3份。按照正交实验得到的最佳提取工艺进行提取,即25倍量的80%乙醇提取2次,每次2h,分别测定总皂苷的提取率分别为2.67%,2.60%和2.69%,表明优选的工艺条件稳定可行。
2.5 核桃分心木总皂苷的纯化[7]
2.5.1 预处理大孔吸附树脂 分别取适量D101、AB-8和X-5型大孔吸附树脂在乙醇中浸泡过夜,湿法装柱后用乙醇冲洗至流出液与水混合(1∶5),不呈现白色浑浊为止,再用蒸馏水冲洗至流出液无醇味,备用。
2.5.2 制备样品溶液 按正交实验结果得到的最佳提取工艺提取新疆核桃分心木总皂苷,即取新疆核桃分心木粉末50.0g,加25倍量体积分数80%的乙醇提取2次,每次2h,将提取液浓缩至无醇味后,加蒸馏水溶解,过滤,滤液定容至1 000mL,即得样品溶液(0.05g·mL-1)。
2.5.3 大孔吸附树脂型号的筛选 静态吸附分别精密称定2.5.1项下备用的3种大孔吸附树脂各1g,分别加入2.4.2项下制备好的样品溶液30mL。封口后放于恒温培养振荡器中(25℃,100r·min-1),24h后取出抽滤。按照2.1.2项方法测定后计算总皂苷的质量浓度。静态吸附量=[(初始质量浓度-吸附后质量浓度)×吸附液体积]/树脂体积。结果计算得D101、AB-8和X-5型3种大孔吸附树脂的静态吸附量分别为26.93,26.98和26.24mg·g-1,静态吸附率分别为84.60%,84.76%和82.44%。可知D101型大孔吸附树脂的静态吸附能力强于另外2种。
将静态吸附项中抽滤后的大孔吸附树脂分别转移到锥形瓶中,加入30mL体积分数70%的乙醇。封口放置于恒温培养振荡器中(25℃,100r·min-1),24h后取出抽滤。按照2.1.2项方法测定并计算总皂苷的质量浓度。解吸率=(洗脱液质量浓度×洗脱液体积)/静态吸附量×100%。结果,D101、AB-8和X-5型3种大孔吸附树脂的解吸率分别为99.04,96.89和90.12%。可知D101型大孔吸附树脂的解吸率最高,综合整个静态实验,D101型大孔吸附树脂吸附率和解吸率均最高,故选择D101型大孔吸附树脂进行动态实验。
2.5.4 泄露曲线考察 准确称取处理好的D101型树脂(相当于干树脂4g),湿法装柱,取上样液300mL,以流速1mL·min-1通过树脂柱,每30mL接收一次流出液,并测定每份流出液中的总皂苷质量浓度,以流份份数与流出液中总皂苷质量浓度做图,结果见图1。在第6个流份开始泄漏,因此确定上样量为180mL。

图1 D101型大孔吸附树脂吸附总皂苷的动态曲线Fig.1 Dynamic adsorption curve of total saponins on D101 macroporous resin
2.5.5 水洗脱量考察 准确称取处理好的D101型树脂(相当于干树脂4g),湿法装柱,取上样液180mL,以流速1mL·min-1通过树脂柱,用蒸馏水冲洗,每个流分为1BV,分别进行Molish反应,观察反应的现象。结果蒸馏水平衡至8BV时,流出液变澄清,且Molish反应呈阴性,故选择用8BV蒸馏水冲洗树脂柱。
2.5.6 洗脱溶剂体积分数考察 准确称取处理好的D101型树脂(相当于干树脂4g),湿法装柱,取上样液180mL,以流速1mL·min-1通过树脂柱,用8BV蒸馏水平衡树脂后依次用体积分数10%,30%,50%和70%乙醇洗脱,洗脱至流出液变澄清,分别收集流出液,测定体积分数10%,30%,50%和70%乙醇流出液分心木总皂苷含量分别为48.3,54.9,41.7和4.95mg,洗脱率分别为26.8,30.5,23.1和2.75%,体积分数10%,30%和50%洗脱下来的核桃分心木总皂苷的总洗脱率为80.4%,故选择体积分数50%的乙醇。
2.5.7 洗脱溶剂用量考察 准确称取处理好的D101型树脂(相当于干树脂4g),湿法装柱,取上样液180mL,以流速1mL·min-1通过树脂柱,用8BV蒸馏水平衡树脂后用体积分数50%乙醇洗脱,每1BV柱体积收集1份,洗脱至流出液变澄清,确定洗脱溶剂用。第7份开始流出液变澄清,故洗脱剂用量为7BV。
3 讨论
本实验对核桃分心木总皂苷的提取工艺进行了研究,采用乙醇回流法提取新疆核桃粉心木,并利用紫外可见光分光光度法在563nm处测定核桃分心木总皂苷的含量,通过正交实验确定了各因素对总皂苷提取率影响程度为:提取次数>乙醇体积分数>固液比>提取时间,最佳提取工艺为加25倍量体积分数80%的乙醇提取2次,每次2h。
本实验对核桃分心木总皂苷的纯化工艺进行了研究,研究表明D101型大孔吸附树脂对核桃分心木皂苷具有良好的吸附性能,具有较大的吸附量,且易吸附、易解吸,最大上样量为180mL,水洗脱量8BV,洗脱剂体积分数50%乙醇,洗脱体积7BV。实验中确定的总皂苷提取纯化工艺可为进一步提取纯化分心木总皂苷提供借鉴,从而为进一步开发分心木有效部位奠定基础。
[1]茹克娅·沙德克.维吾尔医常用药材学(维吾尔文):下册[M].乌鲁木齐:新疆科技卫生出版社,1993:323.
[2]阿巴拜克热·热合曼.维吾尔医常用生药(维吾尔文)[M].乌鲁木齐:新疆人民卫生出版社,2004:772.
[3]穆塔力甫·艾力,阿吉·艾米提.维吾尔医常用草药(维吾尔文)[M].乌鲁木齐:新疆人民卫生出版社,2005:695.
[4]全国中草药汇编编写组.中草药大辞典:上册[M].北京:人民卫生出版社,1975:667.
[5]高莉,王艳梅,帕提古丽·马合木提.核桃分心木粗提物抑菌活性的研究[J].食品科学,2008,29(11):69-71.
[6]宋艺君,王昌利,郭涛.正交实验法优选穿山龙总皂苷的提取工艺[J].西北药学杂志,2010,25(2):101-102.
[7]刘霞,岐琳,李延,等.大孔吸附树脂纯化鹿药总皂苷和总黄酮的研究[J].西北药学杂志,2012,27(6):516-519.
Study on extraction and purification process for total saponins from Xinjiang Diaphragma juglandis Fructus
ZHU Qingmei,LINGHU Chen,Aytulun SZMAYIL*(College of Pharmacy,Xinjiang Medical University,Urumqi 830011,China)
Objective To optimize the extraction and purification process of total saponins from Diaphragma juglandis Fructus.Methods Taking oleanolic acid as a reference substance,the content of total saponins was determined by UV.Effect of extraction time,solid-liquid ratio,ethanol concentration and extraction times on the yield of total saponins was investigated by single factor test and orthogonal test.The total saponins were purified by macroreticular resin.Results The optimized extraction conditions were as follows:the powder of Diaphragma juglandis Fructus was subjected to reflux extraction for 2times with 80%ethanol at 80℃,each extraction lasting for 2h.For each extraction,the solid-liquid ratio was 25.The optimized purification conditions were as follows:D101macroreticular resin,impurities removed with 8folds of water,eluted with 7folds of 50%ethanol.Conclusion The process was simple and feasible.The result was satisfactory.
Diaphragma juglandis Fructus;total saponins;extraction technology;macroreticular resin;purification technology
10.3969/j.issn.1004-2407.2015.01.006
R282
A
1004-2407(2015)01-0020-04
2014-07-29)
乌鲁木齐市科学技术计划项目(编号:Y121310009)
朱青梅,女,在读硕士研究生
*通信作者:阿依吐伦·斯马义,女,教授,硕士生导师
