锰胁迫对甘草生理和生长特性的影响
2015-01-12马生军王文全杜润清侯俊玲北京中医药大学中药学院北京100102新疆农业大学食品科学与药学学院乌鲁木齐83002中国医学科学院药用植物研究所北京100193中药材规范化生产教育部工程研究中心北京
马生军,王文全,杜润清,侯俊玲(1.北京中医药大学中药学院,北京 100102;2.新疆农业大学食品科学与药学学院,乌鲁木齐 83002;3.中国医学科学院药用植物研究所,北京 100193;4.中药材规范化生产教育部工程研究中心,北京
100102;5.新疆农业科学院轮台果树资源圃,轮台 841600)
锰胁迫对甘草生理和生长特性的影响
马生军1,2,王文全1,3,4*,杜润清5,侯俊玲1,4(1.北京中医药大学中药学院,北京 100102;2.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;3.中国医学科学院药用植物研究所,北京 100193;4.中药材规范化生产教育部工程研究中心,北京
100102;5.新疆农业科学院轮台果树资源圃,轮台 841600)
目的 通过对甘草进行不同质量浓度锰处理的研究,探讨锰胁迫对甘草植株生理和生长特性的影响。方法 以1年生甘草移栽苗为实验材料,采用盆栽蛭石的方法,共设置5个锰质量浓度水平,分别为CK(0),1.81,18.1,36.2和54.3mg·L-1,在测定甘草叶片色素含量、光合指标及各抗氧化酶活性的同时,对甘草生长指标和地上、地下生物量进行测定。结果 甘草各项生理和生长指标随着锰处理质量浓度的增加均呈现先升高后下降的趋势,且适当质量浓度的锰处理与CK和54.3mg·L-1处理之间比较差异均显著(P<0.05)。在质量浓度18.1mg·L-1处理时,甘草叶片各色素含量和净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)达到最大值,与54.3mg·L-1处理之间比较差异显著(P<0.05)。超氧化物歧化酶(SOD)和过氧化物酶(POD)活性在质量浓度18.1mg·L-1时达到最大值,与54.3mg·L-1处理之间比较差异显著(P<0.05),而过氧化氢酶(CAT)活性在质量浓度36.2mg·L-1处理时达到最大值,随后三者活性均开始下降。同时,甘草株高、地茎和芦头直径在质量浓度36.2mg·L-1处理,地上和地下部分干质量在18.1mg·L-1处理时达最大值后,均开始下降,且与54.3mg·L-1处理之间比较差异显著(P<0.05)。结论 适当质量浓度的锰处理能够显著提高甘草的各项生理和生长指标,但过高质量浓度的锰则会对甘草生长产生胁迫,抑制其光合产物的积累。
甘草;锰;光合特性;抗氧化酶活性
中药甘草是最常用的大宗中药材,《中国药典》(2010年版)规定其正品来源为甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflataBat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎[1]。甘草具有补脾益气、祛痰止咳、调和诸药等功效,素有“十方九草”之说。近几年甘草作为药材、食物及烟草添加品的市场需求量猛增,野生资源的过度采挖导致甘草药材产量和质量急剧下降,而栽培甘草产量和质量均不稳定,尤其是甘草酸含量普遍达不到药典规定要求。最新的研究发现,通过对甘草根部追施一定质量浓度的锰(Mn)可以有效提高甘草产量,在促进甘草生长的同时,明显提高甘草酸的含量[2]。
作为植物生长发育必需的微量元素之一,锰(Mn)一方面参与光合作用中叶片内叶绿体的结构建成,另一方面又是多种酶的重要氧化还原剂和活化剂,在植物体内发挥着非常重要的生理作用[3-4]。在适宜范围内,增施锰肥可使植物的净光合速率增大、生长速度加快[5]。但过量的锰则会抑制植物对其他元素的均衡吸收,对植株的生长产生胁迫[6]。但目前关于Mn胁迫对甘草生理和生长特性的研究笔者未见报道。因此,本实验通过研究不同质量浓度的锰处理对甘草植株生长影响的同时,对其光合生理及抗氧化酶活性也进行了研究,以期为提高人工栽培甘草药材的产量和质量奠定理论基础。
1 仪器与试药
1.1 仪器 LI-6400便携式光合仪(美国LI-COR公司);SP-754PC紫外可见分光光度计(上海光谱仪器有限公司);BS110S万分之一电子分析天平(德国Sartorius公司);电热恒温水浴锅(上海精密仪器有限公司);Centrifuge(MICRO 17TR)离心机(韩国Hanil公司);Mixer vortex(Voltex-Genie2)漩涡混合器(美国SI公司)。
1.2 试药 甘草种苗(采自内蒙古自治区赤峰市颈复康中药材种植基地);甲硫氨酸、乙二胺四乙酸(EDTA-Na2)、氮蓝四唑、核黄素、愈创木酚、磷酸氢二钠、磷酸二氢钠、双氧水等均为国产分析纯。
2 方法
2.1 样品的处理 2013年4月下旬选取大小基本一致的甘草种苗移栽于北京中医药大学药用植物园花盆内(盆高、盆口和盆底直径分别为35,35和25cm),栽培基质为蛭石∶珍珠岩∶河沙=5∶1∶1,每盆20株,将栽有甘草种苗的花盆埋入土中,尽可能保持根际生长环境的稳定。实验初期向盆中浇灌完全营养液,待一个月植株生长正常后,再进行不同质量浓度的锰处理实验。营养液的选择为能够提供植物基本生长需求且国际通用的Hoagland营养液,每周向花盆基质中定量浇灌,并根据天气情况随时补充水分。实验采用完全随机区组,锰处理质量浓度分别为CK(0),1.81,18.1,36.2和54.3mg·L-15个锰质量浓度,其中1.81mg·L-1为Hoagland营养液中锰离子质量浓度,处理一定时间后取样。每个处理重复4次。
2.2 测定指标及方法
2.2.1 生理生化指标测定 叶绿素含量测定采用丙酮浸提比色法[7]。采用NBT法测定超氧化物歧化酶(SOD)活性,愈创木酚法测定过氧化物酶(POD)活性,紫外吸收法测定过氧化氢酶(CAT)活性[8]。
2.2.2 生长指标测定 利用钢卷尺对不同质量浓度锰处理的甘草株高进行测量,芦头直径和地茎则通过游标卡尺测量,并将其冲洗干净,于55℃烘至恒质量,分别测定地上部分(茎叶)和地下部分(根及根茎)干质量。
2.3 数据分析 利用Excell和SPSS软件进行数据的统计与分析,并绘制图。
3 结果与分析
3.1 不同质量浓度的锰对甘草色素含量的影响 见图1。叶绿素直接参与光能的吸收、传递、分配和转化等过程,是植物吸收光能进行光合作用的重要物质基础,其含量的高低直接反映植物的光合能力、代谢水平及营养条件等[9]。而类胡萝卜素在叶绿素的能量猝灭中起重要作用,担负着植物光合作用辅助色素的功能[10]。
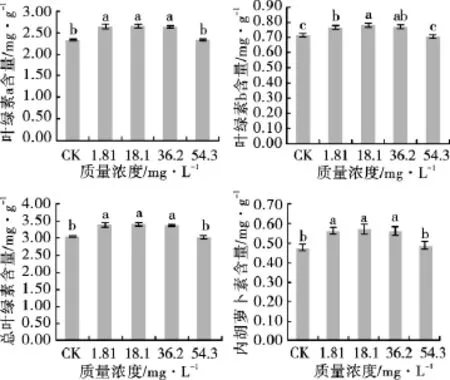
图1 不同质量浓度的锰处理对甘草色素含量的影响Fig.1 Effect of Mn treatment at different concentration on pigment content of G.uralensis
由图1可以看出,随着锰处理质量浓度的增加,甘草叶片中各色素含量的变化均呈现先升高后下降的趋势。在锰质量浓度为18.1mg·L-1时均达到最大值,而后开始下降,在54.3mg·L-1时与对照处理差异不显著,但与其他质量浓度处理差异显著(P<0.05)。锰处理质量浓度为54.3mg·L-1时与对照不施锰时对甘草叶片中各色素含量的影响基本相同,比锰处理质量浓度为18.1mg·L-1时叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别下降了11.28%,10.13%,11.34%和15.52%,明显低于其他各处理。说明适度质量浓度的锰可以显著提高甘草色素含量,但超过一定质量浓度后会对其色素的形成产生胁迫,且随着处理质量浓度的增加,其色素含量的下降幅度亦显著增大(P<0.05)。
3.2 不同质量浓度的锰对甘草光合指标的影响 见图2。较高的光合性能是叶片营养生长旺盛的重要原因之一,有利于光合产物的形成和次生代谢产物的积累[11]。
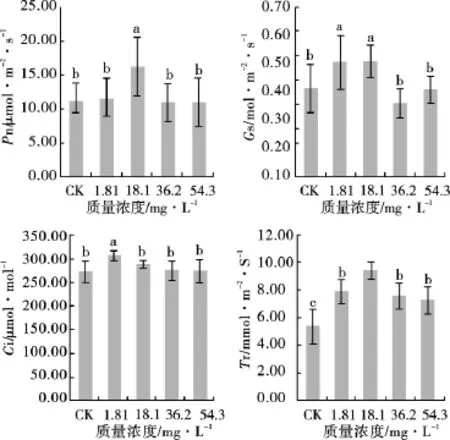
图2 不同质量浓度的锰处理对甘草光合指标的影响Fig.2 Effect of Mn treatment at different concentration on photosynthesis indicators of G.uralensis
物种光合能力的大小可以通过净光合速率(Pn)得以反映。由图2可知,18.1mg·L-1处理下的Pn最高,为16.29μmol·m-2·s-1,显著高于对照和其他处理(P<0.05)。随着锰处理质量浓度的增加,Pn值开始下降,当质量浓度为54.3mg·L-1时,Pn最小,为11.00μmol·m-2·s-1。气孔导度(Gs)和蒸腾速率(Tr)是反映植物气孔行为最为重要的生理指标,受各种因素的影响。从图2可以看出,各处理间均在质量浓度为18.1mg·L-1时,Gs和Tr达到最大值,分别为0.48和9.46mmol·m-2·s-1,随后开始有不同幅度的下降。其中质量浓度36.2和54.3mg·L-1处理时,Gs值与CK处理相比略有下降,但差异不显著。质量浓度36.2与54.3mg·L-1处理之间Tr值差异亦不显著,说明随着锰处理质量浓度的增加,对甘草叶片的生长产生了一定的胁迫,其Gs和Tr值不再增加。外界CO2进入植物叶细胞的浓度由叶片内胞间CO2浓度(Ci)来反映。从图2可知,1.81mg·L-1处理的Ci值最高(307.11μmol·mol-1),显著高于其他质量浓度处理(P<0.05),随后Ci值开始明显下降,分别比1.81mg·L-1处理下降了6.08%,10.31%和10.67%,结果表明随着锰处理质量浓度的增加,明显抑制了大气中CO2进入甘草叶片中的浓度。
3.3 不同质量浓度的锰对甘草抗氧化酶活性的影响 见图3。SOD、POD和CAT是植物体内清除自由基的3种重要保护酶,它们的协同作用能有效清除OH-、H2O2等自由基,防止其对细胞膜的迫害,从而维持植物的正常生长发育[12-13]。

图3 不同质量浓度的锰处理对甘草抗氧化酶活性的影响Fig.3 Effect of Mn treatment at different concentration on antioxidase activities of G.uralensis
由图3可以看出,SOD、POD和CAT 3种抗氧化酶活性随着锰处理质量浓度的增加,先升高后下降,且不施锰对照处理下3种酶活性均显著低于其他各处理组(P<0.05),说明施锰对改善甘草叶片的抗氧化酶活性有一定的作用,但当锰处理质量浓度增加到一定程度时,这3种酶的活性又开始下降,明显低于其最佳处理质量浓度时的酶活性值,表明过量的锰对甘草叶片抗氧化酶活性具有一定的胁迫效应。其中SOD和POD受这种胁迫效应影响最大,锰处理质量浓度为54.3mg·L-1时与最佳处理质量浓度(18.1mg·L-1)时的酶活性值差异显著(P<0.05),分别比其下降了18.73%和25.38%。
3.4 不同质量浓度的锰对甘草生长指标的影响 见图4。由图4可以看出,随着锰处理质量浓度的增加,甘草的株高、地径和芦头直径均逐渐增加,在36.2mg·L-1时达到最大值,分别为62.52,2.09和7.88mm,但随后均表现为下降趋势。锰处理质量浓度为54.3mg·L-1时比36.2mg·L-1时的株高和芦头直径差异显著(P<0.05),分别下降了15.24%和7.11%,但与对照不施锰相比,差异不显著。由此说明,甘草植株生长的促进可以通过追施一定质量浓度的锰达到,但当锰的质量浓度超过甘草根系的吸收阈值范围就会产生不利影响。
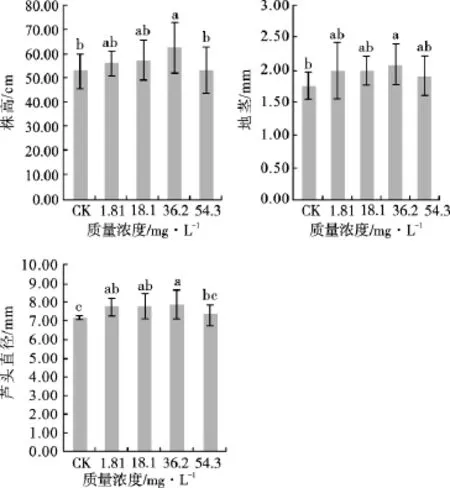
图4 不同质量浓度的锰处理对甘草生长指标的影响Fig.4 Effect of Mn treatment at different concentration on growth indicators of G.uralensis
3.5 不同质量浓度的锰对甘草植株生物量的影响见图5。植物光合作用能力的强弱直接影响各部位产量的多少,而锰是植物生长所必须的微量元素,它直接参与植物光合作用中电子传递系统的氧化还原过程及PSII系统中水的光解[14]。
从图5可以看出,甘草植株地上和地下干质量均在锰质量浓度为18.1mg·L-1时达到最大值,随后开始下降,与36.2mg·L-1处理时差异不显著,但与质量浓度54.3mg·L-1处理时差异显著(P<0.05)。锰质量浓度54.3mg·L-1处理时地上和地下干质量与不施锰的对照处理差异不显著,由此说明缺锰与过量的锰均会影响植物的光合作用,导致植物生长受到抑制,使植株的生物量下降,进而影响甘草药材的产量。

图5 不同质量浓度的锰处理对甘草植株生物量的影响Fig.5 Effect of Mn treatment at different concentration on different parts biomass of G.uralensis
4 讨论
4.1 锰胁迫对甘草光合特性的影响 光合作用是植物的重要生理特性,植物在光合作用过程中不仅为同化CO2提供能量和还原力,同时还裂解水释放O2。放氧反应主要由光系统II(PSII)氧化侧的4个锰原子组成的锰簇催化而完成,因此,锰簇在光合放氧过程中起着至关重要的作用[5]。Mn2+与植物的光合作用关系密切,具有维持叶绿体膜正常结构的功能[15]。而植物叶绿体内参与光合作用的重要色素则是叶绿素,因此,其含量的高低直接关系到甘草药材产量和品质[16]。过量的Mn2+能够抑制Fe2+和Mg2+等元素的吸收及活性,并可导致叶绿体结构破坏、叶绿素合成下降和光合速率降低[3]。李广会等对板栗的研究发现,适当质量浓度的锰浸种能显著增加板栗幼苗叶绿素含量,但当质量浓度超过一定范围时其叶绿素含量大幅下降[15]。在对甘草植株不同质量浓度的锰处理过程中发现,随着锰处理质量浓度的增加,其色素含量和各光合指标均呈现出先升高后下降的趋势,除蒸腾速率(Tr)外,其他各指标在锰处理质量浓度为54.3mg·L-1时与不施锰的对照差异均不显著(P<0.05),说明过量施锰与不施锰效果相似,甚至个别指标还略低于对照,这也是锰毒胁迫最常见的症状之一。产生这种结果的原因,可能是由于高锰胁迫抑制了甘草植株对必需元素Fe2+、Mg2+、Ca2+的吸收与活性,破坏了叶绿体的结构,使叶绿素的合成减少,影响了叶片对原初光能的捕获与传递能力,阻碍了PSII反应的持续发生,并最终导致甘草叶片光合作用效率的下降。
4.2 锰胁迫对甘草抗氧化酶活性的影响 在生长发育过程中由于受到各种不良环境的胁迫,植物细胞会产生大量的活性氧。作为生物体内一类重要的活性氧清除酶,SOD、POD、CAT酶在减轻脂质过氧化作用、膜伤害和消除超氧化物自由基方面发挥着重要作用[1718]。植物细胞膜的稳定性与其耐受能力息息相关,不同的植物对锰的耐受能力不同。关于锰毒对植物抗氧化系统的研究已有不少报道[19]。对甘草植物体内SOD、POD和CAT 3种关键保护酶活性的研究发现,随着锰处理质量浓度的升高,SOD、POD和CAT的活性都呈现出先升高后下降的趋势,尤其是SOD和POD受这种胁迫效应影响最大,在高锰处理质量浓度(54.3mg·L-1)时其下降幅度明显(P<0.05)。这一结果说明,适当质量浓度的锰处理能够清除甘草叶片细胞中产生的活性氧,减少细胞的膜脂过氧化,从而保护植物免受不利环境条件的伤害,但当锰处理质量浓度超过甘草根吸收运转的临界阈值时便会对其抗氧化酶的活性产生不利的影响。原因可能是高锰诱导下Mn2+被光激活的叶绿素氧化为Mn3+,氧化还原电位升高,活性氧自由基(O-2、H2O2和·OH等)大量累积,从而对甘草叶片的生长产生氧化胁迫,最终导致随着锰处理质量浓度的增加其活性反而显著下降。
4.3 锰胁迫对甘草生长特性的影响 在逆境胁迫下,植物的形态与生理可产生一系列保护性代偿反应,以适应渐变或骤变的环境[20]。但当胁迫强度超越植物的适应能力时,损伤便随之发生[21]。尚伟伟等对苋科1年生耐锰植物青葙(Celosia argentea Linn.)的锰胁迫实验很好地说明了这一点[16]。本研究发现,适宜质量浓度的锰处理与不施锰的对照相比,可以显著提高甘草的各生长指标和地上、地下生物量(P<0.05)。但较高质量浓度的锰处理对其均有不同程度地抑制作用,尤其是株高、芦头直径和地上干质量的下降幅度最为明显,与最佳锰处理相比差异显著(P<0.05),这可能与甘草叶片中叶绿素含量下降、光合作用不能正常进行有关。由于光合速率的下降导致碳水化合物形成速率减慢,最终表现为生物体生物量的减少。因此,甘草叶片进行光合作用能力的强弱直接决定了其药材的产量。此外,锰胁迫条件下甘草叶片中细胞膜遭到破坏,矿质元素的吸收和运输受抑制等因素也可能引起甘草植株生物量的下降。
[1]国家药典委员会.中国药典2010年版[S].二部.北京:中国医药科技出版社,2010:80-81.
[2]Wang D,Wan C Y,Wang W Q,et al.Effects of manganese deficiency on growth and contents of active constituents of Glycyrrhiza uralensis Fisch[J].Commun Soil Sci Plan,2012,43(5):2218-2227.
[3]张玉秀,李林峰,柴团耀,等.锰对植物毒害及植物耐锰机理研究进展[J].植物学报,2010,45(4):506-520.
[4]郑鹤龄.微量元素营养诊断[M].天津:天津科技翻译出版公司,2010:12-13.
[5]倪穗,俞慧娜,刘鹏,等.大豆幼苗光合特性对锰营养的响应[J].植物营养与肥料学报,2007,13(6):1135-1142.
[6]王娟,章爱群,邱满平,等.铁、锰胁迫对凤眼莲养分吸收的影响[J].湖北农业科学,2011,50(16):3279-3282.
[7]武维华.植物生理学[M].北京:科学出版社,2008:88-90.
[8]史树德,孙亚卿,魏磊.植物生理学实验指导[M].北京:中国林业出版社,2011:33-36.
[9]Hörtensteiner Stefan,Kräutler Bernhard.Chlorophyll breakdown in higher plants[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,2011,1807(8):977-988.
[10]高明,孙海,张丽娜,等.铁、锰胁迫对人参叶片某些生理特征的影响[J].吉林农业大学学报,2012,34(2):130-137.
[11]贺安娜,李胜华,谭晓利,等.不同季节虎耳草的光合特性、岩白菜素及没食子酸含量比较[J].中药材,2013,36(2):202-205.
[12]王丹,万春阳,王文全,等.钼营养对甘草生理和生长特性的影响[J].现代生物医学进展,2011,11(4):632-636.
[13]张美萍,陕永杰,江玉珍,等.稀土微肥对盐胁迫下黄豆幼苗抗氧化酶的影响[J].稀土,2009,30(3):53-56.
[14]任立民,刘鹏.锰毒及植物耐性机理研究进展[J].生态学报,2007,27(1):357-367.
[15]李广会,郭素娟,熊欢,等.Mn2+促进板栗种子萌发及幼苗生长的临界阈值[J].东北林业大学学报,2014,41(4):13-21.
[16]尚伟伟,刘杰,张学洪,等.锰胁迫对青葙生长及叶绿素荧光特性的影响[J].生态环境学报,2013,22(8):1353-1357.
[17]马英姿,张慧,宋荣,等.高温胁迫对蛇足石杉生理特性的影响[J].中草药,2013,44(2):224-227.
[18]李志国,翁忙玲,姜武,等.模拟酸雨对乐东拟单性木兰幼苗部分生理指标的影响[J].生态学杂志,2007,26(1):31-34.
[19]沈吉红,梁文斌,薛生国,等.锰胁迫对垂序商陆叶片抗氧化系统的影响[J].贵州科学,2009,27(3):58-61.
[20]Klamkowski K,Treder W.Morphological and physiological responses of strawberry plants to water stress[J].Agric Conspec Sci,2006,71(4):159-165.
[21]李珊,程舟,杨晓伶,等.铅、锌胁迫对栝楼幼苗生长及抗逆生理因子的影响[J].生态学杂志,2008,27(2):278-281.
Effects of manganese stress on physiological and growth characteristics of Glycyrrhiza uralensis Fisch.
MA Shengjun1,2,WANG Wenquan1,3,4*,DU Runqing5,HOU Junling1,4(1.School of Chinese Pharmacy,Beijing University of Chinese Medicine,Beijing 100102,China;2.College of Food and Pharmaceutical Science,Xinjiang Agricultural University,Urumqi 830052,China;3.Institute of Medicinal Plant Development,Chinese Academy of Medical Science,100102Beijing,China;4.Engineering Research Center of Good Agricultural Practice for Chinese Crude Drugs,Ministry of Education,Beijing 100193,China;5.Fruit Trees Resources Garden of Luntai,Xinjiang Academy of Agricultural Science,Luntai 841600,China)
Objective To investigate the effects of manganese(Mn)stress on the physiological and growth characteristics of Glycyrrhiza uralensis Fisch..Methods The transplants of one-year-old G.uralensis were subjected to five concentrations of Mn(CK,1.81,18.1,36.2and 54.3mg·L-1)culturing in vermiculite,and 1.81mg·L-1Mn was used as the normal concentration in the complete Hoagland nutrition solution.Then the pigments contents,photosynthesis indicators and antioxidase activities of the leaves of G.uralensis were determined.The growth indicators and biomass of shoots and roots of the plants were also measured.Results All of the physiological and growth characteristics of G.uralensis showed increased with the increase of concentration of Mn treatment,and showed significant difference between the appropriate concentration of Mn and CK or 54.3mg·L-1Mn(P<0.05).The pigments contents,Pn,Gs,Tr reached the highest after 18.1mg·L-1Mn treatment,and showed significant difference between 18.1and 54.3mg·L-1Mn treatment(P<0.05).SOD and POD were the highest after 18.1mg·L-1Mn treatment and showed significant difference between 18.1and 54.3mg·L-1Mn treatment(P<0.05),while CAT was the highest after 36.2mg·L-1treatment.Then all of them began to decline.Meanwhile,the growth indicators of height,root diameter and ground diameter reached the highest after 36.2mg·L-1Mn treatment.Dry weights of the shoots and roots after 18.1mg·L-1treatment were the highest and showed significant difference with 54.3mg·L-1Mn treatment.Conclusion The appropriate concentration of Mn treatment could significantly increase the physiological and growth characteristics of G.uralensis,but excessive concentration of Mn treatment could result in stress on the growth of G.uralensis in all aspects and inhibit the accumulation of photosynthetic products.
Glycyrrhiza uralensis Fisch.;manganese(Mn);photosynthetic characteristics;antioxidase activities
10.3969/j.issn.1004-2407.2015.01.002
R282
A
1004-2407(2015)01-0004-05
2014-07-18)
国家公益性(中医药)行业科研专项项目(编号:201107009-03);中药材规范化生产技术服务平台(编号:工信部消费(2011)340)
马生军,男,讲师,博士研究生
*通信作者:王文全,男,教授,博士生导师
