淫羊藿素促进BMSCs 成软骨分化的研究
2015-01-11汪建样殷嫦嫦王子瑶耿书国胡文龙
汪建样,殷嫦嫦,王子瑶,耿书国,胡文龙,殷 明
1 南昌大学第二附属医院;2 南昌大学研究生院医学部,南昌 330006;3 九江学院,九江 332000
关节软骨属于透明软骨,营养供应和代谢产物的排泄需要通过关节液,一旦发生损伤难以自我修复和再生[1]。软骨损伤很容易引起关节结构和功能的破坏,导致剧烈的疼痛和功能障碍,甚至致残[2]。传统的治疗方案只能缓解疼痛、维持关节的功能,但不能恢复软骨的结构和生物力学特性。目前,软骨组织工程技术被认为是治疗软骨损伤的最有前景的方法之一,可能能够在更大程度上改善患者生活质量、延缓关节退变及人工关节置换[3]。生长分化因子(GDF)5 是骨形态发生蛋白(bone morphogenetic protein,BMP)超家族成员之一,能够诱导BMSCs 成软骨分化[4]。淫羊藿素(Icaritin,ICT)是淫羊藿主要活性成分淫羊藿苷的的衍生物。大量研究表明,ICT 具有类雌激素作用、抗氧化、防治骨质疏松、促进成骨分化、防治前列腺癌、肝癌、肾癌、乳腺癌等作用[5]。但淫羊藿素体外对于BMSCs 向软骨细胞分化作用的研究尚少。本次实验我们利用GDF-5 联合ICT 体外诱导大鼠BMSCs 向软骨细胞分化,探讨淫羊藿素体外是否能够促进BMSCs 向软骨细胞分化,为软骨损伤治疗提供实验参考。
1 实验材料
1.1 实验动物
3 周龄SPF 级SD 大鼠(雌雄不限),购自湖南斯莱克景达实验动物有限公司,合格号:43004700014337。试验单位使用许可证编号:SYXK(赣)2012-0002。
1.2 主要试剂
DMEM/F12 培养基(Hyclone 公司),胎牛血清(FBS)、0.25%胰蛋白酶(含EDTA)(GIBCO 公司),Recombinant murine GDF-5(PEPROTECH 公司),淫羊藿素(上海原叶,HPLC≥98%),Alcian Blue 8GX(Solarbio 公司),GREENspin 细胞RNA 快速提取试剂盒(北京庄盟),HiFiScript 快速去基因组cDNA 第一链合成试剂盒,2×Taq Master Mix、DNA Ladder 2000(SinoBio),引物合成(上海生工生物),总蛋白提取试剂盒(普利莱基因技术有限公司),Prestained Protein Ladder(Thermo Scientific 公司),GAPDH 多克隆抗体、COL1A2 多克隆抗体(Proteintech 公司),Anti-Collagen II antibody(abcam 公司),Goat Anti-Rabbit IgG,HRP(康为世纪),高灵敏度化学发光检测试剂盒(康为世纪)。
2 实验方法
2.1 BMSCs 分离、培养
本研究团队已建立了rBMSCs 的分离、培养及纯度鉴定的研究实验条件[6]。取3 周龄SPF 级SD大鼠,颈椎脱臼法处死,75%酒精浸泡30 min,消毒后无菌分离出股骨和胫骨,采用全骨髓贴壁法分离rBMSCs。用含10% FBS 的DMEM/F12 培养基重悬细胞接种于塑料中,72 h 后换液,以后每2 d 换液一次,待细胞生长至90%时按1∶2 传代。反复贴壁纯化,取P3 代细胞进行实验,并用倒置相差显微镜观察细胞形态。
2.2 BMSCs 向软骨细胞分化
取P3 代细胞,常规消化后,调整细胞密度为1×105/mL,接种于24 孔板中,同时将细胞密度调整为1×106/mL 接种于6 孔板中,并按以下分组进行诱导:(1)对照组;(2)Icaritin 组;(3)GDF-5 组;(4)Icaritin+GDF-5 联合组。上述各组细胞均采用10%FBS+DMEM/F12 培养基培养,其中Icaritin 的终浓度为5 μmol/L,GDF-5 的终浓度为100 ng/mL,每2 d 换液一次,诱导培养14 d,倒置相差显微镜下观察细胞形态变化。
2.3 蛋白聚糖的Alcian Blue 染色
取诱导培养14 d 后的24 孔板进行Alcian Blue染色,PBS 漂洗3 次×5min,4% 多聚甲醛固定30 min,PBS 漂洗1 次,0.1 mol/L 盐酸溶液漂洗5min使pH 降至1.0,1% Alcian Blue 染色过夜,最后用0.1 mol/L 盐酸溶液洗脱非特异性染色。倒置相差显微镜下观察染色情况。
2.4 RT-PCR 检测成软骨分化相关基因表达
取诱导培养14 d 后的6 孔板,按GREENspin 细胞RNA 快速提取试剂盒说明提取细胞总RNA。按HiFiScript 快速去基因组cDNA 第一链合成试剂盒说明将RNA 逆转录成cDNA,按2×Taq Master Mix说明进行扩增。PCR 扩增反应体系:cDNA 1 μL、上游和下游引物各1 μL、2×Master Mix 12.5 μL,ddH2O 9.5 μL,总反应体系25 μL。扩增后产物用1%琼脂糖凝胶电泳25 min 左右。SIM 凝胶成像系统拍照并分析条带灰度值。内参为GAPDH,目的基因为:Aggrecan、Col2a1、Col1a1、Sox9,引物序列和产物大小见表1。

表1 RT-PCR 引物序列Table 1 Sequences of primers
2.5 Western Blot 检测软骨标记蛋白表达
取诱导培养14 d 后的6 孔板,按总蛋白提取试剂盒说明提取细胞蛋白。BCA 法检测蛋白浓度。加入4×蛋白质上样缓冲液95 ℃水浴5 min 变性。每组蛋白上样量为30 μg,在SDS-聚丙烯酰胺(PAGE)凝胶中电泳;然后用湿转法将凝胶中的蛋白转至PVDF 膜上;将PVDF 膜置于含5%脱脂奶粉的TBST 中室温封闭2 h;分别加入 GAPDH(1∶3000)、Col2(1∶5000)、Col1(1∶8000)一抗工作液室温孵育2 h,1×TBST 漂洗3 次,每次5 min;用含标记辣根过氧化物酶的二抗(1∶6000)室温孵育2 h;漂洗后于暗室用ECL 试剂盒进行曝光、显影、定影。晾干后,以GAPDH 为内参,用ImageJ 进行灰度分析。
2.6 统计学分析
采用SPSS 19.0 统计软件进行试验数据分析,数据均以±s 的形式表示。计数资料两样本间率的比较采用χ2检验,检验水平α=0.05,组间比较采用单因素方差分析。
3 实验结果
3.1 rBMSCs 的形态学观察
大鼠骨髓间充质干细胞原代培养接种于培养瓶中,第3 d 部分细胞贴壁生长,呈长梭形、多角形(图1A),第10 d 细胞呈集落生长,漩涡状,近似鱼群样分布但有少量杂细胞,约90%融合(图1B)。传至P3 代,细胞形态基本均一,长梭形或扁平状,呈典型密集旋涡状、鱼群样排列贴壁生长(图1C)。

图1 BMSCs 原代培养3d(A)、BMSCs 原代培养10d(B)及BMSCs 第三代培养3d(C)的细胞形态学观察(×100)Fig.1 Cellular morphology observation of primary BMSCs cultured for 3 days(A),primary BMSCs cultured for 10 days and BMSCs at passage 3 cultured for 3 days(C)(×100)
3.2 rBMSCs 成软骨分化的形态改变及蛋白聚糖的Alcian Blue 染色结果

图2 对照组(A)、淫羊藿素(B)、GDF-5 组(C)及Icaritin+GDF-5 联合组(D)连续诱导14 d 后细胞形态变化及分泌蛋白多糖量的变化(×100)Fig.2 The morphological changes and content of cells secretory proteoglycan changes in control group(A),Icaritin group(B),GDF-5 group(C)and Icaritin+GDF-5 group(D)induced for 14 days(×100)
各组细胞随着诱导时间的延长密度逐渐增加,淫羊藿素(Icaritin)组、GDF-5 组、Icaritin+GDF-5 联合组细胞形态都由长梭形逐渐向短梭形、三角形、类圆形转变,细胞体积逐渐缩小,胞浆丰富。且Icaritin+GDF-5 联合组(图2D)最为明显,GDF-5 组(图2C)和淫羊藿素组(图2B)次之,而对照组(图2A)变化最小。连续诱导14 d 后,对照组(图2A)并没有明显的蛋白聚糖染色,淫羊藿素组(图2B)、GDF-5 组(图2C)、Icaritin+GDF-5 联合组(图2D)Alcian Blue 染色后颜色由浅到深。说明诱导后四组细胞分泌蛋白聚糖的量逐渐增加。
3.3 RT-PCR 结果
RT-PCR 检测结果分析表明,与对照组相比,Icaritin 组、GDF-5 组及Icaritin+GDF-5 联合组软骨标记基因Aggrecan、Col2、Sox9 表达量均明显增加(P<0.05),相反成骨分化相关基因Col1a1 表达量明显减少(P<0.05),但是Icaritin 组Col1a1 表达量增加(P<0.05)。与GDF-5 组比较,Icaritin+GDF-5联合组Aggrecan、Col2、Sox9 基因表达量也增加(P<0.05),相应的Col1a1 表达量下降(P<0.05)(图3)。
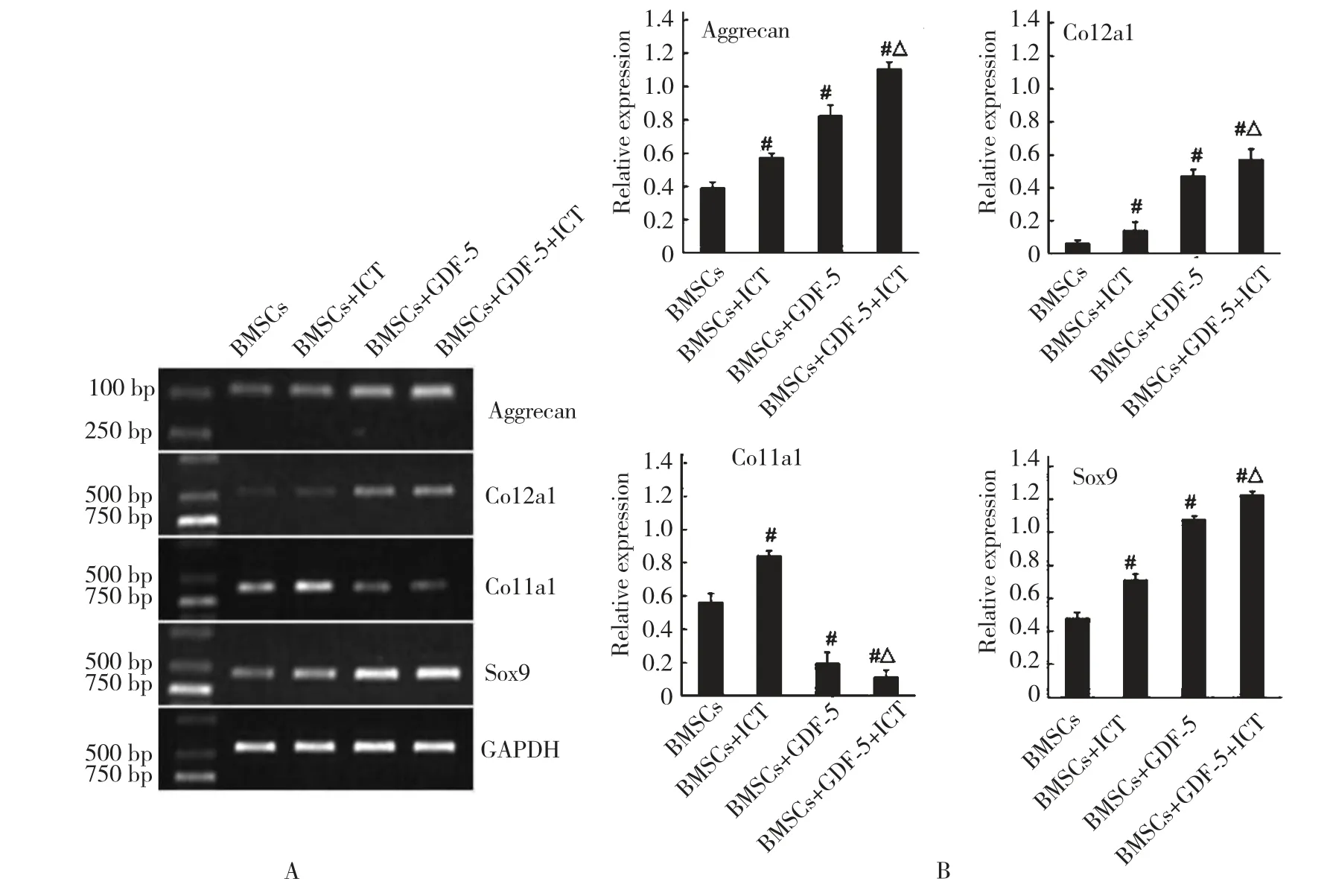
图3 BMSCs 诱导14 d 后成软骨分化相关基因的表达水平Fig.3 Gene relative expression level detected at day 14 after induction

图4 BMSCs 诱导14 天后相关蛋白的表达水平Fig.4 Protein relative expression of COL2 and COL1 after 14 days of induction
3.4 Western Blot 检测结果
Western Blot 检测结果灰度分析表明,相比于BMSCs 组,各诱导组Ⅱ型胶原蛋白表达量均明显增加,差异有统计学意义(P<0.05);相对于BMSCs+GDF-5 组,BMSCs+GDF-5+ICT 组Ⅱ型胶原蛋白表达量增加(P<0.05)。与BMSCs 组相比,BMSCs+ICT 组I 型胶原蛋白相对表达量增加(P<0.05),而BMSCs+GDF-5 组及BMSCs+GDF-5+ICT 组表达减少(P<0.05);与BMSCs+GDF-5 组相比BMSCs+GDF-5+ICT 组I 型胶原蛋白表达减少(P<0.05)(图4)。
4 讨论与结论
BMSCs 是一种多能干细胞,拥有强大的自我更新和良好的分化潜能,在一定的条件下,其可以向成骨细胞、软骨细胞、脂肪细胞、肌细胞等分化[7]。由于它具有来源广、易得到、易于培养扩增、低免疫原性、能与软骨下骨很好的融合[8]等优点,被广泛用于软骨组织工程。GDF-5 也被称为软骨衍生形态发生蛋白-1(CDMP-1),在胚胎发育阶段能够促进肢体发育,参与肌腱、韧带、神经、皮肤、骨及软骨损伤修复[9]。在肢体发育的早期,GDF-5 表达于软骨基原的间充质干细胞凝集区;随后它的表达仅局限于关节形成的中心区域,是滑膜关节的正常形态和发育所必须的[10]。此外,GDF-5 还表达于成年人关节软骨组织中,参与软骨表型和功能的维持[11]。有研究表明:GDF-5 能够诱导干细胞成软骨分化,增加其蛋白聚糖和Ⅱ型胶原的表达[4]。
淫羊藿是一味传统的中草药,根据中国药典记录,我国人民采用该药来壮骨强肾有几千年的历史,利用现代的药物分析手段研究该药的成分发现:其主要的药物成分为黄酮类化合物,统称为淫羊藿总黄酮,进一步的研究证明:淫羊藿总黄酮中主要的活性单体为淫羊藿苷,淫羊藿苷属于具有戊二烯结构的黄酮苷[12]。Zhang L 等[13]研究发现淫羊藿苷能够促进软骨细胞细胞外基质的合成和基因的表达,有利于软骨细胞表型的维持。淫羊藿素(Icaritin,ICT)作为淫羊藿苷的衍生物,是其体内代谢后的主要活性产物,与其前体物质淫羊藿苷具有极其相似的分子结构,具有抗氧化、防治骨质疏松、促进成骨细胞生长和增殖、治疗心血管疾病、保护神经变性损伤、防治乳腺癌等作用[14]。有研究表明:低浓度(4、8 μmol/L)的淫羊藿素能够促进大鼠软骨细胞增殖抑制其凋亡[15],而高浓度则没有这个作用。本实验前期选用1、5、10、20 μmol/L 的ICT 分别联合100 ng/mL 的GDF-5 诱导rBMSCs 分化,Alcian Blue 染色结果提示5 μmol/L 效果最好。因此,本实验采用5 μmol/L 的淫羊藿素联合100ng/mL 的GDF-5 诱导rBMSCs 成软骨分化,实验结果表明5 μmol/L 淫羊藿素的淫羊藿素具有促进GDF-5 诱导的细胞合成和分泌蛋白多糖,促进Aggrecan、Col2、Sox9 mRNA表达,促进Ⅱ型胶原蛋白表达抑制Ⅰ型胶原蛋白表达。其中蛋白聚糖和Ⅱ型胶原蛋白是透明软骨细胞分泌的特异性的软骨细胞外基质的主要成分,Sox9是一种高迁移率族蛋白(HMG-box)转录因子,是间质祖细胞成软骨分化早期阶段的标志[16]。成软骨分化标记基因Aggrecan、Col2、Sox9 mRNA 及Ⅱ型胶原蛋白表达量明显增加提示GDF-5 联合ICT 能够诱导BMSCs 向软骨软骨细胞分化。与单独GDF-5组相比,添加ICT 组上述基因和蛋白表达水平明显增加(差异有统计学意义),说明淫羊藿素体外能够促进rBMSCs 成软骨分化。此外,淫羊藿素能够导入聚乙烯-磷酸三钙(PLGA-TCP)形成新的多孔复合支架,它能持续释放ICT,并且有很好的生物相容性[17],有利于ICT 用于软骨损伤的治疗的应用。
综上所述,GDF-5 联合淫羊藿素能够诱导rBMSCs 成软骨分化,其中5 μmol/L 淫羊藿素能够促进GDF-5 诱导的细胞成软骨分化,为应用ICT 治疗软骨损伤提供实验基础。
1 Counsel PD,Bates D,Boyd R,et al.Cell therapy in joint disorders.Sports Health:A Multidisciplinary Approach,2015,7:27-37.
2 Chu CR,Millis MB,Olson SA.Osteoarthritis:From palliation to prevention.J Bone Joint Surgery,2014,9:130.
3 Mardones R,Jofré CM,Minguell JJ.Cell therapy and tissue engineering approaches for cartilage repair and/or regeneration.Int J Stem Cells,2015,8:48-53.
4 Feng G,Wan Y,Balian G,et al.Adenovirus-mediated expression of growth and differentiation factor-5 promotes chondrogenesis of adipose stem cells.Growth Factors,2008,26:132-142.
5 Zhang SQ.Ultra-high performance liquid chromatography–tandem mass spectrometry for the quantification of icaritin in mouse bone.J Chromatogr B,2015,978:24-28.
6 He DW(何丁文),Yin CC(殷嫦嫦),Gu YR(顾玉荣),et al.Differentiation of rat bone marrow mesenchymal stem cells into neural-like cells induced by bFGF and EGF.Basic Clin Med(基础医学与临床),2013,33:444-449.
7 Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells.Sci,1999,284:143-147.
8 Yan H,Yu C.Repair of full-thickness cartilage defects with cells of different origin in a rabbit model.Arthroscopy:J Arthroscopic Related Surgery,2007,23:178-187.
9 Francis-West PH,Abdelfattah A,Chen P,et al.Mechanisms of GDF-5 action during skeletal development.Development,1999,126:1305-1315.
10 Jin L,Li X.Growth differentiation factor 5 regulation in bone regeneration.Curr Pharm Design,2013,19:3364-3373.
11 Pradhan D,Sharon M,Kumar M,et al.Synthesis of beaded and entwined carbon nanofibers in Ni:Al alloy catalyst.J Nanosci Nanotechnol,2007,7:1034-1038.
12 Guo B.Determination of flavonoids and quality evaluation of Sagittate Epimedium(Epimedium sagittatum).Chin Tradit Herbal Drugs,1996,27:584-585.
13 Zhang L,Zhang X,Li KF,et al.Icariin promotes extracellu-lar matrix synthesis and gene expression of chondrocytes in vitro.Phytother Res,2012,26:1385-1392.
14 Zhu S,Wang Z,Li Z,et al.Icaritin suppresses multiple myeloma,by inhibiting IL-6/JAK2/STAT3.Oncotarget,2015,6:10460-10472.
15 He L,Wang W.A study on the effect of icaritin on rat chondrocytes.J Central South Univ,Med Sci,2015,40:517-521
16 Venkatesan JK,Ekici M,Madry H,et al.SOX9 gene transfer via safe,stable,replication-defective recombinant adeno-associated virus vectors as a novel,powerful tool to enhance the chondrogenic potential of human mesenchymal stem cells.Stem Cell Res Ther,2012,3(3):22-37.
17 Chen SH,Lei M,Xie XH,et al.PLGA/TCP composite scaffold incorporating bioactive phytomolecule icaritin for enhancement of bone defect repair in rabbits.Acta Biomater,2013,9:6711-6722.
