草兔卵透明带3(ZP3)基因真核表达载体的构建与表达
2015-01-07吴景龙隋丹丹张冬辉周智敏郑雪莉韩崇选
吴景龙,隋丹丹,张冬辉,周智敏,李 昊,郑雪莉,韩崇选
(西北农林科技大学 林学院,陕西 杨凌 712100)
草兔卵透明带3(ZP3)基因真核表达载体的构建与表达
吴景龙,隋丹丹,张冬辉,周智敏,李 昊,郑雪莉,韩崇选
(西北农林科技大学 林学院,陕西 杨凌 712100)
【目的】 利用基因重组技术将草兔卵透明带3基因(ZP3)构建到真核表达载体上,并在RK-13细胞中表达ZP3蛋白,为后期的免疫不育研究提供方便。【方法】 提取草兔卵巢总RNA,采用RT-PCR方法克隆ZP3基因,将其与pEGFP-N1真核表达载体连接,构建pEGFP-N1-ZP3表达载体,并将载体转入RK-13细胞中进行ZP3表达。利用倒置荧光显微镜、RT-PCR和Western Bolt方法对重组ZP3蛋白表达情况进行观测。【结果】 RT-PCR获得长为1 260 bp的草兔ZP3基因;成功构建pEGFP-N1-ZP3重组质粒,将其转染RK-13细胞后表达出73 ku的重组ZP3蛋白,RT-PCR验证和Western Bolt结果与ZP3基因的理论长度一致。【结论】 首次构建了草兔ZP3基因真核表达载体并成功在真核细胞中表达重组ZP3蛋白。
草兔;卵透明带3基因;免疫不育;pEGFP-N1;真核表达
草兔(Lepuscapensis)属兔形目(Lagomorpha)兔科(Leporidae),与穴兔属(Oryctolagus)的欧洲兔以及新西兰大白兔不同,属山兔属(Lepus)[1],分布纵跨亚洲、欧洲和非洲,是一类适应性很强的哺乳动物[2]。在我国,从海拔5 000 m以上的西北青藏高原到东部沿海平原,从东北寒冷的大兴安岭地区到最南端热带地区的海南岛都有草兔的分布,甚至在极度干旱的戈壁和沙漠边缘也有它们的活动踪迹。近年来由于人为原因及自然灾害等因素的影响,草兔的活动更加猖獗,给我国的林业、农业和牧业生产带来了极大的损失[3]。然而现在的防治方法还停留在以控制死亡率为目的的传统方法上,如机械捕杀、化学毒杀等,虽然这些方法短时间内对于控制有害生物起到了显著的效果,但是这些方法普遍存在工作量大、成本高、专一性差、灭效短、种群恢复快等缺点,而且化学毒杀方法对环境的污染及公众的安全危害较大。随着公众对环保和动物权益等方面意识的增强,许多国家开始转变有害生物防治的策略,通过减少出生率来控制其数量。应运而生的免疫不育技术显示出了相当诱人的前景,其一方面使种群内部分个体不能繁育,降低种群的出生率,另一方面不育个体存在继续占用空间、消耗资源等竞争性繁殖干扰,保持紧张的社群压力,从而抑制种群数量的恢复和发展。针对像鼠兔类这样的生长发育快、性成熟早、妊娠期短、分娩后可立即发情交配、全年大部分时间都能繁殖且单胎仔数多的有害生物,免疫不育技术的防治效果很好。目前免疫不育已经成为国际上最有潜力的种群控制技术[4]。
免疫不育技术是利用基因重组等分子生物学技术将草兔生育调控激素或相关蛋白与具有免疫活性的“碎片”或其他外源性大分子物质连接起来形成抗原,使机体产生破坏自身生殖的抗体,达到阻断生育的目的。由于免疫不育的抗原自身具有种的特异性,如果再加上专一性强的病原微生物携带和传播[5-6],不仅解决了疫苗传递的问题,降低成本,提高防治效率,而且对防治对象的专一性有了“双保险”的作用。通过免疫途径使动物不育,最关键的是选择免疫不育疫苗,目前避孕疫苗抗原研究主要集中在激素抗原、精子抗原和卵透明带这3类靶抗原上。其中哺乳动物卵透明带(Zona pellucida,ZP)是由卵母细胞合成和分泌并包裹在其外部的一层糖蛋白基质,由3~4种蛋白组成,分别称为ZP1、ZP2、ZP3和ZP4[7-8],是精卵结合的特异性识别媒介,是精子的最初受体,对卵子生成、精卵结合和早期胚胎发育具有重要作用[9]。大量研究表明,ZP3蛋白能以抗原的形式干扰精子与正常ZP3的结合而阻断小鼠、猪、猴子等的生殖过程[10-11]。同时有研究表明,各物种ZP3的羧基端及糖支链特异性抗原表位相对应的区域同源性极低,即使在小鼠和仓鼠之间也不例外,而且ZP3蛋白是卵巢特有的,在其他组织中不表达,不会离开卵巢进入血液循环,不会形成复杂的免疫复合体以及与其他组织发生交叉反应或引起激素水平上的紊乱,因此ZP3蛋白在免疫过程中有很高的种属特异性和组织特异性,是一种很有前途的抗生育疫苗。
有研究证实,ZP3蛋白在哺乳动物中能产生强烈的免疫反应,具有显著的抗生育作用,利用ZP3蛋白免疫能大大降低动物的受精率。目前已有人[12]、小鼠[13]、狗[7,14]、草原兔尾鼠(Laguruslagurus)[15-16]、欧洲兔(Oryctolaguscuniculus)[17]、帽猴(Macacaradiata)[18-20]、狒狒(Papioanubis)[21]、鲤鱼[22]、考拉(Phascolarctoscinereus)[23]和刷尾负鼠(Trichosurusvulpecula)[24-25]等多种哺乳动物的卵透明带蛋白成功在各种表达系统中表达并用于免疫不育的研究,但有关草兔ZP3蛋白的免疫效果却未见报道。本研究对草兔ZP3基因进行了克隆,构建其增强型绿色荧光蛋白pEGFP-N1-ZP3真核表达载体,并对表达载体进行转染和表达,旨在为进一步深入研究草兔免疫不育疫苗奠定基础。
1 材料与方法
1.1 材 料
1.1.1 试验动物 草兔捕自陕北黄土高原地区,雌性,体长30 cm左右。
1.1.2 试 剂 RNAout提取试剂盒,购自上海生工;RQ1 RNase-Free DNase,购自Promega公司;高效琼脂糖DNA凝胶回收试剂盒、质粒小提试剂盒及去内毒素大提试剂盒,购自天根生化科技(北京)有限公司;RevertAidTMFirst Strand cDNA Synthesis Kit,购自Fermentas公司;连接试剂盒DNA Ligation Kit Ver.2.1、QuickCutXhoⅠ/EcoRⅠ,购自TaKaRa(大连)生物有限公司;南美胎牛血清(FBS)、DMEM、100×青霉素链霉素双抗、0.25%胰蛋白酶溶液及细胞转染试剂TurboFect Transfection Reagent,购自Thermo公司;Opti-MEM,购自Gbico公司;2×TaqMasterMix、DNA Marker、抗His标签鼠单抗、抗GFP标签鼠单抗、抗GAPDH内参鼠单抗,二抗Goat Anti-Mouse IgG及eECL Western Blot高灵敏度化学发光检测试剂盒,购自北京康为世纪生物科技有限公司。
1.1.3 质粒、菌株及细胞 克隆载体T-Vector pMD19 (Simple)购自TaKaRa(大连)生物有限公司;真核表达载体pEGFP-N1由西北农林科技大学动物医学院张成成博士馈赠;大肠杆菌克隆菌株DH5α购自北京全式金生物技术有限公司;兔肾脏细胞(RK-13)购自中国典型培养物保藏中心。
1.2 草兔卵巢总RNA的提取及反转录
将刚捕获的草兔从笼中提起,用木槌等硬物用力敲击其后脑处处死,整个过程应做好防护,避免因草兔挣扎而受伤。待确认草兔已死亡后,将其腹面朝上固定于解剖台上,解剖取出卵巢组织,液氮中保存待用。取2只兔子的卵巢于液氮中快速研磨,按照RNAout试剂盒说明提取总RNA,超微量紫外分光光度计检测其总RNA浓度及质量,1.2%琼脂糖凝胶电泳辅助检测,如果有DNA残留,用无RNA酶的DNA酶试剂盒进行消化,然后用First-Strand cDNA Synthesis Kit进行cDNA第一链的合成。
1.3 草兔ZP3全长cDNA的克隆及测序
根据西北农林科技大学林学院森林鼠、兔害防治实验室在GenBank上登录的ZP3基因开放阅读框序列(GenBank登录号:KC447289.1)[26]设计全长引物,上游引物(F1):5′-ATGGGGCTGAGCTACGGG-3′,下游引物(R1):5′-TTATTGGGAAGCAGACCTGG-3′,委托上海生工合成。
以合成的cDNA为模板进行PCR扩增,反应体系50 μL:2×TaqMasterMix 25 μL,引物F1、R1终浓度均为0.5 μmol/L,模板cDNA 30 ng,ddH2O 补足50 μL。扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸90 s,循环35次;最后72 ℃终止补偿延伸7 min。PCR产物用1.2%琼脂糖电泳和紫外凝胶成像系统检测。
PCR产物用胶回收试剂盒进行回收,将回收的产物目标片段亚克隆于T-Vector pMD19 (Simple)载体上,转化DH5α大肠杆菌菌株感受态细胞,转化子涂布于含100 μg/mL氨苄青霉素(Amp)、24 μg/mL IPTG和20 μg/mL 5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)的平板上过夜培养,进行蓝白斑筛选。次日挑取白色单克隆摇管培养,进行菌液PCR验证,验证正确的克隆菌液寄往上海生工,用T-Vector pMD19 (Simple)载体通用引物进行双向测序,测序结果用MEGA 5.0软件进行拼接并与数据库进行比对验证。
1.4 pEGFP-N1-ZP3真核表达载体的构建及鉴定
1.4.1 真核表达目的基因ZP3引物的设计 设计两端分别带有XhoⅠ和EcoRⅠ酶切位点的草兔ZP3全长引物,上游引物(F2):5′-CCGCTCGAGATGGGGCTGAGCTACGGGCTC-3′,下游引物(R2):5′-CCGGAATTCCTTGGGAAGCAGACCTGGGGTG-3′,其中上游引物(F2)包含一个起始密码子(ATG)方便蛋白转录起始(下划线标注为XhoⅠ酶切位点),下游引物(R2)已去掉ZP3终止密码子(TAA)以利于其与后边相连的GFP融合表达(下划线标注为EcoRⅠ酶切位点)。引物委托上海生工合成。
1.4.2 真核表达目的基因ZP3的获得 以1.3中构建并验证正确的pMD-19T-ZP3克隆为模板,F2和R2为引物,菌液PCR(PCR体系及程序同1.3)获得带XhoⅠ和EcoRⅠ酶切位点的目的基因ZP3。PCR产物经凝胶回收试剂盒回收,回收DNA用超微量紫外分光光度计检测其浓度及质量,同时用1.2%的琼脂糖凝胶电泳辅助检测。
1.4.3 真核表达载体pEGFP-N1的获得 提前1 d用试管培养适量的带pEGFP-N1质粒的DH5α大肠杆菌菌株,用质粒小提试剂盒提取pEGFP-N1质粒,超微量紫外分光光度计检测其浓度及质量,同时用1.2%的琼脂糖凝胶电泳辅助检测。
1.4.4 真核表达载体pEGFP-N1和目的基因ZP3的酶切、连接及转化 将1.4.2得到的ZP3基因和1.4.3得到的pEGFP-N1质粒均用XhoⅠ和EcoRⅠ QuickCut限制酶37 ℃酶切1 h。用凝胶回收试剂盒分别回收已酶切的ZP3目的基因片段和pEGFP-N1载体片段,2个片段用DNA Ligation Kit Ver.2.1连接试剂盒16 ℃过夜连接,连接产物转化DH5α菌株。为提高构建成功率,在将2个片段混合之后65 ℃热激4 min,迅速冰浴2 min,然后再加SolutionⅠ过夜连接,同时在转化之前加1 μL转化增强剂Solution Ⅲ(DNA Ligation Kit Ver.2.1连接试剂盒中包含SolutionⅠ和Solution Ⅲ)。
1.4.5 pEGFP-N1-ZP3转化子的筛选及鉴定 将所得pEGFP-N1-ZP3转化子涂布于含50 μg/mL硫酸卡那霉素(Kana)的LB平板上过夜筛选培养,次日挑取单菌落摇菌,菌液PCR验证,同时提取pEGFP-N1-ZP3重组质粒分别进行XhoⅠ、EcoRⅠ单酶切及XhoⅠ和EcoRⅠ双酶切验证。
将上述菌液PCR验证和单/双酶切验证均正确的单克隆菌液寄至上海生工,用pEGFP-N1载体通用引物进行双向测序,测序结果用MEGA 5.0软件进行拼接并比对验证。
1.5 pEGFP-N1-ZP3重组质粒的大量制备
将验证正确的pEGFP-N1-ZP3重组质粒菌株接种于200 mL LB培养基中摇瓶培养,用去内毒素质粒大提试剂盒提取质粒,超微量紫外分光光度计及凝胶电泳检测质粒质量,-20 ℃保存备用。
1.6 RK-13细胞培养及pEGFP-N1-ZP3重组质粒的转染
1.6.1 RK-13细胞的培养 RK-13细胞培养用含有100 U/mL青霉素、100 μg/mL链霉素及体积分数10%胎牛血清的DMEM培养基培养,细胞培养箱设置参数为体积分数5% CO2,37 ℃。细胞培养液每天更换1次,2~3 d传代1次。
1.6.2 RK-13转染细胞的准备 将生长状态良好的RK-13细胞用质量分数0.25%的胰蛋白酶消化,新鲜培养基重悬,取适量细胞悬液台盼蓝染色,在倒置显微镜下用细胞计数板计数,按每孔约5×104个细胞的接种量接种于24孔板中,体积分数5% CO2,37 ℃培养。
1.6.3 pEGFP-N1-ZP3重组质粒的转染 当24孔板中的细胞汇合度达到60%~70%时弃去旧培养基,更换新的完全培养基,转染时每孔重组质粒用量1 μg。具体操作如下:取1 μg pEGFP-N1-ZP3重组质粒,用100 μL的Opti-MEM培养基稀释,加入2 μL的TurboFect转染试剂,移液枪吹打混匀,室温孵育17 min后逐滴加入上述24孔板中,轻轻摇匀,37 ℃继续孵育。12 h后换液,期间如果观察到细胞状态不佳应及时换液,48 h后在倒置荧光显微镜下观察细胞转染表达情况。在转染时同时设置空白RK-13细胞及pEGFP-N1空载体转染RK-13细胞对照组。
1.7 转染pEGFP-N1-ZP3重组质粒的RK-13细胞中ZP3基因的RT-PCR检测
用RNAout试剂盒分别提取转染pEGFP-N1-ZP3或pEGFP-N1载体的RK-13细胞及空白RK-13细胞的总RNA,以提取的总RNA为模板, F2和R2为引物,按照One Step RT-PCR Kit操作手册,RT-PCR法分别检测这3种RK-13细胞中目的基因ZP3的表达情况。
1.8 ZP3在RK-13细胞中的大量表达及Western Blot检测
将RK-13细胞转染体系按比例放大到60 mm培养皿中进行转染表达,48 h后收集细胞,PBS洗涤,细胞裂解液裂解后收集蛋白,取适量样品用蛋白定量试剂盒定量后加蛋白loading buffer,沸水浴10 min,14 000 r/min离心10 min收集上清,-80 ℃保存备用。
取上述已处理样品适量,用8%分离胶的SDS-PAGE电泳,转PVDF膜。将转好的膜在质量分数5%脱脂奶粉的TBST溶液中室温封闭2 h,封闭完将膜从预染蛋白Marker 45 ku左右的位置剪开一分为二,蛋白分子质量大的一块膜封于含5 mL抗GFP标签鼠单克隆抗体(1∶700稀释)的杂交小袋中,另外一块封于装抗GAPDH的鼠单克隆抗体(1∶1 000稀释)杂交小袋中,4 ℃孵育过夜。次日分别用TBST洗膜,洗完后将2块膜一起放入HRP偶联的兔抗鼠二抗(1∶5 000稀释)中室温孵育2 h,TBST洗膜,ECL显影,Bio-Rad Gel Doc XR凝胶成像系统成像分析。
2 结果与分析
2.1 草兔ZP3基因的克隆
提取的总RNA电泳结果显示,28S和18S条带清晰,A260/A280为1.98,RNA含量为213.54 ng/μL;PCR扩增得到长度约为1 250 bp的条带(图1),与理论值相符;测序结果显示其长度为1 260 bp,无碱基缺失及突变。
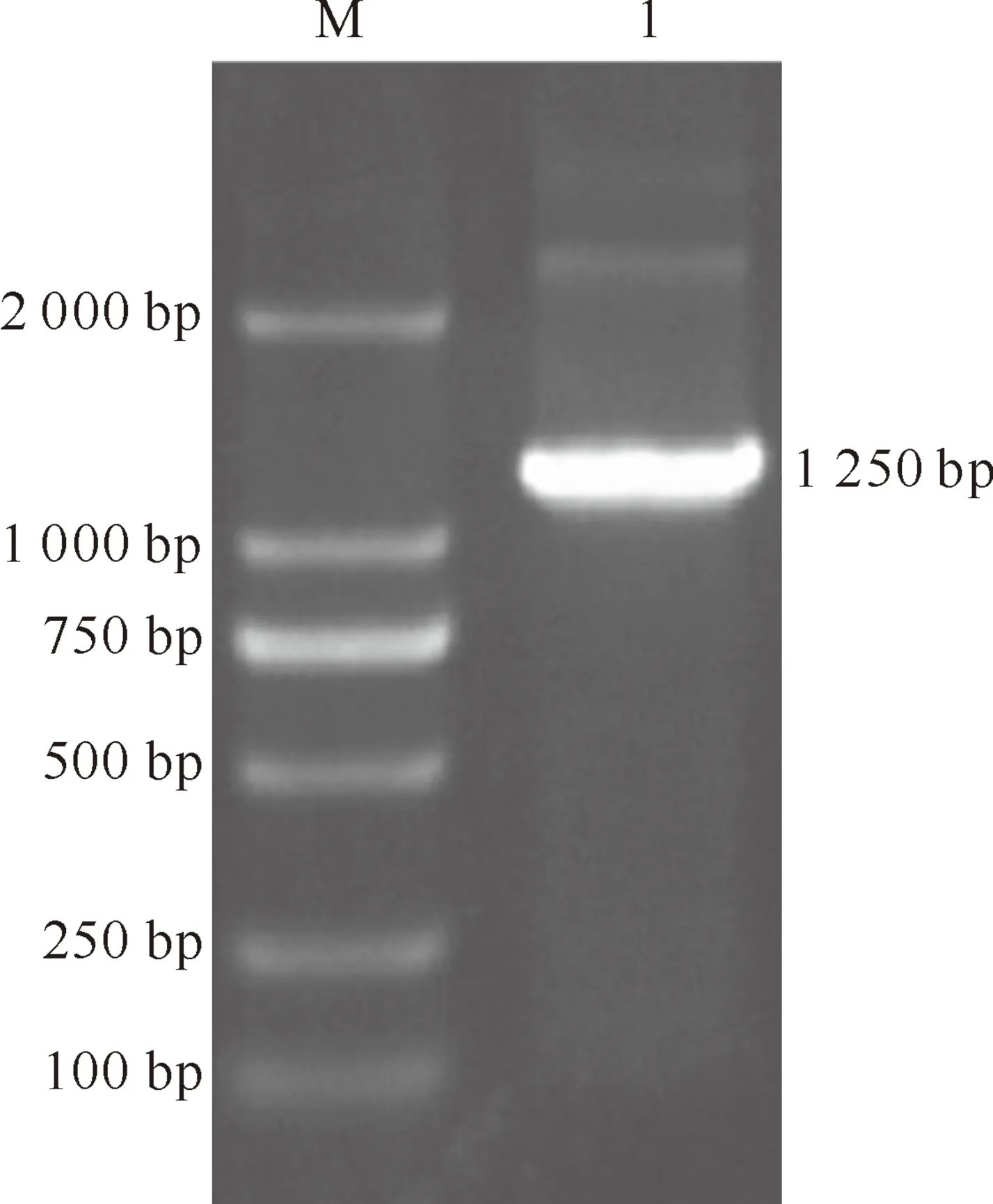
图1 草兔ZP3基因的克隆
2.2 草兔pEGFP-N1-ZP3重组质粒的鉴定
从1.4.5转化的琼脂糖平板上挑取8个pEGFP-N1-ZP3转化子阳性克隆,扩大培养,菌液PCR检测获得了约1 250 bp的条带(图2),条带长度与理论值一致。选取其中4个克隆提取质粒,XhoⅠ和EcoRⅠ双酶切后得到1 250 bp的pEGFP-N1-ZP3目的基因片段和4.7 kb的载体片段;XhoⅠ、EcoRⅠ单酶切均获得1条线性重组质粒条带,大小比双酶切的线性载体条带稍大;而重组质粒由于是超螺旋结构,电泳速度比线性质粒稍快,因此显示比单酶切的条带稍小一些(图3泳道1)。测序结果显示,构建的pEGFP-N1-ZP3重组质粒ZP3基因长度及序列与理论值一致。
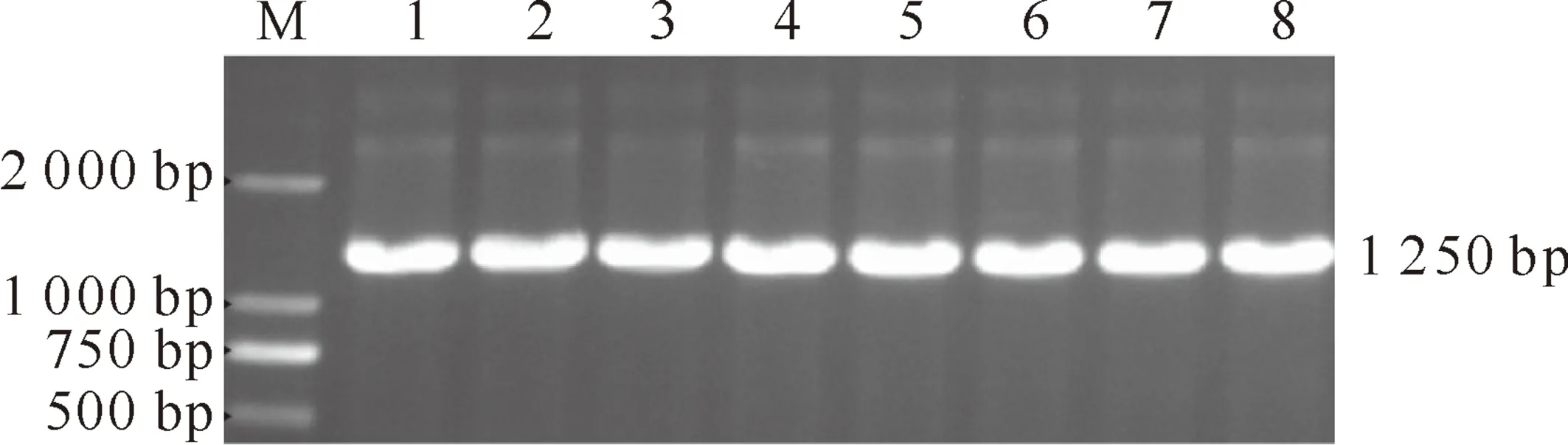
图2 草兔真核表达载体pEGFP-N1-ZP3的菌液PCR检测
2.3 草兔ZP3在RK-13细胞中表达的荧光观察
RK-13细胞转染48 h后置于倒置荧光显微镜下观察,可见转染pEGFP-N1(图4-A)和pEGFP-N1-ZP3(图4-D)的RK-13细胞均有绿色荧光,多为明亮的绿色荧光,少数发出弱荧光;与眀场中的RK-13细胞(图4-C)相比,转染pEGFP-N1-ZP3的细胞约75%成功表达;空白RK-13细胞对照无表达,未见绿色荧光(图4-B)。
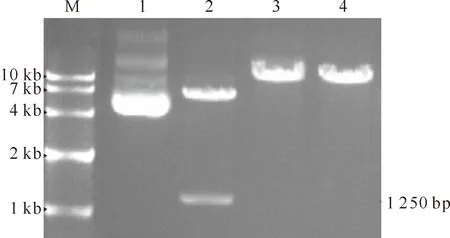
图3 草兔真核表达载体pEGFP-N1-ZP3的单双酶切鉴定M.DNA Marker;1.重组质粒pEGFP-N1-ZP3;2.重组质粒XhoⅠ和EcoRⅠ双酶切;3.重组质粒XhoⅠ单酶切;4.重组质粒EcoRⅠ单酶切

图4 草兔ZP3-GFP融合蛋白在RK-13细胞中表达的荧光显微镜观察(48 h)A.转染pEGFP-N1空载体的RK-13细胞(暗场激光激发);B.空白RK-13细胞(暗场激光激发);C.转染pEGFP-N1-ZP3的RK-13细胞(明场);D.转染pEGFP-N1-ZP3的RK-13细胞(暗场激光激发)
Fig.4 Analysis of ZP3-GFP expression in RK-13 cells after 48 hours with fluorescence microscopy A.RK-13 cells transfected with pEGFP-N1 as control;B.RK-13 cells without being transfected as control;C.Expression of pEGFP-N1-ZP3 cells in bright field;D.Expression of pEGFP-N1-ZP3 cells with green fluorescence
2.4 草兔ZP3在RK-13细胞中表达的RT-PCR检测
RT-PCR产物经1.2%琼脂糖凝胶电泳后,在约1 250 bp处有一清晰条带(图5),与ZP3基因理论长度相符,说明ZP3基因转入RK-13细胞中并成功转录。
2.5 草兔ZP3-GFP重组蛋白的Western Blot检测
RK-13表达细胞的裂解液上清经SDS-PAGE分离,并转至PVDF膜上,与抗GFP的一抗反应后在约73 ku处有一条阳性反应条带,与理论大小一致,而空细胞和转染pEGFP-N1空载体细胞没有阳性条带(图6-A),表明ZP3-GFP融合蛋白在RK-13细胞中成功表达。GAPDH内参条带亮度基本一致(图6-B),从侧面说明3个处理组上样量一致。
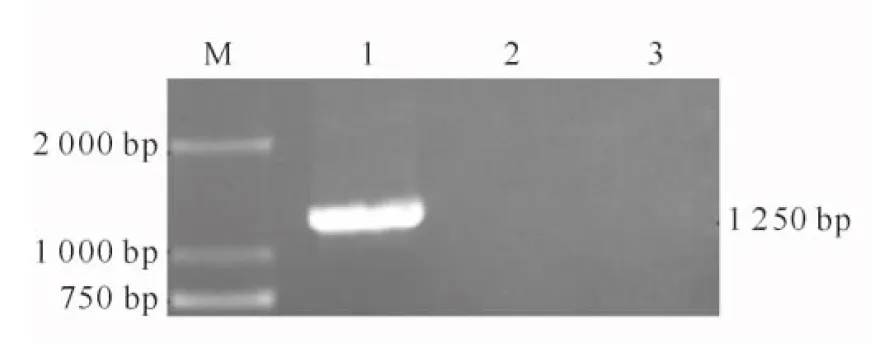
图5 转染RK-13细胞中草兔ZP3基因的RT-PCR检测M.DNA Marker;1.转染重组表达载体pEGFP-N1-ZP3的RK-13细胞;2.转染空载体pEGFP-N1的RK-13细胞;3.未转染的空白RK-13细胞Fig.5 Analysis of expression products of ZP3 in RK-13 cells by RT-PCR M.DNA Marker;1.RK-13 cells transfected by pEGFP-N1-ZP3;2.RK-13 cells transfected by pEGFP-N1 as control;3.RK-13 cells without being transfected as control
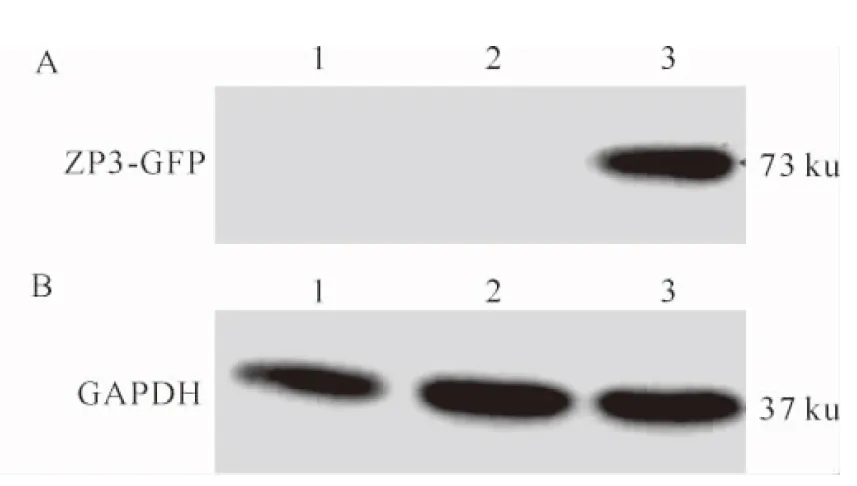
图6 草兔ZP3-GFP重组蛋白的Western Blot分析 A.一抗为抗GFP的鼠单克隆抗体;B.内参基因GAPDH(为保证上样量一致),一抗为抗GAPDH的鼠单克隆抗体 1.空白RK-13细胞对照;2.转染空载体pEGFP-N1的RK-13细胞;3.转染重组质粒pEGFP-N1-ZP3的RK-13细胞Fig.6 Analysis of expression products of ZP3-GFP in RK-13 cells by Western Blot A.Anti-GFP Western Blot;B.Anti-GAPDH Western Blot to equalize the quantity of loading protein;1.RK-13 cells transfected without being transfected as control;2.The cells transfected with pEGFP-N1;3.The cells transfected with pEGP-N1-ZP3
3 讨论与结论
ZP3免疫不育研究最多的是猪ZP3蛋白,印度新德里国家免疫学中心配子抗原实验室曾用猪的ZP3α蛋白辅以弗氏完全佐剂免疫帽猴,成功使其不育,但当抗体滴度下降时,大约有一半的猴子又重新获得了妊娠能力[27-28]。用ZP3免疫在降低受精率的同时伴随有部分动物自身免疫卵巢炎反应,卵巢结构遭受不同程度的破坏,卵泡的发育也受到影响[29-31]。但有害生物防治不同于人类避孕研究,不需要考虑避孕的可逆性,以及免疫动物是否患有卵巢炎及生殖系统被破坏等问题,只要能提高免疫不育的成功率和持久性就行[32]。
目前迫切要解决的问题是要从ZP3蛋白序列中选择一段能够产生免疫不育的蛋白表位片段。研究表明,ZP3蛋白非常保守,其家族成员在结构上都有位于N端的22个氨基酸的信号肽序列、位于尾部C端弗林蛋白酶的切割位点和跨膜区,以及中间大约260个氨基酸的保守序列[33]。有数据显示,人的ZP3蛋白氨基酸序列与小鼠有67%的相似度,与兔子有69%相似,与猪有74%相似,与帽猴的相似度甚至达到93.9%[34],并且这些物种之间大多都存在交叉免疫反应,用他们的ZP3来免疫异种动物都会出现免疫反应[29,35-36],因此本试验选择的免疫表位片段不仅要包括ZP3特性的保守区域,还要带有草兔特异性的识别区域,以保证免疫靶动物的准确性。资料显示,关于ZP3的研究大多都集中在其去信号肽和去跨膜区的保守片段与此片段在原核表达系统中的表达及其免疫原性上。本研究前期曾尝试利用pET-28a(+)载体在大肠杆菌BL21(DE3)菌株中表达,试验经过2个阶段:第1阶段是以去掉前端信号肽的ZP3为目的基因插入pET-28a(+)载体与His标签融合表达[37],但可能是后端疏水的跨膜区影响,ZP3融合蛋白表达量不高;因此第2阶段同时去掉了信号肽和跨膜区区域,只留核心片段,表达量有所提高,但蛋白以包涵体的形式存在,不利于后期的纯化和免疫。有关ZP3蛋白免疫原性的研究表明,ZP3蛋白在表达过程中有很多后期的N-和O-链接糖支链修饰,其是精子识别和结合的重要抗原决定簇位点,起着关键性的作用[38]。但原核表达系统由于没有复杂的细胞器结构和信号调控,并且目标蛋白前段的帮助转运和分泌的信号肽序列也被去掉,因此目标蛋白在表达过程中不存在后期的甲基化和糖基化等修饰,以及二硫键和多肽折叠高级结构的形成。故原核表达系统表达出来的蛋白与天然蛋白相差甚远,更谈不上其免疫原性和特异性。
鉴于前期的探索性试验,本研究选择用哺乳动物细胞真核表达系统来表达ZP3蛋白。相对于其他表达系统,哺乳动物表达系统具有更准确的转录后修饰功能,表达的蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子,表达蛋白可以分泌到细胞外部便于下游产物分离纯化,且外源基因可以整合表达,稳定遗传。在本试验中,表达载体采用pEGFP-N1穿梭质粒,其含有一个编码GFP的基因片段,可在哺乳动物细胞中高效融合表达,方便检测。绿色荧光蛋白编码序列的上游有巨细胞病毒的早期启动子序列和Kozak序列,可促进外源基因的表达起始。多克隆位点可供外源基因片段插入,而外源基因片段无终止密码,且基因读码框架与GFP基因读码框架一致,可与GFP蛋白融合表达。表达ZP3的宿主细胞则选用分类上与草兔更接近的兔源RK-13细胞。
在重组蛋白的转染表达过程中,虽然蛋白得到成功表达,但是笔者发现,转染过程中重组质粒的质量及其与转染试剂的比例非常重要。本试验中,分别采用普通的质粒提取试剂盒和去内毒素试剂盒来提取转染用质粒,其中普通试剂盒试验组在转染表达后期细胞死亡很多,细胞状态很差,而去内毒素试剂盒组的细胞相对前者好很多。同时质粒和转染试剂的量太低转染效率不高,太高则影响细胞的生长;两者之间比例不同,转染效率也不同。因此在采用不同的表达系统和宿主细胞表达时优化很重要,需要长期摸索适宜的条件。另外细胞培养基中的血清成分十分复杂,不利于下游分泌蛋白的分离纯化,因此探索一种低血清或无血清的培养基很重要。
由于重组蛋白带有绿色荧光可在激发光下直接观察,下一步试验可用pEGFP-N1-ZP3重组载体直接注射免疫草兔,研究其在活体内的表达和免疫;也可以采用His标签代替GFP标签构建重组载体,以制备His融合的ZP3蛋白,用Ni离子亲和柱一步纯化分离ZP3蛋白免疫草兔;同时也可以考虑用纯化的蛋白和构建好的重组真核表达载体同时注射草兔联合免疫研究草兔免疫不育;另外,构建病毒表达载体以及以特异性更强的兔黏液瘤病毒为载体来传播疫苗也是一种途径。
[1] 李惠萍,张 放,韩崇选.陕西草兔头骨形态的地理学分化 [J].西北林学院学报,2011,26(1):15-16.
Li H P,Zhang F,Han C X.Geographical differentiation in skull morphology ofLepuscapensisin Shaanxi Province [J].Journal of Northwest Forestry University,2011,26(1):15-16.(in Chinese)
[2] 韩崇选,李金刚,杨学军.中国农林啮齿动物与科学管理 [M].陕西杨凌:西北农林科技大学出版社,2005:15-16.
Han C X,Li J G,Yang X J.Chinese rodents of agriculture and forestry and their management [M].Yangling,Shaanxi:Northwest A&F University Press,2005:15-16.(in Chinese)
[3] 王明春,韩崇选,杨学军,等.草兔对幼树的选择危害及其防治技术研究 [J].西北农林科技大学学报:自然科学版,2004,32(12):52-56.
Wang M C,Han C X,Yang X J,et al.Selective damage of rabbit to tree seedlings and its control techniques [J].Journal of Northwest A&F University:Natural Science Edition,2004,32(12):52-56.(in Chinese)
[4] 张知彬.鼠类不育控制的生态学基础 [J].兽类学报,1995,15(3):229-234.
Zhang Z B.Ecological basis of contraception control in mouse [J].Acta Theriologica Sinica,1995,15(3):229-234.(in Chinese)
[5] Gahlay G K,Batra D,Gupta S K.Baculovirus expressed C-terminal fragment of bonnet monkey (Macacaradiata) zona pellucida glycoprotein-3 inhibits ZP3-mediated induction of acrosomal exocytosis [J].Molecular Reproduction & Development,2005,71(2):237-244.
[6] Mackenzie S M,Mclaughlin E A,Perkins H D,et al.Immunocontraceptive effects on female rabbits infected with recombinant myxoma virus expressing rabbit ZP2 or ZP3 [J].Biology of Reproduction,2006,74(3):511-521.
[7] Gupta S K,Srinivasan V A,Suman P,et al.Contraceptive vaccines based on the zona pellucida glycoproteins for dogs and other wildlife population management [J].American Journal of Reproductive Immunology,2011,66(1):51-62.
[8] Harris J D,Hibler D W,Fontenot G K,et al.Cloning and characterization of zona pellucida genes and cDNAs from a variety of mammalian species:The ZPA,ZPB and ZPC gene families [J].DNA Sequence,1994,4(6):361-393.
[9] Prasad S V,Skinner S M,Carino C,et al.Structure and function of the proteins of the mammalian zona pellucida [J].Cells Tissues Organs,2000,166(2):148-164.
[10] Lloyd M L,Shellam G R,Papadimitriou J M,et al.Immunocontraception is induced in BALB/c mice inoculated with murine cytomegalovirus expressing mouse zona pellucida 3 [J].Biology of Reproduction,2003,68(6):2024-2032.
[11] Gupta S K,Srivastava N,Choudhury S,et al.Update on zona pellucida glycol proteins based contraceptive vaccine [J].Journal of Reproductive Immunology,2004,62(1):79-89.
[12] Rath A,Choudhury S,Hasegawa A,et al.Antibodies generated in response to plasmid DNA encoding zona pellucida glycoprotein-B inhibitinvitrohuman sperm-egg binding [J].Molecular Reproduction & Development,2002,62(4):525-533.
[13] Hardy C M,ten Have J F M,Pekin J,et al.Contraceptive responses of mice immunized with purified recombinant mouse zona pellucida subunit 3 (mZP3) proteins [J].Reproduction,2003,126(1):49-59.
[14] Santhanam R,Panda A K,Kumar V S,et al.Dog zona pellucida glycoprotein-3 (ZP3):Expression inEscherichiacoliand immunological characterization [J].Protein Expression and Purification,1998,12(3):331-339.
[15] 张富春,钱 东,林仁勇,等.鼠透明带3(ZP3)融合蛋白表达以及抗血清制备 [J].生物技术,2002,12(4):11-13.
Zhang F C,Qiang D,Lin R Y,et al.Expression and antiserum preparation of the mouse zona pellicida 3 glycoprotein [J].Biotechnology,2002,12(4):11-13.(in Chinese)
[16] 张爱莲,赵 干,王 宾,等.草原兔尾鼠GST-LZP3融合蛋白的原核表达及其抗体制备 [J].细胞与分子免疫学杂志,2004,20(2):168-170.
Zhang A L,Zhao G,Wang B,et al.Expression ofLagurusZP3 fusion protein in prokaryotic cells and preparation of its antiserum [J].Chinese Journal of Cellular and Molecular Immunology,2004,20(2):168-170.(in Chinese)
[17] Kerr P J,Jackson R J,Robinson A J,et al.Infertility in female rabbits (Oryctolaguscuniculus) alloimmunized with the rabbit zona pellucida protein ZPB either as a purified recombinant protein or expressed by recombinant myxoma virus [J].Biology of Reproduction,1999,61(3):606-613.
[18] Kaul R,Afzalpurkar A,Gupta S K.Expression of bonnet mo-nkey (Macacaradiata) zona pellucida-3 (ZP3) in a prokaryotic system and its immunogenicity [J].Molecular Reproduction & Development,1997,47(2):140-147.
[19] Govind C K,Hasegawa A,Koyama K,et al.Delineation of a conserved B cell epitope on bonnet monkey (Macacaradiata) and human zona pellucida glycoprotein-B by monoclonal antibodies demonstrating inhibition of sperm-egg binding [J].Biology of Reproduction,2000,62(1):67-75.
[20] Govind C K,Gahlay G K,Choudhury S,et al.Purified and refolded recombinant bonnet monkey (Macacaradiata) zona pellucida glycoprotein-B expressed inEscherichiacolibinds to spermatozoa [J].Biology of Reproduction,2001,64(4):1147-1152.
[21] Govind C K,Gupta S K.Failure of female baboons (Papioanubis) to conceive following immunization with recombinant non-human primate zona pellucida glycoprotein-B expressed inEscherichiacoli[J].Vaccine,2000,18(26):2970-2978.
[22] Chang Y S,Wang S C,Tsao C C,et al.Molecular cloning,structural analysis,and expression of carp ZP3 gene [J].Molecular Reproduction & Development,1996,44(3):295-304.
[23] Kitchener A L,Kay D J,Walters B,et al.The immune response and fertility of koalas (Phascolarctoscinereus) immunised with porcine zonae pellucidae or recombinant brushtail possum ZP3 protein [J].Journal of Reproductive Immunology,2009,82(1):40-47.
[24] Duckworth J A,Cui X,Scobie S,et al.Development of a contraceptive vaccine for the marsupial brushtail possum (Trichosurusvulpecula):Lack of effects in mice and chickens immunised with recombinant possum ZP3 protein and a possum ZP3 antifertility epitope [J].Wildlife Research,2008,35(6):563-572.
[25] Cui X L,Duckworth J A,Lubitz P,et al.Humoral immune responses in brushtail possums (Trichosurusvulpecula) induced by bacterial ghosts expressing possum zona pellucida 3 protein [J].Vaccine,2010,28(26):4268-4274.
[26] 张 浩,韩崇选,郑雪莉,等.草兔卵透明带3(ZP3)基因的克隆与序列分析 [J].西北林学院学报,2013,28(6):63-68.
Zhang H,Han C X,Zheng X L,et al.Cloning and sequence analysis ofLepuscapensiszona pellucida 3 cDNA [J].Journal of Northwest Forestry University,2013,28(6):63-68.(in Chinese)
[27] Upadhyay S N,Thillaikoothan P,Bamezai A,et al.Role of adjuvants in inhibitory influence of immunization with porcine zona pellucida antigen (ZP-3) on ovarian folliculogenesis in bonnet monkeys:A morphological study [J].Biology of Reproduction,1989,41(4):665-673.
[28] Bagavant H,Thillai-Koothan P,Sharma M G,et al.Antifertility effects of porcine zona pellucida-3 immunization using permissible adjuvants in female bonnet monkeys (Macacaradiata):Reversibility,effect on follicular development and hormonal profiles [J].Journals of Reproduction & Fertility,1994,102(1):17-25.
[29] Wood D M,Liu C,Dunbar B S.Effect of alloimmunization and heteroimmunization with zonae pellucidae on fertility in rabbits [J].Biology of Reproduction,1981,25:439-450.
[30] Skinner S M,Mills T,Kirchick H J,et al.Immunization with zona pellucida proteins results in abnormal ovarian follicular differentiation and inhibition of gonadotropin-induced steroid secretion [J].Endocrinology,1984,115:2418-2432.
[31] Sehgal S,Gupta S K,Bhatnagar P.Long-term effects of immunization with porcine zona pellucida on rabbit ovaries [J].Pathology,1989,21:105-110.
[32] Xiang R L,Zhou F,Yang Y,et al.Construction of the plasmid pCMV4-rZPC’ DNA vaccine and analysis of its contraceptive potential [J].Biology of Reproduction,2003,68(5):1518-1524.
[33] Rankin T,Dean J.The zona pellucida:Using molecular genetics to study the mammalian egg coat [J].Reviews of Reproduction,2000,5(2):114-121.
[34] Satish K G,Gupta N,Suman P,et al.Zona pellucida-based contraceptive vaccines for human and animal utility [J].Journal of Reproductive Immunology,2011,88:240-246.
[35] Sacco A G.Antigenic cross-reactivity between human and pig zona pellucida [J].Biology of Reproduction,1977,16:164-173.
[36] Sacco A G,Pierce D L,Subramanian M G,et al.Ovaries remain functional in squirrel monkeys (Saimirisciureus) immunized with porcine zona pellucida 55 000 macromolecule [J].Biology of Reproduction,1987,36:481-490.
[37] 张 浩.草兔卵透明带3(ZP3)基因的克隆分析及原核表达初探 [D].陕西杨凌:西北农林科技大学,2013.
Zhang H.Cloning,sequence analysis and prokaryotic expression of hare (Lepuscapensis) zona pellucida 3 [D].Yangling,Shaanxi:Northwest A&F University,2013.(in Chinese)
[38] Bleil J D,Wassarman P M.Identification of a ZP3-binding pr-otein on acrosome-intact mouse sperm by photoaffinity crosslinking [J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(14):5563-5567.
Construction and expression of eukaryotic expression vector ofZP3 gene fromLepuscapensis(brown hare)
WU Jing-long,SUI Dan-dan,ZHANG Dong-hui,ZHOU Zhi-min, LI Hao,ZHENG Xue-li,HAN Chong-xuan
(CollegeofForestry,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The eukaryotic expression vector ofZP3 gene fromLepuscapensis(brown hare) was constructed by recombinant-DNA technique and expressed in RK-13 cells to improve the study of immunocontraception.【Method】 The ovarian RNA was purified from rabbit (Lepuscapensis) ovaries.The full-length ofZP3 gene cloned with RT-PCR was connected with the pEGFP-N1 vector to form pEGFP-N1-ZP3 expression vector before being expressed in RK-13 cells.The expression ofZP3 was detected with RT-PCR,Western Blot analysis and fluorescence microscopy.【Result】 The full-length ofZP3 gene was 1 260 bp,and the recombinant plasmid pEGFP-N1-ZP3 was successfully constructed.The recombinantZP3 obtained from RK-13 cells was 73 ku.Western Blot and RT-PCR further proved that the pEGFP-N1-ZP3 was expressedinvitro.【Conclusion】 This is the first study that successfully cloned the recombinantZP3 into eukaryotic expression vector and expressed it in RK-13 cells.
Lepuscapensis(brown hare);zona pellucida 3 (ZP3) gene;immunocontraception;pEGFP-N1;eukaryotic expression
时间:2015-10-13 08:46
10.13207/j.cnki.jnwafu.2015.11.002
2014-03-31
国家林业公益性行业专项(201404405);西北农林科技大学基本科研业务费项目(QN2012036)
吴景龙(1986-),男,河南南阳人,硕士,主要从事草兔免疫不育疫苗研究。E-mail:lifehouse635@163.com
韩崇选(1962-),男,陕西西安人,教授,主要从事森林鼠、兔害治理研究。E-mail:sendakingcat@qq.com
S829.1
A
1671-9387(2015)11-0009-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151013.0846.004.html
