荧光分析活性氧在血管紧张素Ⅱ诱导心肌成纤维细胞增殖中的作用
2015-01-04王立英苏海燕王璇周艳杨世杰北华大学基础医学院生理教研室吉林0吉林省肿瘤医院预防保健科长春00吉林大学基础医学院药理教研室长春00
王立英苏海燕王璇周艳杨世杰(北华大学基础医学院生理教研室,吉林0)(吉林省肿瘤医院预防保健科,长春00)(吉林大学基础医学院药理教研室,长春00)
荧光分析活性氧在血管紧张素Ⅱ诱导心肌成纤维细胞增殖中的作用
王立英1苏海燕2王璇1周艳*1杨世杰31(北华大学基础医学院生理教研室,吉林132013)2(吉林省肿瘤医院预防保健科,长春130021)
3(吉林大学基础医学院药理教研室,长春130021)
应用荧光分析方法探讨活性氧(Reactive oxygen species,ROS)在血管紧张素Ⅱ (AngiotensinⅡ,Ang Ⅱ)诱导心肌成纤维细胞(Myofibroblasts,myoFbs)增殖中的作用。实验中采用胰酶消化法分离、培养原代新生大乳鼠myoFbs,10%胎牛血清培养,采用2~3代myoFbs,并随机分为正常对照组、AngⅡ处理组、N-乙酰半胱氨酸(N-Acetyl-L-cysteine,NAC)干预组,培养12、24和36 h后,分别采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5)-Dimethylthiahiazo(-z-yl)-3,5-diphenyt-etrazoliumromide,MTT)法测定myoFbs的增殖率;硝酸酶还原法检测myoFbs产生羟自由基(·OH)的量;利用荧光探针DCFH-DA分析检测myoFbs中ROS的水平;免疫细胞化学染色法及荧光共聚焦测定p-PKCα的表达及膜转位。结果显示一定浓度的AngⅡ作用myoFbs 24 h时myoFbs增殖率明显增加(η值(%)为117.05);并诱导myoFbs产生大量ROS,其中myoFbs增殖率越高,·OH的含量(94.53±1.68)越高;免疫细胞化学染色及荧光共聚焦可见,AngⅡ能明显促进p-PKCα的表达及膜转位(与对照组比较p<0.01或p<0.001);NAC(10-4mol/L)可抑制AngⅡ引起myoFbs的增殖(OD值为0.357±0.13),减少myoFbs内ROS及·OH的量(75.57±1.48),抑制p-PKCα的表达及膜转位。
N-乙酰半胱氨酸;血管紧张素Ⅱ;氧自由基;心肌成纤维细胞;蛋白激酶Cα;活性氧
1 引 言
在我国,心血管疾病已经成为仅次于癌症的第二号杀手,防止心血管疾病发生发展并降低其致死致残率已成为我国21世纪提高人民健康水平的重中之重[1]。引起心脏病患者心肌组织变化主要是纤维细胞(Myofibroblasts,myoFbs)数量增多引起纤维化(Myofibrosis,MF),主要是myoFbs的增殖及间质的纤维化,并引起心脏收缩功能障碍、心律失常及室颤,最终引起难治性心力衰竭,这是多种心脏疾病发展的共同结局。临床上抗MF和逆转心肌重塑治疗过程中,先治疗心脏的原发病,同时加强抗MF的治疗,因此,明确MF发生的机制,寻找有效抑制MF甚至逆转MF的药物,减少猝死的发生机率,具有重要的现实意义,并已成为医学研究的重点[2,3]。
目前,MF发生机制的研究多侧重于在体条件下各项指标的检测,细胞内的信号分子研究较少,且均采用传统的免疫生化指标的检测。为明确MF发生时的细胞内信号转导机制,着手于体外培养myoFbs,采用荧光分析方法探讨MF时细胞内各种信号分子的变化,为MF的治疗提供可靠依据。
大量研究表明,氧化应激产生的各种氧自由基(Oxygen free radicals)对心血管具有细胞毒性作用,是许多心血管疾病发生的重要机理[4]。文献[5]报道氧化应激产生的适量氧自由基可作为细胞内信号转导分子,参与调节细胞功能。本研究以AngⅡ为myoFbs氧化应激的诱导剂,通过荧光探针DCFHDA,荧光共聚焦分析及NAC干扰,探讨myoFbs增殖过程中ROS量的变化及在其中的作用,明确心肌重塑细胞内信号转导机制及治疗靶点,为心血管疾病的防治提供参考。
本实验的前期工作中发现蛋白激酶C(Protein kinase C)参与到了MF过程中,在心肌PKC亚型中, PKCα在心肌的表达量最高,磷酸化后可由胞浆转移至胞膜,引起系列细胞内信号传导,从而引起细胞生物学效应改变。以往的研究多通过Westen blot等方法来探讨PKCα在myoFbs增殖中的作用。本实验通过荧光分析PKCα在myoFbs增殖及MF过程中的作用,为抗MF和逆转心肌重塑提供了新的治疗靶点。
2 实验部分
2.1 仪器、试剂及动物
荧光共聚焦显微镜和CKX41倒置显微镜(日本Olympus公司);UV-5300紫外分光光度计(上海元析仪器有限公司);9602A酶标仪(北京艾普生物设备有限公司);HERAEUSCO2培养箱(中国苏净集团安泰公司)。活性氧检测试剂盒(Reactive oxygen species assay kit,ROS碧云天生物技术研究所);OH测定试剂盒(南京建成生物工程公司)。
Iscove′s Modified Dulbecco′s Medium(IMDM)培养基(Gibco公司);小牛血清(杭州四季青公司);胰蛋白酶(Dfico公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、NAC、血管紧张素Ⅱ(Ang Ⅱ)均购于Sigma公司;PKCα一抗(羊抗大鼠p-PKCα抗体,Santa Cruz公司)。Wistar乳鼠(清洁级,由吉林大学动物部提供)。
2.2 实验分组和给药
MyoFbs随机分为对照组、AngⅡ处理组及NAC干预组。各组细胞无血清培育12 h后,均给予1%血清的IMDM培养基,除对照组外,均给予终浓度为10-7mol/L AngⅡ,NAC干预组同时给予NAC,终浓度为1×10-4mol/L。
2.3 MyoFbs的分离与培养
取Wistar大鼠,1~3日龄,无菌开胸取心脏,预冷D-Hank′s液清洗两次,剪成1 mm3碎片,0.125%胰蛋白酶反复消化(37℃水浴,5min/次),收集各次消化上清液,离心(1200 r/min,10min),弃上清液,用含10%胎牛血清的IMDM培养基重悬沉淀,制成细胞悬液,接种于培养瓶中,置37℃、5%CO2培养箱内培养。实验采用第2~3代细胞。
2.4 细胞增殖(M TT法)
将处于对数生长期的myoFbs制成细胞悬液,以1×105个/mL浓度接种于96孔板,每孔200μL。分别给予不同的处理因素作用48 h。每孔加入5 mg/LMTT溶液20μL,37℃继续培养4 h,终止培养,每孔加入150μL DMSO,振荡10min后,酶标仪上于490 nm波长测吸光度(A)。
2.5 MyoFbs内·OH含量和ROS的测定
将处于对数生长期的myoFbs制成细胞悬液,以1×105个/mL浓度接种于96孔板,每孔200μL。分别给予不同的处理因素作用24 h,按试剂盒说明书进行检测。24孔板培养的myoFbs培养48 h后,各组无血清培育12 h,各种处理因素作用24 h后,以PBS溶液冲洗3次,去除细胞培养液;加入终浓度为10mmol/L DCFH-DA,在37℃细胞培养箱内孵育20min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。用荧光共聚焦显微镜观察myoFbs内的ROS,颜色越深,表明ROS生成量越多。
2.6 免疫细胞化学染色检测p-PKCα膜转位和表达
将第3代myoFbs放入预先放置了10 mm×10 mm盖玻片的24孔板,置于37℃、5%CO2培养箱内培养48 h,各组无血清培育12 h,各种处理因素作用24 h后,将生长有myoFbs的盖玻片取出,用预热的PBS洗涤3次,每次5min,4%多聚甲醛固定30min,晾干后用SP法进行免疫细胞化学染色,阳性反应呈棕黄色细密颗粒。应用MediaCybernetics公司的Image-Pro Plus5.0V图像分析软件分析各组p-PKCα 在myoFbs中表达的平均光密度值,每个视野取5个myoFbs。
2.7 荧光共聚焦检测p-PKCα膜转位和表达
MyoFbs的培养及处理的前期步骤同2.6节,4%多聚甲醛固定30min,PBS洗涤3次,0.3%Triton X+100破膜15min,PBS或蒸馏水洗涤3次,1%胎牛血清封闭30min,蒸馏水冲洗3次后,加入1∶100稀释的p-PKCα一抗(每孔300μL),4℃过夜,次日PBS洗涤3次,加入1∶100稀释的荧光标记的兔抗山羊二抗(每孔200μL),避光37℃孵育30min,每孔加入300μL PI继续孵育15min,PBS洗涤3次后,每孔加500μL PBS,检测,阳性反应呈绿色细密颗粒。应用Image-Pro Plus5.0V图像分析软件分析各组p-PKCα在myoFbs中表达的平均绿色光密度值,每个视野取5个myoFbs。此方法便于直接观察p-PKCα的膜转位及表达量的变化。红色代表myoFbs的胞核。
3 结果与讨论
3.1 AngⅡ对体外培养的myoFbs增殖作用的影响
细胞增殖率按给药与对照组吸光度(A490)的百分比计算得出。从表1数据可知,不同浓度的AngⅡ作用myoFbs12 h时,与对照组相比,与对照组相比细胞增殖不明显;作用24 h时,与对照组相比,不同浓度AngⅡ(10-8~10-6moL/L)均可促进myoFbs增殖。浓度为10-7moL/L的AngⅡ作用时间为24 h,在三组中细胞增殖率达到最大(η,%为170.15),随着AngⅡ浓度的升高,作用时间的延长,细胞增殖率反而逐渐降低。目前认为,肾素-血管紧张素-醛固酮系统的激活是诱发及引起MF的主要发病机制, AngⅡ是最为常见的胞外刺激信号,也是重要的致炎致纤维化的因子,是引起MF致心肌重塑的关键物质。AngⅡ可与血管紧张素受体1(AT1)结合激活蛋白激酶C-丝裂素活化蛋白激酶系统[6]一系列细胞信号途径促进myoFbs增殖。MyoFbs增殖需要适宜的AngⅡ浓度及作用时间。若浓度过低、时间过短, myoFbs增殖不明显;而浓度过高、时间过长、由于渗透压及营养物质消耗殆尽等,myoFbs增殖反而降低。由表1可知,AngⅡ作用细胞24h,浓度为10-7moL/L时,与各对照组相比,细胞增殖率明显升高(p<0.001)。
3.2 NAC对AngⅡ诱导myoFbs增殖的抑制作用
AngⅡ作用myoFbs 24 h后与对照组相比,细胞增殖率明显升高(p<0.01);与AngⅡ组相比,NAC组细胞增殖率明显降低(p<0.01)。NAC可抑制AngⅡ诱导myoFbs增殖的作用。NAC分子中的活性巯基(-SH),可对抗不同原因所致的组织氧化损伤。对体内氧自由基(超氧阴离子·、H2O2、羟自由基·OH等)具有明显的拮抗作用;由于NAC易进入细胞内,对能透过细胞膜与多种细胞成分反应、导致心肌细胞损伤坏死并发生纤维化的H2O2、·OH具有抑制、清除作用[7],而抑制 myoFbs增殖,减轻MF,见表2。
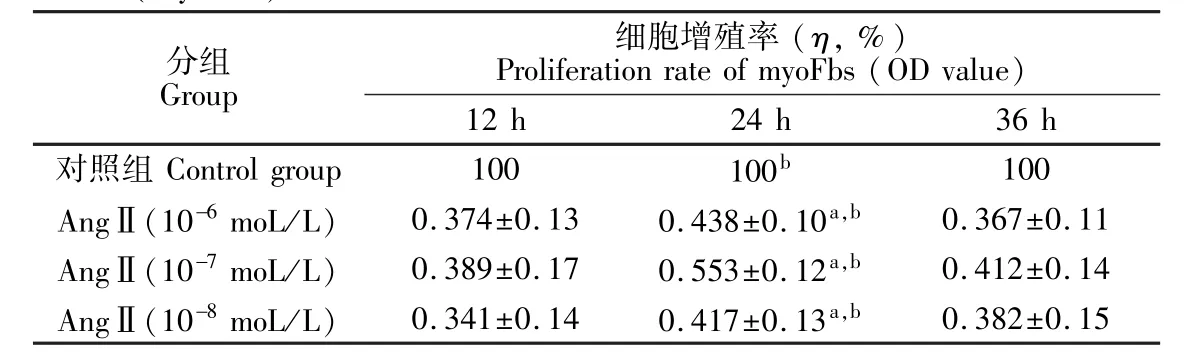
表1 不同浓度的AngⅡ在不同时间对myoFbs增殖的影响Table 1 Effect of angiotensinⅡ(AngⅡ)on the proliferation ofmyofibroblasts(myoFbs)in different concentrations and time
表2 NAC对AngⅡ诱导myoFbs增殖的抑制作用(±s)Table 2 Inhibition of N-actyl-L-cysteine(NAC)on the proliferation of myoFbs induced by AngⅡ(mean±SD)group.
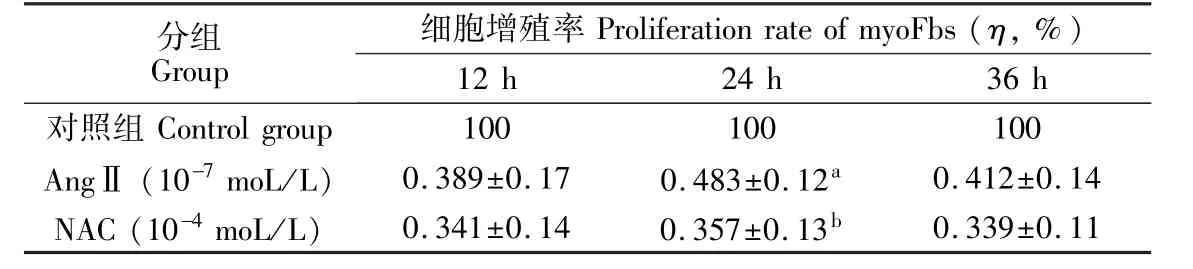
表2 NAC对AngⅡ诱导myoFbs增殖的抑制作用(±s)Table 2 Inhibition of N-actyl-L-cysteine(NAC)on the proliferation of myoFbs induced by AngⅡ(mean±SD)group.
ap<0.001与对照组比较;bp<0.05 vs.AngⅡgroup。ap<0.001 vs.control group;bp<0.05 vs.AngⅡ
分组Group细胞增殖率Proliferation rate ofmyoFbs(η,%)12 h 24 h 36 h对照组Control group 100 100 100 AngⅡ(10-7moL/L) 0.389±0.17 0.483±0.12a 0.412±0.14 NAC(10-4moL/L) 0.341±0.14 0.357±0.13b 0.339±0.11
表3 NAC对AngⅡ诱导myoFbs内·OH含量的抑制作用(±s)Table 3 Inhibition of NAC on the content of OH· in myoFbs induced by AngⅡ(mean±SD)
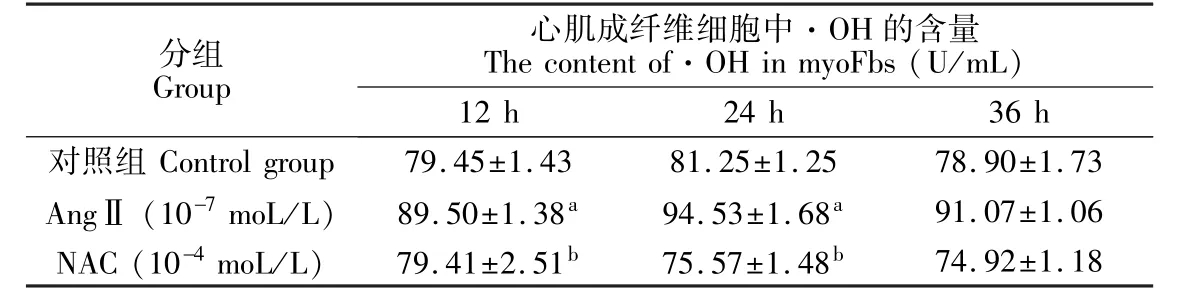
表3 NAC对AngⅡ诱导myoFbs内·OH含量的抑制作用(±s)Table 3 Inhibition of NAC on the content of OH· in myoFbs induced by AngⅡ(mean±SD)
ap<0.05与对照组比较;bp<0.01与AngⅡ组比较。ap<0.05 vs.control group;bp<0.01 vs.AngⅡgroup.
分组Group心肌成纤维细胞中·OH的含量The content of·OH in myoFbs(U/mL)12 h 24 h 36 h对照组Control group 79.45±1.43 81.25±1.25 78.90±1.73 AngⅡ(10-7moL/L) 89.50±1.38a 94.53±1.68a 91.07±1.06 NAC(10-4moL/L) 79.41±2.51b 75.57±1.48b 74.92±1.18
3.3 NAC对AngⅡ诱导myoFbs内·OH含量的影响
由表 3可见,AngⅡ作用于myoFbs不同时间,引起myoFbs产生·OH的量呈时间依赖性,随着时间延长,myoFbs内·OH的量逐渐增加,与对照组相比差异显著(p<0.01)。NAC干预组与AngⅡ处理组相比,·OH的产生量明显降低(p<0.05),而与对照组相比差异不显著(p>0.05)。可见NAC对myoFbs内·OH的产生具有抑制作用。NAC能够通过减少·OH的生成而抑制myoFbs的增殖。
3.4 NAC对AngⅡ诱导myoFbs内ROS含量的影响
采用荧光共聚焦显微镜直接观察myoFbs内ROS量的变化,在myoFbs胞浆中可见到绿色的荧光颗粒,便是ROS的表达,绿色越深,表明ROS量越高。与对照组相比,AngⅡ组ROS量最多(p<0.01);与AngⅡ组相比,NAC组ROS含量较少(p<0.05),见图1A。图1B是应用Image-Pro Plus5.0V图像分析软件分析图1A各组ROS的量绘制而成。
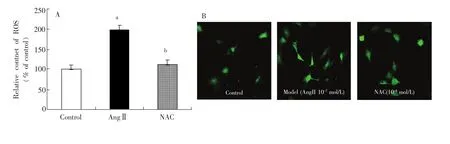
图1 荧光共聚焦(A)和定量分析(B)N-乙酰半胱氨酸对血管紧张素Ⅱ诱导的心肌成纤维细胞内活性氧含量的影响(400×)Fig.1 NAC effects on content of reactive oxygen species(ROS)by AngⅡ in membrane ofmyoFbs with a laser confocal scanningmicroscope(A)and quantitative analysis(B)(400×)a:p<0.01 vs control group;b:p<0.05 vs AngⅡgroup.
利用活性氧检测试剂盒测定ROS,活性氧检测试剂盒是一种利用荧光探针DCFH-DA进行ROS检测的试剂盒。DCFH-DA本身无荧光,可以自由穿过细胞膜,进入细胞内,可被细胞内的酯酶水解,生成DCFH。而DCFH不能通透细胞膜,使探针很容易地被装载到细胞内。细胞内的ROS可以氧化无荧光的DCFH,生成DCF。检测DCF的荧光即可知细胞内ROS的水平[8,9]。由于myoFbs是贴壁培养细胞,因而采用原位装载探针方法,即按照1∶1000用无血清培养液稀释DCFH-DA,使终浓度为10μmol/L,去除细胞培养液,于24孔板的一个孔加入至少300μL已稀释的DCFH-DA。在37℃细胞培养箱内孵育20min。用无血清细胞培养液洗涤细胞3次,充分去除未进入细胞内的DCFH-DA[1]。AngⅡ能提高NADH/NADPH氧化酶的生物学活性及促进ROS的产生,而引起心肌肥厚[10]。少量ROS可调节心肌细胞的正常生理功能,而不损伤心肌细胞的作用。但在过量AngⅡ刺激因子的影响下,还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶被异常激活,产生了过量ROS,引起MF[11]。ROS参与了MF的发生发展过程及导致心肌重塑[12]。此种测定ROS量的方法适用于各种贴壁细胞。
3.5 NAC对AngⅡ诱导myoFbs内p-PKCα膜转位及表达的影响
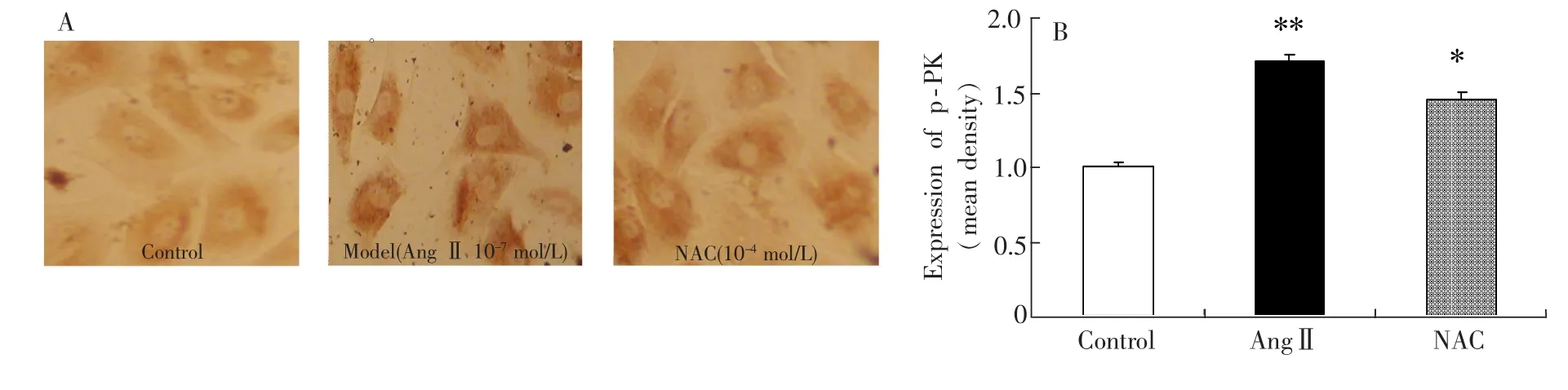
图2 免疫化学分析(A)和定量分析(B)N-乙酰半胱氨酸对p-PKCα在血管紧张素Ⅱ诱导的心肌成纤维细胞膜转位及表达的影响(200×)Fig.2 NAC effect ontranslocation and expression of p-protein kinase Cα(p-PKCα)induced by AngⅡ in membrane ofmyoFbs with immunohistochemistry(A)and quantitive analysis(B)(200×)**:p<0.01 vs.control group;*:p<0.05 vs.AngⅡgroup.
免疫组化(图2A)可见,褐色的深浅表明p-PKCα的表达和转位情况,褐色越深,表明p-PKCα的表达和膜转位越多;荧光共聚焦(图3A)可见,绿色代表p-PKCα的表达和膜转位,红色代表myoFbs的胞核。绿色越深,表明p-PKCα的表达和膜转位越明显;利用Image-ProPlus5.0V图像分析软件分析图2A和图3A,分别得图2B和图3B。由以上可知:AngⅡ作用myoFbs48h后与对照组相比,p-PKCα的表达明显增加(p<0.01);而NAC组却降低了p-PKCα的表达。PKC(α,β1,β2,δ,ε和ζ)存在于成年大鼠和新生大鼠的成纤维细胞中[13]。AngⅡ可以与血管紧张素受体1(AT1)结合并激活PKC,从而引起成纤维细胞增殖[14]。有研究表明,PKCα参与MF过程[15],但目前对其在 MF过程中的作用研究甚少。PKCα涉及多种器官纤维化的过程,如肾脏和心脏[16],可能是引起其纤维化过程的必经传导的共同通路。因此,PKCα在MF过程中的信号转导通路中具有极其复杂的作用。正常生理情况下,未活化的PKCα只存在于胞浆中,当AngⅡ作用于体外培养的myoFbs时,可促进PKCα的活化形成p-PKCα,并大量表达在胞膜。AngⅡ是通过促进p-PKCα的表达而引起MF(图2)。
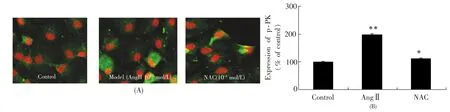
图3 荧光共聚焦(A)和定量分析(B)分析N-乙酰半胱氨酸对p-PKCα在血管紧张素Ⅱ诱导的心肌成纤维细胞膜转位及表达的影响(400×)Fig.3 NACeffectsontranslocationandexpressionofp-PKCαinducedbyAngⅡinmembraneofmyoFbswith alaserconfocalscanningmicroscope(A)andquantitativeanalysis(B)(400×)**:p<0.001vs.controlgroup;*p<0.01vs.AngⅡgroup.
4 结论
采用荧光免疫化学方法分析ROS在AngⅡ诱导myoFbs增殖中的作用,发现AngⅡ能够促进myoFbs增殖并导致MF;表明ROS和p-PKCα在AngⅡ诱导myoFbs增殖并导致MF过程中发挥着重要的作用。NAC通过降低·OH的含量和抑制p-PKCα的膜转位和表达从而抑制myoFbs的增殖和MF。此研究结果为从ROS-PKCα信号转导途径来治疗MF和逆转心肌重塑提供了可能的治疗靶点。
1 ZHANGXing-Guang,YIGui-Yan,LÜXiao-Feng,LIUHan-Ju,XUXiu-Ping,JIAOXiu-Min.ChineseJ.Anal.Chem., 2012,40(6):955-959
张星光,依桂艳,吕肖锋,刘汉菊,许秀萍,焦秀敏.分析化学,2012,40(6):955-959
2 WangLY,LiH,YangSJ,GuanFY.AfricanJ.Pharm.Pharmacol.,2012,29(7):2100-2011
3 WangLY,LiH,YangSJ.ChemicalResearchinChineseUniversities,2012,28(1):84-90
4 GUYu-Mei,WUYang.JournalofNantongUniversity:MedicalSciences,2005,5(3):233
顾玉梅,吴扬.南通大学学报(医学版),2005,25(3):233
5 LIANGHe,DONGShuang-Hai,XIATian,JIANGMin-Bo,TIANJi-Wei.ProgressinModernBiomedicine,2015, 14(15):2777-2779
梁鹤,董双海,夏天,江民波,田纪伟.现代生物医学进展,2015,14(15):2777-2779
6 YuM,ZhengY,SunHX,YUDJ.Molecules,2012,17(3):2738-2751
7 BAOHong-Rong,TONGLi-Li.ZhejiangClinicalMedicineJournal,2008,10(9):1274
鲍红荣,童立力.浙江临床医学,2008,10(9):1274
8 ZielondaJ,HardyM,KalyanaramanB.FreeRadicalBiol.Med.,2009,46(3):329-338
9 SorescuD,GriendlingKK.CongestHeartFail,2002,8(3):132
10 ZHANG Xin.Modern Preventive Medicine,2010,37(22):4316-4318
张鑫.现代预防医学,2010,37(22):4316-4318
11 Jiang B,Du J,Liu JH,Bao Y M,An L J.Brain.Res.,2008,1188(1):139-147
12 Chen Y R,Nie SD,Shan W,Jiang D J,Shi R Z,Zhou Z,Guo R,Zhang Z,Li Y J.Eur.J.Pharmacol.,2007, 571(1):44-50
13 Zhang S,Li H,Yang S J.Acta Pharmacologica Sinica,2010,31(6):671-678
14 YIChun-Tao.Foreign Medical Sciences,2002,8(3):344-346
易春涛.国外医学生理、病理科学与临床分册,2002,8(3):344-346
15 WANG Yan-Chun,Guan Feng-Ying,Li Hong,YANG Shi-Jie.Acta Pharm Sin.,2009,44(6):591-596
王艳春,关凤英,李红,杨世杰.药学学报,2009,44(6):591-596
16 DONGNing.Jilin University Master Thesis,2010,4:1
董宁.吉林大学硕士论文,2010,4:1
(Received 23 April 2015;accepted 18 August2015)
This work was supported by the National Natural Science Foundation of China(No.30873066/C180102)and the Major State Basic Research Development Program(No.2007CB512006)
Role of Reactive Oxygen Species by Fluorescence Analysis in Proliferation of M yofibroblasts Induced by AngiotensinⅡ
WANG Li-Ying1,SU Hai-Yan2,WANG Xuan1,ZHOU Yan*1,YANG Shi-Jie31(Physiology Department ofBasic Medicine College of Beihua University,Jilin 132013,China)
2(Preventive Health Department of Tumor Hospital of Jilin Province,Changchun 130021,China)
3(Pharmocology Department of Basic Medicine College of Jilin University,Changchun 130021,China)
Fluorescence analysiswas performed to explore the role of reactive oxygen species(ROS)in the proliferation ofmyofibroblasts(myoFbs)induced by angiotensinⅡ(AngⅡ).Primary cultures of neonatal rat myoFbswere obtained by enzymatic dissociation ofWistar rat neonates,and myoFbswere cultured under 10% fetal bovine serum.MyoFbs of2-3 generation cultured in vitrowere used in experiments and divided into three groupswhich were treated by AngⅡ,AngⅡ +N-acetyl-L-cysteine(NAC),and normal culture medium, respectively.MyoFbswere cultured for 12,24 and 36 h.In the experiment,the proliferation rate ofmyoFbs induced by AngⅡ under different concentrations of 3-(4,5)-dimethylthiazo(-z-yl)-3,5-diphenyletrazoliumromide(MTT)was detected,the ROS levels ofmyoFbswere detected by fluorescent probes in 2′, 7′-dichlorofluorescein fluorescence Huang Shuang acetate(DCFH-DA),and the contents and levels of oxygen free radicals(·OH)in three groups were detected by spectrophotometry,immunocytochemical staining and fluorescence confocal.Immunocytochemical staining and fluorescence confocal analysis was used to measure membrane translocation and expression of p-protein kinase Cα(p-PKCα).The results showed thatmyoFbs incubated with AngⅡ(10-8-10-6mol/L)for 24 h increased the proliferation rate(the value ofη(%)was 170.15)and ROS,especially the content of·OH(94.53±1.68)reached the highest level.The immunocytochemistry,confocal fluorescence staining and image analysis result showed that AngⅡ could increase the translocation and expression of p-PKCαin membrane(p<0.001 vs control group);NAC could inhibit the proliferation of myoFbs induced by AngⅡ (the value ofη(%)was 117.05),decrease the content of ROS and the levels of·OH(75.57±1.48),and inhibit the translocation and expression of p-PKCαin membrane.
N-Acetyl-L-cysteine;AngiotensinⅡ;Oxygen free racical;Myofibroblasts;Protein kinase Cα;Reactive oxygen species
10.11895/j.issn.0253-3820.150331
2015-04-23收稿;2015-08-18接受
本文系973重大基础研究基金资助课题(No.2007CB512006),国家自然科学基金项目 (No.30873066/C180102),博士启动基金(No.199500033),吉林市科技计划项目(No.201536058)资助
E-mail:ly741023@126.com
