磁性纳米粒子复合物固定漆酶电极作为酶燃料电池阴极和氧电化学传感器的性能研究
2015-01-04曾涵杨阳李小娟白希新能源材料化学实验室新疆师范大学化学化工学院乌鲁木齐830054
曾涵杨阳 李小娟 白希(新能源材料化学实验室,新疆师范大学化学化工学院,乌鲁木齐830054)
磁性纳米粒子复合物固定漆酶电极作为酶燃料电池阴极和氧电化学传感器的性能研究
曾涵*杨阳 李小娟 白希
(新能源材料化学实验室,新疆师范大学化学化工学院,乌鲁木齐830054)
以邻苯二甲酰化壳聚糖和磁性Fe3O4纳米粒子纳米复合物为载体,通过吸附方式固定漆酶分子,并将固酶复合物滴涂在电极表面室温干燥得到固定漆酶基电极,采用循环伏安法、线性扫描伏安法和计时电流法测试了此电极作为酶燃料电池阴极的催化氧还原性能和作为氧电化学传感器的使用性能。实验结果表明,电极在不含电子中介体的溶液中出现一对表征酶活性中心T1与导电基体之间直接单电子准可逆迁移的氧化还原峰信号(中值电位是798 mV,非常接近漆酶活性中心T1的式电位780 mV),导电酶分子表面浓度为1.5×10-9mol/cm2,电子迁移速率0.05 s-1,氧还原起始电位930 mV,单位时间内底物转化频率0.3个/s。最佳检测条件下,此电极在氧气浓度2.6~33.9μmol/L的范围内,稳态催化电流与氧气浓度能保持良好的线性关系,对氧检出限为0.86μmol/L,,灵敏度17.2μA·L/μmol,米氏常数KM=131.1μmol/L。此电极具有良好的重现性和长期使用性,在pH=4.4时具有最大的催化活力。
邻苯二甲酰化壳聚糖;磁性Fe3O4纳米粒子;漆酶;酶燃料电池阴极;电化学传感器
1 引 言
酶燃料电池由于具有催化选择性和能量转化效率高等优点,是极有发展前景的能量转化装置之一[1],目前,制约酶基燃料电池性能的关键因素是阴极电催化还原过程[2],提高酶-电极间直接电子迁移速率是改善固酶阴极性能的关键[3,4]。漆酶(Laccase,Lac)因具有较高的氧化还原式电位被认为是最适宜的电化学催化剂[5,6],但因其结构非常复杂不利于电子在导电基体和酶活性中心之间发生直接迁移,引入媒介体会降低电极的能量输出,而且电极催化底物反应的长期稳定性和生物相容性也较低[7]。目前,已有多种方法可实现Lac分子和电极之间的直接电子迁移[8,9],但对固酶载体结构、形貌以及酶基电极构筑方法等因素对酶基电极催化氧还原动力学的影响缺乏系统的讨论,已有文献报道也缺乏对酶催化过程动力学的定量分析,更重要的是这些电极没有表现出酶与电极之间直接电子迁移的电化学信号[8,9],不利于分析固酶电极催化动力学机制。
磁性纳米粒子具有易制备、导电性能好、粒径和粒子表面官能团结构可控,以及易于磁性分离等优点,常作为固酶载体[10,11]。目前的固酶磁性纳米粒子修饰电极多数需要对市售电极进行改装或自制[10],而且磁性纳米粒子固酶电极由于引入化学试剂对酶活性中心空间构型的影响,导致电极催化性能受到极大影响[11]。壳聚糖及其衍生物对Lac具有较好的生物相容性和良好的成膜性[7,12],但壳聚糖及其衍生物不导电,不适合单独作为电极表面的固酶载体。文献[13,14]表明,具有芳香性环状结构的分子可接近Lac活性中心T1,利于酶性中心-导电基体之间的直接电子迁移,因此将含有芳环结构的壳聚糖衍生物与磁性纳米粒子机械共混,就有可能获得制备简单、性能稳定且可实现酶-电极间有效电子迁移的固酶电极。
通过将邻苯二甲酰化壳聚糖与磁性Fe3O4纳米粒子机械共混制备力学性能良好的磁性纳米粒子复合物,进一步制备了固定Lac的磁性纳米粒子复合物修饰电极,测试了其作为酶燃料电池阴极的直接电化学行为和催化氧还原性能,检测了其作为氧电化学传感器的性能。本研究结果不仅有利于了解酶活性中心在在催化过程中所起的作用和发生的变化,还为合成高性能的“人工酶”提供有价值的参考。
2 实验部分
2.1 仪器和试剂
2K15型高速离心机(德国Sigma公司),BRUKER EQUINDX-55型红外光谱仪(德国BRUKER公司,KBr压片),Analyst 800型原子吸收光谱仪(美国Perkin-Elmer公司),U-2810型紫外可见分光光度计(日本岛津公司),JSM-6700F型场发射扫描电子显微镜(日本JEOL公司,加速电压:0.5~30 kV), CHI-1140A型电化学分析仪(上海辰华公司),AFMSRCE型旋转圆盘电极系统(美国Pine公司)。实验采用三电极体系:玻碳电极(GCE,直径5mm,天津艾达恒晟工贸有限公司),Ag/AgCl(饱和KCl)电极作为参比电极,对电极为铂丝电极。玻碳电极使用前先以1.0和0.5μm氧化铝粉浆抛光,再用丙酮和三次重蒸水超声清洗各2次。如无特殊说明,所有电极电位均为相对于NHE(标准氢参比电极)而言。
云芝漆酶(Lac,源自Trametes Versicolor,Mw68000),2,2′-联氮-双-(-3-乙基苯并噻唑啉-6-磺酸)-二胺盐(ABTS,纯度98.5%),购自Sigma公司;壳聚糖(CTS,脱乙酰度≥90%,Mw250000),购自上海升耀生物技术有限公司;其它化学试剂均为分析纯,购自国药集团化学试剂有限公司。0.2 mol/L磷酸盐缓冲液(PBS)。所有溶液均用Milli-Q超纯水配制。N2,O2(优级纯,南京特气公司)。
2.2 固定漆酶邻苯二甲酰化壳聚糖-Fe3O4磁性纳米粒子复合物修饰电极的构筑
邻苯二甲酰化壳聚糖的制备过程简述如下:称取CTS 2.0016 g,邻苯二甲酸酐0.9201 g,向两者的混合物中加入100 mL N,N-二甲基甲酰胺(DMF),超声共混30min。混合物在N2气氛下于150℃油浴中磁力搅拌4 h。冷却,将反应混合物浸泡在冰水混合物中至出现沉淀,使固液分层。由于邻苯二甲酸酐可溶解于醇,所以采用乙醇为抽提剂,在索氏提取器中油浴90℃抽提20 h。抽提余下的浅黄色固体残渣,再用乙醇冲洗2次后,置于干燥箱中真空(0.1 MPa,40℃)干燥过夜,得到的浅黄色固体即为精制过的邻苯二甲酰接枝壳聚糖(PHCTS);磁性Fe3O4纳米粒子按照文献[15]方法制备。
称取100mg PHCTS、150 mg磁性Fe3O4纳米粒子,加入50 mL DMF中,磁力搅拌6 h得到分散良好的悬浊液,随后加入0.5 g Lac,在4℃下继续磁力搅拌8 h,6000 r/min离心15min,使用永磁铁分离出底部沉积物,上层液相即为制备的固酶复合物。以0.2 mol/L PBS润洗沉积物2~3次,合并上清液与润洗液,测定纳米复合物固定的Lac量。分别移取20μL固酶复合物和同样体积的未固定Lac的磁性纳米粒子复合物滴涂到预处理的玻碳电极表面,室温下自然干燥得到的电极分别记为Lac/PHCTSFe3O4/GC和PHCTS-Fe3O4/GCE电极。
2.3 固酶电极的表征
修饰GCE的固酶磁性纳米粒子复合物的形貌以扫描电镜(SEM)表征。样品制备系固定/未固定Lac的磁性纳米粒子复合物分散液(pH=6.0的PBS缓冲液为分散剂)滴涂在铜网基底上,真空干燥制得。
紫外-可见(UV-vis)光谱表征:游离Lac的紫外可见吸收光谱用溶解于PBS中50mg/mL的Lac溶液测定;分别移取2.2节中制备的固定/未固定Lac的磁性纳米粒子复合物200μL,均匀地涂覆在铟锡氧化物(ITO)玻璃片上,干燥后插入比色槽中,测定UV-vis光谱。
采用石墨炉原子吸收法[16]测定固酶载体磁性Fe3O4纳米粒子复合物对Lac的担载量(mg/g)。电极的活性表面积按照文献[2]的方法标定,实验测定PHCTS-Fe3O4/GCE的实际活性表面积为0.30 cm2。
2.4 固酶电极的直接电化学及催化氧还原性能
以循环伏安法(CV)或线性扫描伏安法(LSV)研究Lac/PHCTS-Fe3O4/GCE的直接电化学行为及催化氧还原性能。以Lac/PHCTS-Fe3O4/GCE作为工作电极,不含底物的PBS缓冲液(pH 4.4)作为电解质溶液。实验中,先向溶液中鼓泡通入N2除氧至少30min,测试过程中电解液上方通入N2,使溶液保持氮气气氛。在氧还原实验前,先向PBS缓冲液中鼓泡通入高纯O2至少15min,使溶液为氧气饱和,实验中还不断向电解液上方通入O2,使溶液上方维持氧气气氛,所有测定均在25.0℃±0.4℃下进行。以极限扩散电流时电位处的电流差|iOxygen-iNitrogen|表征固酶电极的催化氧还原活力。
2.5 固酶电极作为氧电化学传感器的性能
采用计时电流法(CA)评估Lac/PHCTS-Fe3O4/GC对氧气的传感性能。计时电流曲线系固酶电极在含有一系列不同O2浓度的PBS溶液中(pH=4.4)于恒定电压下记录响应催化还原电流-时间关系曲线而得到,这一系列不同O2浓度的PBS溶液是向为N2气饱和的PBS溶液中加入不同体积的空气饱和PBS溶液而制得(为空气饱和的PBS中氧气浓度约为2.6×10-4mol/dm3),氧还原电位参考文献[7]方法,以出现极限扩散电流的电位作为工作电位。

图1 CTS(a)和PHCTS(b)的FTIR谱图Fig.1 FTIR spectra of chitosan(CTS)(a)and phthaloyl chitosan(PHCTS)(b)
3 结果与讨论
3.1 固酶磁性纳米粒子复合物的形貌和结构表征
图1为CTS和PHCTS的傅里叶变换红外光谱图(FTIR)。从图1b可见,PHCTS在1711 cm-1附近的强吸收峰是芳香酰胺的 CO振动的吸收峰,由于环状酰亚胺结构的存在,相邻两个羰基相互作用会使此吸收峰裂分,在高频区1777 cm-1附近还出现了一个吸收峰;721 cm-1的特征吸收峰对应于苯环面内CH摇摆振动;而CTS(图1a)的特征吸收峰则与文献[15]一致。从图2的紫外可见吸收光谱可见,PHCTS-Fe3O4复合物在测试的波长范围内无吸收峰,而固定Lac的磁性纳米粒子复合物在605 nm附近出现一个与游离Lac活性位T1吸收峰相近的吸收峰,对应于Lac活性中心T1氧化态铜离子的d-d配位跃迁[5]。这一现象表明,制备的磁性纳米粒子复合物固定的Lac较好地保持了游离酶T1活性中心氧化态铜中心离子的原有配位构型及其价态。由PHCTS-Fe3O4磁性纳米粒子复合物固酶前后的SEM照片(图3)可见,包覆在纳米粒子表面的PHCTS聚集成团簇,表面疏松多孔的形貌利于诱陷Lac而且利于氧气在复合物中扩散(图3a)。而固酶前后复合物的形貌有较大区别(图3b),球形团簇结构在复合物固酶后部分消失,出现了具有一定排布方向的层状结构。推测这种定向的层状结构的形成与文献[13,14]的结果类似,是由于部分酶分子依靠酶分子活性中心T1附近疏水结合位与PHCTS的芳环之间的相互作用,按一定方向排列成相互平行的层状结构。
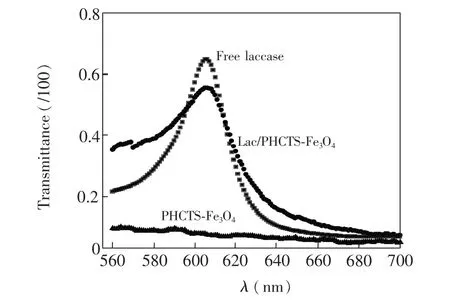
图2 游离漆酶(Lac)的PBS(pH=6.0)溶液、Lac/PHCTS-Fe3O4以及PHCTS-Fe3O4磁性纳米粒子复合物的UV-Vis谱图Fig.2 UV-vis absorption spectra of free laccase (Lac)in PBS(pH=6.0),Lac/PHCTS-Fe3O4and magnetic nano-particle composite of PHCTS-Fe3O4

图3 PHCTS-Fe3O4磁性纳米粒子复合物未固酶(a)和固酶(b)的SEM照片Fig.3 SEM images of PHCTS-Fe3O4magnetic nanoparticle composite without Lac(a)and with Lac(b)
原子吸收法测定结果表明,此磁性纳米粒子复合物与传统的固酶载体(如介孔硅微球[17]以及多孔纳米金粒子[18])相比,具有更高的Lac担载量(210.2 mg/g),更低的固酶百分率(10.5%)。
3.2 电化学方法表征固酶电极作为酶燃料电池阴极的性能
3.2.1 固酶电极的直接电化学由Lac/PHCTS-Fe3O4/GCE在N2饱和的PBS(pH=4.4)中的CV曲线(图4)可见,未固酶磁性纳米粒子复合物修饰电极在扫描电位范围内没有出现任何氧化还原峰,而固定Lac电极则分别在855和741 mV处出现了一对较为对称的氧化峰和还原峰,ip,a/ip,c=1.6,峰峰电位差为114 mV,中值电位是798 mV,非常接近漆酶活性中心T1的式电位(780 mV),表明Lac活性中心T1与电极之间发生了直接电子迁移[5]。图5是Lac/PHCTS-Fe3O4/GC在无氧PBS中以不同扫速获得的CV曲线,附图为对应的阴阳极峰电流与扫描速率之间关系的拟合曲线。从图5可见,固酶电极在不含任何底物的溶液中扫描获得的CV曲线上出现一对还原峰和氧化峰(分别位于750 mV和850 mV附近),ip,a/ip,c数值为1.2~1.6;氧化还原峰峰电位差为102~114 mV。由图5插图还可见,在测定的扫描速率范围内,扫描速率-峰电流之间保持良好的线性关系,表明酶-导电基体之间的直接电子迁移为表面控制的单电子准可逆过程。根据不同扫速所得CV曲线中积分所得氧化还原峰面积与扫速之比,求算电极表面固定的实现直接电子迁移的酶分子表面浓度Γ*:

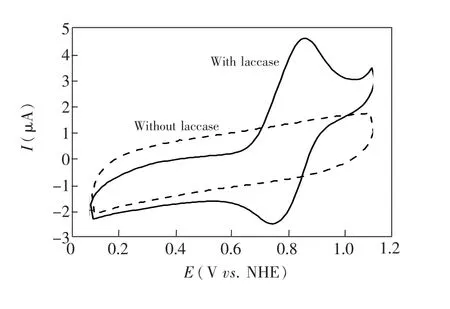
图 4 Lac/PHCTS-Fe3O4/GCE在氮气饱和的 PBS (pH=4.4)中以10 mV/s扫描获得的CV曲线Fig.4 CV curves of Lac/PHCTS-Fe3O4/GCE recorded in nitrogen gas saturated PBS(pH=4.4)at a scan rate of10 mV/s

图5 Lac/PHCTS-Fe3O4/GCE电极静态下在不含底物的无氧PBS(pH=4.4)中以不同扫描速率得到的CVs,插图为对应的阴极,阳极峰电流与扫描速率关系拟合曲线Fig.5 CV curves of Lac/PHCTS-Fe3O4/GCE electrode in deaerated PBS(pH=4.4)without any substrate recorded at variable scan rates when electrode in static status,inset:fitted curves of corresponding cathodic, anodic peak currents versus scan rates
式中,Q为酶活性中心得失电子的平均电量(扣除双层充电电量);Z为活性中心发生直接电子迁移时得失电子数,参照文献[18],设定Z=1。由此可以估测Γ*为1.5×10-9mol/cm2,这个数值是理论上酶分子在电极表面紧密单分子层排列的表面浓度(4.64× 10-12mol/cm2)[18]的近325倍,比文献[18]报道的实现直接电子迁移的纳米多孔金固定漆酶在GCE电极表面的覆盖率(2.1×10-11mol/cm2)高的多。
3.2.2 固酶电极催化氧还原性能图6是Lac/PHCTS-Fe3O4/GCE电极分别在氧气(实线)和无氧(虚线)PBS(pH=4.4)中负向扫描速率为10 mV/s条件下获得的LSV曲线。相对于无氧条件,固酶电极在氧气饱和溶液中负扫得到的还原电流在930mV处开始急剧增加,在760 mV附近出现了一个还原峰,峰电位接近于Lac活性中心T3的式电位(约 780 mV)[5,6]。固酶电极的氧还原起始电位较此pH条件下氧可逆还原式电位970 mV只低了40 mV;相对于未固酶电极的氧还原起始电位(约450 mV,图未给出),氧还原超电势降低了约520 mV。利用获得的稳态催化还原电流(以500 mV时为准)密度j=28.4μA/cm2,结合前述估算的固酶分子表面浓度,由公式:j=nkcΓF(kc为表观电催化氧还原反应速率常数;n为氧还原反应得失电子数,设定为4)可以估算出此电极上固定Lac实现直接电子迁移的速率常数为0.05 s-1。
固酶电极具有较好的力学稳定性,与文献[19]报道的氧化还原水凝胶固酶电极不同,此电极即便在电极转速高达4000 r/min时,稳态催化氧还原电流密度可达87.7μA/cm2(图7),而且电极表面无明显的破损,修饰层中的酶分子也未泄漏到溶液中(石墨炉原子吸收法检测出溶液中的Cu2+)。图7是磁性纳米粒子复合物固酶电极在氧气饱和PBS中以相同扫速不同转速扫描获得的LSV曲线,可以看出:尽管电极旋转速度从0 r/min改变到了4000 r/min,但是氧还原起始电位及还原峰电位或极限催化电流对应电位未发生明显改变,说明改变转速并没有改变催化反应机制。此电极与文献[20]报道的固酶电极类似,电极转速增大促进了氧气在电极表面修饰层中传质过程,导致催化极限电流的增加。按照文献[21]方法,可估算出固酶电极单位时间转化氧分子的频率为0.3个/s,而氧气在电极表面固酶磁性纳米粒子复合物修饰层中扩散速率为6.4×10-8cm2/s,明显低于溶液中氧分子扩散速率1.7×10-5cm2/s[20]。

图6 Lac/PHCTS-Fe3O4/GCE电极静态下分别在无氧和氧气饱和的PBS(pH 4.4)中静止状态时以10 mV/s负向扫描得到的LSVsFig.6 Linear scanning voltammograms(LSVs) of Lac/PHCTS-Fe3O4/GCE in static mode recorded in deaerated and oxygen saturated PBS(pH 4.4)at a scan rate of10 mV/s and negatively scanning

图 7 Lac/PHCTS-Fe3O4/GC在氧气饱和 PBS (pH 4.4)中于不同电极旋转速度下扫描所得的LSVsFig.7 LSVs of Lac/PHCTS-Fe3O4/GC recorded in oxygen saturated PBS(pH 4.4)at a scan rate of 10 mV/s with variable rotating rates of electrode
3.2.3 固酶电极催化性能的重现性、长期使用性、热稳定性及pH耐受性将制备的3个固酶电极在图6条件下扫描获得LSV曲线进行对比(图略),发现3个固酶电极的氧还原LSV曲线基本重合,表明此固酶电极具有良好的催化性能重现性。由固定Lac电极催化氧还原性能(以500 mV时稳态催化电流密度为准)与电极储存时间的关系曲线(图8)可知,储存7 d后,催化性能可以保持为初始值的约96.5%;超过10 d后,电极催化氧还原性能下降迅速;储存21 d后,电极催化性能仍然可以保留初始值的约52%。图9为固酶电极在氧气饱和的不同pH 值PBS溶液中以相同扫速(10 mV/s)测定的稳态催化电流密度-pH关系曲线及相同扫速(10 mV/s)、相同pH(4.4)时测定的稳态催化电流密度-温度关系曲线,可以看出,固定Lac电极催化氧还原性能与游离Lac类似[12],最佳值pH 4.4;在55℃之前,随着温度升高,稳态催化电流密度线性升高,超过55℃后,输出功率急剧下降,与文献[19]报道固酶电极的催化电流密度-温度关系非常相似。根据图9数据可以估算出电池催化反应的表观活化能约为28.5 kJ/mol,而酶变性的活化能约为47.1 kJ/mol。
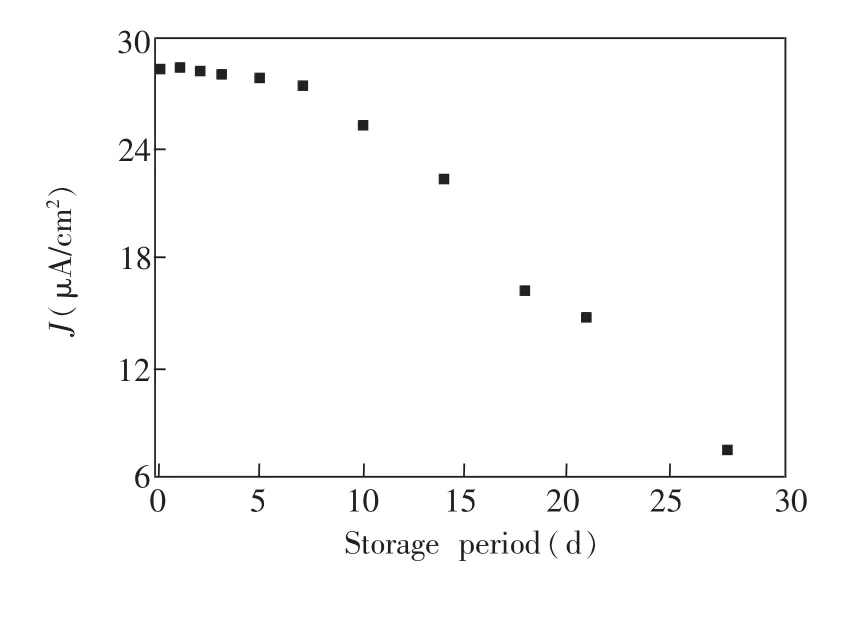
图8 Lac/PHCTS-Fe3O4/GC催化氧还原性能的长期稳定性,实验条件如图6所示Fig.8 Long-term stability of Lac/PHCTS-Fe3O4/GC in catalytic effect on oxygen reduction reaction,test conditions as Fig.6 demonstrated
3.3 固酶电极作为氧电化学传感器的性能评估
图10为Lac/PHCTS-Fe3O4/GC在不含任何电子中介体的无氧PBS(pH=4.4)中,缓慢加入不同体积空气饱和PBS(pH=4.4)时产生的响应电流与时间关系曲线,插图则是固酶电极对氧气的响应稳态催化电流倒数与底物氧分子浓度倒数之间的关系校正曲线。从图10及插图可见,固酶电极在无中介体存在时对氧分子响应迅速,此电极在氧气浓度2.6~33.9μmol/L范围内,稳态催化电流与氧气浓度均能保持良好的线性关系。这一固酶电极具有高灵敏度(为17.2μA·L/μmol,这一数值远高于文献[7]报道的固定Lac电极在扩散型电子中介体存在时对氧分子的灵敏度27.3μA·L/mmol)。
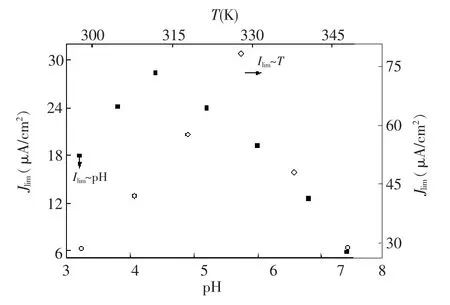
图9 Lac/PHCTS-Fe3O4/GC催化氧还原能力的pH耐受性和热稳定性Fig.9 pH endurance and thermal stability of Lac/PHCTS-Fe3O4/GCE in catalytic effect on oxygen reduction reaction

图10 计时电流法表征Lac/PHCTS-Fe3O4/GC处于静态时作为电化学传感器对氧传感的性能,插图为对应的极限催化电流-氧气浓度关系曲线Fig.10 Performance for oxygen detection of Lac/PHCTS-Fe3O4/GC as electrochemical sensor characterized by chronoamperometricmeasurements,electrode is stationary, inset is calibration curve of the limited catalytic current on the concentration of O2
本研究制备的固酶电极对氧的检出限为0.86μmol/L,远低于文献[7]报道的固酶电极(7.8μmol/L);对氧气的亲和力(KM=131.1μmol/L)远高于文献[7]报道(KM=3.22mmol/L)。根据图10还可以粗略计算出归一化的酶催化氧还原表观速率常数为140 s-1,结合前述扩散速率2.1×10-7s-1,酶-电极间直接电子迁移的速率0.05 s-1,分子内电子迁移速率1000 s-1[4],以及整个催化循环的氧分子转化速率0.3个/s,整个固酶电极催化过程受限于酶分子活性中心-导电基体之间的直接电子迁移过程。
4 结论
由邻苯二甲酰化壳聚糖和磁性Fe3O4纳米粒子共混所得复合物作为载体化学吸附Lac可制备得到固酶电极。在没有任何外加电子中介体情况下,可以实现酶与导电基体之间的直接电子迁移,且具有较良好的催化氧还原性能;这种电极由于制备简易,性能良好,适宜作为在线环境监测的电化学传感器和葡萄糖/乙醇-空气/氧气酶燃料电池的阴极使用。
1 Zhang L L,Zhou M,Dong S J.Anal.Chem.,2012,84(23):10345-10349
2 Zhao H Y,Zhou H M,Zhang JX,Zheng W,Zheng Y F.Biosens.Bioelectron.,2009,25(2):463-468
3 Stolarczyk K,Nazaruk E,Rogalski J,Bilewicz R.Electrochem.Commun.,2007,9(1):115-118
4 Willner I,Yan Y M,Willner B,Tel-Vered R.Fuel Cells,2009,9(1):7-24
5 Shleev S,Jarosz-Wilkolazka A,Khalunina A,Morozova O,Yaropolov A,Ruzgas T,Gorton L.Bioelectrochemistry,2005, 67(1):115-124
6 Osman M H,Shah A A,Walsh F C.Biosens.Bioelectron.,2011,26(7):3087-3102
7 Liu Y,Qu X H,Guo H W,Chen H J,Liu B F,Dong S J.Biosens.Bioelectron.,2006,21(12):2195-2201
8 Arrocha A A,Cano-Castillo U,Aguila SA,Vazquez-Duhalt R.Biosens.Bioelectron.,2014,61:569-574
9 Pang H L,Liu J,Hu D,Zhang X H,Chen JH.Electrochim.Acta,2010,55(22):6611-6616
10 Qiu JD,Peng H P,Liang R P.Electrochem.Commun.,2007,9(11):2734-2738
11 Deng M F,Zhao H,Zhang SP,Tian C Y,Zhang D,Du PH,Liu C M,Cao H B,Li H P.J.Mol.Catal.B,2015, 112:15-24
12 Jiang D S,Long SY,Huang J,Xiao H Y,Zhou JY.Biochem.Eng.J.,2005,25(1):15-23
13 Blandford C F,Heath R S,Armstrong F A.Chem.Commun.,2007,43:1710-1712
14 Martinez-Ortiz J,Flores R,Vazquez-Duhalt R.Biosens.Bioelectron.,2011,26(5):2626-2631
15 Yang L R,Guo C,Chen S,Wang F,Wang J,An Z T,Liu C Z,Liu H Z.Ind.Eng.Chem.Res.,2009,48(2):944-950
16 HUANG Jun,ZHOU Ju-Ying,XIAO Hai-Yan,LONG Sheng-Ya,WANG Jun-Tao.Acta Chim.Sinica,2005,63(14):1343-1347
黄俊,周菊英,肖海燕,龙胜亚,王军涛.化学学报,2005,63(14):1343-1347
17 Zhu Y F,Kaskel S,Shi JL,Wage T,Pee K-H V.Chem.Mater.,2007,19(26):6408-6413
18 Qiu H J,Xu C X,Huang X R,Ding Y,Qu Y B,Gao P J.J.Phys.Chem.C,2008,112(38):14781-14785
19 Mano N,Kim H H,Zhang Y C,Heller A.J.Am.Chem.Soc.,2002,124:6480-6486
20 Tsujimura S,Kamitaka Y,Kano K.Fuel Cells,2007,6:463-469
21 Zeng H,Tang ZQ,Liao LW,Kang J,Chen Y X.Chinese J.Chem.Phys.,2011,12:10888-10895
(Received 26 April2015;accepted 21 July 2015)
This work was supported by the National Natural Science Foundation of China(No.21363024)
Performance of Laccase-entrapped M agnetic Nano-particle Com posite M odified Electrode as Biocathode in Enzymatic Biofuel Cell and Elecrochem ical Sensor for Oxygen Detection
ZENG Han*,YANG Yang,LIXiao-Juan,BAIXi
(Laboratory ofNew Energy Materials Chemistry,Chemistry and Chemical Engineering Academy, XinJiang Normal University,Urumuqi830054,China)
A nano-composite of phthalated Chitosan and magnetic ferroferric oxide nano-particlewas prepared by mechanically mixing as method,and laccase was then adsorbed on the composite ot obtain immobilized laccase.Then the composite with laccase was dripped onto the surface of glassy carbon electrode and dried in air under room temperature to prepare laccase-immobilized biocathode.Catalytic effect in oxygen reduction reaction and performance of oxygen electrochemical sensor of this laccase-based electrode were systematically investigated by cyclic voltammetry,linear scanning voltammetry and chronoamperometry.Experimental results indicated that directelectron transfer between enzyme active centre T1 in laccase and conductivematrix ccould be achieved in solution without any electron relay,characterized with one-electron quasi-reversible redox reaction signal(Equilibrium potential:798 mV,very close to the formal potential of T1 centre in laccase 780 mV).Italso featured with surface coverage of1.5×10-9mol/cm2conductive enzymemolecules,electron relay rate of0.05 s-1,onset potential for oxygen reduction of930mV,substrate turn-over frequency of0.3 dioxygen molecules/s.Linear relationship in steady catalytic current of laccase-based electrode versus oxygen concentration was found within the oxygen concentration range of2.6-33.9μmol/L under optimal conditions.This electrode as oxygen electrochemical sensor showed a low detection limit of0.86μmol/L,high sensitivity (17.2μA·L/μmol),and Michaelis-Menten constant KM=131.1μmol/L.Further tests confirmed its excellent reproducibility and long-term usability in catalytic function towards oxygen reduction,with optimal pH=4.4.
Phthaloyl chitosan;Magnetic ferroferric oxide nanoparticle;Laccase;Biocathode in enzymatic biofuel cell;Electrochemical sensor
10.11895/j.issn.0253-3820.150337
2015-04-26收稿;2015-07-21接受
本文系国家自然科学基金(No.21363024),新疆维吾尔自治区2013年度高校科研计划青年教师培育项目(No.XJEDU2013S29)和新疆师范大学博士科研启动基金项目(No.XJNUBS1228)资助
E-mail:zenghan1289@163.com
